1.本发明属于细胞生物学技术领域,涉及一种感染细胞的方法。
背景技术:
2.现阶段在生物技术方面,无论是传统的科研实验还是细胞治疗领域,通常采用病毒载体感染的方式,使外源dna递送至细胞并使其高效率的表达,如使用慢病毒(lentiviral)载体、逆转录(retroviral)病毒载体以及腺病毒(aav)载体。也可采用脂质体法和电穿孔的方法,前者通过膜结合、膜渗透或细胞内吞作用,来外源递送基因进入细胞体内;后者是通过电场,瞬时提高细胞膜的通透性,来递送外源基因。不过这些方式与病毒载体感染相比,病毒载体大都具有相对较高的感染率、相对持续稳定表达且对目的细胞损伤较小,避免样品损失的优点。但随着生物技术的更新迭代,生物医药领域的蓬勃发展,现阶段的传统的病毒感染方式所带来的感染效率已经不能满足生产或实验的需求。因此,寻找一种节约、便捷的方法来提高细胞感染效率,变得尤为重要。特别是像干细胞领域的需要过表达某一些基因的诱导分化,又或是细胞治疗领域的car-t等等,都需要提高外源基因的感染效率,一方面高感染某类基因的细胞系可使实验数据更具准确性,另一方面高效率的基因工程编辑可使细胞治疗更有好的疗效。
3.因此,针对上述需求,在目前的细胞感染技术上,虽有传统离心的方法离心若干时间细胞和病毒颗粒的混合液,来充分提高细胞与病毒的接触来提高病毒对细胞的感染,但这种方式容易造成细胞的损伤而带来样品的损失;也有工业生产上通过浓缩纯化大量的病毒原液来感染效率的方法,这种需要的代价很高,基本要付出几十倍的成本;再有就是传统病毒悬液共孵育细胞的方法,虽然对细胞系可能会有较高的效率,但对原代细胞,像做car-t、人源干细胞的诱导分化等等,效率就始终不尽人意,往往需要纯化、分选后,才能达到要求。
4.综上所述,提供一种较低成本且方便易捷的方法,来提高病毒对原代悬浮细胞的感染效率,将具有重要意义。
技术实现要素:
5.针对现有技术的不足和实际需求,本发明提供一种感染细胞的方法,所述方法能够显著改善现有方法感染效率低、成本高、易损伤细胞以及操作繁琐等问题。
6.为达上述目的,本发明采用以下技术方案:
7.本发明提供一种感染细胞的方法,所述感染细胞的方法包括:
8.将细胞进行固定,向固定后细胞加入病毒,进行感染。
9.本发明中,发现悬浮细胞在细胞液培养中,会发生自由运动,也会因培养的悬液波动而发生运动,一直发生运动的细胞影响病毒颗粒的附着,即不利于进行感染,本发明使悬浮细胞能够一定时间内附着贴壁或者被固定于特定空间,不能发生对病毒结合感染无益的细胞运动或迁移,在这段附着贴壁或者固定的时间内,加入病毒液感染,能够提高病毒颗粒
的结合效率,从而提高感染效率。
10.优选地,所述固定包括使细胞附着贴壁。
11.优选地,所述固定的方法包括以下方法中任意一种或至少两种的组合:
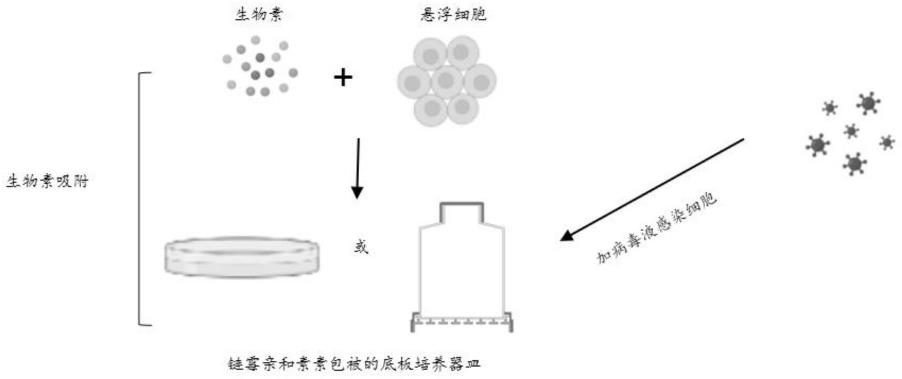
12.a.利用生物素标记的磁性微球标记细胞,使用亲和素包被的培养器皿培养标记后细胞,所述磁性微球识别细胞表面的蛋白,原理示意图如图1所示;
13.b.利用抗体标记细胞,在培养器皿中加入磁珠并培养标记后细胞,使用磁场发生装置固定磁珠,所述抗体与磁珠偶联,所述抗体识别细胞表面的蛋白,原理示意图如图2和图3所示;
14.c.使用多聚赖氨酸包被培养器皿,培养细胞,原理示意图如图4所示。
15.本发明中,所述磁性微球能够识别细胞表面的蛋白,通过免疫酶联结合的原理,由磁性微球的单链可变区片段(scfv端)识别目的抗原蛋白并结合标记细胞,另一端磁珠可被磁铁吸附固定。
16.本发明中,目前已用于商业化的生产目的,标记相应的靶细胞,实现后续科研或工业上的操作的磁性微球均适用于本发明,例如可选择用于人或鼠的t细胞的分选(cd3或cd45抗体磁珠)、其他流式细胞分选(如cd19,cd56等高表达的细胞)、细胞标记(如特定标签结合并标记目的细胞)的磁性微球等。
17.优选地,所述磁性微球可选自cd3抗体磁珠、cd19抗体磁珠、cd45抗体磁珠中或其他细胞表面特异抗原抗体磁珠等中任意一种。
18.本发明中,所述磁性微球和细胞的加料比可根据需求进行调整,不同细胞,针对不同抗原蛋白也有所不同,例如人t细胞分选,每1
×
106的细胞加1
×
105~8
×
105的磁珠,10~80μg。
19.本发明中,能够识别细胞表面蛋白(具体指与细胞表面的蛋白结合)且偶联磁珠的抗体均适用于本发明,不作特殊限制。
20.本发明中,所述抗体可选自cd3抗体、cd19抗体、cd45抗体或其他细胞表面特异抗原抗体中任意一种。
21.本发明中,所述抗体和细胞的加料比可根据需求及不同细胞类型进行调整。
22.本发明中,例如以t细胞为例,cd3的抗体磁珠为1mg/1
×
107beads,现配体积为1ml,与t细胞配比为每1
×
106的t细胞加1
×
105~8
×
105的磁珠,10~80μg抗体。
23.本发明中,控制所述抗体和细胞的加料比,能够进一步提高感染效率。
24.本发明中,多聚赖氨酸的分子量可根据具体情况进行调整,不作限定。
25.优选地,所述多聚赖氨酸的分子量为70000~300000,以t细胞为例,多聚赖氨酸的分子量进一步选择70000~150000。
26.本发明中,多聚赖氨酸分子式为(c6h
12
n2ohbr)n h2o,其分子量一般常见的有70000~150000,150000~300000和》300000,分子量越大,黏附力越强,但相对完全溶解较困难,对细胞的回收率有所降低。
27.优选地,所述多聚赖氨酸的浓度为0.01~0.32mg/ml,包括但不限于0.012mg/ml、0.015mg/ml、0.018mg/ml、0.02mg/ml、0.05mg/ml、0.08mg/ml、0.1mg/ml、0.2mg/ml、0.22mg/ml、0.25mg/ml、0.28mg/ml、0.3mg/ml或0.31mg/ml,优选为0.1mg/ml。
28.本发明中,控制采用细胞培养级别的多聚赖氨酸的浓度,在提高感染率的同时,不
会过多损失细胞样品。
29.本发明中,控制多聚赖氨酸的浓度,使用特定浓度的多聚赖氨酸包被培养器皿,能够进一步提高感染效率。
30.作为优选的技术方案,本发明所述感染方法包括以下步骤:
31.(1)将细胞进行固定,所述固定的方法包括以下方法中任意一种或至少两种的组合:
32.a.利用生物素标记的磁性微球标记细胞,使用亲和素包被的培养器皿培养标记后细胞,所述磁性微球识别细胞表面的蛋白;
33.b.利用抗体标记细胞,在培养器皿中加入磁珠并培养标记后细胞,使用磁场发生装置固定磁珠,所述抗体与磁珠偶联,所述抗体识别细胞表面的蛋白;
34.c.使用多聚赖氨酸包被培养器皿,培养细胞;
35.(2)向固定后细胞加入病毒,进行感染。
36.与现有技术相比,本发明具有以下有益效果:
37.本发明的感染细胞的方法,创造性地将细胞固定后进行感染,操作便捷,即可提高病毒对悬浮细胞的感染效率,不易损伤细胞,也不会造成样品的损失且可与浓缩纯化后的病毒或其他方法联用,实现叠加效果,具有广阔应用的前景,如特定基因细胞系的建立(高感染效率可减少后续纯化分选的步骤,节约时间和成本)、如细胞治疗中car-t的生产(感染效率的提高既减少成本又能带来更高的疗效)或如科研实验中过表达转录因子、关键基因等。
附图说明
38.图1为生物素标记悬浮细胞与链霉亲和素包被的底板培养皿示意图;
39.图2为磁珠设计和偶联悬浮细胞示意图;
40.图3为磁珠吸附固定悬浮细胞示意图;
41.图4为多聚赖氨酸吸附悬浮细胞示意图;
42.图5为实施例1中感染效率图;
43.图6为实施例3中感染效率图;
44.图7为实施例4(第一组和第四组)中感染效率图;
45.图8为实施例4(其余组)感染效率图;
46.图9为实施例2中感染效率图;
47.图10为实施例5中感染效率图。
具体实施方式
48.为进一步阐述本发明所采取的技术手段及其效果,以下结合实施例和附图对本发明作进一步地说明。可以理解的是,此处所描述的具体实施方式仅仅用于解释本发明,而非对本发明的限定。
49.实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购获得的常规产品。
50.实施例1
51.本实施例提供一种感染细胞的方法,所述方法包括以下步骤:
52.(1)复苏pbmc细胞、使用人t细胞分选试剂盒分选纯化t细胞并激活培养12h;
53.(2)实验分3组,第一组,对照组,加2mltakaragt-t551h2(10%血清)培养基重悬1
×
106的t细胞;第二组(传统方法组),加1ml培养基重悬1
×
106的t细胞,并加已测好moi值的1ml病毒液(car19-gfp,病毒悬液,采用的包装系统是2代包装系统,即三质粒系统,该系统包括1个包装质粒(pspax2)、1个包膜质粒(pmd2g)、1个目的基因质粒和1株包装细胞(293tcell),于72h收集病毒悬液)进行感染;第三组,加1ml培养基重悬1
×
106的t细胞,加60μlcd3 的抗体磁珠(美天旎公司dynabeads
tm
flowcomp
tm
cd3 磁珠)标记t细胞,孵育5min,在培养皿底部加入磁铁,并加已测好moi值的1ml病毒液进行感染;感染24h,37℃,5%co2培养箱培养放置;
54.(3)撤去磁铁,吹悬各组细胞,300
×
g离心5min后,使用pbs重悬,采用流式细胞术跑样记fitc(gfp)百分占比,计算感染效率。
55.实施例2
56.本实施例提供一种感染细胞的方法,与实施例1相比,区别仅在于将步骤(2)中cd3 的抗体磁珠替换为等量cd7 或cd5 抗体。
57.实施例3
58.本实施例提供一种感染细胞的方法,与实施例1相比,区别仅在于步骤(2)中第三组中cd3 的抗体磁珠采用不同的用量进行试验,分别为20μl、40μl、60μl和80μl。
59.实施例4
60.本实施例提供一种感染细胞的方法,所述方法包括以下步骤:
61.(1)使用蒸馏水,溶解多聚赖氨酸粉末(gibco
tm
公司,多聚-d-赖氨酸包含分子量为50,000
–
150,000道尔顿的聚合物),配制成10mg/ml的储存液,于-20℃储存;
62.(2)调整ph至中性,于121℃灭菌15min;配制硼酸缓冲液(ph=8.4),为a、b两种,a液:硼砂溶液--1.907g溶于100ml超纯水(0.05m);b液:硼酸溶液--1.237g溶于100ml超纯水(0.2m),取a液4.5ml和b液5.5ml配成硼酸缓冲液备用;
63.(3)加5ml由(1)中配好的多聚赖氨酸溶于(2)中配好的50ml硼酸缓冲液中,配成1mg/ml的多聚赖氨酸溶液,0.22μm的滤器过滤除菌,-20℃保存;
64.(4)用超纯水稀释按不同浓度(3)配制1mg/ml的多聚赖氨酸溶液,分别为0.01mg/ml、0.02mg/ml、0.04mg/ml、0.08mg/ml、0.16mg/ml和0.32mg/ml,包被培养皿底板;
65.(5)复苏从atcc上购得的jurkat-wt细胞,正常培养扩增;
66.(6)实验分7组,第一组,对照组,加2ml培养基(gibco公司的培养基rpmi1640,10%血清)重悬1
×
106jurkat-wt细胞,于普通48孔板培养;第二组(传统方法组),加1ml培养基重悬1
×
106的细胞,于底板预先包被好多聚赖氨酸的48孔板培养(0.01mg/ml多聚赖氨酸溶液包被),并加已测好moi值的1ml病毒液感染(gfp-luciferase,病毒悬液,采用的包装系统是2代包装系统,即三质粒系统,该系统包括1个包装质粒(pspax2)、1个包膜质粒(pmd2g)、1个目的基因质粒和1株包装细胞(293tcell),于72h收集病毒悬液);第三组,加1ml培养基重悬1
×
106的细胞,于底板预先包被好多聚赖氨酸的48孔板培养(0.02mg/ml多聚赖氨酸溶液包被),并加已测好moi值的1ml病毒液感染;第四组,加1ml培养基重悬1
×
106的细胞,于底
板预先包被好多聚赖氨酸的48孔板培养(0.04mg/ml多聚赖氨酸溶液包被),并加已测好moi值的1ml病毒液感染;第五组,加1ml培养基重悬1
×
106的细胞,于底板预先包被好多聚赖氨酸的48孔板培养(0.08mg/ml多聚赖氨酸溶液包被),并加已测好moi值的1ml病毒液感染;第六组,加1ml培养基重悬1
×
106的细胞,于底板预先包被好多聚赖氨酸的48孔板培养(0.16mg/ml多聚赖氨酸溶液包被),并加已测好moi值的1ml病毒液感染;第七组,加1ml培养基重悬1
×
106的细胞,于底板预先包被好多聚赖氨酸的48孔板培养(0.32mg/ml多聚赖氨酸溶液包被),并加已测好moi值的1ml病毒液感染;感染24h,37℃,5%co2培养箱培养放置;
67.(7)吹悬各组细胞,300
×
g离心5min,pbs重悬,流式跑样记fitc(gfp)百分占比,计算感染效率。
68.实施例5
69.本实施例提供一种感染细胞的方法,所述方法包括以下步骤:
70.(1)复苏pbmc细胞、使用人t细胞分选试剂盒(购自美天旎公司)分选纯化t细胞并激活培养12h;
71.(2)实验分3组,第一组,对照组,加2mltakaragt-t551h2(10%血清)培养基重悬1
×
106的t细胞;第二组(传统方法组),加1ml培养基重悬1
×
106的t细胞,并加已测好moi值的1ml病毒液(car19-gfp,病毒悬液,采用的包装系统是2代包装系统,即三质粒系统,该系统包括1个包装质粒(pspax2)、1个包膜质粒(pmd2g)、1个目的基因质粒和1株包装细胞(293tcell),于72h收集病毒悬液)进行感染;第三组,加1ml培养基重悬1
×
106的t细胞,加5μl生物素标记的anti-cd3抗体,将细胞加入到链霉亲和素包被的培养板中;再加入步骤(2)中同等量的病毒液,感染24h,37℃,5%co2培养箱培养放置;
72.(3)吹悬各组细胞,300
×
g离心5min后,使用pbs重悬,采用流式细胞术跑样记fitc(gfp)百分占比,计算感染效率。
73.对实施例中细胞感染方法的感染效率进行比较,实施例5结果如图5所示,与传统共孵育感染(第二组实验,感染率7.13%)相比,本发明采用抗体偶联磁珠吸附固定细胞后进行感染(感染率23.7%),能够显著提高感染效率;实施例3结果如图6所示,结果表明,本发明控制所述抗体和细胞的加料比,能够进一步提高感染效率;实施例4结果如图7所示,与传统共孵育感染(感染率12.6%)相比,本发明采用多聚赖氨酸吸附固定细胞后进行感染(感染率31.9%),能够显著提高感染效率,此外,实施例4中其余组结果如图8所示,表明本发明控制多聚赖氨酸的浓度,使用特定浓度的多聚赖氨酸包被培养器皿,能够进一步提高感染效率;实施例2结果如图9所示,相比较于传统方式的12.5%效率,使用cd5或cd7抗体磁珠吸附固定,都能有所提高感染效率,分别为21.6%和25.9%;实施例5结果如图10所示,相比较于传统方式的15.6%效率,使用生物素吸附固定,能提高细胞感染效率到24.1%。
74.综上所述,本发明设计一种全新的感染细胞的方法,创造性地将细胞固定后进行感染,操作便捷,即可提高病毒对悬浮细胞的感染效率,不易损伤细胞,也不会造成样品的损失,且成本低,具有广阔应用的前景。
75.申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。