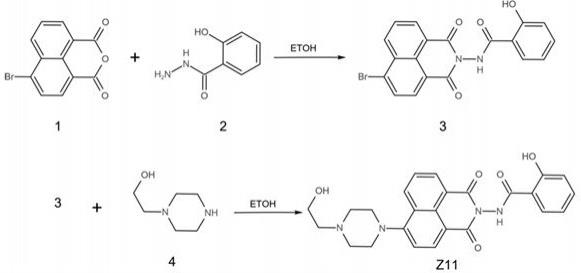
一种nk细胞扩大培养的培养方案
技术领域
1.本发明属于生物技术领域,具体涉及一种nk细胞扩大培养的培养方案。
背景技术:
2.人类自然杀伤细胞(natural killer,nk)占所有循环淋巴细胞的15%。nk 细胞发现于20世纪70年代,主要与杀死感染的微生物和恶性转化的同种异体和自体细胞有关。nk细胞表现出抗肿瘤细胞毒性,无需事先致敏和产生细胞因子以及调节各种免疫反应的趋化因子。人外周血nk细胞可分为cd56
bright
和 cd56
dim
两大类。cd56
bright nk细胞主要通过分泌细胞因子发挥作用,而cd56
dim
nk细胞则具有潜在的细胞毒性,可直接杀伤肿瘤细胞。由于nk细胞能够识别和裂解肿瘤细胞,以nk细胞为基础的肿瘤免疫治疗领域受到广泛关注。nk细胞的特点是它们具有通过不同机制杀死肿瘤细胞的潜力,而无需事先致敏,因此已成为癌症免疫治疗中的重要工具。
3.限制nk细胞应用于实体肿瘤治疗的主要因素之一是免疫抑制性肿瘤微环境(tumor microenvironment,tme)。在那里,肿瘤和其他免疫细胞为肿瘤增殖创造了适当的条件,同时阻止了nk细胞的激活。此外,tme中nk细胞的代谢受损,这可能是由于营养和氧气缺乏以及肿瘤衍生的代谢终产物浓度较高,如乳酸。nk细胞的这种代谢限制限制了它们的效应器功能,它可能代表一个潜在的目标,以提高基于nk细胞的疗法对实体瘤的疗效。felicesm、lenviktr等的研究表明,表达嵌合抗原受体的nk细胞(car-nks)、双特异性和三特异性杀伤细胞接合剂(bikes和trikes)、nk细胞联合免疫检查点抑制剂,和 nk细胞联合溶瘤病毒疗法等均能够有效克服tme的免疫抑制作用,发挥抗肿瘤效应。
4.现有的方法在体外扩增nk细胞,有多种因素都会影响到nk细胞的活性和数量,从而降低nk成药的可能性。因此,需要有一种能够提高扩增数量和纯度的nk细胞制备方法。
技术实现要素:
5.现有的无滋养层细胞的nk细胞培养方式,细胞的扩增倍数多在400倍以内,在不进行分选的情况下,nk细胞的比例在90%以下,无论从获得细胞的纯度还是细胞的数量上来说都存在一定的缺陷。
6.为此,本发明提供了nk细胞扩大培养的方法,解决了实际应用中获得大量高纯度的nk细胞难的技术问题。
7.一方面,本发明提供了一种抗体组合及其在扩增nk细胞中的应用,所述抗体组合包括cd137、cd28、cd3中至少一种。
8.优选地,所述抗体组合是cd137、cd28、cd3的组合。
9.在本技术中,术语“抗体”包括与抗原特异性结合的完整抗体、以及与抗原特异性结合的抗原结合区(抗原结合片段);所述“抗原结合区(抗原结合片段)”通常是抗体分子的一部分,其包含负责抗体与抗原之间的特异性结合的氨基酸序列。抗体的制备方法本身是周知的常规方法,在本技术中,抗体可以是通过常规方法制备的(包括但不限于通过重组手
段制备、表达、产生或分离的抗体),也可以是市售的产品。
10.优选地,所述cd137、cd28、cd3可以各自独立的是人源的单抗。
11.另一方面,本发明提供了一种抗体包被液及其在扩增nk细胞中的应用,所述包被液中包括前述抗体组合;
12.优选地,所述包被液是含有前述抗体组合的生理盐水。
13.优选地,所述cd137、cd28、cd3的浓度比是1:1:1。
14.优选地,所述cd137的浓度为0-10μg/ml(0、1、2、3、4、5、6、7、8、9、 10);更优选地,8μg/ml。
15.优选地,所述cd28的浓度为0-10μg/ml(0、1、2、3、4、5、6、7、8、9、 10);更优选地,8μg/ml。
16.优选地,所述cd3的浓度为0-10μg/ml(0、1、2、3、4、5、6、7、8、9、 10);更优选地,8μg/ml。
17.另一方面,本发明提供了一种激活培养基及其在扩增nk细胞中的应用,所述培养基含il-2、il-15、il-12、cd137、血浆;
18.优选地,所述il-2、il-15、il-12的浓度比是20:10:1。
19.优选地,所述il-2浓度为1000-10000iu/ml;1000-5000iu/ml;更优选地, 2000iu/ml。
20.优选地,所述il-15浓度为500-2000iu/ml;更优选地,1000iu/ml。
21.优选地,所述il-12浓度为50-500iu/ml;更优选地,100iu/ml。
22.优选地,所述cd137浓度为0-10μg/ml(0、1、2、3、4、5、6、7、8、9、 10);更优选地,5μg/ml。
23.优选地,所述血浆百分比3-10%;更优选地,5%。
24.本发明所述的血浆百分比是血浆占需要添加的培养基的体积百分比。
25.如本发明所述“血浆”包括灭活血浆、或人血白蛋白、或脐血灭活血浆;优选地使用灭活血浆,其可以按本领域常规方法或本发明具体实施例中所使用的方法制备;具体地是:56℃,30min灭活。
26.优选地,所述灭活血浆和被培养的细胞来源相同,例如,欲以a受试者的样本中分离细胞扩大培养nk细胞,则进行细胞培养时,使用从a受试者样本中分离得到的灭活血浆,在这种情况下,所述“灭活血浆”还可以称为“自体血浆”。
27.另一方面,本发明提供了第一扩增培养基及其在扩增nk细胞中的应用,所述培养基含il-2、il-15、il-12、血浆;
28.优选地,所述il-2浓度为1000-10000iu/ml;1000-5000iu/ml;更优选地, 2000iu/ml。
29.优选地,所述il-15浓度为500-2000iu/ml;更优选地,1000iu/ml。
30.优选地,所述il-12浓度为50-500iu/ml;更优选地,100iu/ml。
31.优选地,所述血浆体积占比3-10%(3、4、5、6、7、8、9、10);优选地, 5%。
32.另一方面,本发明提供了第二扩增培养基及其在扩增nk细胞中的应用,所述培养基含il-2、il-15、il-21。
33.优选地,所述il-2浓度为1000-10000iu/ml;1000-5000iu/ml;更优选地, 2000iu/
ml。
34.优选地,所述il-15浓度为500-2000iu/ml;更优选地,1000iu/ml。
35.优选地,所述il-21浓度为20-100iu/ml;更优选地,50iu/ml。
36.优选地,所述第二扩增培养基不含有血浆,实际操作中可根据实际情况自行选择。
37.优选地,所述激活培养基、第一扩增培养基、第二扩增培养基的基础培养基,各自独立地,可以是任意通用细胞培养基;
38.如本发明所述“通用细胞培养基”可以是自行配制的培养基,或者商品化的产品。所述通用细胞培养基可选自各种常规细胞培养基,如dmem、rpmi1640、 mem、deme/f12、f10、cd293、medium231、medium106。然而,如使用上述培养基培养细胞时必须添加胎牛血清或者人血清。然而添加血清将带来一些问题,例如引入血清来源的病原体污染,不同批次血清间可能存在的差异,免疫排斥风险等等。
39.所以在实际应用中可以,更优选地,使用x-viv015、texmacs或imsf100 等基础培养基。优选x-viv015培养基。
40.优选地,所述激活培养基、第一扩增培养基、第二扩增培养基的基础培养基是x-vivo15。(厂家:lonza)。
41.优选地,本发明所述制备nk细胞的应用包括高倍数扩增nk细胞,例如获得500、600、700、800、900、1000倍以上初始数量的nk细胞,如本发明具体实施例的扩增至少获得了820、900、1000倍的扩增倍数。
42.另一方面,本发明提供了一种预处理细胞培养容器的方法,所述方法包括使用前述抗体包被液处理细胞培养容器。
43.同时提供了经过以上预处理的培养容器,及其应用。所述预处理过的培养容器在使用前可在室温保存12h,或4℃条件下保存7天。
44.另一方面,本发明提供了一种nk细胞的制备方法,所述方法包括在经过前述预处理的细胞培养容器中使用前述激活培养基培养单个核细胞。
45.优选地,所述培养是在37℃,co2浓度为5%,饱和湿度的环境下进行。
46.优选地,所述细胞培养容器可以是培养瓶,或者其他任意常规细胞培养容器。
47.优选地,所述培养的初始细胞浓度是1.0
×
106个/ml-10.0
×
106个/ml;优选地,所述培养的初始细胞浓度是1.0
×
106个/ml-5.0
×
106个/ml;具体地包括1.0
×
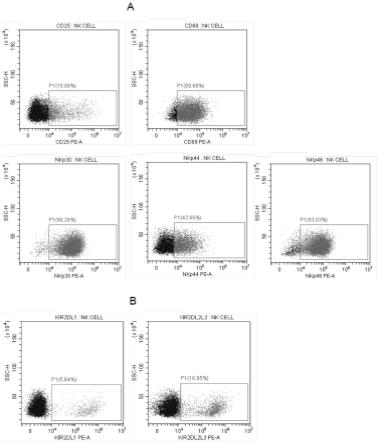
106个 /ml、1.5
×
106个/ml、2.0
×
106个/ml、2.5
×
106个/ml、3.0
×
106个/ml、3.5
×
106个/ml、 4.0
×
106个/ml、4.5
×
106个/ml、5.0
×
106个/ml。
48.如本发明具体实施例具体是以2.0
×
106个/ml、2.5
×
106个/ml、3.0
×
106个/ml 为初始细胞浓度进行的接种。
49.优选地,所述单个核细胞来源于血液、脐血、骨髓;优选地,所述血液是外周血。
50.优选地,所述单个核细胞是外周血来源的单个核细胞(peripheral bloodmononuclear cells,pbmc)。
51.优选地,所述单个核细胞可以由任何方法制备得到;优选地,是由ficoll密度梯度离心方法制备获得的;具体地,所述单个核细胞的制备方法如本发明具体实施例所述。
52.优选地,所述方法还包括以下步骤:
53.1)在接种细胞的7天之内(第168小时内)补充第一扩增培养基;优选地,补充两次;
54.2)在接种细胞的第7-15天(第168-360小时)补充第二扩增培养基;优选地,补充四次;
55.优选地,在第15-17天收获细胞。如本发明所述的,接种细胞的时间记为第 0天。
56.优选地,每次补充培养基后所述培养基的终体积变为2倍、3倍、4倍或更多。更详细地,所述添加培养基的步骤如下所示:
57.1)第3天时,添加第一扩增培养基,终体积为初体积的3倍;
58.2)第5天时,添加第一扩增培养基,终体积为初体积的9倍;
59.3)第7天时,添加第二扩增培养基,终体积为初体积的27倍;
60.4)第9天时,添加第二扩增培养基,终体积为初体积的54倍;
61.5)第11天时,添加第二扩增培养基,终体积为初体积的108倍;
62.6)第13天时,添加第二扩增培养基,终体积为初体积的216倍;
63.优选地,在第15天收获细胞。
64.本发明中,激活培养基的体积称为一倍体积(初体积),在本发明的具体实施例中所使用的一倍体积是20ml,完成全部培养步骤后培养基的终体积变为 4320ml。
65.在本发明中所述终体积是指体积的总和,在细胞培养容器容积限制的情况下,可以分成多个细胞培养容器分别进行培养。具体地,如具体实施例中所述,本发明在第3次补液后转移到培养袋进行培养,之后的第4、5、6次补液后还将细胞培养液分装到了多个培养袋中进行培养。
66.另一方面,本发明提供了以上制备方法处理得到的nk细胞及其应用。
67.优选地,所述nk细胞的纯度达到85%以上,具体包括86、87、88、89、 90、91、92、93、94、95、96、97、98、99%以上;
68.优选地,所述nk细胞高表达cd56且低表达cd3;
69.优选地,所述nk细胞激活性受体表达上调;所述激活性受体包括cd25、 cd69、nkp30、nkp44、nkp46;
70.优选地,所述nk细胞抑制性受体表达下调或小幅度变化;所述抑制性受体包括kir2dl1、kir2dl2l3。
71.更优选地,所述nk细胞在体内存活时间长,例如实施例所证明的本发明所制备得到的nk细胞在体内存活至少15天,在第10天即可发挥作用;
72.优选地,所述应用包括但不限于任何nk细胞的应用,具体地,在制备细胞治疗的药物、制备抗病毒感染的药物、制备治疗癌症或自身免疫性疾病的药物中的用途;在nk细胞与抗体药物、核酸药物、小分子药物、溶瘤病毒药物和细胞药物联合治疗中的应用;在nk细胞与放射治疗、化疗药物、干细胞移植手术、介入治疗、消融治疗等治疗手段联合中的应用。
73.优选地,本发明所述的癌症涵盖了任何类型的癌症,包括实体癌症和非实体癌症。
74.优选地,所述实体癌症根据肿瘤发生的部位不同,临床上可分为头颈部、胸部、消化道、泌尿生殖系统、骨科、中枢神经系统、软组织、皮肤和附件等多种肿瘤。
75.优选地,所述非实体癌症包括急性淋巴细胞白血病、慢性淋巴细胞白血病、造血系肿瘤、多发性骨髓瘤、非霍奇金氏淋巴瘤、急性髓性白血病、b细胞淋巴瘤、t细胞淋巴瘤。如本发明具体实施例所示,所述应用在k-562(人慢性髓原白血病传代细胞)中进行了验证。
76.优选的,本发明所述的抗体药物,示例性的包括但不限于:曲妥珠单抗、西妥昔单
抗、达利珠单抗、他尼珠单抗、阿巴伏单抗、阿德木单抗、阿夫土珠单抗、阿仑单抗、培化阿珠单抗、阿麦妥昔单抗、阿泊珠单抗、巴维昔单抗、贝妥莫单抗、贝利木单抗、贝伐单抗、莫-比伐珠单抗、贝伦妥单抗-维多汀、莫坎妥珠单抗、拉坎妥珠单抗、卡罗单抗喷地肽、卡妥索单抗、泊西他珠单抗、西妥木单抗、可那木单抗、达西珠单抗、达洛珠单抗、地莫单抗、依美昔单抗、依决洛单抗、依洛珠单抗、恩司昔单抗、依帕珠单抗、厄马索单抗、埃达珠单抗、法勒珠单抗、芬妥木单抗、加利昔单抗、吉妥珠单抗、吉妥珠单抗、吉瑞昔单抗、格莱木单抗
ꢀ‑
维多汀、替伊莫单抗、伊戈伏单抗、拉英达西单抗、英妥木单抗、伊珠单抗奥佐米星、伊匹木单抗、伊妥木单抗、拉贝珠单抗、来沙木单抗、林妥珠单抗、莫洛伏珠单抗,包括其抗原结合片段。
77.另一方面,本发明提供了包含以上制备方法处理得到的nk细胞的组合物,以及nk细胞与抗体药物联合使用的方法。
78.可与本发明所述nk细胞、组合物联合使用的其他药物包括但不限于化疗药物,示例性的例如:阿霉素、长春新碱、长春瑞滨、紫杉醇、顺铂、放线菌素、博来霉素、白消安、卡培他滨、卡铂、卡莫司汀、苯丁酸氮芥、环磷酰胺、阿糖胞苷、柔红霉素、表阿霉素、依托泊甙、足叶乙甙、鬼臼乙叉甙、氟阿糖腺苷酸;氟尿嘧啶、吉西他滨(gemcitabine);赫赛汀、羟基脲、伊达比星、异环磷酰胺、依立替康、洛莫司汀、环己亚硝脲、美法仑、左旋苯丙氨酸氮芥、巯基嘌呤、氨甲蝶呤、丝裂霉素、米托蒽醌、二羟基蒽酮、奧沙利铂、丙卡巴肼、甲(基) 苄肼、美罗华(rituxan)、类固醇、链佐星、链脲霉素、泰素帝(taxotere,多烯紫杉醇)、硫鸟嘌呤、噻替哌、硫替哌、三胺硫磷、雷替曲塞、拓扑替康、曲奧舒凡、5-氟尿嘧啶、希罗达(xeloda)、长春碱、长春花碱、长春地辛、长春瑞宾、格列卫、羟基喜树碱、拉帕替尼(tykerb,lapatinib)、torisel(temsirolimus)、舒尼替尼(sunitinib,sutent)、易瑞沙(iressa、吉非替尼片)、它赛瓦(tarceva,特罗凯)、赫赛汀(herceptin,trastuzumab)、阿瓦斯汀(avastin,bevacizumab)、三氧化二砷、反式维甲酸、万珂(velcade,bortezomib)、替莫胺(temodar)、爱必妥(erbitux,cetuximab)、大沙替尼(dasatinib sprycel)、索拉非尼(sorafenib, nexavar)、巾白尼单抗(vectibix,panitumumab)、替吉奧(ts-1)、ixempra (ixabepilone)、利妥昔单抗(rituximab,rtx,商品名:美罗华)、替伊莫单抗(ibritumomab,商品名:泽娃灵zevalin)、托西莫单抗(tositumomab,商品名:bexxar)、奥法木单抗(ofatumumab,商品名:arzerra)、奥瑞珠单抗 (ocrelizumab,商品名:ocrevus)、阿妥珠单抗(obinutuzumab,商品名:gazyva)、达雷妥尤单抗(daratumumab)、伊沙妥昔单抗(也即艾沙妥昔单抗,isatuximab)、 zolbetuximab(imab362,claudixmab)。
79.优选地,所述组合物是药物组合物,所述药物组合物还可以包括药学上可接受的载体、稀释剂或赋形剂。
80.优选地,所述药学上可接受的载体、稀释剂或赋形剂包括但不限于已经由美国食品和药品管理局或中国食品药品监督管理局批准可用于人或家畜的任何佐剂、载体、赋形剂、助流剂、甜味剂、稀释剂、防腐剂、染料/着色剂、增味剂、表面活性剂、润湿剂、分散剂、悬浮剂、稳定剂、等渗剂、溶剂、表面活性剂或乳化剂。
81.所述药物组合物可以是任何剂型,并以任何方式施用。
82.优选地,所述药物组合物中还可以包含单克隆抗体,示例性的包括但不限于:曲妥珠单抗、西妥昔单抗、达利珠单抗、他尼珠单抗、阿巴伏单抗、阿德木单抗、阿夫土珠单抗、阿仑单抗、培化阿珠单抗、阿麦妥昔单抗、阿泊珠单抗、巴维昔单抗、贝妥莫单抗、贝利木单抗、
贝伐单抗、莫-比伐珠单抗、贝伦妥单抗-维多汀、莫坎妥珠单抗、拉坎妥珠单抗、卡罗单抗喷地肽、卡妥索单抗、泊西他珠单抗、西妥木单抗、可那木单抗、达西珠单抗、达洛珠单抗、地莫单抗、依美昔单抗、依决洛单抗、依洛珠单抗、恩司昔单抗、依帕珠单抗、厄马索单抗、埃达珠单抗、法勒珠单抗、芬妥木单抗、加利昔单抗、吉妥珠单抗、吉妥珠单抗、吉瑞昔单抗、格莱木单抗-维多汀、替伊莫单抗、伊戈伏单抗、拉英达西单抗、英妥木单抗、伊珠单抗奥佐米星、伊匹木单抗、伊妥木单抗、拉贝珠单抗、来沙木单抗、林妥珠单抗、莫洛伏珠单抗,包括其抗原结合片段。
83.另一方面,本发明提供了使用制备方法处理得到的nk细胞治疗癌症或自身免疫性疾病的方法。
84.本发明所述nk细胞包括经修饰的nk细胞,例如car-nk细胞。
附图说明
85.图1是nk细胞的增殖曲线图。
86.图2是nk细胞纯度的统计结果图。
87.图3是外周血来源的单个核细胞在第0天及第15天的nk细胞流式结果图,a:第0天,b:第15天。
88.图4是外周血来源的单个核细胞在第0天及第15天的细胞照片,a:第0天,b:第15天。
89.图5是脐血来源的单个核细胞在第0天nk细胞流式结果图,a:激活性受体, b:抑制性受体。
90.图6是脐血来源的单个核细胞在第15天的nk细胞流式结果图,a:激活性受体,b:抑制性受体。
91.图7是1.0
×
106个/ml密度接种的骨髓来源的单个核细胞在第0天及第15天的 nk细胞流式结果图,a:第0天,b:第15天。
92.图8是3.0
×
106个/ml密度接种的脐血来源的单个核细胞在第0天及第15天的 nk细胞流式结果图,a:第0天,b:第15天。
93.图9是以2.0
×
106个/ml密度接种的外周血来源的单个核细胞培养15天后,nk 细胞不同效靶比时杀伤活性的统计结果图。
94.图10是以2.0
×
106个/ml密度接种的外周血来源的单个核细胞培养15天后,不同效靶比时nk细胞的inf-γ分泌量,a:标准曲线,b,不同效靶比时nk细胞的inf-γ分泌量的统计结果图。
95.图11是以2.0
×
106个/ml密度接种的外周血来源的单个核细胞培养15天后,nk 细胞在免疫缺陷小鼠体内的数量变化统计图。
具体实施方式
96.下面将结合附图及实施例对本发明进行详细描述,以便于本领域技术人员理解和实施本发明,并进一步认识本发明的优点。除非在本发明说明书中另有定义,否则在此所有的技术术语都是根据本领域一般技术人员所通常使用和理解的惯用定义来使用。下述实施例中所述实验方法,如无特殊说明,均为常规方法;所述试剂和材料,如无特殊说明,均可从
商业途径获得。
97.以下所述,仅是对本发明的较佳实施例而已,并非对本发明做其他形式的限制,任何熟悉本专业的技术人员可能利用上述揭示的技术内容加以变更为同等变化的等效实施例。凡是未脱离本发明方案内容,依据本发明的技术实质对以下实施例所做的任何简单修改或等同变化,均落在本发明的保护范围内。
98.实施例1、由不同来源的样品制备nk细胞
99.一、由外周血样本制备nk细胞并检测
100.外周血样本为外周血全血样本或采用单采机采集的外周血单个核细胞。下面以外周血为例进行阐述:
101.1.1细胞培养瓶的预处理
102.将20ml含cd137为8μg/ml,cd28为8μg/ml,cd3为8μg/ml的生理盐水溶液,加入到225cm2底面积的细胞培养瓶(nunc)中,并使液体充分在瓶底分散,4℃平放过夜。
103.1.2外周血单个核细胞(pbmc)的分离
104.80ml外周血为例,如血量不同,可按此操作做相应调整。将经平皿检菌后无菌的80ml患者外周血在室温下差速离心(湘仪)水平低速心机中进行,离心30 分钟,升9降7(即从1800rpm至0rpm的降速时间为10min),使血浆和血细胞分离。
105.将上层血浆转入离心管,56℃灭活30min之后,2000rpm离心10min,取上清 4℃备用。
106.将血细胞沉淀用等体积的生理盐水混匀,通过ficoll密度梯度离心分离外周血单个核细胞(pbmc)。具体的,将上述混合物小心加到含ficoll层的50ml离心管中,室温离心20分钟(升9降0,即2000rmp至0rmp,30min)。吸取白膜层,尽量吸尽两液面交界处的细胞层,加生理盐水吹打混匀,室温1500rpm离心10分钟。利用生理盐水再次洗涤细胞。
107.弃去上清后,用10ml无血清培养基(x-vivo15)重悬细胞,定容到30ml。吸取少量细胞计数。同时取少量细胞悬液进行流式检测,nk(cd3-cd56
)比例为6%。
108.1.3接种
109.按照2.0
×
106个/ml的细胞浓度,将步骤1.2获得的pbmc细胞,采用含 2000iu/ml il-2、1000iu/ml il-15、100iu/ml il-12、5ug/ml cd137和5%灭活血浆(灭活血浆添加量1-10%皆可实现实验目的,此处根据实际实验情况,添加5%) 的20ml培养基(x-vivo15)重组细胞,接种到包被培养瓶中。在培养箱中(37℃, co2浓度为5%,饱和湿度)培养。
110.1.4 nk细胞的第一次补液
111.在培养的第3天,检测细胞团密度>50%。此时,向培养瓶中补加含有5%的灭活血浆(灭活血浆添加量1-10%皆可实现实验目的,此处根据实际实验情况,添加5%)、il-2 2000iu/ml、il-15 1000iu/ml、il-12 100iu/ml的扩增培养基(基础培养基为x-vivo15),确保培养基的终体积为60ml。注意,请勿吹打细胞。
112.1.5 nk细胞的第二次补液
113.在第5天,检测细胞团密度>50%,向培养瓶中继续补加含有5%的患者灭活血浆(灭活血浆添加量1-10%皆可实现实验目的,此处根据实际实验情况,添加 5%)、il-2 2000iu/ml、il-15 1000iu/ml、il-12 100iu/ml的扩增培养基(基础培养基为x-vivo15),确保培养基的终体积为180ml。注意,请勿吹打细胞。
114.1.6 nk细胞的第三次补液及转瓶
115.第7天,检测细胞浓度为3.67
×
106个/ml。将培养瓶底部的细胞轻轻拍散(约180ml),将其与360ml含有il-2 2000iu/ml、il-15 1000iu/ml、il-21 50iu/ml 和1.5%灭活血浆(灭活血浆添加量1-10%皆可实现实验目的,此处根据实际实验情况,添加1.5%)的x-vivo无血清细胞培养基(x-vivo15),一起装入到细胞培养袋(gt-t610,来自takara公司)中,确保终体积为540ml。同时进行细胞计数,监测细胞的生产状况。
116.1.7第四次补液
117.第9天,检测细胞浓度为4.95
×
106个/ml。将培养袋从细胞培养箱(37℃,co2浓度为5%)中取出,将细胞悬液均匀分至2个培养袋中,并等体积补充扩增培养基2(含有il-2 2000iu/ml、il-15 1000iu/ml、il-21 50iu/ml的x-vivo无血清细胞培养基),确保终体积为1080ml。将两袋细胞放入培养箱中继续培养。同时进行细胞计数,确定细胞的生产状况。
118.1.8第五次补液
119.第11天,检测细胞浓度为5.98
×
106个/ml。将培养袋从细胞培养箱(37℃, co2浓度为5%)中取出,等体积补充扩增培养基二(含有il-2 2000iu/ml、il-15 1000iu/ml、il-21 50iu/ml的x-vivo无血清细胞培养基),每袋体积为1080ml,总体积为2160ml。将两袋细胞放入培养箱中继续培养。同时进行细胞计数,确定细胞的生产状况。
120.1.9第六次补液
121.第13天,检测细胞浓度为6.93
×
106个/ml。将培养袋从细胞培养箱(37℃, co2浓度为5%)中取出,将细胞悬液均匀分至4个培养袋中,等体积补充扩增培养基二(含有il-2 2000iu/ml、il-15 1000iu/ml、il-21 50iu/ml的x-vivo无血清细胞培养基),每袋体积为1080ml,总体积为4320ml。将两袋细胞放入培养箱中继续培养。同时进行细胞计数,确定细胞的生产状况。
122.1.10检菌
123.细胞培养第15天,细胞浓度为9.14
×
106个/ml。对细胞悬液进行检菌和内毒素检测。结果表明,无菌,内毒素小于0.25eu/ml。
124.二、由脐血样本或骨髓制备nk细胞并检测
125.利用前述方法,从数个不同样品的不同接种浓度的单个核细胞扩增了nk细胞,并对所扩增的nk细胞进行检测。具体是,按照1.1和1.2的步骤对培养瓶进行预处理并分离外周血、脐血、骨髓的单个核细胞。
126.以1.0
×
106个/ml骨髓来源的单个核细胞、2.5
×
106个/ml外周血来源的单个核细胞和3.0
×
106个/ml脐血来源的单个核细胞的接种浓度,将细胞接种到按照实施例1 中1.1步骤预处理的培养瓶中。然后,按照实施例1中1.4至1.8相同的步骤进行六次扩增,并按照实施例1中1.9的步骤进行检菌。
127.最后,通过流式细胞试验,对所扩增的nk细胞进行检测。
128.三、细胞培养情况检测
129.在以上培养的过程中,在培养过程中对细胞密度进行监控,不同来源的单个核细胞在培养中的细胞扩增情况分别如以下表1-3所示:
130.表1.nk细胞扩增表(外周血样本)
[0131][0132]
表2.nk细胞扩增表(骨髓样本)
[0133][0134]
表3.nk细胞扩增表(脐血样本)
[0135][0136][0137]
根据扩增表(表1)即可获得增殖曲线(扩增曲线),外周血来源的单个核细胞的生长扩增曲线如图1所示。
[0138]
在培养过程中对nk细胞的比例进行监控,以对2.0
×
106个/ml密度接种的外周血来源的pbmc细胞进行培养为例,nk细胞比例变化如图2所示。对比第0天和第15天的nk细胞流式结果,如图3所示。显微镜下细胞照片为图4所示,a是第0 天,b是第15天。对第0天和第15天的激活性受体及抑制性受体进行流式检测,图5a是第0天激活性受体结果,图5b是第0天抑制性受体结果,图6a是第15天激活性受体结果,图6b是第15天抑制性受体结果。
[0139]
同样对其他来源的单个核细胞第0天和第15天的流式细胞检测结果进行对比。以1.0
×
106个/ml密度接种的骨髓来源的pbmc在培养期间,第0天及第15天的nk 细胞流式结果如图7所示。以3.0
×
106个/ml密度接种的脐血来源的pbmc在培养期间,第0天及第15天的nk细胞流式结果如图8所示。
[0140]
以上结果说明1.0
×
106个/ml-3.0
×
106个/ml的任何来源的单个核细胞,经过本发明所提供的方法,都可以得到1000倍左右的nk细胞(根据表1-3中总细胞数变化可知)。
[0141]
实施例2、实施例1所扩增得到的nk细胞的检测
[0142]
以对2.0
×
106个/ml密度接种pbmc细胞进行培养为例,对第15天收获细胞悬液进行杀伤功能、因子分泌及nk细胞体内分布的检测。
[0143]
一、肿瘤抑制试验
[0144]
试验步骤:
[0145]
取对数生长期的k562细胞株作为靶细胞,以5.0
×
105个/ml铺于96孔培养板中,每孔50μl。同时,每孔加入50μl浓度为2.5
×
106个/ml、5.0
×
106个/ml、1.0
×
107个 /ml的待测试nk细胞,使效靶比(实施例1制备的nk细胞和k562之比)分别为5:1、 10:1、20:1,n=3。
[0146]
1)具体的接种方式如下:
[0147]
实验组(a值):k562(100ul,5.0
×
105个/ml) 所制备的nk(100μl,2.5
×
106个/ml、5.0
×
106个/ml、1.0
×
107个/ml)
[0148]
ldh最大释放组:k562(100ul,5.0
×
105个/ml) x-vivo基础培养基(50μl) 10%总体积的ldh释放试剂
[0149]
ldh自然释放组:k562(100ul,5.0
×
105个/ml) x-vivo基础培养基(100μl)
[0150]
背景空白对照组:x-vivo基础培养基(200μl)
[0151]
将效靶比=5:1、10:1、20:1的nk细胞(效)、k562细胞(靶)加入96孔圆底板;同时设背景空白对照孔、ldh自然释放孔、ldh最大释放孔。上述各组均设3个复孔。
[0152]
2)离心500rpm/5min,使效靶细胞密切结合,置37℃、5%co2培养箱培养4 小时;
[0153]
3)到预定的检测时间点前1小时,从细胞培养箱里取出细胞培养板,在[ldh 最大释放孔]加入ldh释放试剂,加入量为原体积的10%。吹打均匀后放入培养箱继续培养;
[0154]
4)到预定时间后,将培养板400g/5min离心,分别取各孔上清120μl,加入到新的培养板中,随即进行样品检测;
[0155]
5)样品测定:
[0156]
①
各孔分别加入60μl ldh检测液;
[0157]
②
混匀,室温避光孵育30min(可用锡箔纸包裹后摇床震荡);
[0158]
③
490nm(如果酶标仪没有此波长选用450nm)处测定吸光度值,使用>
[0159]
600nm的任何波长进行双波长测定;
[0160]
④
计算nk细胞活性,nk杀伤活性=
[0161]
[(实验孔od-自然释放孔od)/(最大释放孔od-自然释放孔od)]*100%
[0162]
实验结果:
[0163]
在不同效靶比下,细胞杀伤活性的结果如表4、图9所示,该实验结果表明通过实施例1所培养得到的nk细胞在不同效靶比下均有较好的杀伤活性。
[0164]
表4.吸光度值结果(od
450nm-od
620nm
)
[0165]
[0166][0167]
二、细胞因子检测试验
[0168]
试验步骤:
[0169]
取对数生长期的k562细胞株作为靶细胞,以2.0
×
105个/ml铺于96孔培养板中,每孔50μl。同时,每孔加入100μl浓度为1.0
×
106个/ml、5.0
×
105个/ml、1.0
×
105个/ml的待测试nk细胞,使效靶比(实施例1制备的nk细胞和k562之比)分别为 10:1、5:1、1:1,n=3。
[0170]
1)具体的接种方式如下:
[0171]
实验组(a值):k562(50ul,2.0
×
105个/ml) 所制备的nk(100μl/孔,1.0
×
106个/ml、5.0
×
105个/ml、1.0
×
105个/ml)
[0172]
nk对照组:所制备的nk(100μl/孔,1.0
×
106个/ml、5.0
×
105个/ml、1.0
×
105个/ml) 1640基础培养基(50μl)
[0173]
将效靶比=10:1、5:1、1:1的nk细胞(效)、k562细胞(靶)加入96孔圆底板;同时设nk对照孔。上述各组均设3个复孔。
[0174]
6)离心200g/1min,使效靶细胞密切结合,置37℃、5%co2培养箱培养4小时;
[0175]
7)到预定时间后,将培养板400g/5min离心,分别取各孔上清备用,
[0176]
8)样品检测;
[0177]
9)样品测定(参照联科生物human ifn-γelisa kit检测试剂盒,货号: ek180-96):
[0178]
①
准备工作:准备所有的试剂和梯度稀释的标准品,板条加入300μl,1
×
洗液静置浸泡30秒;
[0179]
②
加样:标准品孔加入100μl 2倍倍比稀释的标准品,空白孔加入100μl培养基(0浓度),样本孔加入100μl细胞培养上清。每孔加入50μl1:100稀释的检测抗体;
[0180]
③
孵育:封膜,室温rpm300,孵育2小时后,洗涤6次;
[0181]
④
加hrp标记物:每孔加入100μl1:100稀释的辣根过氧化物酶标记的链霉亲和素;
[0182]
⑤
孵育:封膜,室温孵育45分钟后,洗涤6次;
[0183]
⑥
显色:每孔加入100μl显色底物,避光,室温孵育20-30分钟后,每孔加入100μl终止液;
[0184]
⑦
检测:30分钟内,在450nm波长检测od值,参考波长570nm或630nm。
[0185]
⑧
结果计算:
[0186]
计算标准品和样本的平均od值,然后减去零浓度标准品的od值。
[0187]
以标准品浓度为横坐标,od值为纵坐标,用计算机软件进行回归拟合生成标准曲线。回归分析确定最佳拟合曲线。
[0188]
实验结果:
[0189]
在不同效靶比下,nk细胞inf-γ分泌量有显著差异,结果如表5-6、图10所示,该实验结果表明通过实施例1所培养得到的nk细胞在不同效靶比下inf-γ的分泌均有升高。
[0190]
表5.标准曲线(od
450nm-od
570nm
)
[0191][0192]
表6.吸光度值结果(od
450nm-od
570nm
)
[0193][0194][0195]
三、nk细胞在免疫缺陷小鼠体内的监测
[0196]
6周龄雌性ncg小鼠6只,在动物房适应性饲养1周后,尾静脉注射nk 细胞2*10^7/鼠,给药当天记为day 0,各鼠分别在day 0(6h)、day 1、day 2、day3、day 5、day 7、day 9、day 11、day 14、day 17分别眼球采血100μl,edta 抗凝。取上述小鼠外周血样本100μl,加入1ml红细胞裂解液,离心5min,弃上清,pbs洗3遍,加入抗体(hcd45,hcd3,hcd56),混匀,避光孵育30min, pbs洗涤后混悬均匀,流式细胞仪上样检测,计数样本中nk细胞绝对数。可见,免疫缺陷小鼠静脉注射nk细胞后,以其day 0(给药后6h) 为起点,其外周血中的含量持续升高,至day 5时达到顶峰,是day 0时的12 倍,此后nk含量缓慢下降,至day 14时降至day 0时水平。nk细胞在免疫缺陷小鼠体内的变化如图11所示。
[0197]
实施例3、实施例1所扩增得到的nk细胞与药物的联合使用
[0198]
1、nk细胞与单抗联合对肿瘤细胞系的杀伤作用验证
[0199]
实验方案同上述肿瘤抑制试验步骤,实验时,除背景空白对照组、自发释放组及最大释放组外,实验组分为:
[0200]
1)nk细胞实验组,按效应细胞(nk细胞)和靶细胞(肿瘤细胞)的比例为:0.5:1、1:1、5:1、10:1,每孔加入肿瘤细胞和对应比例的nk细胞;
[0201]
2)nk细胞与单抗联合用药组,按效应细胞(nk细胞)和靶细胞(肿瘤细胞)的比例为:0.5:1、1:1、5:1、10:1,每孔加入肿瘤细胞和对应比例的 nk细胞,同时加入一定浓度的单抗(0.01
–
10.00μg/ml);
[0202]
3)nk细胞单抗组合物组,按效应细胞(nk细胞单抗组合物)和靶细胞(肿瘤细胞)的比例为:0.5:1、1:1、5:1、10:1,每孔加入肿瘤细胞与对应比例的nk细胞与单抗组合物(组合物数量按nk细胞数量计)。其余步骤均同上。
[0203]
2、在动物体内对肿瘤的作用的验证
[0204]
1)肿瘤细胞系免疫缺陷小鼠移植瘤模型的建立
[0205]
肿瘤细胞系(1*10^6
–
1*10^7)皮下注射或尾静脉注射于免疫缺陷小鼠体内 (如ncg小鼠),监测肿瘤体积大小或肿瘤荧光强度,在达到一定体积或荧光强度时,按其值大小对荷瘤鼠进行分组:1组为阴性对照组;2组为nk细胞治疗组;3组为单抗治疗组;4组为nk细胞和单抗联合用药组;5组为nk细胞单抗组合物组;每组6只小鼠。
[0206]
2)分组、给药及监测抗肿瘤作用
[0207]
分组后即开始给药,1组阴性对照组,静脉注射等体积pbs;2组nk细胞治疗组,静脉注射nk细胞,剂量为1*10^7nk细胞/鼠,每周给药1次,共给药4次;3组单抗治疗组,腹腔注射单抗,剂量为1-10mg/kg,每周1次,共给药4次;4组nk细胞和单抗联合用药组,静脉注射nk细胞,剂量为1*10^7 nk细胞/鼠,每周给药1次,共给药4次,同时,腹腔注射单抗,剂量为1-10mg/kg,每周1次,共给药4次;5组nk细胞单抗组合物组,静脉注射nk细胞单抗组合物,剂量按nk细胞计,为1*10^7细胞/鼠,每周给药1次,共给药4次。治疗期间,每周测量肿瘤体积或荧光强度2次,绘制肿瘤生长曲线及抑瘤率或生存曲线,每周测量小鼠体重2次。
[0208]
本发明将制备得到的nk细胞和pd1抑制剂联合,用于黑色素瘤、肝癌、肺癌、消化道肿瘤、妇科肿瘤、burkitt's淋巴瘤治疗,实验结果均验证了其在体外的细胞杀伤活性、及在体内的作用,均证明了其良好杀伤活性。
[0209]
本发明还将实施例1制备得到的nk细胞和her2单抗联合,用于乳腺癌、卵巢癌、子宫内膜癌、输卵管癌、胃癌和前列腺癌等疾病的治疗,实验结果均验证了其在体外的细胞杀伤活性、及在体内的作用,均证明了其良好杀伤活性。
[0210]
本发明还将实施例1制备得到的nk细胞和cd20单抗联合,用于滤泡性淋巴瘤(包括复发/难治性滤泡性淋巴瘤及新发滤泡性淋巴瘤)及弥漫大b细胞淋巴瘤(包括复发/难治性弥漫大b细胞淋巴瘤及新发弥漫大b细胞淋巴瘤)等疾病的治疗,实验结果均验证了其在体外的细胞杀伤活性、及在体内的作用,均证明了其良好杀伤活性。
[0211]
具体地,所述cd20的抗体药包括利妥昔单抗(rituximab,rtx,商品名:美罗华)、替伊莫单抗(ibritumomab,商品名:泽娃灵zevalin)、托西莫单抗 (tositumomab,商品名:bexxar)、奥法木单抗(ofatumumab,商品名:arzerra)、奥瑞珠单抗(ocrelizumab,商品名:ocrevus)以及阿妥珠单抗(obinutuzumab,商品名:gazyva)。
[0212]
本发明还将实施例1制备得到的nk细胞和cd38单抗联合,用于多发性骨髓瘤患者的治疗,实验结果均验证了其在体外的细胞杀伤活性、及在体内的作用,均证明了其良好杀伤活性。
[0213]
具体地,所述cd38单抗包括达雷妥尤单抗(daratumumab)、伊沙妥昔单抗(也即艾沙妥昔单抗,isatuximab)、tsk011010、sc-7325、sc-526499、sc-531872。
[0214]
本发明还将实施例1制备得到的nk细胞和claudin18.2单抗联合,用于 claudin18.2阳性的实体瘤患者(如胃癌、胰腺癌)的治疗,实验结果均验证了其在体外的细胞杀伤活性、及在体内的作用,均证明了其良好杀伤活性。
[0215]
具体地,所述claudin18.2单抗包括zolbetuximab(imab362,claudixmab)、 tst001、ab001、amg910、askb589、gb7004、bnt212、dr30303、dr30310、 cldn18.2
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。