1.本发明涉及检验检测技术领域,具体涉及一种肼类化合物及其制备方法和在溶酶体和自噬体中作为缓冲荧光探针(bfp)中的用途。
背景技术:
2.正常情况下,细胞内部存在不同的亚细胞器区室,这些亚细胞器以膜与周边细胞质隔开并发挥特定的功能,这些特定功能的发挥需要不同的ph值,因此同一细胞内不同区域的 ph 不尽相同。例如细胞核 p h 为 7.2-7.4,线粒体 ph约为8.0,高尔基体 ph为 6.0-6.7,溶酶体 p h 为4.0-5.5。了解和测定各个细胞器的ph的变化,对探索细胞内的分子作用机制与相关疾病起着至关重要的作用。
3.溶酶体作为真核细胞中一个重要的酸性细胞器, 是细胞的重要组成部分,包含超过 60 种的酸性水解酶、组织蛋白酶及各类特异性的膜蛋白,能够降解大分子和相关的细胞组分,参与质膜修复、蛋白降解、病原体清除以及细胞内吞与自噬等过程。不正常的溶酶体 ph或溶酶体ph的异常波动均会引起其功能失调及溶酶体功能缺陷,进而导致细胞功能紊乱,从而诱发溶酶体贮积病(台-萨氏综合征、ⅱ型糖原累积病、细胞内含物病等)、神经退行性疾病(阿尔茨海默)、休克、类风湿性关节炎、癌症等多种疾病。因此,动态监测溶酶体和溶酶体自噬过程的ph变化对于细胞内的生命活动分子机制以及与溶酶体相关的疾病诊断与治疗具有重要的意义。溶酶体作为细胞内的“消化器官”, 其相关研究一直是生命科学的热点之一。
4.细胞及细胞器中常见的ph检测方法有电化学传感法、核磁共振法(nmr)、表面增强拉曼法(sers)等。在这些方法中通常需要高精度的仪器,复杂的处理过程,从而限制了其在活细胞水平ph实时监测的应用。荧光检测法即荧光探针法,作为一种可用于亚细胞结构的研究强有力手段,具有无损检测、高时空分辨率、实时动态监控等优势,使其在生物成像分析中受到了广泛关注。
5.然而,现有溶酶体ph荧光探针,均存在各种各样的缺陷。如中性红系列(neutral red)、吖啶橙(acridine orange)、lysotracker等对溶酶体定位的特异性不强, 一旦溶酶体内 ph升高, 这类探针会离开溶酶体, 导致荧光淬灭;长时间与溶酶体共孵育还可能导致溶酶体内 ph升高。而根据溶酶体为物质代谢场所而设计的大分子荧光探针,则具有较强的毒性, 不适用于溶酶体的长期示踪。因此,开发低毒性,高灵敏度,高选择性,可在生理ph范围内变化实现实时动态监测,且不易漂白的新型溶酶体ph探针具有十分重大的价值。
技术实现要素:
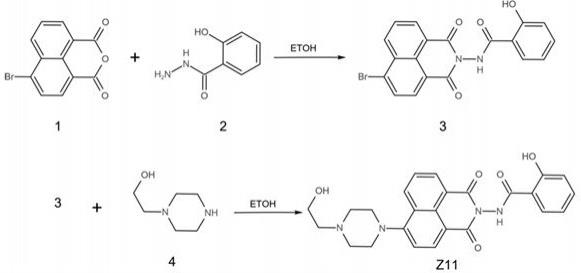
6.第一方面,本发明提供一种肼类化合物。
7.为实现上述目的,本发明的技术方案为:一种肼类化合物z11,具有如下所示化学结构:
。
8.第二方面,本发明提供上述化合物z11的制备方法。
9.化合物z11的制备方法,以水杨酰肼与4-溴1,8-萘二酸酐反应,然后再用4-羟乙基哌嗪取代溴制得;z11的合成路线如下所示:化合物z11的制备方法,以水杨酰肼与4-溴1,8-萘二酸酐反应,然后再用4-羟乙基哌嗪取代溴制得;操作步骤如下:(1)化合物3的合成:将化合物1溶于乙醇中,加入化合物2,搅拌回流4 h,放冷至室温,过滤,滤饼用乙醇(5 ml
×
2)洗涤,50℃减压烘干,得化合物3;(2)z11的合成:化合物3用dmso溶解后,加入n-(2-羟乙基)哌嗪和碳酸钠,搅拌升温至90℃反应,tlc监控,当化合物3的斑点消失后停止反应,放冷至室温,加纯化水稀释,加1 mol/l的盐酸调ph至6,过滤,滤饼先用纯化水洗涤,50℃减压烘干,收得化合物z11。
10.第三方面,本发明提供化合物z11在制备缓冲荧光探针(buffering fluorogenic probe,bfp)中的应用。
11.进一步,本发明提供化合物z11在制备溶酶体和/或自噬体或/和自噬过程稳定成像的缓冲荧光探针(bfp)中的应用。
12.本发明提供化合物z11在制备追踪溶酶体和/或自噬体或/和自噬过程ph变化的试剂盒中的应用。
13.本发明化合物z11可以制备成在生理ph范围的具有超长时间稳定成像的缓冲荧光探针(bfp)。
14.本发明化合物z11在制备和溶酶体和/或自噬体或/和自噬过程在生理ph范围的超长时间稳定成像的缓冲荧光探针(bfp)中的应用。
15.具体的说,本发明所述的化合物z11在制备生理ph范围的超长时间稳定成像的缓
冲荧光探针(bfp)中的应用,具体的生理ph范围荧光探针是指荧光变化(强度)与生理ph(ph5.4-ph7.4)呈良好的线性相关,为溶酶体或/和自噬体或和自噬过程的ph变化提供了良好的检测手段。
16.具体的说,本发明所述的新的生理ph范围的,超长时间稳定成像的缓冲荧光探针(bfp)中,具体的“缓冲荧光探针”(buffering fluorogenic probe,bfp)是指在被检测物(溶酶体或/和自噬体)外有较高的浓度形成缓冲池,荧光探针交换速率大于光漂白速率,以及在被检测物(溶酶体或/和自噬体)外部未与质子结合的探针不会产生显著的荧光信号。
17.有益效果本发明提供了一种化合物z11可以用于制备生理ph范围的超长时间稳定成像的缓冲荧光探针(bfp),具体的超长时间稳定成像是通过缓冲策略来实现的,即采用ph缓冲荧光探针”(buffering fluorogenic probe,bfp)的策略来解决溶酶体或/和自噬过程动态成像中光稳定性的问题。缓冲荧光探针在溶酶体或/和自噬体内被漂白,外部完整的探针交换进入溶酶体或/和自噬体继续进行荧光显色。该策略不仅提供了对新生成的被检测物(溶酶体或/和自噬体)进行荧光显色外,还确保了被检测物(溶酶体或/和自噬体)内部光漂白的荧光探针会被外部周围新的和完整的荧光探针有效取代,保证了荧光成像的稳定性。
附图说明
18.图1是化合物3的1h nmr谱图;图2 是z11的高分辨质谱(hrms);图3 是z11的红外光谱(ft-ir);图4 是z11的1h nmr谱图;图5 是z11的
13
c nmr谱图;图6 是z11(4.0μm)在dmso/tris-hcl(1:20,v/v)溶液中,ph 从2.0到11.0时的紫外吸收光谱谱图。插入的是可见光下,探针z11在ph为 5.4和ph 7.8的 dmso/tris-hcl(1:20,v/v)中的图像;图7 是z11(4.0μm)在dmso/tris-hcl(1:20,v/v)中,ph 从3.5到10(λ
ex
=405 nm,ex/em slit=3/3 nm)时的荧光光谱图。插入的是在紫外光(365 nm)下,探针z11在ph 为5.4和ph 7.8的dmso/tris-hcl(1:20,v/v)中的图像;图8 是z11(4.0μm)在530 nm处荧光强度与ph值(3.5-10.0)的非线性拟合图。插入的是z11在530nm处荧光强度与ph值(5.4-7.8)之间的线性关系,r2=0.9966,方程式:y=-42.937x 391.65;图9 是z11(4.0μm)在dmso/tris-hcl(1:20,v/v)中,ph从 5.4到ph 7.8时,在紫外灯(365nm)下观察的荧光变化以及可见光下颜色的变化图;图10 是z11(4.0μm)在ph 5.4、6.8和7.8的dmso/tris-hcl(1:20,v/v)中加入不同离子时的荧光强度响应(530nm):1:空白,2:hpo
42-,3:hco
3-,4:ch3coo-,5:cu
2
,6:hg
2
,7:br-,8:ca
2
,9:co
2
,10:cd
2
,11:na
,12:cl-,13:ni
2
,14:so4
2-,15:mg
2
,16:f-,17:fe
3
,18:zn
2
,19:ag
,20:mn
2
,21:pb
2
,22:k
,23:i-,24:fe
2
,25:no
3-,即z11复杂生理条件下的其他离子的干扰实验谱图;图11 是在不同ph(分别为5.4、6.8和7.8)下, z11(4.0μm)在dmso /tris-hcl(1:
20,v/v)中的荧光强度的时间过程,即z11在不同ph条件下的光照稳定性实验谱图;图12 是z11在(4.0μm)在dmso/tris-hcl(1:20,v/v)中,ph 在5.4和7.4之间变化时,其荧光强度的变化情况,即z11在不同ph的可逆性实验谱图;图13 是z11在dmso-d6溶液中,加入1当量的tfa-d1后的1h nmr图,即z11得核磁滴定图;图14 是采用gaussian 09软件,使用dft/b3lyp/6-31g(d,p)理论水平的密度泛函理论,对z11及z11-h
的homo和lumo轨道的能量计算谱图。z11的高占据分子轨道(homo)电子密度云分布在1,8-萘酰亚胺和哌嗪基团中,而z11-h
的homo主要位于1,8-萘酰亚胺基团上。z11和z11-h
的最外层占据分子轨道(lomo)均位于1,8-萘酰亚胺基上。此外,z11和z11-h
的能隙分别为2.37 ev和3.53 ev,并且变得更高;图15是采用cck-8法检测探针z11细胞毒性的结果,z11与a549细胞共孵育24 h,横坐标表示z11浓度,纵坐标表示对应的cck-8试剂在活细胞环境中发生呈色反应后用酶标仪测得的吸光度,吸光度的大小反映了活细胞的数量;图16是a549细胞用不同浓度z11染色后的荧光图像;图17是a549细胞用20 μm z11染色不同时间后的明场、荧光场以及叠加场图像;图18是溶酶体荧光共定位成像结果,dapi荧光染料标记细胞核,由蓝色通道显示,lyso-tracker red对溶酶体进行标示,由红色通道显示;z11的荧光成像由绿色通道显示。将三种通道的荧光图像进行叠加,可评估z11与lyso-tracker red重叠情况;图19是在改变细胞内ph的情况下,z11对a549细胞的成像情况;图20是用z11对a549细胞染色后,不用pbs缓冲液洗涤,直接在荧光显微镜下观察,e组在荧光显微镜的激发光源下一直照射,ue组在采像结束后关闭光源,两组在0 min、5 min、10 min、15 min定时采像结果。
具体实施方式
19.下面通过具体实施例对本发明进行具体描述,在此指出以下实施例只用于对本发明进行进一步说明,不能理解为对本发明保护范围的限制,本领域的技术熟练人员可以根据上述发明内容对本发明作出一些非本质的改进和调整。本发明所用原料及试剂均为市售产品。除特殊说明外,本发明所述份数均为重量份,所述百分比均为质量百分比。
20.本发明提供了一种生理ph范围,超长时间稳定成像的缓冲荧光探针,其中的羟乙基哌嗪及水杨酰基部分为溶酶体靶向,n-羟乙基哌嗪作为ph响应基团,在质子化前后分子内电荷发生了很大的变化,使z11能够测量溶酶体或/和自噬体或/和自噬过程的ph值。并能够应用于溶酶体或/和自噬体的自噬过程的ph变化成像。
21.根据本技术的生理ph范围,超长时间稳定成像的缓冲荧光探针合成方法的实施方案中,z11属于生理ph范围的溶酶体荧光探针,具有超长时间稳定成像,有缓冲作用,光稳定性好,不易被漂白,有很好的荧光响应以及较低的荧光毒性。并能长时间监控溶酶体或/和自噬体或/和自噬过程的ph变化。
22.化合物z11的合成水杨酰肼与4-溴1,8-萘二酸酐反应,然后再用4-羟乙基哌嗪取代溴而得到。z11的合成路线如下所示。
23.化合物3的合成:将2.77 g(0.01mol)化合物1于混悬30 ml乙醇中,加入1.67 g(0.011mol)化合物2,搅拌回流4 h,放冷至室温,过滤,滤饼用乙醇(5 ml
×
2)洗涤,50℃减压烘干,收得3.62 g化合物3。收率:88%。熔点:超过250℃ 1
h nmr(附图1)z11的合成:取0.822 g(0.002 mol)化合物3,4 ml加入dmso溶解后,加入0.32 g(0.0024mol)n-(2-羟乙基)哌嗪和1.272 g(0.006 mol)碳酸钠,搅拌升温至90℃反应,tlc监控(乙酸乙酯/石油醚:1/2),当化合物3的斑点消失后停止反应。放冷,加纯化水30 ml,加1 mol/l的盐酸调ph至6,过滤,滤饼先用纯化水(10 ml
×
3)洗涤,50℃减压烘干,收得0.71化合物z11,收得化合物0.82 g。收率:90%。熔点:223.4~226.4℃ ,hrms见附图2,hrms(positive-esims)calcd for c
24h25
o5n4(m h)
:46.1825,found:461.1813。ft-ir见附图3。1h nmr附图4,1h nmr (600 mhz, dmso-d6) δ 11.33 (s, 1h), 8.54 (d, j = 7.2 hz, 1h), 8.51 (d, j = 8.4 hz, 1h), 8.46 (d, j = 8.1 hz, 1h), 8.00 (dd, j = 7.9, 1.5 hz, 1h), 7.88
ꢀ–ꢀ
7.84 (m, 1h), 7.54
ꢀ–ꢀ
7.49 (m, 1h), 7.37 (d, j = 8.2 hz, 1h), 7.05 (d, j = 8.3 hz, 1h), 7.01 (t, j = 7.5 hz, 1h), 4.54 (s, 1h), 3.60 (t, j = 6.2 hz, 2h), 3.29 (s, 4h), 2.78 (s, 4h), 2.56 (t, j = 6.2 hz, 2h)。
13
c nmr见附图5,
13
c nmr (151 mhz, dmso-d6) δ 167.02, 161.72, 159.45, 156.85, 133.47, 131.92, 131.88, 129.73, 126.62, 125.90, 122.73, 119.58, 117.90, 115.64, 115.43, 115.25, 60.63, 59.02, 53.56, 53.11。
24.的荧光性能评价对探针在不同ph条件下的紫外光谱和荧光光谱进行研究,取z11,加不同ph 的dmso/tris-hcl(1:20,v/v)溶液溶解并稀释制成浓度为4μmol/l的溶液,进行350 nm-550 nm范围内的紫外吸收光谱扫描及荧光光谱测定(λ
ex
=405 nm,夹缝3 nm),记录450 nm-650 nm范围内的荧光光谱。紫外扫描见附图6。荧光光谱见附图7。在紫外光谱中,随着ph的降低,吸收光谱会发生红移,吸光度也有所降低。在荧光光谱中,530 nm是z11的最大荧光发射波长,随着ph的降低,其荧光强度升高。根据荧光光谱数据,对530 nm的荧光强度和ph进行非线性拟合和线性曲线拟合,结果见附图8(插入为线性拟合图)。随着ph的升高,z11在530 nm处的荧光增强了23倍。在ph 5.4~7.8 范围内,z11在530 nm的荧光强度与ph呈良好的线性相关。其线性方程为:y=-42.937x 391.65,相关系数r=0.9966。取ph 5.4~7.8的z11溶液,分别置365 nm的紫外灯和可见光下面观察,结果见附图9,随着ph的降低,其荧光逐渐增强,逐
渐从无色透明变成变黄色透明溶液。
25.干扰实验在浓度为4.0μm,ph分别为5.4,ph6.8和ph7.8,溶剂为dmso/tris-hcl(1:20,v/v)的z11溶液中,加入不同浓度的干扰物质,测定其荧光光谱,见附图10,图中标示分别为1:blank,2:hpo
42
‑ꢀ
(2.0 mm),3:hco3‑ (2.0 mm),4:ch3coo
‑ꢀ
(2.0 mm),5:cu
2 (2.0 mm),6:hg
2 (2.0 mm),7:br
‑ (2.0 mm),8:ca
2 (2.0 mm),9:co
2 (2.0 mm),10:cd
2 (0.2 mm),11:na
(1.5 m),12:cl
‑ (1.5 m),13:ni
2 (0.2 mm),14:so
42
‑ (0.2 mm),15:mg
2 (2.0 mm),16:f
‑ (2.0 mm),17:fe
3 (2.0 mm),18:zn
2 (2.0 mm),19:ag
(2.0 mm),20:mn
2 (2.0 mm),21:pb
2 (2.0 mm),22:k
(150 mm),23:i
‑ (2.0 mm),24:fe
2 (2.0 mm),25:no3‑ (2.0 mm)。结果表明,探针z11在ph5.4,ph6.8和ph7.8的溶液中均能保持可忽略变化的荧光信号,说明探针z11对h 的选择性良好。
26.光稳定性及可逆性实验取浓度为4.0μm,ph为5.4,ph6.8和ph7.8,溶剂为dmso/tris-hcl(1:20,v/v)的z11溶液,用荧光光谱仪连续照射120 min,分别于0 min,5 min,10 min,15 min,30 min,45 min,60 min,80 min,100 min,和120 min测定其荧光光谱,见附图11。结果表明,探针z11在ph5.4、ph6.8和ph7.8的溶液中,照射120 min稳定。取浓度为4.0μm,溶剂为dmso/tris-hcl(1:20,v/v)的z11溶液,加盐酸和氢氧化钠交替调ph至5.4和7.8,测定其荧光光谱,见附图12,结果表明,z11在5.4和7.8能稳定的交替的产生和淬灭荧光,其可逆性良好。
27.核磁滴定及荧光产生机理研究为了研究z11对ph的响应性,对z11的核磁滴定进行了研究。在z11的dmso-d6溶液中,加入等当量的氘代三氟乙酸(tfa-d),记录其1h nmr图并与z11的1h nmr比较,见附图13,从图中可以看出,2位和3位的质子峰发生了明显的化学位移,而1位和4位的质子,因为受到相邻碳原子和氢原子的影响,而化学位移有所变化。表明加入酸性质子(调节ph)首先和z11中链接羟乙基的氮原子结合而产生荧光。其pka为6.1。
28.为了解z11酸化前后的光物理性质,对z11和酸化后的z11-h
进行了密度泛函数理论(dft)的计算。采用gaussian 09软件,使用dft/b3lyp/6-31g(d,p)理论水平的密度泛函理论,计算了z11和z11-h
的homo和lumo轨道的能量。结果见附图14。在为酸化之前,z11的高占据分子轨道(homo)电子密度云分布在1,8-萘酰亚胺和哌嗪基团中,而低占据分子轨道(lomo)位于1,8-萘酰亚胺基团,激发时的电子的转移造成pet现象,抑制了z11的荧光。酸化后的z11-h
,其高占据分子轨道(homo)和低占据分子轨道(lomo)电子密度云分布在1,8-萘酰亚胺和哌嗪基团中,激发时电子转移收到抑制,pet过程也就受到抑制,导致荧光增强。此外,z11和z11-h
的能隙分别为2.37 ev和3.53 ev,变得更高,说明随着ph值的降低,吸收光谱会发生红移,与紫外吸收光谱实验结果一致。
29.细胞毒性实验探针z11对a549细胞的毒性通过cck-8法测得,将a549细胞爬版到96孔板上,每孔细胞数为1
×
103,培养液体积维持在100μl,在37℃,5%co2气体环境中孵育12 h,每5个孔加入一定浓度的探针(0 μm、5 μm、10 μm、20 μm、30μm、40 μm、50 μm、60 μm、70 μm、80 μm),然后继续孵育24 h,再向每孔中加入100μl cck-8试剂继续孵育3个小时,最后用酶标仪测得各孔在450 nm 波长下的吸光度,绘制出各浓度对应的吸光度的柱状图。结果见附图15,结
e组荧光随着时间延长,荧光开始变弱,这是因为在强度极高的激发光源刺激下,z11发生了光漂白,ue组的荧光随着时间延长,荧光强度没有明显变化,这是因为每次采像时细胞内的z11发生光漂白后,细胞环境中未受激发光源照射的z11可以补充到细胞内,实现稳定成像。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
