1.本发明属于生物技术领域,具体涉及一种临床级自体尿源干细胞培养基及其应用。
背景技术:
2.尿源干细胞是一种新型的肾脏上皮来源的干细胞,由于其可通过自体尿液无创获取,来源广泛易得,增殖分化能力旺盛,无免疫排斥等优势,在干细胞治疗领域受到广泛关注,它是组织修复、材料以及疾病模型研究上的理想种子细胞。
3.尿源干细胞具有自我更新能力和向脂肪、骨、软骨、平滑肌、骨骼肌、神经等多谱系分化的潜能。它的发现和研究是干细胞治疗领域的重要进展之一。
4.截至2022年,尿源干细胞的有效治疗疾病覆盖泌尿生殖道损伤(膀胱、尿路、肾脏等)、神经系统损伤、骨骼肌及运动系统、骨再生领域等,而且它所能治疗的疾病种类还在不断地增加。自体尿液获取简易,无创,可大量获取,一旦需要使用时,不需配型,细胞增殖活力强,无免疫排斥的危险,移植成活率高,医疗成本低。
5.尿源干细胞移植治疗泌尿生殖系统疾病,主要表现在尿源干细胞在泌尿道发育及损伤的修复中发挥作用。植入到泌尿系统后,可整合入组织,促增殖与区域分化,分化产生的子代细胞将逐渐替代有缺陷或死亡的细胞。因此,尿源干细胞是膀胱、尿路、肾脏等泌尿生殖道器官疾病治疗的理想种子细胞。
6.中国发明专利cn102925409a与cn102925409b公开了一种尿液间充质干细胞的提取及扩增培养方法和应用。技术手段涉及从人的尿液中分离间充质干细胞,并在含有细胞生长因子的培养基中培养和扩增尿液间充质干细胞,用以修复多种组织器官损伤。
7.中国发明专利cn107254432a与cn107254432b公开了一种同时分离尿源性干细胞两种亚群的培养基、分离方法及应用。技术手段涉及通过优化分离培养方法,有效分离培养两种形态稳定、功能不同的尿源性干细胞亚群,不仅为组织工程和细胞治疗提供了良好的种子细胞来源,也为尿源性干细胞的临床应用提供了科学依据和理论基础。
8.尿源干细胞的临床应用前景广阔。虽然目前公开的各类尿源干细胞制备方法虽均能获得干细胞,但都不符合临床应用的标准,限制了其在临床治疗上的进一步应用。尤其是胎牛血清因获取量大、污染轻而被广泛应用,但近年随着人畜共患病发病率的增加,以异种血清培养的组织向临床应用的安全性受到质疑,因此自体血清培养越来越受到重视。如何通过不添加异体动物源成分,获得大量患者自体来源的高增殖、高分化潜能的尿源干细胞是其临床应用的基础。
技术实现要素:
9.为了解决现有技术存在的问题,本发明提供了一种临床级自体尿源干细胞培养基及其应用,在保持尿源干细胞良好干细胞特性、增殖能力的基础上,从尿液采集开始直至尿源干细胞制备完成的全过程实现了自体治疗、临床级的系统操作流程,以实现尿源干细胞
的临床标准产品。
10.本发明的目的是提供一种临床级自体尿源干细胞培养基。
11.本发明的另一目的是提供上述临床级自体尿源干细胞培养基的应用。
12.根据本发明的具体实施方式的临床级自体尿源干细胞培养基,所述临床级自体尿源干细胞培养基包括以下原料:df-12基础培养基,双抗溶液,胰岛素-转铁蛋白,硒溶液,纤连蛋白,乙醇胺,叶酸,氢化可的松,肾上腺素,甲状腺素,人表皮生长因子,血小板衍生生长因子,成纤维细胞生长因子和自体血清。
13.进一步的,所述原料重量体积配比如下:
14.df-12基础培养基,双抗溶液0.5-20%wt,胰岛素-转铁蛋白0.5-20ug/ml,硒溶液0.5-20ug/ml,纤连蛋白0.5-20ug/ml,乙醇胺0.5-20ug/ml,叶酸0.5-20ng/ml,氢化可的松0.5-20um,肾上腺素0.5-20ug/ml,甲状腺素0.5-20ng/ml,人表皮生长因子0.5-20ng/ml,血小板衍生生长因子0.5-20ng/ml,成纤维细胞生长因子0.5-20ng/ml和自体血清0.5-20%。
15.进一步的,所述自体血清的制备方法包括:供者自体采血,室温静置25-35min,离心分离,吸取上清液,50-60℃水浴灭活补体后,冷藏保存待用。
16.进一步的,每1
×
106个细胞使用所述培养基1~30ml。
17.所述的临床级自体尿源干细胞培养基在培养尿源干细胞中的应用。
18.进一步的,所述应用包括一下步骤:
19.(1)提取尿源干细胞,得到细胞沉淀物;
20.(2)将步骤(1)得到的细胞沉淀物用所述临床级自体尿源干细胞培养基重悬,细胞培养箱中进行培养;观察后续细胞克隆形成情况,补充所述临床级自体尿源干细胞培养基,出现克隆时进行全换液,待细胞克隆长满后,使用胰酶消化传代,吸除胰酶,用所述临床级自体尿源干细胞培养基重悬,接种于新的培养容器中,记为第1代,此后传代方法同第1代。继续使用胰酶消化传代,吸除胰酶,用所述临床级自体尿源干细胞培养基重悬,接种于新的培养容器中,记为第2代。
21.进一步的,步骤(1)中,使用无菌培养瓶收集尿液,第一次离心分离,弃上清,pbs洗涤,再次离心分离,弃上清,得到细胞沉淀物。
22.进一步的,第一次离心分离具体为1200rpm离心10min,再次离心分离具体为1200rpm离心10min。
23.进一步的,步骤(2)中,细胞沉淀物用所述临床级自体尿源干细胞培养基重悬,每孔2ml铺板于0.1%明胶提前包被好的六孔板中,37℃细胞培养箱进行培养,记为第0代第1天;观察后续细胞克隆形成情况,补充所述临床级自体尿源干细胞培养基,出现克隆时进行全换液,待细胞克隆长满后,使用胰酶消化传代,吸除胰酶,所述临床级自体尿源干细胞培养基吹打重悬,接种于新的六孔板内,记为第1代。
24.进一步的,观察后续细胞克隆形成情况,第3天每孔加1ml培养基,第7天出现克隆时进行全换液,所述全换液具体为:吸出培养基,pbs洗涤1次,加入2ml所述临床级自体尿源干细胞培养基,待一个细胞克隆长满10x物镜下视野,使用0.25%胰酶消化传代,消化时间小于30秒,吸除胰酶,2ml所述临床级自体尿源干细胞培养基吹打重悬,接种于新的六孔板内,记为第1代。
25.与现有技术相比,本发明具有如下有益效果:
26.(1)本发明的尿源干细胞培养基不含动物源成分,所用成分源于同一供者自体,操作简单易行,可用于患者自体后续的临床级治疗。
27.(2)本发明的临床级自体尿源干细胞培养基为临床级培养基,维持了尿源干细胞的间充质干细胞特性与旺盛的增殖能力。
28.(3)此培养基成分取材于供者,降低了成本,其生产成本可以控制在国内外同类型培养基价格1/2左右。
附图说明
29.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
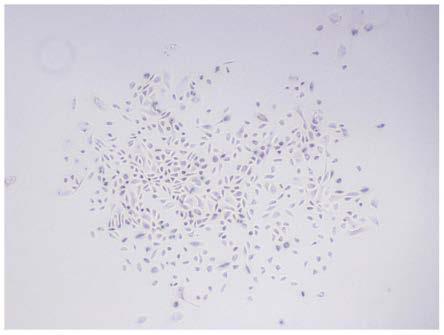
30.图1显示使用本发明的培养基原代提取的usc克隆形成图;
31.图2为采用实施例1的培养基培养得到的第1代尿源干细胞(usc)的形态结构图;
32.图3为采用实施例2的培养基培养得到的第1代尿源干细胞(usc)的形态结构图;
33.图4为采用实施例3的培养基培养得到的第1代尿源干细胞(usc)的形态结构图;
34.图5为采用对比例1的培养基培养得到的第1代尿源干细胞(usc)的形态结构图;
35.图6为采用对比例2的培养基培养得到的第1代尿源干细胞(usc)的形态结构图;
36.图7为培养得到的第7代尿源干细胞(usc)的形态结构图;
37.图8为尿源干细胞(usc)的msc表面标记物鉴定结果图。
具体实施方式
38.为使本发明的目的、技术方案和优点更加清楚,下面将对本发明的技术方案进行详细的描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施方式,都属于本发明所保护的范围。
39.本发明中的试剂或其他原料除特殊说明外,均为普通市售商品。
40.在一些较为具体的实施方案中,所述临床级自体尿源干细胞培养基包括以下原料,所述原料重量体积配比如下:
41.df-12基础培养基,双抗溶液0.5-20%wt,胰岛素-转铁蛋白0.5-20ug/ml,硒溶液0.5-20ug/ml,纤连蛋白0.5-20ug/ml,乙醇胺0.5-20ug/ml,叶酸0.5-20ng/ml,氢化可的松0.5-20um,肾上腺素0.5-20ug/ml,甲状腺素0.5-20ng/ml,人表皮生长因子0.5-20ng/ml,血小板衍生生长因子0.5-20ng/ml,成纤维细胞生长因子0.5-20ng/ml和自体血清0.5-20%。
42.进一步的,所述自体血清的制备方法包括:供者自体采血,室温静置25-35min,离心分离,吸取上清液,50-60℃水浴灭活补体后,冷藏保存待用。
43.进一步的,每1
×
106个细胞使用所述培养基1~30ml。
44.所述的临床级自体尿源干细胞培养基在培养尿源干细胞中的应用。
45.进一步的,所述应用包括一下步骤:
46.(1)提取尿源干细胞,得到细胞沉淀物;
47.(2)将步骤(1)得到的细胞沉淀物用所述临床级自体尿源干细胞培养基重悬,细胞培养箱中进行培养;观察后续细胞克隆形成情况,补充所述临床级自体尿源干细胞培养基,出现克隆时进行全换液,待细胞克隆长满后,使用胰酶消化传代,吸除胰酶,用所述临床级自体尿源干细胞培养基重悬,接种于新的培养容器中,记为第1代,此后传代方法同前。
48.进一步的,步骤(1)中,使用无菌培养瓶收集尿液,第一次离心分离,弃上清,pbs洗涤,再次离心分离,弃上清,得到细胞沉淀物。
49.进一步的,第一次离心分离具体为1200rpm离心10min,再次离心分离具体为1200rpm离心10min。
50.进一步的,步骤(2)中,细胞沉淀物用所述临床级自体尿源干细胞培养基重悬,每孔2ml铺板于0.1%明胶提前包被好的六孔板中,37℃细胞培养箱进行培养,记为第0代第1天;观察后续细胞克隆形成情况,补充所述临床级自体尿源干细胞培养基,出现克隆时进行全换液,待细胞克隆长满后,使用胰酶消化传代,吸除胰酶,所述临床级自体尿源干细胞培养基吹打重悬,接种于新的六孔板内,记为第1代。
51.进一步的,观察后续细胞克隆形成情况,第3天每孔加1ml培养基,第7天出现克隆时进行全换液,所述全换液具体为:吸出培养基,pbs洗涤1次,加入2ml所述临床级自体尿源干细胞培养基,待一个细胞克隆长满10x物镜下视野,使用0.25%胰酶消化传代,消化时间小于30秒,吸除胰酶,2ml所述临床级自体尿源干细胞培养基吹打重悬,接种于新的六孔板内,记为第1代。
52.以下通过实施例并结合附图进一步详细说明本发明的技术方案。然而,所选的实施例仅用于说明本发明,而不限制本发明的范围。
53.实施例1
54.本实施例提供了一种临床级自体尿源干细胞培养基包括以下原料,重量体积配比如下:
55.df-12基础培养基,双抗溶液20%wt,胰岛素-转铁蛋白20ug/ml,硒溶液0.5ug/ml,纤连蛋白0.5ug/ml,乙醇胺20ug/ml,叶酸0.5ng/ml,氢化可的松20um,肾上腺素0.5ug/ml,甲状腺素20ng/ml,人表皮生长因子0.5ng/ml,血小板衍生生长因子20ng/ml,成纤维细胞生长因子0.5ng/ml和自体血清20%。
56.自体血清的制备方法包括:供者自体采血,室温静置35min,离心分离,吸取上清液,50℃水浴灭活补体后,冷藏保存待用。
57.上述的临床级自体尿源干细胞培养基在培养尿源干细胞中的应用包括一下步骤:
58.(1)提取尿源干细胞,得到细胞沉淀物;
59.(2)将步骤(1)得到的细胞沉淀物用所述临床级自体尿源干细胞培养基重悬,细胞培养箱中进行培养;观察后续细胞克隆形成情况,补充所述临床级自体尿源干细胞培养基,出现克隆时进行全换液,待细胞克隆长满后,使用胰酶消化传代,吸除胰酶,用所述临床级自体尿源干细胞培养基重悬,接种于新的培养容器中,记为第1代,此后传代方法同前。
60.实施例2
61.本实施例提供了一种临床级自体尿源干细胞培养基包括以下原料,重量体积配比如下:
62.df-12基础培养基,双抗溶液0.5%wt,胰岛素-转铁蛋白0.5ug/ml,硒溶液20ug/
ml,纤连蛋白20ug/ml,乙醇胺0.5ug/ml,叶酸20ng/ml,氢化可的松0.5um,肾上腺素20ug/ml,甲状腺素0.5ng/ml,人表皮生长因子20ng/ml,血小板衍生生长因子0.5ng/ml,成纤维细胞生长因子20ng/ml和自体血清0.5。
63.自体血清的制备方法包括:供者自体采血,室温静置25min,离心分离,吸取上清液,60℃水浴灭活补体后,冷藏保存待用。
64.实施例3
65.本实施例提供了一种临床级自体尿源干细胞培养基包括以下原料,重量体积配比如下:
66.df-12基础培养基,双抗溶液10%wt,胰岛素-转铁蛋白10ug/ml,硒溶液10ug/ml,纤连蛋白10ug/ml,乙醇胺10ug/ml,叶酸10ng/ml,氢化可的松10um,肾上腺素10ug/ml,甲状腺素10ng/ml,人表皮生长因子10ng/ml,血小板衍生生长因子10ng/ml,成纤维细胞生长因子10ng/ml和自体血清10%。
67.自体血清的制备方法包括:供者自体采血,室温静置30min,300rpm离心15min,吸取血清,56℃水浴30min灭活补体后,放置4℃保存待用。
68.对比例1
69.本对比例与实施例3的区别在于:本对比例培养基的原料中不含有血小板衍生生长因子,其他原料添加量与实施例3均相同。
70.对比例2
71.本对比例与实施例3的区别在于:本对比例培养基的原料中不含有硒溶液,其他原料添加量与实施例3均相同。
72.对比例3
73.本对比例与实施例3的区别在于:本对比例培养基的原料中不含有纤连蛋白,其他原料添加量与实施例3均相同。
74.对比例4
75.本对比例与实施例3的区别在于:本对比例培养基的原料中不含有乙醇胺,其他原料添加量与实施例3均相同。
76.对比例5
77.本对比例与实施例3的区别在于:本对比例培养基的原料中不含有叶酸,其他原料添加量与实施例3均相同。
78.实施例4
79.本实施例提供了一种临床级自体尿源干细胞培养基培养尿源干细胞的方法,具体如下:
80.(1)自体血清采集与灭活:供者自体采血4管(生化管),室温静置30min,300rpm离心15min,吸取血清,56℃水浴30min灭活补体后,放置4℃保存待用。
81.(2)配置临床级自体尿源干细胞培养基:df-12基础培养基,双抗溶液0.5-20%wt,胰岛素-转铁蛋白0.5-20ug/ml,硒溶液0.5-20ug/ml,纤连蛋白0.5-20ug/ml,乙醇胺0.5-20ug/ml,叶酸0.5-20ng/ml,氢化可的松0.5-20um,肾上腺素0.5-20ug/ml,甲状腺素0.5-20ng/ml,人表皮生长因子0.5-20ng/ml,血小板衍生生长因子0.5-20ng/ml,成纤维细胞生长因子0.5-20ng/ml,自体血清0.5-20%。
82.(3)尿源干细胞提取与培养:使用t75无菌培养瓶收集尿液200ml左右,50ml离心管分装,1200rpm离心10min,弃上清,pbs洗涤,再次1200rpm离心10min,弃上清,细胞沉淀用12ml培养基重悬,每孔2ml铺板于0.1%明胶提前包被好的六孔板中,放置5%,37℃细胞培养箱。记为第0代第1天(p0-day1)。第3天每孔加1ml培养基,观察后续细胞克隆形成情况。大约第7天左右出现克隆(采用实施例3的培养基进行培养的usc形态结构如图1所示),从图1中可以看出,使用本发明的尿源干细胞培养基原代提取usc,体外培养第7天时形成usc克隆;此时进行全换液,具体为,吸出培养基,pbs洗涤1次,加入2ml培养基。待一个细胞克隆长满10x物镜下视野,使用0.25%胰酶消化传代(消化时间小于30秒),吸除胰酶,2ml培养基吹打重悬,接种于新的六孔板内,记为第1代(p1)。
83.采用实施例1的培养基进行培养的usc(尿源干细胞)形态结构如图2所示;
84.采用实施例2的培养基进行培养的usc(尿源干细胞)形态结构如图3所示;
85.采用实施例3的培养基进行培养的usc(尿源干细胞)形态结构如图4所示;
86.采用对比例1的培养基进行培养的usc(尿源干细胞)形态结构如图5所示;
87.采用对比例2的培养基进行培养的usc(尿源干细胞)形态结构如图6所示;
88.从图5和图6中可以看出,采用对比例1和对比例2的培养基进行培养尿液干细胞,没有成功;采用对比例3-5的培养基进行培养尿液干细胞,也没有成功;从图2-4中可以看出,第1代usc 100%融合,长满整个培养皿,增殖旺盛,采用本发明的培养基对尿源干细胞进行培养,可短期获取大量细胞;此后传代方法同前。
89.采用实施例3的培养基进行培养的第7代usc形态结构如图7所示;从图中可以看出,第7代usc 100%融合,长满整个培养皿,增殖旺盛。
90.对采用实施例3的培养基进行培养的第7代usc的msc表面标记物进行鉴定,结果如图8所示。结果显示usc阳性表达msc特异性表面标记物cd29、cd73、cd90、cd44,阳性表达多潜能干性标记物ssea-4,其造血干细胞、内皮细胞来源的标记物cd45、cd34、cd31、hla-dr等均阴性,说明该培养条件下的usc干细胞特性稳定。
91.以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
