binding affinity of several phytocannabinoids do not explain their effects on neural cell cultures”,neurotoxicology and teratology,2014,第46卷,第49-56页)。δ
9-四氢大麻酚(thc)与大麻二酚(cbd)(sativex,nabiximols)的组合用于治疗多发性硬化症相关的痉挛,并且作为晚期癌症患者的有效的止痛剂。最近,纯化的大麻二酚(cbd)被批准为用于治疗癫痫的孤儿药。cb1受体拮抗剂为食欲抑制剂,增强认知并且控制成瘾行为。选择性cb2激动剂可作为出色的止痛剂和免疫调节剂,其不存在与cns cb1激动相关联的不良的精神活性作用。已证明,δ
9-四氢大麻酚(thc)(屈大麻酚)在单药治疗或与昂丹司琼(zofran,5-ht3拮抗剂)以及与丙氯哌嗪(多巴胺d2受体拮抗剂)联合使用以治疗癌症患者接受化疗所引起的恶心和呕吐方面临床有效性(m.b.may和a.e glode,“dronabinol for chemotherapy-induced nausea and vomiting unresponsive to antiemetics”,cancer management and research,2016,第8卷,第49-55页)。
7.用作治疗剂的大麻素由大麻(cannabis sativa)油的分馏获得,或由芳族化合物和萜烯起始材料全合成获得。由于大麻油中包含60多种不同的天然产物,此类油分馏需要进行大量层析纯化,以提供基本上纯(纯度>99%)的任何单一成分,并且如此众多的成分使其生产和储存难以重现。例如,从其他大麻成分中(特别是从异构体δ
8-四氢大麻酚)中纯化δ
9-四氢大麻酚(thc)效率低下且成本高昂。此外,由于大麻油中的许多大麻素作为cb1和cb2受体中的任一者或两者的完全、部分、反向或中性激动剂或拮抗剂具有不同的作用,因此各种分离的天然产物中不含显著水平(低于ppm级)的任何其他大麻素天然产物(其具有不希望的生物学效应)并且确定的质量标准得到高效重现尤其重要。更复杂的是,获得的许多大麻素天然产物为油状物,通常无法结晶,并且易于空气氧化降解,其分离需要使用大量昂贵且难以规模化应用的色谱法和/或衍生化(例如参见:b.trawick和m.h.owens,“process for the preparation of(-)-delta 9-tetrahydrocannabinol”,wo 2009/099868 a1;巨arslantas和u.weigl,“method for obtaining pure tetrahydrocannabinol”,美国专利7,923,558 b2;j.e.field、j.oudenes、b.l.gorin、r.orprecio、f.e.silva e souza、n.j.ramjit和e.-l.moore,“separation of tetrahydrocannabinols”,美国专利7,321,047 b2;p.bhatarah、k.j.batchelor、d.mchattie和a.k.greenwood,“delta 9tetrahydrocannabinol derivatives”,wo 2008/099183 a1;d.c.burdick、s.j.collier、f.jos、b.biolatto、b.j.paul、h.meckler、m.a.helle和a.j.habershaw,“process for production of delta-9-tetrahydrocannabinol”,美国专利7,674,922 b2)。
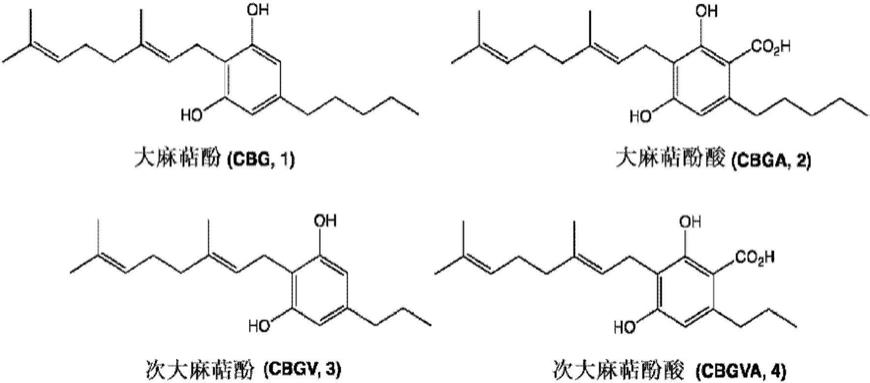
8.大麻素大麻萜酚(cbg,1)、大麻萜酚酸(cbga,2)、次大麻萜酚(cbgv,3)、次大麻萜酚酸(cbgva,4)也已经以不同的纯度从大麻油(cannabis sativa)中得到分离和表征。大麻萜酚(cbg,1)是大麻植物中的第二种主要植物大麻素。
[0009][0010]
制备大麻素的许多已知的合成路线使用昂贵的试剂,并且在大规模使用时不经济,或依赖于单萜起始材料与烷基间苯二酚衍生物诸如5-正戊基间苯二酚(橄榄醇)在酸性反应条件下的缩合反应,这些反应经常产生源于碳鎓离子重排反应和/或副反应的副产物。例如,通过布朗斯特酸或路易斯酸催化的缩合反应由橄榄醇和单萜生产δ
9-四氢大麻酚(thc)的过程由于异构体δ
8-四氢大麻酚及其他杂质的同时形成而变得复杂化。此类杂质也相当复杂,并且提高了获得基本上纯的大麻素活性药物成分的成本(例如参见:r.k.razdan,“the total synthesis of cannabinoids”,收录于“the total synthesis of natural products”,j.apsimon主编,1996,第4卷,第185-262页,new york,n.y.:wiley and sons;c.steup和t.herkenroth,“process for preparing synthetic cannabinoids”,美国专利申请2010/0298579 a1;r.j.kupper,“cannabinoid active pharmaceutical ingredient for improved dosage forms”,wo 2006/133941 a2;j.erler和s.heitner,“method for the preparation of dronabinol”,美国专利8,324,408 b2;a.l.gutman、m.etinger、i.fedotev、r.khanolkar、g.a.nisnevich、b.pertsikov、i.rukhman和b.tishin,“methods for purifying trans-(-)-δ
9-tetrahydrocannabinol and trans-( )-δ
9-tetrahydrocannabinol”,美国专利9,278,083 b2)。
[0011]
大麻萜酚(1)之前已通过路易斯酸或布朗斯特酸催化缩合由橄榄醇和香叶醇合成(s-h.baek、c.n.yook和d.s.han,“boron trifluoride etherate on alumina-a modified lewis acid reagent(v)a convenient single-step synthesis of cannabinoids”,bulletin of the korean chemical society,1995,第16卷,第293-6页)。以类似的方式,次大麻萜酚(3)已经由5-丙基间苯二酚合成(m j.kavarana和r.c.peet,“bioenzymatic synthesis of thc-v,cbv and cbn and their use as therapeutic agents”,us20170283837 a1)。
[0012]
大麻萜酚酸(2)和次大麻萜酚酸(4)的合成通过大麻二酚(1)和大麻二酚(3)分别与甲氧基镁碳酸甲酯反应来进行(r.peet和m.sun,“apparatus and methods for the simultaneous production of compounds”,us 2016/0053220 a1)。
[0013]
大麻萜酚(cbg,1)非精神药物,对cb1受体的亲和力低,但抑制花生四烯酸乙醇胺(anandamide)的吸收。它用作小鼠脑膜中α2肾上腺素受体的有效激动剂。此外,其调控5ht1a受体,并且像许多植物大麻素一样,大麻萜酚(cbg,1)调控许多trp阳离子通道。它是一种有效的trpa1激动剂、trpv1和trpv2的弱激动剂以及有效的trpm8拮抗剂。它已被证明
communications,2015,第10卷,第1009-12页。
[0014]
次大麻萜酚(cbgv,3)的生物活性尚未得到充分研究。它具有治疗干性皮肤综合征和减少花生四烯酸(aa)诱导的“痤疮样”脂肪生成和作为抗炎剂的潜力。此外,它作用于trp阳离子通道,例如作为trpa1的激动剂,并且它使其他trp通道脱敏(例如参见:shoyama,y.、hirano,h.、oda,m.、somehara,t.和nishioka,i.,“cannabis ix cannabichromevarin and cannabigerovarin,two new propyl homologs of cannabichromene and cannabigerol”,chemical&pharmaceutical bulletin,1975,第23卷,第1894-1895页;de petrocellis,l.、orlando,p.、moriello,a.s.、aviello,g.、stott,c.、izzo,a.a.和di marzo,v.,“cannabinoid actions at trpv channels:effects on trpv3 and trpv4 and their potential relevance to gastrointestinal inflammation”,acta physiologica,2012,第204卷,第255-266页;petrosino,s.、verde,r.、vaia,m.、allarf
à
,m.、iuvone,t.和di marzo,v.,“anti-inflammatory properties of cannabidiol,a nonpsychotropic cannabinoid,in experimental allergic contact dermatitis”,journal of pharmacology and experimental therapeutics,2018,第365卷,第652-663页)。
[0015]
大麻素羧酸大麻萜酚酸(cbga,2)和次大麻萜酚酸(cbgva,4)目前在生物和医学领域的应用有限。据称大麻萜酚酸(cbga,2)是大麻二酚(cbd)和大麻萜酚(cbg,1)所引起的对卵巢、乳腺、肺、胰腺和其他癌细胞的生长的抑制作用的适度的调节剂,并且本身可杀死乳腺癌细胞。它是g蛋白偶联受体gpr55的反向激动剂、单酰基甘油酯脂肪酶的拮抗剂和双重ppar α/γ激动剂。大麻萜酚酸(cbga,2)还被认为具有止痛作用。据报道,高剂量的次大麻萜酚酸(cbgva,4)在体外对白血病细胞具有抗癌细胞抑制作用。据称,cbga(2)、cbgva(4)或另一种大麻素与伪吲羟帽柱木碱或7-羟基帽柱木碱和另一种添加剂的混合物可用于治疗炎症、痉挛或疼痛。仅基于体外细胞测定,大麻萜酚酸(cbga,2)及其他酸性大麻素已被声称可用于增加动物的天然抵抗力、增强细胞抵抗力、治疗糖尿病或动脉粥样硬化和减少衰老过程中发现的应激反应下降。(d
′
aniello,e.、fellous,t.、iannotti,f.a.、gentile,a.、allar
à
,m.、balestrieri,f.、gray,r.、amodeo,p.、vitale,r.m.和di marzo,v.,“identification and characterization of phytocannabinoids as novel dual ppar α/γ agonists by a computational and in vitro experimental approach”,biochimica et biophysica acta general subjects,2019,第183卷,第586-597页;korthout,h.a.a.j.、verhoeckx,k.c.m.、witkamp,r.f.、doornbos,r.p.和mei wang,m.,“medicinal acidic cannabinoids:,美国专利7,807,711;parolaro,d.、massi,p.,antonio,a.、francesca borelli,f.、aviello,g.、di marzo,v.、de petrocellis,l.、schiano moriello,a.s.、ligresti,a.、alexandra ross,r.a.、ford,l.a.、anavi-goffer,s.、guzman,m.、velasco,g.、lorente,m.、torres,s.、kikuchi,t.、guy,g.、stott,c.、wright,s.、sutton,a.、potter,d.和etienne de meijer,e.,“phytocannabinoids in the treatment of cancer”,美国专利8,790,719;javid,f.a.、duncan,m.和stott,c.,“use of phytocannabinoids in the treatment of ovarian carcinoma”,美国专利10,098,867;stott,c.、duncan,m.和hill,t.,“active pharmaceutical ingredient(api)comprising cannabinoids for use in the treatment of cancer”,美国专利9,962,341;scott,
thereof”,wo专利申请2016/181394 a1)。
[0018]
如果大麻素酸2和4更容易以更大的量和更高的纯度提供,将有可能更好且更彻底地检查它们在医学领域中作为单一治疗剂或与其他大麻素或其他生物活性化合物组合使用的用途。值得注意的是,大麻素的混合物可能比单一成分更有效(随行效应)。例如,thca和其他大麻素的存在已被证明可以增强thc作为抗肿瘤剂在er /pr 、her2 和三阴性乳腺癌的细胞培养物和动物模型中的功效(例如参见:blasco-benito,s.、seijo-vila,m.、caro-villalobosa,m.、tundidor,i.、andradas,c.、garc
í
a-taboada,e.、wade,j.、smith,s.、guzm
á
n,m.、p
é
rez-g
ó
mez,e.、gordon,m.和s
á
nchez,c.,“appraising the“entourage effect”:antitumor action of a pure cannabinoid versus a botanical drug preparation in preclinical models of breast cancer”,biochemical pharmacology,2018,第157卷,第285-293页)。
[0019]
本发明旨在通过为大麻素1至4提供有效/可重现的生产路线并且提供灵活的新型大麻素类似物的合成方法来克服高纯度的所有这些化合物的可用性问题,这些新型大麻素类似物可单独用作活性化合物,或与已知大麻素或药物制剂中的其他药物组合用作活性化合物,用于治疗疼痛、多发性硬化症相关的痉挛、恶心、厌食、癫痫、阿尔茨海默氏病和神经退行性疾病、脑损伤/脑震荡/创伤性脑损伤、卒中、癌症、感染,减轻炎症和免疫炎症相关疾病、眼部的疾病/损伤(包括但不限于青光眼、干眼、角膜损伤或疾病和视网膜变性或疾病)、免疫炎症疾患、肺损伤或疾病、肝损伤或疾病、肾损伤或疾病、胰腺炎和胰腺疾患、心血管损伤或疾病以及器官移植,减少其他疾病中的术后炎症,以及用作抗氧化剂。
技术实现要素:
[0020]
在本文所公开的益处和改善中,本发明所公开的实施例的其他目的和优势将根据以下内容变得显而易见,其中类似的标号指示若干附图中类似的部件。本文公开了大麻素化合物、中间化合物以及制备大麻素和大麻素化合物及其中间体的方法的详细实施例;但是,应当理解,本发明所公开的实施例仅为本发明的例示性说明,其可以多种形式实施。此外,结合本发明的各种实施例所提供的实例中的每一个旨在作为例示性的而非限制性的。
[0021]
在整个说明书和权利要求中,除非上下文另外明确指出,否则以下术语具有本文明确关联的含义。尽管如本文所用的短语“在一些实施例中”和“在一些实施例中”可以指相同的一个或多个实施例,但它们不一定指相同的一个或多个实施例。尽管如本文所用的短语“在另一个实施例中”可以指不同的实施例,但它们不一定指不同的实施例。因此,如下文所述,在不脱离本发明的范围或精神的情况下,可以容易地组合各种实施例。
[0022]
此外,除非上下文另外明确指出,否则如本文所用的术语“或”是包含性的“或”运算符,并且等同于术语“和/或”。除非上下文另外明确规定,否则术语“基于”并非排他性的,并且允许基于未描述的其他因素。此外,在整个说明书中,“一个”、“一种”和“该”的含义包括复数指代。“在
……
中”的含义包括“在
……
中”和“在
……
上”。
[0023]
此外,术语“基本”、“基本上”、“相似”、“相似地”、“类似”、“类似地”、“近似”、“近似地”以及它们的任意组合表示所比较的特征或特性之间的差异小于测量和/或定义的比较特征或特性的相应的值/大小的25%。
[0024]
本文所述的联合或辅助疗法的目的是通过使用第二种或更多种药物来增强某种
药物的功效或通过使用第二种或更多种药物来降低某种药物的剂量限制性毒性。
[0025]
如本文所用,术语“取代的苄基”意指在一个或多个芳环位置带有1个、2个或3个独立变化的c1-c4烷基、c1-c4烷氧基、氟、氯、羟基、三氟甲基、三氟甲氧基、亚甲二氧基、氰基或甲氧基甲基基团或在苄基亚甲基处带有1个或2个独立变化的c1-c4烷基的苄基环。
[0026]
如果在本文中没有另外定义,则术语“任选地取代的芳基”意指任选地带有1个、2个或3个独立变化的c1-c4烷基、c1-c4烷氧基、氟或氯基团的苯环。
[0027]
如果在本文中没有另外定义,则术语“取代的”意指任选地在任意位置被变化的c1-c4烷基、c1-c4烷氧基、氟、氯、羟基、三氟甲基、三氟甲氧基、亚甲二氧基、氰基或甲氧基甲基取代。
[0028]
本发明涉及一种使用烯丙重排和芳构化的级联序列由简单廉价的起始材料从前体6经由中间体7制备多种已知和新型大麻素5(包括大麻萜酚(cbg,1)、大麻萜酚酸(cbga,2)、次大麻萜酚(cbgv,3)和次大麻萜酚酸(cbgva,4))以及其他天然存在的单环大麻素和其他合成单环类似物的方法。
[0029][0030]
其中:
[0031]
ra为h、co2h及其药用盐、co2rc、conhrd、conrdre;
[0032]
rb为:h;或c1至c2烷基、线性或支化c3至c
10
烷基或双支化c4至c
10
烷基,其在每种情况下任选地被一个或两个羟基基团取代或任选地被一个或多个氟基团取代;(ch2)
o-c3至c6环烷基;(ch2)
p-orf;或任选地被c1至c8烷基取代的c3至c6环烷基;
[0033]
o为0、1、2、3、4、5或6;
[0034]
p为1、2、3、4、5或6;
[0035]
rc为c1至c6烷基、(ch2)
q-c3至c6环烷基、烯丙基、苄基、取代的苄基或2-苯乙基;
[0036]
q为0、1、2、3、4、5或6;
[0037]
rd为c1至c6烷基、(ch2)
r-c3至c6环烷基、烯丙基、苄基、取代的苄基或2-苯乙基;re为c1至c6烷基、(ch2)
r-c3至c6环烷基、烯丙基、苄基、取代的苄基或2-苯乙基;或者nrdre为氮杂环丁烷基、吡咯烷基、吗啉基或哌啶基,其各自任选地被一个或两个羟基基团或羟甲基基团取代,例外的是对于吗啉,羟基基团不得在带有杂环氮或杂环氧的碳上;
[0038]
rf为c1至c6烷基、(ch2)
r-c3至c6环烷基;
[0039]
每个r独立地为0、1、2、3、4、5或6;
[0040]
rα和rβ独立地为c1至c6烷基或任选地取代的芳基,或者rα和rβ结合为(ch2)s(s为4、5或6),其中rα和rβ优选地均为甲基。
[0041]
这些合成方法适合大规模使用和用于生产目的。使用合成路线可获得的已知大麻素的实例为大麻萜酚(cbg,1)、大麻萜酚酸(cbga,2)、次大麻萜酚(cbgv,3)和次大麻萜酚酸(cbgva,4)。这些合成方法也适用于生产新型大麻素,并且这些化合物也是本发明的组成部分。以下大麻素5为大麻萜酚(cbg,1)、大麻萜酚酸(cbga,2)、次大麻萜酚(cbgv,3)和次大麻
萜酚酸(cbgva,4)的新型类似物,也可以通过本文所述的合成路线获得并且构成本发明的组成部分。这些大麻素5具有式:
[0042][0043]
其中:
[0044]
ra为h、co2h及其药用盐、co2rc、conhrd、conrdre;
[0045]
当ra为h或co2h时,rb为h或c1至c2烷基、线性或支化c3至c
10
烷基或双支化c4至c
10
烷基,其在每种情况下任选地被一个或两个羟基基团取代或任选地被一个或多个氟基团取代;(ch2)
o-c3至c6环烷基;(ch2)
p-orf;或任选地被c1至c8烷基取代的c3至c6环烷基,但rb为正-丙基或正-戊基除外;
[0046]
o为0、1、2、3、4、5或6;
[0047]
p为1、2、3、4、5或6;
[0048]
rc为c1至c6烷基、(ch2)
q-c3至c6环烷基、烯丙基、苄基、取代的苄基或2-苯乙基;
[0049]
q为0、1、2、3、4、5或6;
[0050]
rd为c1至c6烷基、(ch2)
r-c3至c6环烷基、c3至c6环烷基、烯丙基、苄基、取代的苄基或2-苯乙基;re为c1至c6烷基、(ch2)
r-c3至c6环烷基、烯丙基、苄基、取代的苄基或2-苯乙基;或者nrdre为氮杂环丁烷基、吡咯烷基、吗啉基或哌啶基,其各自任选地被一个或两个羟基基团或羟甲基基团取代,例外的是对于吗啉,羟基基团不得在带有杂环氮或杂环氧的碳上;
[0051]
rf为c1至c6烷基、(ch2)
r-c3至c6环烷基;
[0052]
每个r独立地为0、1、2、3、4、5或6。
[0053]
具有上文限定的式1-4的上述新型大麻素可单独用作活性化合物,或与已知大麻素(诸如但不限于δ
9-四氢大麻酚(thc)、四氢次大麻酚(thcv)、大麻二酚(cbd)或次大麻二酚(cbvd)单独或组合)或与其他药物组合或联合用作活性化合物,用于治疗疼痛、多发性硬化症相关的痉挛、恶心、癫痫、阿尔茨海默氏脑损伤/脑震荡、癌症、感染、青光眼和视网膜变性、免疫炎症疾患、肺损伤或疾病、肝损伤或疾病、肾损伤或疾病、眼部损伤或疾病及其他病状。在一些实施例中,具有上文限定的式5的所述新型大麻素可单独或与已知大麻素(诸如但不限于δ
9-四氢大麻酚(thc)、四氢次大麻酚(thcv)、大麻二酚(cbd)或次大麻二酚(cbdv)单独或组合)或与其他药物组合配制为适合施用于患者的形式的药物组合物。此类制剂除具有一种或多种活性大麻素或组合治疗剂中的其他药物以外,还包含药用稀释剂和赋形剂。在本发明的上下文中,术语赋形剂涵盖本领域的普通技术人员所熟知的标准赋形剂(例如参见:niazi,s.k.,“handbook of pharmaceutical manufacturing formulations,compressed solid products,2009,第1卷,第67页和第99-169页,第2版,informa healthcare),但也可以包括合成或分离自大麻(cannabis sativa)和柑橘油的单萜的挥发性物质或挥发性物质的混合物。上述药物组合物可通过肠内、舌下、鼻内、吸入、直肠或肠胃外药物施用或通过其他已知的临床施用方法施用于患者。
具体实施方式
[0054]
大麻萜酚(cbg,1)、大麻萜酚酸(cbga,2)、次大麻萜酚(cbgv,3)、次大麻萜酚酸(cbgva,4)和类似物的大规模合成
[0055]
本发明涉及一种使用烯丙重排和芳构化的级联序列由简单廉价的起始材料制备多种已知和新型大麻素5(包括大麻萜酚(cbg,1)、大麻萜酚酸(cbga,2)、次大麻萜酚(cbgv,3)和次大麻萜酚酸(cbgva,4))以及其他天然存在的单环大麻素的大规模方法。本发明包括呈油或晶体衍生物形式(视情况包括溶剂化物、水合物和多晶型)的目标大麻素。该方法涉及大麻素5的大规模合成:
[0056][0057]
其中:
[0058]
ra为h、co2h及其药用盐、co2rc、conhrd、conrdre;
[0059]
rb为:h;或c1至c2烷基、线性或支化c3至c
10
烷基或双支化c4至c
10
烷基,其在每种情况下任选地被一个或两个羟基基团取代或任选地被一个或多个氟基团取代;(ch2)
o-c3至c6环烷基;(ch2)
p-orf;或任选地被c1至c8烷基取代的c3至c6环烷基;
[0060]
o为0、1、2、3、4、5或6;
[0061]
p为1、2、3、4、5或6;
[0062]
rc为c1至c6烷基、(ch2)
q-c3至c6环烷基、烯丙基、苄基、取代的苄基或2-苯乙基;
[0063]
q为0、1、2、3、4、5或6;
[0064]
rd为c1至c6烷基、(ch2)
r-c3至c6环烷基、烯丙基、苄基、取代的苄基或2-苯乙基;re为c1至c6烷基、(ch2)
r-c3至c6环烷基、烯丙基、苄基、取代的苄基或2-苯乙基;或者nrdre为氮杂环丁烷基、吡咯烷基、吗啉基或哌啶基,其各自任选地被一个或两个羟基基团或羟甲基基团取代,例外的是对于吗啉,羟基基团不得在带有杂环氮或杂环氧的碳上;
[0065]
rf为c1至c6烷基、(ch2)
r-c3至c6环烷基;
[0066]
每个r独立地为0、1、2、3、4、5或6;
[0067]
所述方法包括:
[0068]
将具有所述式6的第一中间体用以下试剂进行处理:(1)酰化试剂rbcoz,其中rb中的任意一个或多个羟基基团在第一碱8的存在下以及在第一路易斯酸9的存在下得到保护;(2)钯催化剂10与任选的另外的配体11;以及(3)二氧化硅或替代性的等效固体试剂或第二碱12及随后的布朗斯特酸或第二路易斯酸13或单独的碱(诸如乙酸铯);并且进行任选的脱保护,以提供第二中间体7;其次所述6发生水解与任选的脱羧或酯交换或形成酰胺以及适当情况下的任选的脱保护,以提供5;
[0069][0070]
其中:
[0071]
z为卤素,优选地为氯,或者rbcoz为替代性的反应性亲电酰化剂;
[0072]
rα和rβ独立地为c1至c6烷基或任选地取代的芳基,或者rα和rβ结合为(ch2)s(s为4、5或6),其中rα和rβ优选地均为甲基;
[0073]
第一碱8为胺或杂环胺诸如吡啶;
[0074]
第一路易斯酸9优选地为氯化镁;
[0075]
钯催化剂10来源于钯(ii)预催化剂或钯(0)催化剂本身,并且任选的另外的配体11包括但不限于一种或多种膦或二膦或其等同物,优选地,钯催化剂10和配体11具体地为但不限于在三芳基膦或三杂芳基膦(特别是三-2-呋喃基膦)存在下的钯(0)的膦配合物,诸如四(三苯基膦)钯(0)或三(二亚苄基丙酮)二钯(0)[pd2(dba)3];
[0076]
第二碱12为乙酸铯或碳酸铯或碳酸钾;
[0077]
布朗斯特酸或第二路易斯酸13在使用时为乙酸或氯化氢;
[0078]
其中:
[0079]
任选的一个或多个羟基保护基团为甲硅烷基保护基团;
[0080]
任选的一个或多个羟基保护基团优选独立地为叔丁基二甲基甲硅烷基、叔己基二甲基甲硅烷基、叔丁基二苯基甲硅烷基或三异丙基甲硅烷基保护基。
[0081]
应当指出的是,这些合成中的若干中间体可以酮和烯醇互变异构体的形式存在。酮形式的结构图示还包括对应的烯醇形式,包括同时包含酮和烯醇形式的混合物。另外,烯醇形式的结构图示还包括对应的酮形式,包括同时包含酮和烯醇形式的混合物。以举例的方式,尽管出于简化的原因将中间体6绘制为酮形式,但是这两种中间体以酮和烯醇形式的混合物形式存在。
[0082]
先前已经发表了中间体6和7的小规模合成(rα和rβ均为甲基;rb为me、acoch2、反式-phch=ch)并且已知[ma,t.k.、white,a.j.p.和barrett,a.g.m.,meroterpenoid total synthesis:conversion of geraniol and farnesol into amorphastilbol,grifolin and grifolic acid by dioxinone-β-keto-acylation,palladium catalyzed decarboxylative allylic rearrangement and aromatization,tetrahedron letters,2017,58,2765-2767;elliott,d.c.、ma,t.k.、selmani,a.、cookson,r.、parsons,p.j.和barrett,a.g.m.,sequential ketene generation from dioxane-4,6-dione-keto-dioxinones for the synthesis of terpenoid resorcylates,organicletters 2016,18,1800-1803;cordes,j.、calo,f.、anderson,k.、pfaffeneder,t.、laclef,s.、white,a.j.p.和barrett,a.g.m.,total syntheses of angelicoin a,hericenone j,and hericenol a via migratory prenyl-and geranylation-aromatization sequences,journal of organic chemistry 2012,77,652-657]。然而,迄今为止尚未发表用于大规模
合成上述新型大麻素5的方法。
[0083]
保护基团是本领域的技术人员熟知的,并目描述于诸如greene和wuts编著的教科书中(p.g.m.wuts和t.w.greene,“greene
′
s protective groups in organic synthesis”,2006,第4版,john wiley,new york)。
[0084]
通过皂化或等效方法裂解中间体7的二噁英酮环以产生大麻素羧酸5(ra=co2h)按以下文献所述进行:r.cookson,t.n.barrett和a.g.m.barrett,“β-keto-dioxinones and β,δ-diketo-dioxinones in biomimetic resorcylate total synthesis”,accounts of chemical research,2015,第48卷,第628-642页;及其引用文献。
[0085]
大麻素羧酸5(ra=co2h)的脱羧按以下文献所述进行:h.perrotin-brunel、w.buijs、j.van spronsen、m.j.e.van roosmalen、c.j.peters、r.verpoorte和g.-j.witkamp,“decarboxylation of δ
9-tetrahydrocannabinol:kinetics and molecular modeling”,journal of molecular structure,2011,第987卷,第67-73页;及其引用文献。
[0086]
酰胺形成通过羧酸的活化来实现,例如通过形成n-羟基琥珀酰亚胺酯并且与相应的胺偶联来实现,例如参见goto等人的报道(y.goto、y.shima、s.morimoto、y.shoyama、h.murakami、a.kusai和k.nojima,“determination of tetrahydrocannabinolic acid-carrier protein conjugate by matrix-assisted laser desorption/ionization mass spectrometry and antibody formation”,organic mass spectrometry,1994,第29卷,第668-671页)。替代性的酰胺偶联剂包括但不限于:二环己基碳二亚胺(dcc)、二-异丙基碳二亚胺(dic)、o-(7-氮杂苯并三唑-1-基)-1,1,3,3-四甲基脲鎓六氟磷酸盐(hatu)、o-(苯并三唑-1-基)-1,1,3,3-四甲基脲鎓六氟磷酸盐(hbtu)和溴代三(吡咯烷子基)鳞六氟磷酸盐(pybrop)(e.valeur和m.bradley,“amide bond formation:beyond the myth of coupling reagents”,chemical society reviews,2009,第38卷,第606-631页)。
[0087]
具有以上式5的上述新型大麻素可单独用作活性化合物,或与已知大麻素(诸如但不限于δ
9-四氢大麻酚(thc)、四氢次大麻酚(thbv)、大麻二酚(cbd)或次大麻二酚(cbdv))或其他药物组合用作活性化合物,用于治疗疼痛、多发性硬化症相关的痉挛、恶心、癫痫、阿尔茨海默氏脑损伤/脑震荡、癌症、感染、青光眼和视网膜变性、免疫炎症疾患、肺损伤或疾病、肝损伤或疾病、肾损伤或疾病、眼部损伤或疾病及其他病状。在一些实施例中,具有以上式5的所述新型大麻素可单独或与已知大麻素(诸如但不限于δ
9-四氢大麻酚(thc)、四氢次大麻酚(thbv)、大麻二酚(cbd)或次大麻二酚(cbdv))或其他药物组合配制为适合施用于患者的形式的药物组合物。此类制剂除具有组合治疗剂中的一种或多种活性大麻素以外,还包含药用稀释剂和赋形剂,其可包括:粘结剂,诸如乳糖、淀粉、纤维素、山梨醇、聚乙二醇或聚乙烯醇或其他药用寡糖或聚合物;崩解剂,诸如聚乙烯吡咯烷酮、羧甲基纤维素或其他药用崩解剂;媒介物,诸如凡士林、二甲基亚砜、矿物油或ω-3水包油纳米乳液或与环糊精(诸如羟丙基-β-环糊精)的复合物;防腐剂,包括抗氧化剂,诸如维生素a、维生素e、维生素c、棕榈酸视黄酯、半胱氨酸、蛋氨酸、柠檬酸钠、柠檬酸、对羟基苯甲酸酯或替代性的药用防腐剂;抗粘剂、润滑剂和助流剂,诸如硬脂酸镁、硬脂酸、滑石粉、二氧化硅、药用脂肪或油;包衣,诸如纤维素醚、羟丙基甲基纤维素、明胶或其他药用包衣;风味剂和香精,诸如但不限于大麻和柑橘类水果的挥发性萜烯;及其他药用稀释剂或赋形剂。上述药物组合物可通过肠内施用(例如作为丸剂、片剂或胶囊)、通过舌下施用(例如作为片剂、条剂、滴剂、喷雾剂、
锭剂、泡腾片)、通过鼻内施用(例如作为喷雾剂或微粉剂)、通过吸入施用(例如作为喷雾剂或微粉剂)、通过肠内施用(例如作为栓剂或溶液)、通过肠胃外药物施用、通过肌内、皮下或静脉内注射(例如作为溶液)或通过其他已知的临床施用方法施用于患者。
[0088]
芳构化反应适用于生产新型大麻素5并且这些化合物也是本发明的组成部分。本发明包括呈油或晶体衍生物形式(视情况包括溶剂化物、水合物和多晶型)的目标大麻素。这些新型大麻素5具有式:
[0089][0090]
其中:
[0091]
ra为h、co2h及其药用盐、co2rc、conhrd、conrdre;
[0092]
rb为:h;或c1至c2烷基、线性或支化c3至c
10
烷基或双支化c4至c
10
烷基,其在每种情况下任选地被一个或两个羟基基团取代或任选地被一个或多个氟基团取代;(ch2)
o-c3至c6环烷基;(ch2)
p-orf;或任选地被c1至c8烷基取代的c3至c6环烷基;
[0093]
o为0、1、2、3、4、5或6;
[0094]
p为1、2、3、4、5或6;
[0095]
rc为c1至c6烷基、(ch2)
q-c3至c6环烷基、烯丙基、苄基、取代的苄基或2-苯乙基;
[0096]
q为0、1、2、3、4、5或6;
[0097]
rd为c1至c6烷基、(ch2)
r-c3至c6环烷基、c3至c6环烷基、烯丙基、苄基、取代的苄基或2-苯乙基;re为c1至c6烷基、(ch2)
r-c3至c6环烷基、烯丙基、苄基、取代的苄基或2-苯乙基;或者nrdre为氮杂环丁烷基、吡咯烷基、吗啉基或哌啶基,其各自任选地被一个或两个羟基基团或羟甲基基团取代,例外的是对于吗啉,羟基基团不得在带有杂环氮或杂环氧的碳上;
[0098]
rf为c1至c6烷基、(ch2)
r-c3至c6环烷基;
[0099]
每个r独立地为0、1、2、3、4、5或6;
[0100]
以下大麻素除外:大麻萜酚(cbg,1)、大麻萜酚酸(cbga,2)、次大麻萜酚(cbgv,3)、次大麻萜酚酸(cbgva,4)和大麻素5[ra=h且rb=h,rb=ch3,rb=n-c3h7,rb=ch2oh,rb=n-c5h
11
,rb=n-c7h
15
,rb=ch2och3,rb=ch2ch
2 ch2ch2ch2oh,rb=c(ch3)2(ch2)5ch3,rb=ch2(choh)-n-c3h7,rb=c2h4(choh)-n-c2h5,rb=c3h6(choh)ch3]、5[ra=co2h且rb=n-c3h7,rb=n-c5h
11
]、5[ra=co2ch3且rb=ch3,rb=n-c3h7,rb=n-c5h
11
]和5[ra=co2ch2ch3且rb=n-c5h
11
]。
[0101]
下面的二噁英酮间羟苯甲酸酯衍生物7是用于合成大麻素的中间体,也可通过本文所述的合成路线获得并且作为本发明的组成部分。这些新型二噁英酮衍生物7具有式:
[0102]
[0103]
其中:
[0104]
rb为:h;或c1至c2烷基、线性或支化c3至c
10
烷基或双支化c4至c
10
烷基,其在每种情况下任选地被一个或两个羟基基团取代或任选地被一个或多个氟基团取代;(ch2)
o-c3至c6环烷基;(ch2)
p-orf;或任选地被c1至c8烷基取代的c3至c6环烷基;
[0105]
o为0、1、2、3、4、5或6;
[0106]
p为1、2、3、4、5或6;
[0107]
rα和rβ独立地为c1至c6烷基或任选地取代的芳基,或者rα和rβ结合为(ch2)s;
[0108]
s为4、5或6。
[0109]
7除外(rb=me;rα=rβ=me)。
[0110]
实例
[0111]
实例1
[0112]
(e)-3,7-二甲基八-2,6-二烯-1-基4-(2,2-二甲基-4-氧代-4h-1,3-二噁英-6-基)-3-氧代丁酸酯(6,r
α
=r
β
=me)
[0113][0114]
将n-(3-二甲基氨基丙基)-nv-乙基碳二亚胺盐酸盐(16)(2.6g,12.5mmol)和4-二甲基氨基吡啶(dmap)(1.5g,12.5mmol)依次加入2-苯基-1,3-二噁烷-4,6-二酮(14,r
γ
=ph,r
δ
=h)(2.4g,12.5mmol)在无水二氯甲烷(125ml)中的溶液中。5分钟后,在搅拌下加入一份2-(2,2-二甲基-4-氧代-4h-1,3-二噁英-6-基)乙酸(15,r
α
=r
β
=me)(2.3g,12.5mmol)。在室温下反应16小时后,加入水(100ml),并且分离出有机级分。将有机级分用1m盐酸(2
×
100ml)和盐水(100ml)洗涤。洗涤后的有机层以mgso4干燥,过滤,并且在减压下浓缩。将粗产物立即溶于无水甲苯(100ml)中,并且在搅拌下逐滴加入香叶醇(18)(1.1ml,6.3mmol)。将溶液加热至55℃,并且在该温度保持4小时。耗竭起始材料后,将溶液在减压下浓缩。利用快速柱层析法纯化粗制反应产物(etoac:戊烷;4:20),以得到标题化合物6(r
α
=r
β
=me),其为无色油状物(1.9g,5.3mmol,84%):1h nmr(400mhz,cdcl3)δ5.43-5.27(m,2h),5.11-5.04(m,1h),4.71-4.63(m,2h),3.51(s,2h),3.50(d,j=0.5hz,2h),2.15-2.00(m,4h),1.71(s,6h),1.69(s,1h),1.68(d,j=1.3hz,4h),1.60(d,j=1.4hz,3h);
13
c nmr(101mhz,cdcl3)δ195.8,166.5,163.7,143.8,132.1,123.7,117.4,107.5,97.3,62.8,49.3,47.1,39.7,26.4,25.8,25.2,17.9,16.7;
[0115]
ir(纯)2966,2917,2856,1718,1636,1388,1270,1200,1014,900cm-1c20h29
o6[m h]
的hrms(es )m/z计算值365.1959,实测值365.1968;rf 0.14(etoac:戊烷;4:20)uv/香草
(3,7-二甲基八-2,6-二烯-1-基)-7-羟基-2,2-二甲基-5-戊基-4h-苯并[d][1,3]二噁英-4-酮7(r
α
=r
β
=me,rb=正-戊基)(200mg,0.5mmol)和水(30μl,2mmol)。搅拌72小时后,加入水(10ml)和et2o(10ml),并且将两相混合物相分离。将有机层用水(3
×
10ml)萃取。将收集的水性级分用4m盐酸(10ml)酸化,直至达到ph1。将酸性溶液用二氯甲烷(3
×
10ml)萃取,并且将合并的有机萃取物用mgso4干燥,过滤,并且在减压下浓缩。利用柱层析法纯化残余物(acoh∶etoac∶戊烷;0.01∶1∶20),以得到大麻萜酚酸(2),其为白色粉末(120mg,0.34mmol,68%):1h nmr(400mhz,cd3od)δ6.20(s,1h),5.21(tq,j=7,1.5hz,1h),5.05(ddq,j=8.5,6,1.5hz,1h),3.27(d,j=7hz,2h),2.91-2.76(m,2h),2.09-2.00(m,2h),1.95(dd,j=8.5,6.5hz,2h),1.76(d,j=1.5hz,3h),1.59(t,j=1.5hz,4h),1.58-1.48(m,4h),1.41-1.27(m,4h),0.96-0.87(m,3h);
13
c nmr(101mhz,cd3od)δ175.4,164.7,161.1,146.8,135,132,125.5,124.2,114.0,110.9,104.5,40.9,37.6,33.2,33.0,27.7,25.8,23.6,22.8,17.7,16.2,14.4;ir(纯)3534,3400,2959,2911,1635,16101457,1271,1245,1169,754cm-1
;c
22h33
o4[m h]
的hrms(es )m/z计算值361.2373,实测值361.2372;rf 0.32(acoh∶etoac∶戊烷;0.01∶1∶20)uv/香草醛。
[0124]
实例4
[0125]
大麻萜酚(1)
[0126][0127]
在可密封的反应瓶中,将(e)-8-(3,7-二甲基八-2,6-二烯-1-基)-7-羟基-2,2-二甲基-5-戊基-4h-苯并[d][1,3]二噁英-4-酮7(r
α
=r
β
=me,rb=正-戊基)(100mg,0.25mmol)溶于1,4-二噁烷(2.5ml)中。加入5m koh(1.25ml),并且将两相混合物用氮气鼓泡10分钟。将反应瓶密封,并且在120℃加热18小时。冷却至室温后,将反应混合物用冷却的4m盐酸(10ml)酸化,并且将水层用etoac(3
×
20ml)萃取。将合并的有机萃取物用盐水(20ml)洗涤,经mgso4干燥,过滤,并且在减压下浓缩。利用柱层析法纯化粗产物(et2o∶戊烷;2∶20),以得到大麻萜酚(1),其为白色粉末(50mg,0.16mmol,64%):1h nmr(400mhz,cdcl3)δ6.41(s,1h),5.91(s,1h),5.20(tq,j=7.3,1.3hz,1h),5.08-4.99(m,1h),3.33(d,j=7.2hz,2h),3.05-2.93(m,2h),2.06(tq,j=9.5,5,3.5hz,4h),1.79(d,j=1.5hz,3h),1.67(d,j=3hz,9h),1.59(d,j=1.5hz,6h),1.45-1.24(m,5h),0.94-0.82(m,5h);
13
c nmr(101mhz,cdcl3)δ160.6,160.2,156.2,148.0,139.0,132.2,123.8,120.9,113.0,112.7,110.1,105.2,104.7,39.8,34.4,32.0,30.8,26.5,25.9,22.7,22.1,17.9,16.4,14.2;ir(纯)3215,2956,2912,2854,1689,1591,1420,1297,912,863cm-1
;c
21h32
o2[m h]
的hrms(es )m/z计算值316.2402,实测值316.2402;rf 0.22(et2o∶戊烷;2∶20)uv/香草醛。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。