1.本发明涉及表位区域交联型双互补位抗体及制造其的方法。更具体而言,涉及作为激动剂或拮抗剂的功能得到提高的双互补位抗体。
背景技术:
2.近年来,对于使用抗体的药物,根据其靶标特异性而作为非常具魅力的分子靶向药物进行了研究。抗体治疗药与靶标的特定部分(表位)结合。抗体药物的有用性不仅仅依赖于抗体所结合的抗原的种类,因结合所致的蛋白质功能的紊乱取决于由该结合所致的相互作用发生在何处,因抗原中的表位不同而发生大幅变动。因此,抗体所结合的表位区域可以说是决定抗体功能的重要因子。
3.迄今为止本发明人们开发了一种表位均质化抗体群体(专利文献1),其为如下技术:基于“网罗性”地识别靶分子表面的所有结构的多个抗体的反应性曲线,分离为各抗体所识别的表位区域,选择包含针对网罗靶分子的各表位区域的抗体的、由最小总数的抗体构成的抗体群体,并且从其中挑选对于功能表达而言重要的表位区域,由此网罗抗原分子上的表位区域而取得功能抗体。通过该技术,减少用于鉴定抗体所结合的表位区域的劳力,能够自抗体药物的开发初期开始对于与其表位区域相关联的功能进行研究,有助于具有各种功能的抗体的表达和开发。
4.现有技术文献
5.专利文献
6.专利文献1:国际发明第2018/092907号
技术实现要素:
7.用于解决课题的技术手段
8.在本发明中,使该表位均质化抗体群体技术进一步发展,发现一种能够开创出使其功能
·
效果最大化的抗体药物的表位区域交联型双互补位抗体制作技术。即,在本发明中,通过在表位均质化抗体群体技术中进一步加入表位的位置信息,从而以组的形式制作表位区域交联型双互补位抗体,搜索功能分子,明确其功能机制,由此开发出了用于合理地设计表位区域交联型双互补位抗体的高度技术。
9.因此,本发明提供以下技术方案。
10.(项目1)一种表位区域交联型双互补位抗体、或者该抗体的抗原结合片段或功能等同物,包含:源自针对抗原(通过结合靶分子而活化)中的第1表位而言的抗体的、重链可变区域及轻链可变区域的序列;和源自针对与第1表位不同的第2表位而言的抗体的、重链可变区域及轻链可变区域的序列,
11.通过与上述抗原的结合而形成具有抗原:抗体为(m
×
n):n的结构的复合体,n为1或大于1的同一数值,m为针对互补位而言的抗原结合结构域的数量的最大值。
12.(项目2)根据项目1所述的表位区域交联型双互补位抗体、或者该抗体的抗原结合
片段或功能等同物,其中,上述第1表位属于第1表位区域(选自上述抗原中的多个表位区域),上述第2表位属于与上述第1表位区域不同的第2表位区域。
13.(项目3)根据项目1或2所述的表位区域交联型双互补位抗体、或者该抗体的抗原结合片段或功能等同物,其中,m为1。
14.(项目4)根据项目1~3中任一项所述的表位区域交联型双互补位抗体、或者该抗体的抗原结合片段或功能等同物,其中,通过与上述抗原的结合而形成具有抗原:抗体为1:1的分子内交联结构的复合体。
15.(项目5)根据项目1~3中任一项所述的表位区域交联型双互补位抗体、或者该抗体的抗原结合片段或功能等同物,其中,通过与上述抗原的结合而形成具有抗原:抗体为n:n(n为2或大于2的同一数值)的分子间交联结构的复合体。
16.(项目6)根据项目1~4中任一项所述的表位区域交联型双互补位抗体、或者该抗体的抗原结合片段或功能等同物,其中,在与上述抗原结合时,具有针对上述第1表位和上述第2表位而言的抗原特异性,上述第1表位和上述第2表位在上述抗原上彼此存在于相同侧。
17.(项目7)根据项目1~3及5中任一项所述的表位区域交联型双互补位抗体、或者该抗体的抗原结合片段或功能等同物,其中,在与上述抗原结合时,具有针对上述第1表位和上述第2表位而言的抗原特异性,上述第1表位和上述第2表位在上述抗原上彼此存在于不同侧。
18.(项目8)根据项目1~4及6中任一项所述的表位区域交联型双互补位抗体、或者该抗体的抗原结合片段或功能等同物,其中,在与上述抗原结合时,具有针对上述第1表位和上述第2表位而言的抗原特异性,上述第1表位和上述第2表位存在于上述抗原上的结合上述靶分子的一侧。
19.(项目9)根据项目1~3、5及7中任一项所述的表位区域交联型双互补位抗体、或者该抗体的抗原结合片段或功能等同物,其中,在与上述抗原结合时,具有针对上述第1表位和上述第2表位而言的抗原特异性,上述第1表位存在于上述抗原上的结合上述靶分子的一侧,上述第2表位存在于上述抗原上的不结合上述靶分子的一侧。
20.(项目10)根据项目1~4、6及8中任一项所述的表位区域交联型双互补位抗体、或者该抗体的抗原结合片段或功能等同物,其与天然抗体相比,拮抗剂活性提高。
21.(项目11)根据项目1~4、6、8及10中任一项所述的表位区域交联型双互补位抗体、或者该抗体的抗原结合片段或功能等同物,其与天然抗体相比,激动剂活性受到抑制。
22.(项目12)根据项目1~11中任一项所述的表位区域交联型双互补位抗体、或者该抗体的抗原结合片段或功能等同物,其中,上述抗原为膜蛋白质。
23.(项目13)根据项目1~12中任一项所述的表位区域交联型双互补位抗体、或者该抗体的抗原结合片段或功能等同物,其中,上述抗原为属于tnf受体超家族的任意的膜蛋白质。
24.(项目14)根据项目1~13中任一项所述的表位区域交联型双互补位抗体、或者该抗体的抗原结合片段或功能等同物,其中,上述抗原为tnfr2。
25.(项目15)一种表位区域交联型双互补位抗体、或者该抗体的抗原结合片段或功能等同物,其是针对tnfr2而言的表位区域交联型双互补位抗体、或者该抗体的抗原结合片段
或功能等同物,并且包含:
26.(a)包含下述序列的重链,所述序列为选自由序列号1(tr45重链)、序列号2(tr92重链)、序列号3(tr94重链)、序列号4(tr96重链)及序列号5(tr109重链)组成的组中的2个重链可变区域的各自的cdr1、cdr2及cdr3、或它们的功能的等同序列、或与它们的氨基酸序列具有至少80%以上的序列同源性的氨基酸序列;以及
27.(b)包含下述序列的轻链,所述序列为选自由序列号6(tr45轻链)、序列号7(tr92轻链)、序列号8(tr94轻链)、序列号9(tr96轻链)及序列号10(tr109轻链)组成的组中的2个轻链可变区域的各自的cdr1、cdr2及cdr3、或它们的功能的等同序列、或与它们的氨基酸序列具有至少80%以上的序列同源性的氨基酸序列,所述2个轻链可变区域源自与(a)的抗体重链同源的抗体。
28.(项目16)根据项目15所述的表位区域交联型双互补位抗体、或者该抗体的抗原结合片段或功能等同物,其中,包含:
29.(a)包含序列号2(tr92重链)所示的氨基酸序列的cdr1、cdr2及cdr3、或它们的功能的等同序列、或与它们的氨基酸序列具有至少80%以上的序列同源性的氨基酸序列的重链,和包含序列号5(tr109重链)所示的氨基酸序列的cdr1、cdr2及cdr3、或它们的功能的等同序列、或与它们的氨基酸序列具有至少80%以上的序列同源性的氨基酸序列的重链;以及
30.(b)包含序列号7(tr92轻链)所示的氨基酸序列的cdr1、cdr2及cdr3、或它们的功能的等同序列、或与它们的氨基酸序列具有至少80%以上的序列同源性的氨基酸序列的轻链,和包含序列号10(tr109轻链)所示的氨基酸序列的cdr1、cdr2及cdr3、或它们的功能的等同序列、或与它们的氨基酸序列具有至少80%以上的序列同源性的氨基酸序列的轻链。
31.(项目17)根据项目15所述的表位区域交联型双互补位抗体、或者该抗体的抗原结合片段或功能等同物,其中,上述表位区域交联型双互补位抗体为下述抗体:
32.(i)抗体,其包含(a1)和(b1),
33.(a1)为包含序列号1(tr45重链)所示的氨基酸序列的cdr1、cdr2及cdr3、或它们的功能的等同序列、或与它们的氨基酸序列具有至少80%以上的序列同源性的氨基酸序列的重链,和包含序列号3(tr94重链)所示的氨基酸序列的cdr1、cdr2及cdr3、或它们的功能的等同序列、或与它们的氨基酸序列具有至少80%以上的序列同源性的氨基酸序列的重链,
34.(b1)为包含序列号6(tr45轻链)所示的氨基酸序列的cdr1、cdr2及cdr3、或它们的功能的等同序列、或与它们的氨基酸序列具有至少80%以上的序列同源性的氨基酸序列的轻链,和包含序列号8(tr94轻链)所示的氨基酸序列的cdr1、cdr2及cdr3、或它们的功能的等同序列、或与它们的氨基酸序列具有至少80%以上的序列同源性的氨基酸序列的轻链;
35.(ii)抗体,其包含(a2)和(b2),
36.(a2)为包含序列号1(tr45重链)所示的氨基酸序列的cdr1、cdr2及cdr3、或它们的功能的等同序列、或与它们的氨基酸序列具有至少80%以上的序列同源性的氨基酸序列的重链,和包含序列号4(tr96重链)所示的氨基酸序列的cdr1、cdr2及cdr3、或它们的功能的等同序列、或与它们的氨基酸序列具有至少80%以上的序列同源性的氨基酸序列的重链,
37.(b2)为包含序列号6(tr45轻链)所示的氨基酸序列的cdr1、cdr2及cdr3、或它们的功能的等同序列、或与它们的氨基酸序列具有至少80%以上的序列同源性的氨基酸序列的
轻链,和包含序列号9(tr96轻链)所示的氨基酸序列的cdr1、cdr2及cdr3、或它们的功能的等同序列、或与它们的氨基酸序列具有至少80%以上的序列同源性的氨基酸序列的轻链;
38.(iii)抗体,其包含(a3)和(b3),
39.(a3)为包含序列号5(tr109重链)所示的氨基酸序列的cdr1、cdr2及cdr3、或它们的功能的等同序列、或与它们的氨基酸序列具有至少80%以上的序列同源性的氨基酸序列的重链,和包含序列号4(tr96重链)所示的氨基酸序列的cdr1、cdr2及cdr3、或它们的功能的等同序列、或与它们的氨基酸序列具有至少80%以上的序列同源性的氨基酸序列的重链,
40.(b3)为包含序列号10(tr109轻链)所示的氨基酸序列的cdr1、cdr2及cdr3、或它们的功能的等同序列、或与它们的氨基酸序列具有至少80%以上的序列同源性的氨基酸序列的轻链,和包含序列号9(tr96轻链)所示的氨基酸序列的cdr1、cdr2及cdr3、或它们的功能的等同序列、或与它们的氨基酸序列具有至少80%以上的序列同源性的氨基酸序列的轻链;
41.(iv)抗体,其包含(a4)和(b4),
42.(a4)为包含序列号4(tr96重链)所示的氨基酸序列的cdr1、cdr2及cdr3、或它们的功能的等同序列、或与它们的氨基酸序列具有至少80%以上的序列同源性的氨基酸序列的重链,和包含序列号2(tr92重链)所示的氨基酸序列的cdr1、cdr2及cdr3、或它们的功能的等同序列、或与它们的氨基酸序列具有至少80%以上的序列同源性的氨基酸序列的重链,
43.(b4)为包含序列号9(tr96轻链)所示的氨基酸序列的cdr1、cdr2及cdr3、或它们的功能的等同序列、或与它们的氨基酸序列具有至少80%以上的序列同源性的氨基酸序列的轻链,和包含序列号7(tr92轻链)所示的氨基酸序列的cdr1、cdr2及cdr3、或它们的功能的等同序列、或与它们的氨基酸序列具有至少80%以上的序列同源性的氨基酸序列的轻链;
44.(v)抗体,其包含(a5)和(b5),
45.(a5)为包含序列号5(tr109重链)所示的氨基酸序列的cdr1、cdr2及cdr3、或它们的功能的等同序列、或与它们的氨基酸序列具有至少80%以上的序列同源性的氨基酸序列的重链,和包含序列号3(tr94重链)所示的氨基酸序列的cdr1、cdr2及cdr3、或它们的功能的等同序列、或与它们的氨基酸序列具有至少80%以上的序列同源性的氨基酸序列的重链,
46.(b5)为包含序列号10(tr109轻链)所示的氨基酸序列的cdr1、cdr2及cdr3、或它们的功能的等同序列、或与它们的氨基酸序列具有至少80%以上的序列同源性的氨基酸序列的轻链,和包含序列号8(tr94轻链)所示的氨基酸序列的cdr1、cdr2及cdr3、或它们的功能的等同序列、或与它们的氨基酸序列具有至少80%以上的序列同源性的氨基酸序列的轻链;或者
47.(vi)抗体,其包含(a6)和(b6),
48.(a6)为包含序列号3(tr94重链)所示的氨基酸序列的cdr1、cdr2及cdr3、或它们的功能的等同序列、或与它们的氨基酸序列具有至少80%以上的序列同源性的氨基酸序列的重链,和包含序列号2(tr92重链)所示的氨基酸序列的cdr1、cdr2及cdr3、或它们的功能的等同序列、或与它们的氨基酸序列具有至少80%以上的序列同源性的氨基酸序列的重链,
49.(b6)为包含序列号8(tr94轻链)所示的氨基酸序列的cdr1、cdr2及cdr3、或它们的
功能的等同序列、或与它们的氨基酸序列具有至少80%以上的序列同源性的氨基酸序列的轻链,和包含序列号7(tr92轻链)所示的氨基酸序列的cdr1、cdr2及cdr3、或它们的功能的等同序列、或与它们的氨基酸序列具有至少80%以上的序列同源性的氨基酸序列的轻链。
50.(项目18)一种表位区域交联型双互补位抗体、或者该抗体的抗原结合片段或功能等同物的制造方法,其中,包括:
51.工序(a),提供针对抗原而言的抗体集合作为原始抗体群体(original antibody panel),该抗体集合中所含的抗体数n为针对该抗原而言的目标抗体数n以上;
52.工序(b),获得该原始抗体群体中所含的抗体的结合数据;
53.工序(c),基于该结合数据,将该原始抗体群体进行聚簇;
54.工序(d),根据需要从该原始抗体群体中除去1个或多个抗体而生成1个或多个部分群体,针对各个该1个或多个部分群体,各自基于该结合数据进行聚簇;
55.工序(e),算出该原始抗体群体及该1个或多个部分群体的表位组数e,在存在满足e≥与该抗原有关的目标表位组数e的原始抗体群体或部分群体的情况下,以满足e≥e的原始抗体群体或部分群体作为表位均质化抗体群体,在不存在满足e≥e的原始抗体群体或部分群体的情况下,向该原始抗体或该部分群体中加入新的抗体,制作新的抗体集合,重复工序(a)~工序(d);
56.工序(f),在上述得到的表位均质化抗体群体中所包含的多个表位中选择2个表位;以及
57.工序(g),将与上述2个表位结合的抗体的fab区域连结。
58.(项目19)根据项目18所述的方法,其中,上述工序(f)中以上述2个表位的位置存在于上述抗原上的相同侧的方式进行选择。
59.(项目20)根据项目18所述的方法,其中,上述工序(f)中以上述2个表位的位置存在于上述抗原上的相对侧的方式进行选择。
60.(项目a1)根据上述项目中任一项所述的表位区域交联型双互补位抗体、或者该抗体的抗原结合片段或功能等同物,其完全抑制了激动剂活性。
61.(项目a2)根据上述项目中任一项所述的表位区域交联型双互补位抗体、或者该抗体的抗原结合片段或功能等同物,其提高了激动剂活性。
62.(项目a3)根据上述项目中任一项所述的表位区域交联型双互补位抗体、或者该抗体的抗原结合片段或功能等同物,其针对的是为了作为激动剂发挥功能所需的表位的组合、或者为了作为拮抗剂发挥功能所需的表位的组合。
63.(项目a4)根据上述项目中任一项所述的表位区域交联型双互补位抗体、或者该抗体的抗原结合片段或功能等同物,其用于制作抗体药物复合体(adc)。
64.(项目a5)一种抗体药物复合体(adc),其由上述项目中任一项所述的表位区域交联型双互补位抗体、或者该抗体的抗原结合片段或功能等同物制作而成。
65.(项目b1)根据上述项目中任一项所述的方法,其用于制造激动剂活性被完全抑制了的表位区域交联型双互补位抗体、或者该抗体的抗原结合片段或功能等同物。
66.(项目b2)根据上述项目中任一项所述的方法,其用于制造激动剂活性提高了的表位区域交联型双互补位抗体、或者该抗体的抗原结合片段或功能等同物。
67.(项目b3)根据上述项目中任一项所述的方法,其用于制造针对下述表位的组合
的、表位区域交联型双互补位抗体、或者该抗体的抗原结合片段或功能等同物,所述表位的组合是为了作为激动剂发挥功能所需的表位的组合、或者为了作为拮抗剂发挥功能所需的表位的组合。
68.(项目b4)根据上述项目中任一项所述的方法,其用于制造用于制作抗体药物复合体(adc)的、表位区域交联型双互补位抗体、或者该抗体的抗原结合片段或功能等同物。
69.(项目b5)一种抗体药物复合体(adc)的制造方法,其使用上述项目中任一项所述的表位区域交联型双互补位抗体、或者该抗体的抗原结合片段或功能等同物来制作抗体药物复合体(adc)。
70.在本发明中旨在表明上述的一个或多个特征除了所明示的组合以外还可进一步组合来提供。对于本发明的进而其他的实施方式及优点,只要根据需要阅读以下的详细说明进行理解,就能被本领域技术人员所认识。
71.需要说明的是,对于上述以外的本发明的特征及显著的作用
·
效果,本领域技术人员通过参考以下的发明的实施方式的项及附图即可明确。
附图说明
72.图1是在本发明的一个实施方式中示出用于制作抗tnfr2双互补位抗体的5个表位的位置的抗原-抗体复合体。位于各复合体的右侧部分的大致球状的部分是作为tnfr2的天然配体的tnfα。位于各复合体的左侧部分的纵长的大致棒状部分是tnfr2。各个由虚线的圆包围的部分为表位。
73.图2是示出tnfr2的4个富含半胱氨酸结构域(crd)的存在部位的示意图、和示出本发明的一个实施方式的表位解析中所使用的变异体的置换部位的示意图。tnfr2具有4个crd,从细胞膜的远位的细胞外结构域起依次称为crd1、2、3、4。图2的下侧部分所示的人tnfr2中,涂黑的部分被置换为小鼠直系同源序列。在crd中具有通过二硫键保持三维结构的被称为模块的结构单元,抗体表位区域向小鼠直系同源序列的置换被设计为使该模块结构不发生大幅变化。
74.图3为示出5个单克隆抗体(tr45、tr92、tr94、tr96、tr109)与图2中制作的各变异体的反应性的流式细胞仪(fcm)的解析结果。各tnfr2变异体通过使编码各变异体的表达质粒载体瞬时表达来表达至293t细胞上。这些表达载体被设计为在与tnfr2变异体相同的mrna上由ires介导表达tagbfp,能够以tagbfp荧光的形式监控抗原的表达水平(图的纵轴)。另外,抗体的结合利用pe标签的2次抗体进行检测,并且利用与tagbfp不同的荧光通道进行检测(图的横轴),所得的结果能够以bfp对pe的2d进行绘图。在抗体进行特异性结合的情况下,结合水平与抗原的表达水平相关,能够确认右肩上升的点分布。另一方面,由粗框包围的抗原-变异体的组合可见结合丧失,由细框包围的抗原-变异体的组合可见结合减弱。抗体对这些变异体的反应性的消失表明在各变异体中各抗体所识别的表位结构发生变化,根据该消失模式特定表位的结构上的位置。
75.图4为将图3的基于fcm的抗原-抗体结合性解析结果与各变异体的置换部位相关联地显示的示意图。在所有序列中,涂黑的部分被置换为小鼠直系同源序列。符号-所示的部位为可见与抗体的结合丧失的部位,符号
±
所示的部位为可见与抗体的结合减弱的部位。
76.图5为本发明的一个实施方式中的报道子检测的结果。使用10个表位区域交联型双互补位抗体及5个单克隆抗体,以吸光度测定了激动剂活性及拮抗剂活性,将所得的结果用棒图来表示。对于激动剂活性,使用表达有tnfr2的ramos-blue报道子细胞,将通过各抗体刺激被诱导的nfkb依赖性信号作为报道子蛋白质的分泌性碱性磷酸酶的表达,使用pnpp基质进行了检测。对于拮抗剂活性,将表达tnfr2及tnfr1的ramos-blue报道子细胞在各抗体的存在下用tnfα进行刺激,检测出所诱导的nfkb依赖性信号。各抗体的浓度均设为0、0.0001、0.001、0.01、0.1、1、10及100nm。深色箭头所示的抗体为强的激动剂或拮抗剂,浅色箭头所示的抗体为中程度的激动剂或拮抗剂、空心箭头所示的抗体为弱的激动剂或拮抗剂。
77.图6为对本发明的一个实施方式中的表位区域交联型双互补位抗体及单克隆抗体在tnfr2强制表达细胞上的结合能力进行评价得到的fcm解析结果。各抗体的浓度均设为0.01、0.1、1、10、100、1000、10000及100000ng/ml。纵轴是用pe标签的2次抗体检测各抗体的结合、并以median fluorescence intensity(中位荧光强度值)的形式来表示。
78.图7是用表面等离激元共振(spr)对本发明的一个实施方式中的表位区域交联型双互补位抗体及单克隆抗体分别在tnfr2单体抗原及tnfr2二聚体抗原上的结合能力进行评价得到的结果。黑色圆形图标(
●
)所示的部位为双互补位抗体与二聚体抗原的结合,黑色方形图标(
■
)所示的部位为表位区域交联型双互补位抗体与单体抗原的结合,黑色三角图标(
▲
)所示的部位为单克隆抗体与二聚体抗原的结合,
×
图标所示的部位为单克隆抗体与单体抗原的结合。均显示为越是位于上侧越是结合得快、越是位于左侧越是解离得慢,因此显示为越是位于左上侧越是亲和性高。
79.图8是示出本发明的一个实施方式中的tnfr2单体抗原及tnfr2二聚体抗原的制作步骤的示意图。通过将依那西普(etanercept)用酶进行消化而得到二聚体,再将该二聚体供于还原再氧化反应,由此得到单体。
80.图9为针对图5、图6、图7所示的、各抗体的激动剂活性、拮抗剂活性、基于fcm得到的tnfr2强制表达细胞上的结合活性以及基于spr得到的单体抗原及二聚体抗原上的结合活性分别按照抗体进行归纳得到的图表。能够进行抗体间的比较评价。
81.图10为将体积排阻色谱(sec)和多角度光散射检测器(mals)连接、并对各抗原-抗体复合体的形态进行调查的结果。上段为bp109-92(左图:有抗原,右图:无抗原)的结果,下段为tr109(左图:有抗原,右图:无抗原)的结果。在有抗原的情况下,均具有2个溶出的峰,显示出仅先溶出的抗原-抗体复合体和后溶出的抗原的各自的分子量。由各个溶出位置能够算出分子量,因此能够推定抗原-抗体复合体中的抗原与抗体的分子数比。所算出的抗体与抗原的结合比如各图的下方所示。
82.图11为针对bp109-92、bp94-96、bp45-96及bp94-92的sec-mals的解析结果。均是添加8当量或0.25当量的tnfr2抗原。上段及下段的各自的中央所示的示意图表示在非激动剂及激动剂的各自的情况下的结合方式。
83.图12为示出本发明的一个实施方式中成为激动剂的6个表位区域交联型双互补位抗体(bp45-96、bp94-92、bp109-96、bp109-94、bp45-94及bp96-92)所结合的2个表位位置的组合的示意图。位于复合体的右侧部分的大致球状的部分是作为tnfr2的天然配体的tnfα。位于复合体的左侧部分的纵长的大致棒状的部分是tnfr2。在tnfr2表面上,各个表位位置
均存在于相对侧。
84.图13为示出本发明的一个实施方式中不构成激动剂的4个表位区域交联型双互补位抗体(bp96-94、bp109-92、bp109-45、bp45-92)所结合的2个表位位置的组合的示意图。位于复合体的右侧部分的大致球状的部分是作为tnfr2的天然配体的tnfα。位于复合体的左侧部分的纵长的大致棒状的部分是tnfr2。在tnfr2表面上,各个表位位置均存在于相同侧。
85.图14为示出在本发明的一个实施方式的表位区域交联型双互补位抗体的制作中使用的表位及属于该表位的表位群的抗体群体。
86.图15为对本发明的一个实施方式的表位区域交联型双互补位抗体的tnfr2依赖性细胞内化能力进行比较得到的图表。各抗体的浓度均设为1、10、100、1000ng/ml。吸光度的降低表示引起细胞毒性,因此表示为发生抗体内化。
87.图16为对示意图的制作法进行例示的图,用于判定本发明的一个实施方式的表位区域交联型双互补位抗体所结合的抗原上的2处表位位置是位于“相同侧”还是“相对侧”。
88.图17为用于判定本发明的一个实施方式的表位区域交联型双互补位抗体所结合的抗原上的2处表位位置是位于“相同侧”还是“相对侧”的示意图。例如在使用tr94和tr96、或者tr109和tr92来制作表位区域交联型双互补位抗体的情况下,由于投影图中的向量间所成的角度小于90
°
,因此能够判定为“相同侧”。另一方面,例如在使用tr94和tr109、或者tr92的tr96来制作表位区域交联型双互补位抗体的情况下,由于投影图中的向量间所成的角度为90
°
以上,因此能够判定为“相对侧”。
89.图18为示出制作本发明的一个实施方式的表位区域交联型双互补位抗体时的c侧及n侧的示意图。对于成为材料的抗体,在将具有fc区域的fab区域设为c侧、将不具有fc区域的fab区域设为n侧来制作双互补位抗体的情况下,能够将所制作的双互补位抗体中具有原始的fc区域的fab区域称作c侧,将不具有fc区域的fab区域称作n侧。
具体实施方式
90.以下,参照附图来说明本发明的一个实施方式及实施例。
91.在整个本说明书中,只要没有特别说明,单数形式的表达应理解为也包括其复数形式的概念。因此,只要没有特别说明,单数形式的冠词(例如,在英语的情况下“a”、“an”、“the”等)应理解为也包括其复数形式的概念。另外,只要没有特别说明,本说明书中所使用的术语应理解为以该领域中通常使用的含义来使用。因此,只要没有其他定义,本说明书中所使用的所有专业术语及科技术语具有与本发明所属领域的普通技术人员通常所理解的含义相同的含义。在矛盾的情况下,以本说明书(包括定义)为准。
92.(定义)
93.在本说明书中,“约”是指后续数值
±
10%。
94.在本说明书中,“表位”是指抗体所结合的抗原上的部分。表位是抗原的特定的一部分,在抗原为蛋白质或多肽的情况下,能够以该抗原的氨基酸序列中的特定的氨基酸残基或其范围的形式呈现。或者,也能以构成表位的氨基酸中所含的一部分原子集合的形式来呈现。应理解为表位可以是由几个~十几个构成的氨基酸序列等比整个抗原分子小的区域。
95.在本说明书中,“互补位”是指来源于抗体的fv且用于与抗原的1个表位特异性结
合的结构。天然igg型抗体在1分子中包含2个相同的互补位(fv),作为抗体,虽然是2价,但互补位的数量为1个(1种)。
96.在本说明书中,“抗原结合部位”是指包含1个互补位的结构,该互补位用于各抗体分子与抗原靶标结合。对于天然igg型抗体,虽然互补位为1个(1种),但是由于在1分子中具有2个包含相同互补位的抗原结合部位,因此成为2价。
97.在本说明书中,“双互补位抗体”(bpab)是指下述人工抗体:来源于针对抗原靶标的2个不同抗体,具有分别对固有的表位显示特异结合能力的2种互补位,针对各互补位,各自在一分子中具有1个以上分别单独识别该2种互补位的抗原结合结构域。双互补位抗体能够与抗原上的不同的2个表位结合。
98.在本说明书中,“表位区域”是指:针对某表位的抗体和针对属于相同表位区域的别的表位的其他抗体不能同时结合的、抗原上的表位所能存在的部分的全体,在抗原为蛋白质或多肽的情况下,能够以氨基酸的位置的范围或这些氨基酸中所含的一部分原子集合的形式来表示。即,针对属于某表位区域的表位的某抗体、和针对属于同一表位区域的表位的别的抗体有时也不同时与抗原结合、或者阻碍彼此向抗原结合。对于表位区域,实验性地使用结合检测来确定,但是也能通过结合的模拟来推定。另外,在本说明书中,“表位群”是指如上所述的属于同一表位区域的1个或多个表位的集合,与属于同一表位群的表位结合的抗体显示同样的反应性曲线。
99.在本说明书中,将源自通过表位均质化抗体群体法鉴定的与不同表位区域结合的2个抗体的、具有2个不同互补位的双互补位抗体称作“表位区域交联型双互补位抗体(epitope region-bridging biparatopic antibody:erbba)”。表位区域交联型双互补位抗体能够在分子内或分子间桥连表位而形成多种多样的免疫复合体。例如,在表位区域交联型双互补位抗体与单一抗原分子上的不同的2个表位结合的情况下,形成具有分子内交联结构的免疫复合体。另外,在表位区域交联型双互补位抗体与2个抗原分子上的各自的表位结合的情况下,形成具有分子间交联结构的免疫复合体。
100.在本说明书中,“激动剂”是指对于成为对象的实体(例如受体)表达或增强该受体的生物学作用的物质。除天然的激动剂(也称作配体)外,还能列举合成的激动剂、修饰的激动剂等。在抗体具有激动剂活性的情况下,称作“激动剂抗体”。
101.在本说明书中,“拮抗剂”是指对于成为对象的实体(例如受体)抑制或阻碍该受体的生物学作用的表达的物质。除天然的拮抗剂外,还能列举经合成的拮抗剂、经改进的拮抗剂等。除与激动剂(或配体)竞争性地抑制或阻碍的拮抗剂外,还包括非竞争性地抑制或阻碍的拮抗剂等。还能通过修饰激动剂来获得。由于抑制或阻碍生理现象,因此拮抗剂也能包含在抑制剂(阻碍剂)或抑制(的)因子的概念中。在抗体具有拮抗剂活性的情况下,称作“拮抗剂抗体”。
102.在本说明书中,“生物学的作用”是指某分子本来具有的作用、效果或功能,或者有时也会指该作用的结果、在生物体中产生的活动或变化。与生物学的效果、生物效果或生物作用同义,例如如果是抗体,则包含如上述所述的激动剂活性、拮抗剂活性,如果是酶,则也包括其催化的化学反应的抑制效果、促进效果。
103.在本说明书中,“直系同源映射(ortholog mapping)”是指如下方法:在与抗原来源的动物(例如人)不同的其他动物种(例如小鼠)中,从具有与抗原相同的祖先基因的分子
(即,直系同源)中提取抗原的类似结构,用于制作变异体。对于直系同源,由其在异种动物中显示与抗原类似的生体功能可知,其是保证了具有功能的构象(conformational)结构的分子,因此在通过直系同源映射制作抗原变异体的情况下,破坏分子整体结构的可能性与不考虑通常的直系同源的变异体制作方法相比显著变低。作为结果,对于直系同源映射中使用的变异体,分子整体呈现正确的构象结构的可能性高,因此能够增加数据的可靠性。
104.在本说明书中,“片段”是指:相对于长度为n的全长的多肽或多核苷酸而言,具有1~n-1的序列长度的多肽或多核苷酸。片段的长度能够根据其目的进行适当变更,例如,作为其长度的下限,在多肽的情况下,可列举3、4、5、6、7、8、9、10、15、20、25、30、40、50及其以上的氨基酸,在此未具体列举的以整数表示的长度(例如11等)也能适合作为下限。另外,在多核苷酸的情况下,可列举5、6、7、8、9、10、15、20、25、30、40、50、75、100及其以上的核苷酸,在此未具体列举的以整数表示的长度(例如11等)也能适合作为下限。在本说明书中,对于这样的片段,例如,在全长的多肽或多核苷酸作为标记物或靶分子发挥功能的情况下,该片段本身只要具有作为标记物或靶分子的功能,也应理解为落入本发明的范围内。
105.在本说明书中,“功能等同物”能够使用在氨基酸序列中插入、置换或缺失1个或多个氨基酸、或者向其一末端或两末端添加1个或多个氨基酸而成的物质。修饰氨基酸序列能够为插入、置换或缺失、或者向其一末端或两末端添加例如1~30个、优选1~20个、更优选1~9个、进一步优选1~5个、特别优选1~2个氨基酸的氨基酸序列。对于修饰氨基酸序列,可优选使其氨基酸序列为在tnfr2或本发明的双互补位抗体的氨基酸序列中具有1个或多个(优选1个或几个或1、2、3或4个)保守置换的氨基酸序列。
106.因此,应理解为:在“表位区域交联型双互补位抗体或其片段”的“功能等同物”中,例如在抗体的情况下,除包含具有tnfr2的结合活性、需要时的抑制活性的抗体本身及其片段本身外,还包含嵌合抗体、人化抗体、多功能抗体、双特异性或寡特异性(oligospecific)抗体、单链抗体、scfv、抗体二聚体(diabodies)、sc(fv)2、scfv-fc等。另外,这样的“功能等同物”能够与下述表位结合,该表位与“双互补位抗体或其片段”所结合的表位相同。
107.在本发明中,“活性”是指最广义上的分子的功能。活性并非旨在限定,概况而言,包含分子生物学的功能、生化学的功能、物理功能或化学功能。活性包括例如:酶活性;与其他分子相互作用的能力;以及将其他分子的功能进行活化、促进、稳定化、阻碍、抑制或不稳定化的能力;稳定性;局限在特定的细胞内位置的能力。在能够应用的情况下,该术语还涉及最广义上的蛋白质复合体的功能。
108.在本说明书中,活性的“减少”、“减弱”、或“抑制”或者其同义词是指特定的活性的量、质或效果的减少、或者减少的活性。减少中已“丧失”的情况是指活性、表达产物等小于检测限。在本说明书中,“丧失”包含在“减少”或“抑制”中。
109.在本说明书中,活性的“增加”、“增强”、或“活化”或者其同义词是指特定的活性的量、质或效果的增加或者增加的活性。在本说明书中,对于“活化”这一词,相比于活性、表达产物等小于检测限的状态,还包含活性、表达产物等达到检测限以上的状态。
110.本发明的表位区域交联型双互补位抗体、或者该抗体的抗原结合片段或功能等同物能够对于某靶标(例如tnfr2等)具有上述的抑制或活化的功能。
111.(优选的实施方式)
112.以下说明本发明的优选实施方式。以下提供的实施方式是为了更好地理解本发明
而提供的,可理解为本发明的范围不应被限定为以下的记载。因此,显而易见的是本领域技术人员能够参酌本说明书中的记载而在本发明的范围内进行适当改变。另外,应理解为本发明的以下的实施方式能够单独使用或将它们组合使用。
113.表位区域交联型双互补位抗体
114.以下,对本发明的表位区域交联型双互补位抗体进行说明。在本发明的一个实施方式中,提供一种表位区域交联型双互补位抗体、或者该抗体的抗原结合片段或功能等同物,其对抗原(通过结合靶分子而活化)中的多个表位区域群的、属于第1表位群(选自各个表位区域中所含的表位群)的第1表位和属于第2表位群(包含在与包含上述第1表位群的表位区域不同的表位区域中)的第2表位具有抗原特异性,上述抗体包含:源自针对上述第1表位而言的抗体的重链可变区域及轻链可变区域的序列、和源自针对上述第2表位而言的抗体的的重链可变区域及轻链可变区域的序列。
115.因此,在本发明的一个实施方式中,在本发明的表位区域交联型双互补位抗体针对1个互补位具有m个(m为针对互补位的抗原结合结构域的数量的最大值)抗原结合结构域的情况下,优选的是通过与抗原结合而形成具有抗原:抗体为m
×
n:n(n为1或大于1的同一数值)的结构的复合体。
116.在本发明的一个实施方式中,在本发明的表位区域交联型双互补位抗体针对1个互补位具有1个抗原结合结构域的情况下,优选的是通过与抗原结合来形成具有抗原:抗体为n:n(n为1或大于1的同一数值)的结构的复合体。单克隆(单互补位)抗体是以特定的蛋白质作为靶标、并且与单一抗原表位具有特异性的抗体,因此在与抗原结合的情况下,形成抗原:抗体为2:1的免疫复合体。另一方面,双互补位抗体能够与单一种类的1个或大于1个的抗原上的不同的2个表位结合,因此在与单一抗原分子上的不同的2个表位结合而形成具有分子内交联结构的免疫复合体的情况下,抗原:抗体为1:1。另外,在与2个抗原分子上的各自的表位结合的情况下,抗原:抗体为n:n(n为2以上的同一数值)。在本发明的一个实施方式中,优选使抗原:抗体为1:1,形成具有分子内交联结构的免疫复合体。另外,在形成具有分子间交联结构的免疫复合体的情况下,优选使抗原:抗体为2:2、3:3、4:4、5:5、6:6、或7:7,只要能作为本发明的双互补位抗体发挥功能,则n并不受限制,另外也不限于整数,但是在个别进行计数的情况下也能按照整数来计数。
117.在本发明的其他实施方式中,在本发明的表位区域交联型双互补位抗体针对1个互补位具有2个以上抗原结合结构域、且与2个互补位对应的抗原结合结构域的数量相同的情况下,即,也能为2个不同的可变区域各具有2个或各具有3个的结构,例如igg-scfv、dvd-ig等之类的结构。在这样的情况下,将各自的抗原结合结构域的数量设为m,本发明的双互补位抗体能够通过与抗原结合而形成具有抗原:抗体为(m
×
n):n(n为1以上的同一数值)的结构的复合体。例如在2个可变区域各具有2个的4价抗体的情况下,还能使抗原:抗体=2:1、4:2、6:3等。另外,在本发明的表位区域交联型双互补位抗体针对2个互补位具有不同数量(即2以外)的抗原结合结构域的情况下,针对其数量较多一方,将其数量设为m(即针对各互补位而言的抗原结合结构域的数量的最大值),与上述的例子同样,能够通过与抗原结合来形成具有抗原:抗体为(m
×
n):n的结构的复合体。例如在2个可变区域各具有2个的4价抗体的情况下,也能使抗原:抗体=2:1、4:2、6:3等。需要说明的是,在hetero-fc igg型、scfv-scfv型等的情况下,由于m=1,因此形成如上所述的具有抗原:抗体为n:n(n为1或大
于1的同一数值)的结构的复合体。
118.虽然不期望受到理论束缚,但是在本发明的一个优选实施方式中,重点之一在于由双互补位抗体(2个可变区域各具有1个)得到1:1的复合体,该结构的复合体显示与抗体将抗原2分子间交联的复合体不同的性质,优选能够使由分子间交联带来的不期望的活性丧失也是至关重要的。在本发明的一个优选实施方式中,能够完全使激动剂活性显著减少或丧失也是至关重要的。在一个实施方式中,例如在使用抗体作为adc的情况下,激动剂活性完全抑制是有用的。例如,针对由信号(促进癌增殖)介导的受体而言的抗体会使癌细胞增殖,但是,如果是通过本发明的方法得到的完全抑制激动剂活性的双互补位抗体,则即使在adc化的情况下也是安全的,能够期待抗肿瘤效果。另外,对于抗体药物,由于施用量多,半衰期也长,因此即使是弱的激动剂活性,也不能排出其危险性,但是,如果是通过本发明的方法得到的双互补位抗体,则能够完全抑制激动剂活性,因此是有用的。
119.在本发明的一个实施方式中,抗原-抗体复合体的分子量尺寸及分子形状能够通过本领域中公知的分子量和/或分子形状的各种测定法来测定。例如体积排阻色谱-多角度光散射法(sec-mals)能够基于静态光散射法进行粒径解析,还能进一步得到绝对分子量、与分子形状有关的信息。分子量可以是数均分子量(mn)、重均分子量(mw)或峰分子量(mp)的任意种类。另外,这些分子量也能使用体积排阻色谱或其他液相色谱技法、静态光散射法、超离心法来测定。另外,在本发明的一个实施方式中,抗原-抗体复合体的分子形状也能使用电子显微镜进行拍摄。
120.在本发明的一个实施方式中,作为通过结合靶分子来活化的抗原,可列举:通过结合神经传达物质、激素、或细胞增殖因子等物质(配体)来引发细胞的反应的受体;针对生物体内的化学反应作为催化剂发挥功能的酶等。在本发明的一个实施方式中,在受体为抗原的情况下,并非旨在限定活性的种类,但本发明的表位区域交联型双互补位抗体通过与作为抗原的受体结合而具有表达或增强该受体本来的生物学作用的激动剂活性、或具有抑制或阻碍该受体的生物学作用的表达的拮抗剂活性。在本发明的一个实施方式中,在酶为抗原的情况下,本发明的表位区域交联型双互补位抗体优选抑制或阻碍该酶本来催化的化学反应。或者,在本发明的一个实施方式中,在酶为抗原的情况下,本发明的表位区域交联型双互补位抗体也能促进或增强该酶本来催化的化学反应。
121.在本发明的一个实施方式中,本发明的表位区域交联型双互补位抗体所结合的2个表位分别属于识别不同表位区域的表位群。
122.在本发明的一个实施方式中,对于成为拮抗剂的本发明的表位区域交联型双互补位抗体,至少一个可变区域源自与表位群(所结合的抗体为拮抗剂)结合的抗体。另一方面,对于成为激动剂的本发明的表位区域交联型双互补位抗体,依赖于所结合的2个表位间的相对位置关系,对于与各表位结合的原本的抗体是否为激动剂而言实质上没有影响。例如,在本发明的一个实施方式中,在某双互补位抗体所结合的抗原上的2处表位位置存在于该抗原上的相对侧的情况下,该双互补位抗体成为激动剂。另一方面,在某双互补位抗体所结合的抗原上的2处表位位置存在于该抗原上的相同侧的情况下,该双互补位抗体不构成激动剂,或者在2个不同互补位分别各具有1个的双互补位抗体中能够显著减小激动剂活性。
123.在此,通过使某双互补位抗体所结合的抗原上的2处表位位置处于“相对侧”或“相同侧”,从而控制双互补位抗体所结合的抗原上的2处表位位置与抗体的2个可变区域的相
对关系,能够实现所期望的结合方式。例如,通过将2处表位位置选择在抗原上的“相同侧”,从而能够使单一抗体的2个可变区域与单一抗原上的该2处表位结合。另一方面,在2处表位位置存在于抗原上的“相对侧”的情况下,单一抗体的2个可变区域能够与2个抗原上的各1处共计2处表位(即,一个表位存在于抗原a1、另一个表位存在于抗原a2且抗原a1和a2为同一种类的抗原的情况)结合。在本发明的一个实施方式中,选择双互补位抗体所结合的抗原上的2处表位时,还能考虑该2处表位的位置在距离上相隔多远或多近这样的要素。
124.例如,在本发明的一个实施方式中,作为“相同侧”或“相对侧”,从tnfr2抗原分子的立体结构中,将属于4个crd结构域的所有原子投影到任意的平面上时,定义出包含所有投影图的最小圆,由此也能够进行判定。在该情况下,选择使该圆的面积最小的投影图。根据该投影图,通过以下的步骤来决定表位的方向。首先,在各变异体中,针对置换成源自直系同源的氨基酸序列的区域中所含的所有原子,求出各个原子最接近的圆周上的点b(圆依据上述的定义)。接着,按照各抗体来定义圆周上的点x,计算弧bx间的长度。此时,按照各抗体,对源自可见反应性丧失的变异体的弧bx的长度进行2倍加权,对源自可见反应性减弱的变异体的弧bx的长度进行1倍加权(即,图4中,将源自成为
“‑”
的区域的点b处的弧bx的长度设为
×
2,将源自成为
“±”
的区域的点b处的弧bx的长度设为
×
1)。源自变异体中的未见反应性减弱的区域的点b处的弧bx的长度设为0。另外,在天然型tnfr2抗原(与各变异体中置换为源自直系同源的氨基酸序列的区域相当)中的氨基酸残基为arg、tyr、phe、trp的情况下,源自属于该氨基酸的原子的弧bx的长度以2倍进行加权,源自属于其他氨基酸的原子的弧bx的长度以1.5倍进行加权。将使得所有b处的弧bx的总和最小的点x设为该特定抗体的表位的中心点a。这样能够按照各表位得到向量oa,该向量oa通过针对各抗体所定义的表位的中心点a和先前所定义的最小圆的中心o(图16)。在针对2个表位而言的向量的内积为正值的情况下,即在将tnfr2抗原看作圆筒时从该圆筒的底面观察的情况下,如果投影图中的向量间所成的角度小于90
°
,则判定2个表位处于“相同侧”。在向量的内积为0或负值的情况下,也能判定为处于“相对侧”(图17)。
125.在本发明的一个实施方式中,在2处表位的位置或该表位所属的2个表位区域在距离上接近的情况下,即使将2处表位位置选择在抗原上的“相同侧”,表位区域交联型双互补位抗体的2处可变区域也会竞争而阻碍同时结合,表位区域交联型双互补位抗体变得不能结合在单一抗原上。在该情况下,不能得到选择使表位区域交联型双互补位抗体所结合的抗原上的2处表位位置处于“相同侧”的效果。另外,在其他实施方式中,在想要将2处表位位置选择在抗原上的“相同侧”的情况下,如上述那样配置于双互补位抗体分子时,也能排除针对能产生竞争阻碍的表位而言的抗体可变区域的组合。
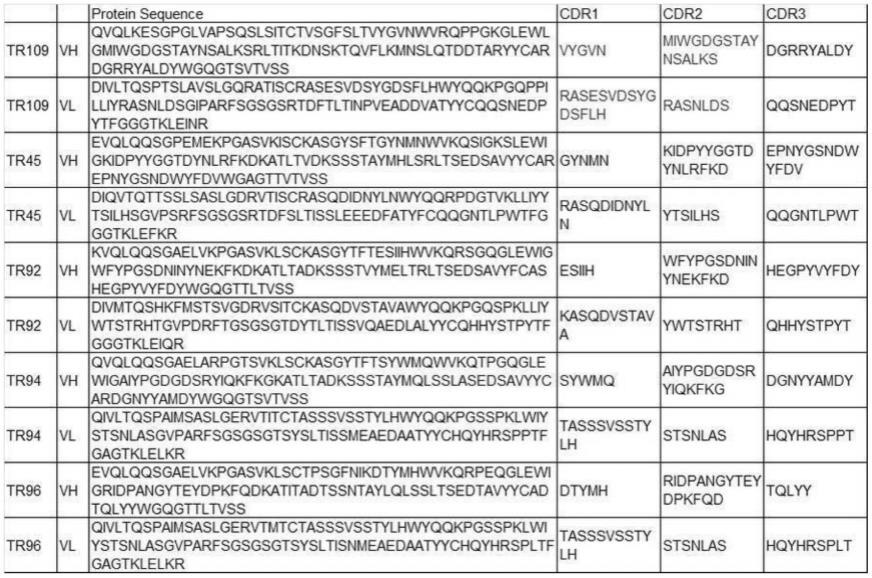
126.在本发明的一个实施方式中,本发明的表位区域交联型双互补位抗体能够针对抗原而与存在于抗原本来的结合靶分子(例如天然配体)的一侧的2个表位结合。即,在这样的情况下,表位区域交联型双互补位抗体所结合的抗原上的2处表位位置存在于该抗原上的相同侧。另一方面,在本发明的一个实施方式中,本发明的表位区域交联型双互补位抗体也能针对抗原而与存在于抗原本来的结合靶分子的一侧的第1表位和存在于不结合靶分子的一侧的第2表位结合。即,在这样的情况下,表位区域交联型双互补位抗体所结合的抗原上的2处表位位置存在于该抗原上的、与配体结合部位相对的一侧。
127.在本发明的一个实施方式中,本发明的表位区域交联型双互补位抗体与其原本的
单克隆抗体相比激动剂活性增强。如上述所示,在本发明的表位区域交联型双互补位抗体中,在其原本的单克隆抗体所结合的2个表位位置相互存在于抗原上的相对侧的情况下,该表位区域交联型双互补位抗体成为激动剂抗体,在该情况下,该激动剂活性能够比原本的单克隆抗体的激动剂活性显著增强。
128.在天然的单克隆抗体的情况下,保持激动剂活性和拮抗剂活性两者的活性。例如,在图5所示的针对tnfr2而言的单克隆抗体(tr92、tr109、tr45、tr94及tr96)中,tr109具有强拮抗剂活性,另一方面,还保持中程度的激动剂活性。这样,在天然的单克隆抗体的情况下,有时还会使得“某抗体为拮抗剂,同时也为激动剂”,在两活性的平衡中显示复杂的行为。在本发明的一个实施方式中,本发明的表位区域交联型双互补位抗体能够不具有作为激动剂或拮抗剂的性质。因此,本发明的表位区域交联型双互补位抗体例如能够为激动剂活性被抑制、拮抗剂活性得到显著增强的抗体。
129.另外,在本发明的一个实施方式中,本发明的表位区域交联型双互补位抗体能够增强或抑制抗原所具有的本来的生物学作用,因此例如在抗原为酶的情况下,本发明的表位区域交联型双互补位抗体还能完全地抑制或阻害该酶本来催化的化学反应。
130.表位均质化抗体群体的制作方法
131.针对本说明书中记载的表位均质化抗体群体而言,作为本发明中使用的表位均质化抗体群体,除了wo2017/143838中记载的表位均质化抗体群体外,还可以基于该记载施加以下的改良。例如,基于抗原的序列解析,以下述单元,将全长序列的抗原进行聚簇,所述单元保持抗体结合功能所需的抗原的高次结构。接着,用直系同源、旁系同源等的抗原同系物的序列将各簇(cluster)进行置换,由此以论理上网罗表位区域的方式制作有限数量的部分变异抗原系列。将各抗体相对于各变异体的结合强度的变化定量为亲和性损失的程度,以与wo2017/143838中记载的“表位均质化抗体群体”技术相同的方式得到以各抗体的亲和性作为标准的参数。在此,为了得到仅反映表位位置而非亲和性的信息而进行利用。将所得的反应性曲线按照各种各样的分辨率进行分组。使用此,以与wo2017/143838中记载的“表位均质化抗体群体”相同的方式按照功能表位的单元设定分辨率,由此能够成为包含位置信息的“表位均质化抗体群体”。
132.这样,作为本发明中所使用的“表位均质化抗体群体”,可以使用包含位置信息的表位均质化抗体群体,应理解为该群体的制造法构成本发明的一部分。
133.首先,基于抗原的序列解析,按照单元(其保持抗体结合功能所需的抗原的高次结构)将全长序列的抗原进行聚簇。接着,以直系同源、旁系同源等的抗原同系物的序列将各簇进行置换,由此以论理上网罗表位区域的方式制作有限数量的部分变异抗原系列。将各抗体相对于各变异体的结合强度的变化定量为亲和性减弱的程度,由此得到与以各抗体的亲和性作为标准的表位位置相关的参数。将所得的反应性曲线按照各种各样的分辨率进行分组,由此能够对“表位均质化抗体群体”添加位置信息。
134.在一个具体实施方式中,在本说明书记载的表位均质化抗体群体中使用如本说明书记载那样的直系同源映射的情况下,对于亲和性丧失的程度,使用小鼠直系同源中结构域尺寸的变异体时,在所有抗体中能够明确确认到其为大致1或0。群体抗体的表位区域的划分与各抗体在变异体上的亲和性减弱的模式一致。例如在从本说明书记载的表位均质化抗体群体中选择抗体时,能够按照基准(抗体具有作为高亲和性、抗体分子的稳定性高等的
物质的优点、或者抗体人源化、抗体先于其他抗体确定fv序列等),选择作为参比抗体,并将该抗体作为本发明的表位区域交联型双互补位抗体的材料。在该情况下,可预期表位均质化抗体群体中的抗体只要使所有的表位区域的位置适当地分散、并隔开某程度的距离而存在,便能够在利用它们的互补位来制作表位区域交联型双互补位抗体的情况下创造出新的相互作用,因此是理想的。
135.另外,在本发明的一个实施方式中,优选的是在设计本发明的表位区域交联型双互补位抗体时能够判明或以某精度推定成为其结合对象的抗原的高次结构。另外,在本发明的一个实施方式中,作为抗原的表位的位置信息,优选能获得其“方向”(例如在本说明书中所记载的“相同侧”、“相对侧”)、距离信息。
136.在本发明的一个实施方式中,在使用直系同源映射的情况下,也能在同系物(直系同源和旁系同源)映射法的一部分中使用直系同源的全长。或者,在其他实施方式中,在针对变异体所源自的直系同源没有想要测定的抗体的结合性、且抗原的域结构清晰的情况下,也能将无抗原性的免疫宿主的直系同源(即小鼠直系同源)用于部分交换用途。在该情况下,所有的抗体对小鼠直系同源不显示结合性。
137.针对本说明书中记载的表位均质化抗体群体而言,作为本发明中使用的表位均质化抗体群体,能够使用由多个抗体(其以抗体群特有的逐次结合模式为指标来均质地识别靶标上的多个表位区域)构成的抗体群体。只要使用该识别表位区域经均质化的抗体群,便能无疏漏且有效地调查抗原基于抗体进行功能表达的可能性。在该情况下可理解的是,虽然未获得抗原结合部位的位置信息、并且必须进行抗体间的逐对检测,但是,通过使用同系物映射,可解决该问题点。即,代替抗体相互间的逐对检测反应值,而重新取得各抗体对于抗原的直系同源(由与抗原共同祖先的基因通过种分化而生成的不同生物中存在的、具有相同功能的基因群)、旁系同源(由与抗原共同祖先的基因通过进化而派生、并且在抗原所源自的生物中具有相同结构(作为个别分子存在)的基因群)的反应性数据,使用这些反应性数据作为各抗体特性值,能够制作表位均质化群体。这样,在本发明的一个实施方式中,能够改良以往的表位均质化抗体群体法,这样的经改良的表位均质化抗体群体法也在本发明的范围内。虽然不期望受到理论束缚,但是,通过表位均质化抗体群体法的这样的改良,具有下述优点:无需逐次结合检测,仅以抗体的反应性数据便能完成抗体群体,还能推定表位区域的抗原结构上的位置。
138.在开发抗体的情况下,进行动物实验,因此大多情况显示交叉反应性或需要与拓扑学(topology)上相同的表位区域结合的替代抗体,在本说明书中,所例示那样的直系同源映射是有用的。在本发明的一个实施方式中,为了得到用于制作表位均质化群体的反应值,能够使用全长的同系物。通过使用直系同源、旁系同源,从而保证抗原的正常构象,同时通过使用加入有多个部位的变异的变异体来判定表位的均质化,为此,能够将所需的变异体个数减少至实用性水平。可理解:利用对同系物的反应性得到的参数不能立即与位置信息相结合。例如,在抗原具有a-b-c-d这样的表位区域、小鼠的直系同源具有a-b-c-d这样的区域的情况下,能够检测反应性不同的区域(b≠b、d≠d),但是仅凭此无法获知位置信息。因此,首先,为了得到聚簇中使用的推定值,需要规定同系物中的变异的频率和场所的变化的范围。为此,在本发明的一个实施方式中,针对抗体和各变异体的结合性,通过引入亲和性损失(考虑了野生型抗原与变异体抗原之比)的概念,从而能够得到表位的位置信息。
activity by tnf receptortype ii-targeting pharmacological agents,front immunol 9(594,2018sheng y,li f,qin z,tnf receptor 2 makestumor necrosis factor a friend of tumors,front immunol 9(1170,2018
155.#11 shaikh f,he j,bhadra p,chen x,siuswi,tnf receptor type ii as an emerging drug target for the treatment ofcancer,autoimmune diseases,and graft-versus-host disease:curre ntperspectives and in silico search for small molecule binders,front immunol9(1382,2018
156.#12 salomon bl,leclerc m,tosello j,ronine,piaggio e,cohen jl,tumor necrosis factor alpha and regulatory t cells inoncoimmunology,front immunol 9(444,2018
157.#13 nie y,he j,shirota h,trivett al,yang,klinman dm,oppenheim jj,chen x,blockade of tnfr2 signaling enhancesthe immunotherapeutic effect of cpg odn in a mouse model of colon cancer,scisignal 11(511):2018
158.#14 fischer r,proske m,duffey m,stanglh,martinez gf,peters n,kraske a,straub rh,bethea jr,kontermann re,pfizenmaierk,selective activation of tumor necrosis factor receptor ii inducesantiinflammatory responses and alleviates experimental arthritis,arthritisrheumatol 70(5):722-735,2018
159.#15 faustman dl,tnf,tnf inducers,andtnfr2 agonists:a new path to type 1 diabetes treatment,diabetes metab res rev3 4(1):2018
160.#16 torrey h,butterworth j,mera t,okuboy,wang l,baum d,defusco a,plager s,warden s,huang d,vanamee e,foster r,faustman dl,targeting tnfr2 with antagonistic antibodies inhibits proliferationof ovarian cancer cells and tumor-associated tregs,sci signal 10(462):2017
161.#17 williams gs,mistry b,guillard s,ulrichsen jc,sandercock am,wang j,gonzalez-munoz a,parmentier j,black c,soden j,freeth j,jovanovic j,leyland r,al-lamki rs,leishman aj,rust sj,stewart r,jermutus l,bradley jr,bedian v,valge-archer v,minter r,wilkinson rw,phenotypic screening reveals tnfr2 as a promising target forcancer immunotherapy,on cotarget 7(42):68278-68291,2016
162.#18 okubo y,torrey h,butterworth j,zhengh,faustman dl,treg activation defect in type 1diabetes:correction with tnf r2 agonism,clin transl immunology 5(1):e56,2016
163.另一方面,对于tnfr2的功能,其详细功能还不明确,需要潜心进行有关其具有何种功能、阐明其作用的研究。tnfr2的表达限于血管内皮细胞、包含淋巴细胞的t细胞集团等(ware,c.f.et al.tumor necrosis factor(tnf)receptor expressionin t lymphocytes.differential regulation of the type itnf receptor duringactivation of resting and effector t cells.j.immunol.147,4229-4238(1991).),报道了依赖于tnfr2活化的t细胞增殖、细胞存活亢进(kim ey,priatel jj,teh sj,teh hs.tnf receptor type 2(p75)functions as a costimulator for antigendriven t cell responses in vivo.journalof immunology.176(2),1026-35.
(2006).)。根据以上内容,虽然预测了tnfr2对于炎症的控制、生物体防御机制具有大的作用,但是期待其详细功能的阐明会与病态的发病、恶化以及tnfr2作为治疗药靶标的利用联系起来(#7)。
164.已知tnfr2是在起到免疫抑制作用的调节性t细胞(以下为treg)中高表达的膜型受体,由tnfr2介导的信号对于treg的增殖和功能是至关重要的。已知tnfr2在通过内源性配体(tnfα)的结合来活化时,通过转录因子nfκb而起到treg增殖和免疫抑制表达的作用,这些生物学活性也通常包含在内。
165.在本说明书中,“肿瘤坏死因子受体2(tnfr2)”是受体的一种,也表示为tnfrii、tnfrsf1b、cd120b、tbpii、tnf-r-ii、tnf-r75、tnfbr、tnfr1b、tnfr80、p75、p75tnfr、肿瘤坏死因子受体超家族成员(tumor necrosis factor receptor superfamily member)1b等。其结合肿瘤坏死因子(tnf)α来介导信号传递。针对该基因信息进行描述时,refseq(mrna)是nm_001066(人)及nm_011610(小鼠),对于其基因产物,就ncbi中记载的登录号(accession numbers)来看,refseq(protein)为np_001057.1(人)、np_035740(小鼠)或np_035740.2(小鼠)。由tnf受体(tnfr,广泛存在于除红细胞外的生物体内的细胞中)介导而表达tnf的生理作用。据报道,tnfr存在tnfr1(p60)和tnfr2(p80),对tnfr2的亲和性比对tnfr1的亲和性高5倍。tnfr也与tnf同样形成三聚体而存在,tnfr1在构成上表达于全身的大多组织,与此相对,tnfr2是由某些刺激介导而表达于免疫系细胞的诱导型受体。通过进行抗体产生的亢进而参与感染防御、抗肿瘤作用,另一方面,还参与关节风湿病、干癣等的自身免疫疾病等。
166.如上所述,已知由tnfr2介导的信号对于起免疫抑制作用的调节性t细胞(以下为treg)的增殖和功能是至关重要的。已知tnfr2在通过内源性配体(tnfα)的结合来活化时,通过转录因子nfκb而起到treg增殖和免疫抑制表达的作用,因此通过施用抗tnfr2拮抗剂抗体,从而损害浸润至癌组织的treg而促进患者的抗肿瘤免疫,这有望成为新的癌症治疗法。
167.另外,除treg以外,tnfr2也在髓源抑制性细胞(mdscs,myeloid-derived suppressor cells)等不同类型的免疫抑制活性细胞中特异性地高表达,并介导重要的增殖信号。认为抗tnfr2抗体抑制这些细胞的增殖,结果解除免疫抑制,从而促进癌症免疫,对于癌症治疗有用。
168.此外,有时在多发性骨髓瘤、大肠癌、卵巢癌等多种癌细胞中高水平地表达tnfr2,常见的是通过tnfr2下游的nfkb的活化来促进癌细胞的增殖,因此认为在利用抗tnfr2抗体损害这些癌细胞时显示抗肿瘤效果。
169.为了损害表达tnfr2的treg、mdsc、癌细胞等,通过抗体结合来阻碍内源性配体的结合、并且作为不产生细胞内信号的拮抗剂发挥功能的抗体是有用的。另外,作为可能性高的抗体的效应子功能,认为有通过抗体与抗原结合后、再与nk细胞等免疫细胞上的fc受体结合而诱导的adcc(抗体依赖性细胞介导的细胞毒作用(antibody-dependent cell-mediated cytotoxicity))、adcp(抗体依赖性细胞介导的细胞吞噬作用(antibody-dependent cell-mediated cytotoxicity and complementdependent cytotoxicity))等细胞毒作用。另外还可期待通过与抗原结合的抗体由fc区域介导结合补体从而引起的补体依赖性细胞毒作用。
170.因此,对于抗tnfr2拮抗剂抗体,可考虑将其应用在下述治疗药中,该治疗药不仅通过与内源性配体tnfα的竞争来阻碍treg、mdsc、tnfr2阳性的癌细胞等的增殖和功能,而且还通过抗体的效应子作用而毒害这些细胞,从而促进毒害表达tnfr2的调节性t细胞和mdsc的癌症免疫,另外,还可考虑将其应用于损害tnfr2阳性的癌细胞本身的抗体药物中。
171.在自身免疫疾病等由过度免疫引起的疾病中,增强treg的增殖和功能而抑制免疫的治疗是备受期待的。为了增强treg的增殖和功能,下述抗体是有用的,该抗体通过抗体结合而显示诱导与内源性配体同样的细胞内信号的激动剂功能。
172.例如,能够期待激动剂抗体即使在tnf相关疾病中也具有对难治性自身免疫病的治疗效果。作为例子,可列举克罗恩病(crohn's disease)、干燥综合征(sjogren's syndrome)、多发性硬化症、i型糖尿病、红斑狼疮(sle)、强直性脊柱炎、慢性风湿病性关节炎等疾病。此外,可期待能够利用于期待对某种神经疾病的保护作用的疾病(作为例子,为海马修复、视网膜神经保护等)中。另外,tnfr2激动剂通过在1型糖尿病的病态中修正treg的功能不全、抑制自身免疫而存在对改善病态有用的可能性(ref#18)
173.有可能将利用抗tnfr2激动剂抗体进行的treg增殖用于自体细胞移入疗法(将体内的treg取出至体外,在细胞培养中进行该treg增殖,将扩增的免疫抑制treg细胞返回至患者体内)、过继性免疫疗法(ref#2)。
174.在本发明的一个实施方式中,作为针对tnfr2而言的表位区域交联型双互补位抗体的原本的单克隆抗体,只要是能够以tnfr2作为抗原而与任意的表位区域结合的单克隆抗体,则并无特别限制,可列举例如图14所示的tr92、tr109、tr45、tr94及tr96等。图14中tr或c所示的抗体均为针对tnfr2而言的单克隆抗体,例如在制作针对tnfr2而言的表位区域交联型双互补位抗体的情况下,可以使用该单克隆抗体中属于不同表位区域的任意组合。
175.在本发明的一个实施方式中,例如针对作为抗原的tnfr2而言的表位区域交联型双互补位抗体能够使用识别针对tnfr2而言的不同表位区域的2个单克隆抗体来制作,其组合可以为任意的组合。另外,对于双互补位抗体,如上所述,来源的抗体为2个,因此呈非对称,来自原来的2个抗体的互补位的任意者可以为n侧,也可以为c侧。例如,在针对tnfr2而言的表位区域交联型双互补位抗体中,使用tr96作为n侧的序列且使用tr94作为c侧的序列而得到的表位区域交联型双互补位抗体(bp96-94)、与将n侧及c侧互换而制作的表位区域交联型双互补位抗体(bp94-96)显示相同的性质。
176.在本发明的一个实施方式中,针对tnfr2而言的表位区域交联型双互补位抗体例如能够包含选自tr92、tr109、tr45、tr94及tr96中的2个抗体的重链可变区域及轻链可变区域。另外,在其他实施方式中,针对tnfr2而言的表位区域交联型双互补位抗体例如也能包含选自tr92、tr109、tr45、tr94及tr96中的2个抗体的重链cdr(cdr1、cdr2、cdr3)及轻链cdr(cdr1、cdr2、cdr3)。
177.在本发明的一个实施方式中,如上述所示,表位区域交联型双互补位抗体所源自的2个单克隆抗体可以为任意的组合,但是所制作的表位区域交联型双互补位抗体的性质会根据其所选择的2个单克隆抗体而发生变化。例如,在本发明的一个实施方式中,在由tr92和tr109制作表位区域交联型双互补位抗体的情况下,拮抗剂活性极度增强,另一方面,激动剂活性显著减弱或被除去。这与各个单克隆抗体所结合的表位彼此的相对位置相关联。另外,在tr45和tr94、tr45和tr96、tr109和tr96、tr96和tr92、tr109和tr94、tr94和
tr92制作表位区域交联型双互补位抗体的情况下,激动剂活性增强。这也与各个单克隆抗体所结合的表位彼此的相对位置相关联。
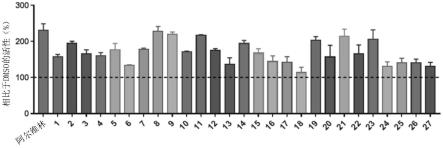
178.各抗体的重链及轻链、以及各自的cdr1、cdr2、cdr3的序列如以下所示(基于kabat的定义)。
179.[表1]
[0180][0181]
在本发明的一个实施方式中,各单克隆抗体的重链及轻链、以及各自的cdr1、cdr2、cdr3的序列可以具有下述的氨基酸序列,该氨基酸序列分别与表1记载的序列具有至少约50%以上的序列同源性、或具有约60%以上的序列同源性、或具有约70%以上的序列同源性、或具有约80%以上的序列同源性,优选具有至少约90%以上的序列同源性,更优选具有至少约95%以上、约96%以上、约97%以上、约98%以上、约99%以上的序列同源性,最优选具有100%的序列同源性。
[0182]“cdr”是抗原结合蛋白质的互补决定区氨基酸序列,它们是免疫球蛋白重链及轻链的超可变区域。免疫球蛋白的可变部分存在3个重链cdr和3个轻链cdr(或cdr区域)。因此,在本说明书中,“cdr”是指3个重链cdr、3个轻链cdr、或所有的重链及轻链cdr。
[0183]
在本发明的一个实施方式中,重链、轻链、或可变结构域序列等抗体序列的氨基酸残基能够按照kabat编号规则进行编号。或者,在其他实施方式中也能使用除kabat编号规则以外的编号规则,例如也能使用chothia、aho、imgt等本技术领域中周知的编号规则。因此,在本发明的一个实施方式中,抗体序列的氨基酸残基能够使用按照任意编号规则的序列,或者也能使用按照2个以上编号规则的最小重复区域作为最小结合单元。
[0184]
在本发明的一个实施方式中,本发明的表位区域交联型双互补位抗体也能利用针对抗原的高亲和性、长半衰期而以抗体药物复合体(adc)的形式内化(internalization)在细胞内。通过将本发明的表位区域交联型双互补位抗体adc化,从而内化在细胞内,低分子化合物在溶酶体(lysosome)等代谢体系中以具有活性的形式释放,能够杀伤细胞,因此本
发明的表位区域交联型双互补位抗体也能使细胞内蛋白质成为靶标。
[0185]
本发明的抗体能够以具有两个以上功能的抗体的形式来提供。这样的具有两个以上功能的双互补位抗体也称作多功能双互补位抗体。在本发明的一个实施方式中,本发明的表位区域交联型双互补位抗体能够以维持其原本的单克隆抗体所具备的内化能力的状态来制作。因此,例如,本发明的表位区域交联型双互补位抗体能够具有显著增强的拮抗剂活性、并且还具备内化能力,即使在需要adc化等内化的情况下,本发明的表位区域交联型双互补位抗体也是有用的。
[0186]
在一个特定实施方式中,本发明的抗体能够以具有两个以上功能的抗体的形式来提供。这样的具有两个以上功能的双互补位抗体也称作多功能双互补位抗体。
[0187]
在本发明的一个实施方式中,本发明的表位区域交联型双互补位抗体能够为增强或抑制激动剂活性的抗体、增强或抑制拮抗剂活性的抗体等通过以能够发挥目标生物学作用的方式选择其结合的2个表位的位置(例如表位位置的“相同侧”或“相对侧”、或者抗原抗体复合体的“分子内交联”或“分子间交联”等)而具有目标生物学作用的抗体。这样的本发明的表位区域交联型双互补位抗体所具有的目标生物学作用对基于adc化的内化不产生影响,因此在本发明的一个实施方式中,本发明的表位区域交联型双互补位抗体也能为具有生物学作用(需要靶蛋白质的内化)的抗体。
[0188]
(一般技术)
[0189]
在本说明书中,所使用的分子生物学方法、生化学方法、微生物学方法、生物信息学方法能够使用在该领域中公知、周知或惯用的任意的方法。
[0190]
在本说明书中,“或”被使用在可以采用文章中所列举的事项的“至少一项以上”时。“或者”也同样。在本说明书中明确记载为“两个值”的“范围内”的情况下,其范围也包括两个值本身。
[0191]
在本说明书中所引用的科学文献、专利、专利申请等参考文献其全部内容作为参考以与各自具体记载的情况相同的程度被援用于本说明书中。
[0192]
以上,为了便于理解而示出优选的实施方式来说明本发明。以下,基于实施例来说明本发明,但是,上述的说明及以下的实施例仅以例示的目的来提供,并不以限定本发明的目的来提供。因此,本发明的范围并不限定于本说明书中具体记载的实施方式和实施例,而仅受到权利要求书的限定。
[0193]
(实施例)
[0194]
以下,使用实施例更详细地说明本发明,但本发明并不受这些实施例限定。
[0195]
以下,对本发明中使用的实验方法及材料进行说明。需要说明的是,在本实施方式中使用以下的实验方法,但是,即使使用除此以外的实验方法,也能得到同样的结果。另外,试剂类使用具体记载于实施例中的制品,但是也能以其他制造商(sigma-aldrich、和光纯药、nakalai tesque、r&d systems、uscn life science inc等)的同等品来代替。
[0196]
(实施例1:用于制作抗tnfr2表位区域交联型双互补位抗体的直系同源映射)
[0197]
针对tnfr2而言的表位均质化抗体群体通过wo2018/092907的实施例4中所公开的方法来制作(图14)。在本实施例中,选择所得的7个表位区域中代表各区域的参比抗体,鉴定了以5个表位作为靶标的参比单克隆抗体的序列。使用所鉴定的fv序列,由人igg1的恒定区序列制作抗tnfr2表位区域交联型双互补位抗体。5个参比单克隆抗体包括属于ep2的
tr45、属于ep3的tr94、属于ep4的tr96、属于ep5的tr92及属于ep7的tr109(图14)。将用于制作抗tnfr2双互补位抗体的5个表位示于图1中。各个由虚线的圆包围的部分为表位。
[0198]
如图2的示意图所示,tnfr2具有4个富含半胱氨酸结构域(crd),从细胞膜的远位的细胞外结构域起依次称为crd1、2、3、4(croft m,benedict ca,ware cf.clinical targeting of the tnf andtnfr superfamilies.nat rev drug discov.12(2),147-68.(2013).;mukai y,nakamura t,yoshikawa m,yoshioka y,tsunoda s,nakagawa s,yamagata y,tsutsumi y.solution of the structure of the tnf-tnfr2 complex.sci signal.3(148),ra83.(2010).)(以后,设为结构域1、2、3、4)。tnfr2的配体tnfα通过与结构域2和结构域3结合来活化(grell m,douni e,wajant h,lohden m,clauss m,maxeiner b,georgopoulos s,lesslauer w,kollias g,pfizenmaier k,scheurich p.thetransmembrane form of tumor necrosis factor is the prime activating ligand ofthe 80kda tumor necrosis factor receptor.cell.83(5),793-802.(1995).)。已知有经典路径和非经典路径,在经典路径中,通过活化而诱导使nfκb(p50/rela)停留于细胞质的ikb分解,并且使nfκb(p50/rela)进行核内迁移,在非经典路径中,nfκb(p100/relb)的p100被磷酸化,由此诱导加工(processing),成为nfκb(p52/relb)并在核内迁移(naude pj,den boer ja,luiten pg,eisel ul.tumor necrosis factorreceptor cross-talk.febs j.278(6),888-98.(2011).)。另一方面,对于抗tnfr2抗体系列,由于在用于免疫和特异抗体分离的筛选中使用tnfr2的细胞外部分的全长,因此有可能与配体结合部位以外也结合。无法明确识别哪个表位的抗体具有何种功能。
[0199]
为了调查所使用的5个单克隆抗体在靶标表位的tnfr2上的位置关系,进行了直系同源映射。制作将图2的人tnfr2的涂黑的部分置换为小鼠直系同源序列的dna序列。将该dna序列转染于细胞并使之结合抗体,将其反应性与天然型单克隆抗体的反应性进行了比较。与天然型单克隆抗体相比。以基于直系同源映射得到的变异体的反应性减弱作为指标,将其置换部分设为抗体的表位部位。
[0200]
在变异体制作中,大到形成以crd结构域作为1个单位而置换为小鼠直系同源序列的dna序列。小到形成将由1个以上的转角(turn)构成的区域、或被2个转角夹持的片(sheet)区域置换为小鼠直系同源序列的dna序列。10个氨基酸以内的置换通过kod-plus-mutagenesis kit(东洋纺)来进行,向10个氨基酸以上的长链的置换是将小鼠序列dna和人序列dna通过使用了kod-plus-neo(东洋纺)的pcr进行扩增、并通过nebuilderhifi dna assembly master mix(new england biolabs)掺入来制作。
[0201]
(实施例2:变异体的反应性试验)
[0202]
使用包含10%fbs及1%ps的dulbecco改良eagle培养基(以下为dmem),在37℃、5%co2条件下对hek293t细胞进行了继代培养。将hek293t细胞调整为5
×
105cells/ml,以2ml/孔添加至6孔平底孔板(costar)中,在37℃、5%co2条件下培养一夜。按照pei max(polysciences,inc.)的方法,将tnfr2-ires-tagbfp转染于hek293t,在37℃、5%co2条件下培养一夜。使用facs缓冲液(0.1%叠氮化钠、2.5%fbs、pbs溶液),将用包含0.05%edta的0.53mm胰蛋白酶处理过的hek293t调整为8
×
105cells/ml,以25μl/孔添加至96孔v底孔板(violamo)中。进而,分离瞬时表达细胞后,以25μl/孔添加调整为1.5μg/ml的各tnfr2抗体,在冰上静置1小时,使其相互作用。在1200rpm下离心5分钟后,除去上清液。用facs缓冲
液清洗1次后,以25μl/孔添加稀释200倍后的anti-mouse igg-pe,在冰上、暗处静置30分钟。在1200rpm下离心5分钟后,除去上清液。用facs缓冲液清洗1此后,以200μl/孔进行悬浊,利用流式细胞仪(fcm)进行了解析。
[0203]
将fcm的解析结果示于图3中。另外,将使该数据与直系同源映射的位置数据相关的结果示于图4中。如图3及4所示,在tr45单克隆抗体中,在将crd3区域的一部分进行了置换的mc3b变异体中,与抗原的反应性消失。由此可知,tr45单克隆抗体所结合的tnfr2上的表位部位存在于crd3区域中。同样,特定tr92、tr94、tr96及tr109的各单克隆抗体所结合的tnfr2上的表位部位。各表位部位相当于由图1的虚线的圆包围的部分。
[0204]
(实施例3:双互补位抗体的制作)
[0205]
使用与按照以上方式特定的各表位部位结合的5个单克隆抗体(tr45、tr94、tr96、tr92、tr109),利用将han,l.,chen,j.,et al.efficient generation of bispecific igg antibodies bysplit intein mediated protein trans-splicing system.sci.rep.,7,8360(2017).及wo2017/143838中记载的方法改良后的方法,制作双互补位抗体。即,在上述文献中,通过断裂型内含肽的蛋白质反式剪接反应,在抗体的铰链区域掺入2个亲本抗体片段,制作无重链/重链及轻链/重链的错配的双互补位抗体。在该方法中,通过利用内含肽(细菌蛋白质dnae所具有的肽链重组序列),从而制作可直接使用而不会在产物中残留重组标签的抗体。
[0206]
首先,“n侧”片段按照以下方式来制作。将dna序列(导入有cfa dnae intn(stevens,a.j.,brown,z.z.,shah,n.h.,sekar,g.,cowburn,d.,muir,t.w.,j.am.chem.soc.138,2162-2165(2016))、麦芽糖结合蛋白质(mbp)、6
×
his标签)掺入至“n侧”fab区域重链(vh-ch1)的下游而成的质粒和编码“n侧”轻链的质粒导入expi293f细胞(thermo fisher scientific)中,在37℃、8%co2条件下振荡培养6天或7天。通过complete his-tag purification resin(rochediagnostics)从培养基上清液中回收n侧片段,通过基于hiload superdex20026/600pg(ge healthcare)的体积排阻色谱,将其纯化。
[0207]
另外,“c侧”按照以下方式来制作。在fc的异源二聚化(heterodimerization)中利用merchant,a.m.,zhu,z.,yuan,j.q.,goddard,a.,adams,c.w.,presta,l.g.and carter,p.anefficient route to human bispecific igg.nat.biotechnol.,16,677-681(1998)中所报道的变异体。与akiba,h.,satoh,r.,nagata,s.,tsumoto,k.,antib.ther.,2,65-69(2019)中所报道的变异体同样地、在knob链中制作包含“c侧”fab区域重链(vh-ch1)、铰链和变异体fc的基因。在hole链中制作包含6
×
his标签、mbp、cfa dnae intc、铰链和变异体fc的基因。在该2个质粒中加入编码“c侧”轻链的质粒,导入至expi293f细胞(thermo fisher scientific)中,在37℃、8%co2条件下振荡培养6天或7天。通过complete his-tag purification resin(rochediagnostics),从培养基上清液中回收c侧片段,通过基于hiload superdex20026/600(ge healthcare)的体积排阻色谱,将其纯化。
[0208]
对于双互补位抗体,将n侧片段15μm、c侧片段10μm、二硫苏糖醇2mm混合,在37℃下培养2小时。通入至直链淀粉树脂(amylose resin,newengland biolabs),除去未反应体及副产物后,通过基于superdex200increase10/300(ge healthcare)的体积排阻色谱,将其纯化。
[0209]
按照上述方式制作的双互补位抗体中的单克隆抗体的组合如以下表2所示。
[0210]
[表2]
[0211][0212]
双互补位抗体(bp所示的抗体)是将2个抗体的fab区域连结的抗体,因此使得fc区域源自任一抗体。因此,严密地使连接子部分呈非对称,但是在使用tr94和tr96制作的bp94-96和bp96-94中,即使将其n侧和c侧互换,也如预测那样活性不存在差异。在以下的实施例中,使用bp94-96。
[0213]
(实施例4:报道子检测)
[0214]
使用按照以上方式制作的10个表位区域交联型双互补位抗体及作为比较例的原本的单克隆抗体,测定了激动剂活性及拮抗剂活性。
[0215]
首先,激动剂活性的测定按照以下方式来进行。使用表达了tnfr2的ramos-blue报道子细胞,添加各抗体,由此诱导tnfr2下游的nfkb依赖性信号,以该信号作为报道子蛋白质的分泌性碱性磷酸酶的表达,利用以对硝基苯基磷酸(pnpp)作为基质的显色法进行了检测。抗体使用与双互补位抗体及单克隆抗体一起使用expi293细胞株而得到的重组人嵌合抗体。
[0216]
将2
×
105cells的细胞以在包含10%fbs的imdm中成为100μl的方式进行悬浊,添加至96-孔培养孔板的各孔中。在各孔中以0、0.0001、0.001、0.01、0.1、1、10、100nm的浓度添加各抗体,培养一夜。第二天,通过各抗体的刺激而产生nfkb依赖性地分泌至细胞的培养上清液中的碱性磷酸酶的酶活性,利用吸光度变化测定基于该酶活性产生的作为显色基质的pnpp的水解。计算3次吸光度测定值的平均,根据在激动剂活性的情况下为“无抗体且无tnfα时的吸光度”、或者在拮抗剂活性的情况下为“无抗体且有tnfα时的吸光度”,对添加各抗体而得到的测定结果进行了评价。将以上的实验独立地进行3次,以棒图表示平均和标准偏差。将激动剂活性的测定结果示于图5的上段。
[0217]
接着,在同样的实验体系中,使用表达了tnfr2的ramos-blue报道子细胞,用作为tnfr2的内源性配体的tnfα(50ng/ml)进行刺激,对在tnfα的存在下的各抗体的nfkb依赖性信号的抑制进行调查,由此研究了各抗体的功能性拮抗剂活性。
[0218]
ramos-blue报道子细胞除了已经表达导入的tnfr2之外还表达内源性的tnfr1,因此在用作为内源性配体的tnfα进行刺激的情况下,发生tnfr2和tnfr1两者的活化。因此,由抗tnfr2抗体获得的功能性拮抗剂效果成为仅由tnfr2介导的局部效果。将拮抗剂活性的测定结果示于图5的下段。
[0219]
关于激动剂活性,所使用的单克隆抗体均显示为中程度激动剂。另一方面,可知表位区域交联型双互补位抗体分为显示强激动剂活性的抗体和显示弱激动剂活性的抗体。具体而言,bp45-94、bp45-96、bp109-96、bp96-92、bp109-94及bp94-92共计6个双互补位抗体显示极强的激动剂活性,与单克隆抗体中显示最强激动剂活性的tr94相比,显示10倍以上的强激动剂活性。即,可知这6个表位区域交联型双互补位抗体即使在低浓度下也能有效地用作激动剂抗体。
[0220]
另一方面,关于拮抗剂活性,表位区域交联型双互补位抗体依赖于其原本的单克隆抗体的拮抗剂活性。即,只要双互补位抗体的原本的2个单克隆抗体中的至少一者不是拮抗剂抗体,则所制作的双互补位抗体不会成为拮抗剂抗体。即使是成为拮抗剂抗体的表位区域交联型双互补位抗体,对于bp109-92而言,可知:由于完全抑制激动剂活性,因此作为拮抗剂抗体比原本的tr109更有效。
[0221]
(实施例5:在强制表达细胞上的结合评价)
[0222]
接着,使用表达了tnfr2的ramos-blue报道子细胞,评价了各抗体的结合能力。对报道子检测中使用的tnfr2-ramos-blue细胞添加浓度为0.01、0.1、1、10、100、1000、10000及100000ng/ml的各抗体,在冰上培养小时。在1200rpm下离心5分钟后,除去上清液。用facs缓冲液清洗1次后,向各孔中添加anti-human igg-pe,在冰上、暗处静置30分钟。在1200rpm下离心5分钟后,除去上清液。用facs缓冲液清洗1次后,利用流式细胞仪(fcm)进行荧光解析。
[0223]
将荧光强度的平均值作为相当于结合量的值。独立进行2次同条件的实验。
[0224]
对于除具有tr94的可变区域的抗体(bp45-94、bp94-96、bp109-94、bp94-92、及tr94)以外的10点抗体,将高浓度侧3点(坪区(plateau region))的荧光强度平均值设为ai(i=1,2,
…
10。相当于各抗体),求出σi(kai
第1次-ai
第2次
)2最小时的k,使用该值,将2次实验数据进行平均。针对各标绘图(plot),将平均值和标准偏差示于图6中。可知:除tr94(最下方的线)外,在所有抗体中,对抗原的亲和性均为大致相同程度。
[0225]
(实施例6:对重组抗原的反应性评价)
[0226]
利用使用biacore t200设备(ge healthcare)的表面等离激元共振(spr)法,进行了各抗体对单体抗原及二聚体抗原的结合动力学分析和评价。准备单体及二聚体抗原,评价各抗体对该单体及二聚体抗原的结合性,对有无分子内交联活性进行了调查。spr技术基于金包覆生物传感器芯片(gold coated biosensor chip)的表面附近处的折射率的测定来进行。折射率的变化表示因固定化抗体与注入至溶液中的单体或二聚体抗原的相互作用而引起的表面上的质量变化。在分子与表面上被固定化的抗体结合的情况下,质量增加,相反,在分析物从固定化抗体解离的情况下,质量减少。通过将双互补位抗体和其原本的单克隆抗体用spr进行解析,不仅能够评价各抗体的性能,而且还能观察到多价结合的影响。即,在为表位区域交联型双互补位抗体时从图7所示的
■
到
●
变化变大的情况下,以及在为单克隆抗体时从图7所示的
×
到
▲
变化变大的情况下,可以说多价结合是至关重要的。
[0227]
如图8的示意图那样准备了单体抗原及二聚体抗原。首先,准备tnfr2细胞外区域的作为fc融合蛋白的依那西普(pfizer),通过酶分解和还原再氧化反应,取得了tnfr2抗原分子。使用biacore t200设备(ge healthcare),如操作规程所示使用human antibody capture kit,将抗体固定于传感器芯片。以上述2种抗原作为分析物解析了相互作用。将各抗体的spr参数示于表3,并且将图表中所归纳的结果示于图7中。
[0228]
[表3]
[0229][0230]
由图7可知,单克隆抗体tr94在二聚体抗原上的结合活性弱,tr96在单体抗原上的结合活性高。这表明在单克隆抗体中也会有例外的结合活性。另外,在双互补位抗体多的情况下,对二聚体抗原的结合活性充分强,特别是在bp94-92、bp109-92及bp94-96中,显示出显著强的结合活性。进而,与大多的单克隆抗体同样,bp45-92在单体抗原上的结合活性弱,另一方面,其他的双互补位抗体与其源自的单克隆抗体相比显示更高的亲和性。另外,还可知该结果与上述基于fcm得到的评价结果不矛盾。表位区域交联型双互补位抗体与天然型抗体相比,具有不逊色或得到改善的抗原特异结合亲和性。
[0231]
(实施例7:浓度依赖性比较)
[0232]
接着,针对各抗体分别将实施例4的通过报道子检测得到的各抗体的激动剂活性及拮抗剂活性、实施例5的基于流式细胞仪得到的对tnfr2表达细胞的结合活性、以及实施例6的spr结果绘于相同图表中,调查了对抗原的结合活性与激动剂活性及拮抗剂活性如何浓度依赖性地发生变化。将其结果示于图9中。
[0233]
(实施例8:基于sec-mals的交联能力评价)
[0234]
为了评价所制作的双互补位抗体与抗原以何种比例结合,使用作为更绝对分子量
测定法的体积排阻色谱-多角度光散射检测(sec-mals)(sec:superose 6 10/300,ge healthcare,mals:dawn 8,wyatttechnology),实施了结构解析。混合重组抗体
·
抗原蛋白质,实施sec-mals,由此可知复合体的分子量尺寸。分析按照常规方法来进行。图10中的各图示出bp109-92和tr109的sec-mals的结果,上段2图为bp109-92的结果,另外,下段2图为tr109的结果。在左侧的各图中,相对于各抗体,混合了8当量的tnfr2-ecd。
[0235]
如图10的左侧的上下图所示,可知sec-mals图谱含有先溶出的峰和后溶出的峰。对于横截各峰的线,溶出时间表示所检测到的分子种类的分子量。由左上的bp109-92(无激动剂活性)图所示的结果可知:在与作为抗原的tnfr2混合时,检测到180kda的峰分子量(第1峰),抗体与抗原以1:1结合。另外,由左下图可知:tr109(有激动剂活性)与作为抗原的tnfr2混合时,检测到215kda的峰分子量(第1峰),如预测那样抗体与抗原以1:2结合。即,由此可知tr109为2价天然型单克隆抗体。
[0236]
同样,针对其他双互补位抗体(bp94-96、bp45-96、bp94-92),也使用sec-mals对其结合形态进行了解析。将其结果示于图11中。在图11的右上图所示的bp94-96(无激动剂活性)中,可知:在与8当量的tnfr2混合时,检测到190kda的峰分子量(第1峰),抗体与抗原以1:1结合。另外,图11的下段图所示bp45-96(有激动剂活性)及bp94-92(有激动剂活性)中,可知:分别与0.25当量的tnfr2混合时,检测到350kda以上或310kda的峰分子量(第1峰),抗体与抗原以2:2结合。
[0237]
将各抗体的sec-mals的结果归纳于表4中。另外,将归纳各抗体及抗原-抗体复合体的粗略的分子量得到的结果示于表5中。
[0238]
[表4]
[0239]
[0240][0241]
形成1:1的复合体的是tr94、bp109-92、bp94-96、bp109-45,其中,bp109-92和bp109-45无激动剂活性,bp94-96显示弱激动剂活性。对于tr94而言,在测定浓度条件下细
胞上结合不饱和(图6),显示为特殊的结合,因此认为未完成复合体。另外,形成1:2的复合体的是tr109、tr45、tr92、tr96及bp45-92,其中,tr109、tr45、tr92、tr96为单克隆抗体,均显示中程度的激动剂活性,bp45-92显示弱激动剂活性。关于bp45-92,tr45和tr92所结合的表位接近,在双互补位抗体上配置两者的抗原结合部位时,发生竞争阻碍,有可能不能与单一抗原结合。另外,形成2:2的复合体的bp45-96、bp94-92、bp109-96、bp45-94及bp96-92与显示具有浓度依赖性的行为的bp109-94显示强激动剂活性。
[0242]
由这些结果可知:抗原与抗体结合而形成多聚体的情况下成为强力的激动剂。将对构成该激动剂的(以抗体-抗原为2:2或更大来形成复合体)6个表位区域交联型双互补位抗体所结合的2个表位位置的组合进行调查,结果示于图12中。可知:在tnfr2表面中,各个表位位置均存在于相对侧。另外,将对不构成激动剂的(以抗体-抗原为1:1或1:2形成复合体)4个双互补位抗体所结合的2个表位位置的组合进行调查,结果示于图13中。图13的虚线为显示弱激动剂活性的表位位置的组合。可知:在tnfr2表面中,各个表位位置均存在于相同侧。
[0243]
由这些结果可知:在tnfr2抗原的“相对侧”具有表位,即,在fab结合时,配置为fab的从抗原观察的相对侧(根部)不远离的的情况下,必然成为将2个以上tnfr2分子交联的复合体,可见在该情况下必然成为激动剂。另外,可知:在tnfr2抗原的“相同侧”具有表位的情况下,不构成激动剂。
[0244]
(实施例9:各种的抗tnfr2双互补位抗体与抗tnfr2天然型抗体的tnfr2依赖性细胞内化的比较)
[0245]
对所制作的抗tnfr2双互补位抗体与天然的抗tnfr2单克隆抗体的细胞内化能力进行了比较。将所制作的双互补位抗体及它们的亲本嵌合抗体在tnfr2/ramos-blue细胞或cd30/ramos-blue细胞与2次adc的存在下进行了培养。在4天后利用wst-8法测定活细胞数,测定由抗体的内化产生的细胞毒性。吸光度的降低表明产生细胞毒性,因此表明发生了抗体内化。将其结果示于图15中。
[0246]
所制作的双互补位抗体均同样地显示tnfr2抗原依赖性的内化能力。该内化能力为与天然型抗体相同的程度,与各双互补位抗体的强激动剂活性还是强拮抗剂活性无关。由此认为:规定激动剂活性和拮抗剂活性的分子间交联和分子内交联的不同不会影响内化。认为adc化等需要内化的抗体修饰即使在拮抗剂的情况下也有效。
[0247]
(实施例10:免疫应答性小鼠肿瘤模型中的表位区域交联型抗tnfr2双互补位拮抗剂抗体的强力的抗肿瘤活性)
[0248]
使用将小鼠基因组上的tnfr2基因置换为人tnfr2基因的tnfr2人源化小鼠,将天然型抗tnfr2抗体tr109和具有强力拮抗剂活性的表位区域交联型双互补位抗体tr92-tr109的抗肿瘤活性进行比较评价。在tnfr2人源化小鼠中,与野生型小鼠中的小鼠tnfr2基因的表达模式同样,置换的人tnfr2局限在调节性t细胞中,人tnfr2代替小鼠tnfr2来发挥功能。即,在tnfr2人源化小鼠中,人tnfr2受到来自内源性tnf的刺激,控制调节性t细胞的增殖和功能。在对该tnfr2人源化小鼠皮下移植小鼠癌细胞(例如源自结肠癌的细胞mc38细胞)时,移植细胞经时性地植入,肿瘤增大。在移植肿瘤增大至约100mm3的时间点,将小鼠分为4组,1组无处理,1组腹腔内施用阴性对照的人igg1,1组腹腔内施用天然型抗体tr109,1组腹腔内施用表位区域交联型双互补位抗体tr92-tr109。经时地观察施用后的肿瘤的增大
时,在未处理组及阴性对照的人igg1施用组中观察到持续性的肿瘤增大,但是在天然型抗体tr109施用组中检测到弱的肿瘤增殖抑制,在表位区域交联型双互补位抗体tr92-tr109的施用组中观察到肿瘤增殖停止。在通过组织染色来确认浸润至各小鼠的肿瘤组织的调节性t细胞时,在表位区域交联型双互补位抗体tr92-tr109施用组的肿瘤组织中几乎不浸润调节性t细胞。因此,在表位区域交联型双互补位抗体中,可得到以天然型抗体所不能实现的强水平的拮抗剂效果,抑制调节性t细胞,显示强抗肿瘤效果。
[0249]
此外,不言而喻,本发明可以进行各种变形,在不改变发明主旨的范围内可以进行各种改变而并不限定于上述的一个实施方式。
[0250]
综上所述,使用本发明的优选实施方式来例示了本发明,但是可理解为本发明应当仅通过权利要求书来解释其范围。在本说明书中引用的专利、专利申请及其他文献可理解为与其内容本身被具体记载于本说明书的情况同样地援引该内容作为针对本说明书的参考。本技术对2020年3月30日向日本专利局申请的日本特愿2020-61014主张优先权,其全部内容如同构成本技术的内容的情况同样地作为参考援引于本文中。
[0251]
序列表文本
[0252]
序列号1:tr45重链
[0253]
序列号2:tr92重链
[0254]
序列号3:tr94重链
[0255]
序列号4:tr96重链
[0256]
序列号5:tr109重链
[0257]
序列号6:tr45轻链
[0258]
序列号7:tr92轻链
[0259]
序列号8:tr94轻链
[0260]
序列号9:tr96轻链
[0261]
序列号10:tr109轻链
[0262]
序列号11:tr45重链cdr1
[0263]
序列号12:tr45重链cdr2
[0264]
序列号13:tr45重链cdr3
[0265]
序列号14:tr92重链cdr1
[0266]
序列号15:tr92重链cdr2
[0267]
序列号16:tr92重链cdr3
[0268]
序列号17:tr94重链cdr1
[0269]
序列号18:tr94重链cdr2
[0270]
序列号19:tr94重链cdr3
[0271]
序列号20:tr96重链cdr1
[0272]
序列号21:tr96重链cdr2
[0273]
序列号22:tr96重链cdr3
[0274]
序列号23:tr109重链cdr1
[0275]
序列号24:tr109重链cdr2
[0276]
序列号25:tr109重链cdr3
[0277]
序列号26:tr45轻链cdr1
[0278]
序列号27:tr45轻链cdr2
[0279]
序列号28:tr45轻链cdr3
[0280]
序列号29:tr92轻链cdr1
[0281]
序列号30:tr92轻链cdr2
[0282]
序列号31:tr92轻链cdr3
[0283]
序列号32:tr94轻链cdr1
[0284]
序列号33:tr94轻链cdr2
[0285]
序列号34:tr94轻链cdr3
[0286]
序列号35:tr96轻链cdr1
[0287]
序列号36:tr96轻链cdr2
[0288]
序列号37:tr96轻链cdr3
[0289]
序列号38:tr109轻链cdr1
[0290]
序列号39:tr109轻链cdr2
[0291]
序列号40:tr109轻链cdr3
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。