1.本发明属于基因检测技术领域,具体涉及一种泛实体瘤精准用药基因检测组合及其应用。
背景技术:
2.从临床肿瘤学到肿瘤病理研究,越来越多与肿瘤相关的突变基因被发现,这些基因变异会使细胞失去正常的调控功能,从而无限增殖,最终致使癌症的发生。靶向治疗药物可以针对携带特定基因变异的肿瘤细胞进行杀伤,疗效显著。但是,对于不同的患者,其体内携带的基因变异也是千差万别的,这种差异导致了每名患者对于相同的抗肿瘤药物所表现出来的敏感性与毒副反应不尽相同。肿瘤基因的多变性、复杂性,意味着临床需要更为深度地对肿瘤进行基因检测分型和实施患者个体化精准治疗。
3.目前临床大多以肿瘤手术组织或活检标本为检测目标,通过组织形态和肿瘤细胞含量进行判断,但由于肿瘤组织具有异质性,诊断结果准确度低。此外用于肿瘤靶向治疗的伴随诊断产品多以arms-pcr(等位基因特异性扩增法)为主,虽然其灵敏度和准确性都较高,但其检测通量相对较低。
4.高通量靶向测序panel(指在高通量靶向测序中预先设计的dna或rna探针池,该探针池是由多个基因、多个位点构成的固定基因组合或集合)检测成为大势所趋。目前主要的高通量检测包括使用高通量测序技术对患者进行多重基因检测,以筛选适合靶向药物治疗的患者。在检测已知、多个临床可用药的靶点时,一般使用高通量测序技术;在发现未知基因、探索疗效监测、预后判断和发现耐药机制时,一般使用高通量测序技术。
5.目前,商业市场多数使用大panel(一般指广泛适用于多个癌种,由几百甚至上千个基因组成大型基因检测组合)进行检测,但由于目前已上市的靶向药物比较固定,当测序基因数量覆盖足够靶点基因后,再增加基因数量未必能进一步提供更多的靶向药物指导,这些panel(基因检测组合)提供的往往是一些额外的评析,如遗传评估;此外,业界对于用大panel(大型基因检测组合)评估tmb水平的一致认可,用中小基因检测组合评估tmb水平的方法还处于探索阶段。
6.因此,为了贴近临床需求,为患者提供一个高性价比的肿瘤精准用药基因检测方案,以满足临床医生和患者对靶向治疗药、化疗药、免疫治疗药的临床用药指导需求尤为重要。
技术实现要素:
7.针对现有技术存在的不足,本发明的目的在于提供一种泛实体瘤精准用药基因检测组合及其应用。本发明通过设计涵盖临床意义明确的用药基因的捕获探针池,采用高通量靶向捕获测序,并结合生物信息分析,建立适用于肿瘤组织、血液或石蜡包埋组织样本的检测方法,一次检测即可同时实现靶向治疗药、化疗药、免疫治疗药的用药指导及遗传性肿瘤分析,此外还可初步评估tmb状态。本发明建立的检测方法可以更高效地检测出对肿瘤精
准治疗、耐药性动态监测和预后判断有指导意义的基因突变;同时,本发明可用于肿瘤患者的分层,帮助患者入组特定新药的临床试验;对临床发现敏感的靶向治疗药物具有重要指导意义。本发明所述泛实体瘤精准用药基因检测组合为中等大小的基因检测组合(1.5 mb),本发明所述基因检测组合对应的检测结果与ngs大型基因检测组合(2.7mb)的结果一致性高达95%,能够满足临床用药检测的需求,同时能够进一步降低成本,在评估肿瘤tmb状态中具有重要应用价值。
8.为达到此发明目的,本发明采用以下技术方案:第一方面,本发明提供一种泛实体瘤精准用药基因检测组合,所述基因检测组合中的靶标基因包括118个靶向治疗相关基因、18个免疫治疗相关基因、21个化疗用药相关基因和114个微卫星不稳定性位点;所述靶向治疗相关基因如下表所示:。
9.优选地,所述免疫治疗相关基因如下表所示:。
10.优选地,所述化疗用药相关基因如下表所示:。
11.优选地,所述微卫星不稳定性位点如下表所示:
。
12.本发明中,114个微卫星不稳定性位点(msi位点)共计有339条探针。
13.本发明中在检测时,对以下靶向用药、化疗用药以及免疫用药相关基因的全外显子进行点突变、插入缺失及拷贝数检测:abl1、abcb1、abcg2、akt1、akt2、akt3、alk、apc、ar、arid1a、atm、atrx、bap1、bard1、braf、brca1、brca2、brd4、brip1、btk、card11、casp7、ccnd1、ccnd2、ccnd3、cd274、cdh1、cdk12、cdk4、cdk6、cdk8、cdkn1a、cdkn1b、cdkn2a、cdkn2b、cdkn2c、cebpa、chek2、comt、ctnnb1、cyp19a1、cyp2c19、cyp2c8、cyp2d6、cyp3a4、dpyd、egfr、epcam、epha3、erbb2、erbb3、erbb4、esr1、etv6、ezh2、fanca、fancl、fancm、fbxw7、fgf19、fgf3、fgfr1、fgfr2、fgfr3、flt3、gata3、gna11、gnaq、gstp1、hdac2、hras、idh1、idh2、jak1、jak2、kdm6a、kdr、kit、kmt2d、kras、map2k1、map2k4、mapk1、mdm2、mdm4、met、mir4713hg、mlh1、msh2、msh3、msh6、mthfr、mtor、myc、nat2、nf1、nf2、notch1、notch2、nras、nrg1、ntrk1、ntrk2、ntrk3、palb2、pbrm1、pdgfra、pdgfrb、pik3ca、pik3r1、pms2、pold1、pole、pten、ptpn11、rad51b、rad51c、rad51d、rad54l、rb1、ret、ros1、sdhb、sdhc、sdhd、slc19a1、slco1b1、smad4、
smarcb1、smo、stk11、tnfrsf11b、tnfsf11、tp53、tpmt、tsc1、tsc2、ugt1a1、vegfa和vhl。
14.本发明中在检测时,除了对上述用药指导基因进行点突变、插入缺失、拷贝数检测,还对以下基因融合区域进行检测:alk、braf、brca1、brca2、egfr、etv6、fgfr1、fgfr2、fgfr3、kit、met、msh2、myc、notch2、ntrk1、ntrk2、ntrk3、pdgfra、ret和ros1。
15.优选地,所述基因检测组合用于检测包括靶基因的点突变、基因片段插入、基因片段缺失、拷贝数变化、基因融合或基因重排。
16.本发明中,所述靶标基因包括118个肿瘤靶向用药基因、18个免疫治疗相关基因、21个化疗药相关基因以及114个微卫星不稳定性位点。本发明的泛实体瘤基因探针池为ngs中型基因检测组合,相较于市场ngs上的大型基因检测组合而言,精简目标区域,一次性检测多位点的多种dna突变和变异(snv、indel、cnv、基因融合等)。根据fda/nmpa/专业临床指南推荐用药、专家共识推荐用药以及临床试验新药等,本发明囊括了目前临床意义明确的靶向治疗药基因、化疗药基因以及肿瘤免疫治疗疗效预测评估的微卫星不稳定(microsatelliteinstability,msi)和突变负荷(tumormutationburden,tmb)检测。所述泛实体瘤基因检测组合的tmb检测结果与ngs大型基因检测组合的结果一致性高达95%,能够满足临床检测需求且进一步降低成本,在评估肿瘤患者是否受益于免疫治疗具有重要指导价值。综上,本发明提供了一种基因位点全面、实用性能强、成本低且高性价比的肿瘤靶向治疗药、化疗药和免疫治疗药的基因检测方案。
17.第二方面,本发明提供一种泛实体瘤多基因捕获探针池,所述捕获探针池为针对第一方面所述的泛实体瘤精准用药基因检测组合中的靶基因的捕获探针池。
18.第三方面,本发明提供一种基于第二方面所述的泛实体瘤多基因捕获探针池的靶向富集检测方法,所述靶向富集检测方法包括如下步骤:使用第二方面所述的泛实体瘤多基因捕获探针池捕获目标dna,构建捕获终文库,对捕获终文库进行高通量测序,对测序结果进行生物信息学分析,分析目标基因的变异情况,所述变异情况包括点突变、基因片段插入、基因片段缺失、拷贝数变化、基因融合或基因重排。
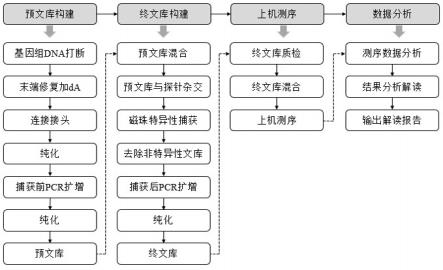
19.优选地,所述靶向富集检测方法包括如下步骤:s1:ngs文库准备;s2:使用捕获探针捕获目标dna,对捕获的目标dna进行分离纯化;pcr扩增捕获的目标dna并纯化pcr扩增的产物,获得捕获终文库;s3:对所得捕获终文库进行片段大小质检和qpcr定量,根据文库qpcr定量结果及测序数据量进行上机测序;s4:对测序结果进行生物信息学分析,分析目标基因的变异情况;s5:根据测序分析结果,对靶向治疗用药检测结果、免疫治疗用药检测结果、化疗用药检测结果以及体细胞突变变异、胚系变异进行解读。
20.本发明中,所述靶向富集检测方法的实施流程图如图1所示。
21.优选地,步骤s1中,所述ngs文库采用如下方法制备:将提取的基因组dna进行片段化处理;对片段化双链dna进末端修复加碱基a,获得粘性末端片段;对所述粘性末端片段的两端连接udi接头,获得接头连接片段;纯化连接产
物以去除未连接的接头序列以及接头二聚体等;对上述纯化后的接头连接产物进行第一扩增,获得pre-pcr(捕获前pcr)产物,即预文库;对预文库样品进行片段质检及qubit定量。
22.本发明中,对基因组dna进行片段化处理,可以是机械波打断,也可是酶法打断,优选为酶法打断。需要说明的是,血浆游离cfdna或ffpe样本无需打断。对于gdna或ffpe样本,起始投入量为100ng、200ng或300ng;gdna的起始投入量优选为200ng,ffpe的起始投入量优选为240ng。对于cfdna起始投入量为20ng、40ng、60ng或80ng,优选为20ng。
23.本发明中,捕获终文库的构建采用如下方法进行:对定量后的预文库按所需投入量,可以是进行多个预文库混合测序,每份泛所述探针池可以用于1、2、3、4、5、6、7、8、9或10个样本的杂交,优选地,样本个数为4个;取上述样本文库按数据量需求混合,混合后总量可以是500 ng、1000 ng、1500 ng或2000 ng进行杂交,优选地,ffpe及其配对血细胞样本检测,分别选择300 ng和120 ng进行杂交反应。
24.本发明中,所述泛实体瘤的捕获探针池为泛实体瘤中型探针池,大小约1.5 mb,需要说明的是,所述探针池主要具有以下特点:(1)参考nccn、csco等机构指南、统一共识,涵盖非小细胞肺癌、胃肠肿瘤、乳腺癌、卵巢癌、前列腺癌、甲状腺癌、肾癌、胰腺癌或黑色素等二十多种实体瘤的靶向治疗,囊括所有临床意义明确的靶向治疗用药基因;(2)检测化疗用药相关21个基因,可同时分析化疗相关多态性位点的基因型,以及预测常见化疗药物的疗效和副作用;(3)检测114个微卫星不稳定性位点,评估msi状态,预测免疫治疗疗效;(4)适合动态监测耐药性和敏感性基因突变,并可以初步评估tmb状态。
25.本发明根据美国国立生物技术信息中心(ncbi)公开的人类全基因组序列为参考,使用软件primer premier 5.0设计捕获探针;将目标基因的dna序列及其两侧的侧翼序列作为目标区域,设计多个能够与目标区域杂交的dna探针;dna探针的长度限定为120个碱基,探针以首尾相连方式进行平铺设计,对复杂区域进行2层平铺覆盖设计,完整覆盖全部待测基因全外显子,所述探针由第三方公司(integrated dna technologies idt)合成。
26.第四方面,本发明提供第一方面所述的泛实体瘤精准用药基因检测组合和/或第二方面所述的泛实体瘤多基因捕获探针池在制备泛实体瘤检测产品中的应用。
27.第五方面,本发明提供一种泛实体瘤精准用药检测试剂盒,所述检测试剂盒中含有至少一次用量的第二方面所述的泛实体瘤多基因捕获探针池。
28.第六方面,本发明提供一种第五方面所述的泛实体瘤精准用药检测试剂盒以非疾病诊断目的的使用方法,所述使用方法包括如下步骤:测序:对待测样本的dna进行提取,利用第五方面所述的泛实体瘤的检测试剂盒进行靶向富集,进行高通量测序,获得测序结果;对比:对高通量测序的结果进行处理,获得基因变化信息;分析:分析获得的基因变化信息,对靶向治疗用药检测结果、免疫治疗用药检测结果、化疗用药检测结果以及体细胞突变变异、胚系变异进行解读。
29.第七方面,本发明提供一种泛实体瘤的检测装置,所述检测装置包括:测序模块,用于对待测样本的dna进行提取,利用第二方面所述的泛实体瘤多基因捕获探针池或第五方面所述的泛实体瘤精准用药检测试剂盒进行靶向富集,进行高通量测
序,获得测序结果;对比模块,用于对高通量测序的结果进行处理,获得基因变化信息;分析模块,用于分析获得的基因变化信息,对靶向治疗用药检测结果、免疫治疗用药检测结果、化疗用药检测结果以及体细胞突变变异、胚系变异进行解读。
30.本发明中,所述分析模块解读信息后出具解读报告。
31.优选地,所述对比模块中,所述基因变化信息包括点突变、基因片段插入、基因片段缺失、拷贝数变化、基因融合或基因重排。
32.相对于现有技术,本发明具有以下有益效果:(1)本发明提供的泛实体瘤基因探针池适用于多种临床样本,如组织、ffpe或血液。
33.(2)本发明提供的泛实体瘤基因探针池为ngs中型探针池,相较于市场上的ngs大型探针池而言,其囊括所有临床意义明确的用药基因,精简目标区域,降低测序成本,是极具性价比的综合性基因检测方案。
34.(3)本发明提供的泛实体瘤基因探针池与肿瘤ngs大型探针池的tmb检测结果一致,ngs中型探针池即可初步评估tmb状态,打破了仅ngs大型探针池可实现tmb评估的传统。
35.(4)本发明提供的靶向富集检测方法仅需要一次富集检测即可实现多样本(1-10个)、多基因、多靶点、多种变异类型的检测,通量高且检测全面。
附图说明
36.图1是靶向富集检测方法的实施流程图;图2是实施例2中终文库使用高通量生物片段分析仪(qsep400)片段质检结果图;图3是实施例3中msi检测性能验证结果图;图4是实施例4中tmb检测性能验证结果图。
具体实施方式
37.下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
38.实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购获得的常规产品。
39.实施例1泛实体瘤基因探针池本实施例提供一种泛实体瘤基因探针池,所述探针池为泛实体瘤中型探针池,大小约1.5 mb,所述探针池的基因列表如表1-表4所示。
40.靶向治疗相关基因如表1所示:表1
免疫治疗相关基因如表2所示:表2化疗用药相关基因如表3所示:表3微卫星不稳定性位点如表4所示:表4
根据美国国立生物技术信息中心(ncbi)公开的人类全基因组序列为参考,使用软件primer premier 5.0设计探针;将基因列表中的目标基因的dna序列及其两侧的侧翼序列作为目标区域,设计多个能够与目标区域杂交的dna探针;dna探针的长度限定为120个碱基,探针以首尾相连方式进行平铺设计,对复杂区域进行2层探针覆盖设计,完整覆盖全部待测基因全外显子,该探针由第三方公司(integrated dna technologies idt)合成。
41.实施例2泛癌种多基因的靶向富集检测本实施例所使用的试剂列表如表5所示:表5
1、样本dna提取1.1用商业化dna提取试剂盒(qiagen qiaamp dna mini kit)对5例组织及配对白细胞进行基因组dna提取;样本来源如下表6所示:表61.2将提取的dna片段质检及定量溶解在50 μl nuclease-free water(无核酸酶水)中,用于文库构建。
42.2、预文库构建2.1片段化gdna的末端修复2.1.1准备所需试剂,于冰上加入表7中所示组分;表72.1.2将其混匀后置于pcr仪中,20℃孵育30min,然后65℃孵育30min,4℃保温。
43.2.2连接接头2.2.1准备所需试剂,于冰上加入表8中各组分;表82.2.2将上述混合液混匀后置于pcr仪中,20℃孵育15 min,停止在4℃。
44.2.3ampure xp纯化2.3.1提前将ampure xp磁珠从4℃冰箱拿出,涡旋混匀,室温放置30 min;2.3.2震荡混匀ampure xp磁珠,取40μl磁珠加入93μl连接产物中,使用移液器温和反复吹吸10次,使其充分混匀,室温孵育5 min;2.3.3将离心管放置磁力架上静置5 min,待溶液澄清后移弃上清液,保留磁珠;2.3.4保持离心管在磁力架上,在反应管中加入200μl新配制的80%的乙醇,静置30s后移弃上清液,保留磁珠;2.3.5重复上述步骤一次;2.3.6将离心管中残留的乙醇尽可能去除,置于磁力架上静置5 min至磁珠完全干燥;2.3.7向每个样本中加22μl无核酸酶水,吹吸混匀,瞬时离心,室温孵育2 min;2.3.8将离心管放在磁力架上2-3 min,待溶液澄清;2.3.9小心吸取20μl上清至一新的200μl pcr管中,丢弃磁珠,冰上放置备用,随即进入pre-pcr(捕获前pcr扩增)步骤。
45.2.4pcr扩增2.4.1在冰上按表9各组分并配制pcr反应液;表9中的接头连接的dna来自于步骤2.3.9;表9
2.4.2加样完涡旋振荡混匀,短暂离心1次将管盖上液体离心至管底;2.4.3将样品放入pcr仪中按表10所示程序运行。
46.表102.5ampure xp磁珠纯化2.5.1提前将ampure xp磁珠从4℃冰箱拿出,涡旋混匀,室温放置30 min;2.5.2震荡混匀ampure xp磁珠,取45μl磁珠加入pcr产物中,使用移液器温和反复吹吸10次,使其充分混匀,室温孵育5 min;2.5.3将离心管放置磁力架上静置5min,待溶液澄清后移弃上清液,保留磁珠;2.5.4保持离心管在磁力架上,在反应管中加入200μl新配制的80%的乙醇,静置30s后移弃上清液,保留磁珠;2.5.5重复上述步骤一次;2.5.6将离心管中残留的乙醇尽可能去除,置于磁力架上静置5 min至磁珠完全干燥;2.5.7向每个样本中加25μl无核酸酶水,吹吸混匀,瞬时离心,室温孵育2 min;2.5.8将离心管放在磁力架上2-3 min,待溶液澄清;2.5.9小心吸取23μl上清至一新的200μl pcr管中,丢弃磁珠,取部分产物进行文库定量和质检,剩余部分-20℃保存。
47.3、终文库构建3.1预文库混合3.1.1取上述10例样本文库,癌组织文库取190ng,其配对白细胞文库取60ng与所述探针池混合;3.1.2向已混合的文库中分别加入封闭试剂,5μl human cot-1 dna和2μl universal blockers;3.1.3将其置于真空浓缩仪中,60℃恒温干燥,直至没有液体。
48.3.2文库与探针杂交3.2.1依次向上述已干燥的pcr管中加入表11中各组分:表11
3.2.2用移液器吹打混匀,室温放置5min,涡旋混匀,瞬时离心,将pcr管置于pcr仪器中按表12程序运行。
49.表123.3链酶亲和素磁珠准备3.3.1将dynabeads m-270(链酶亲和素磁珠)从4℃冰箱中取出,室温放置30 min;3.3.2涡旋混匀15 s;3.3.3每个杂交反应吸取50μldynabeads m-270(链酶亲和素磁珠)于一新的1.5ml低吸附离心管中;3.3.4加入100μl 1
×
bead wash buffer(磁珠洗脱缓冲液),吹吸混匀10次;3.3.5将离心管转移至磁力架上,至液体完全澄清,弃上清,保留磁珠;3.3.6加入100μl1
×
bead wash buffer,涡旋混匀10s,将离心管转移至磁力架上,至液体完全澄清,小心移弃上清液,保留磁珠;3.3.7重复上一步骤,共洗涤两次;3.3.8每个杂交反应加入17μl磁珠重悬液,迅速吹吸混匀;3.3.9转移17 μl磁珠溶液至新的0.2ml pcr反应管中,随即进入下一步。
50.3.4链酶亲和素磁珠捕获目标dna3.4.1待hyb程序运行完成后,将杂交反应管从pcr仪中取出,将pcr仪器设置为65℃,保温;3.4.2将17 μl磁珠溶液转移至杂交反应管中,涡旋混匀,使磁珠充分重悬;3.4.3放置pcr仪中,65℃孵育45min;3.4.4孵育完成后,立即进行下一步漂洗。
51.3.5漂洗去除非特异性dna3.5.1从pcr仪上取下反应管,加入100μl 65℃预热的1
×
wash buffer 1(洗脱缓冲液1),用移液器吹打混匀10次,切勿产生气泡;3.5.2将离心管转移至磁力架上至液体完全澄清,小心去除上清,保留磁珠;3.5.3取下离心管,加入150μl 65℃预热的1
×
stringent wash buffer(洗脱缓冲液),吹吸混匀10次,切勿产生气泡,65℃孵育5min;3.5.4将离心管转移至磁力架,至液体完全澄清,小心移弃上清液,保留磁珠;3.5.5取下离心管,加入150μl 65℃预热的1
×
stringent wash buffer(洗脱缓冲液),吹吸混匀10次,切勿产生气泡,65℃孵育5min;
3.5.6将离心管转移至磁力架,至液体完全澄清,小心移弃上清液,保留磁珠;3.5.7取下离心管,加入150μl室温的1
×
wash buffer 1(洗脱缓冲液1),吹吸混匀;3.5.8孵育2min,涡旋30s和静置30s相互交替,确保充分混匀;3.5.9将离心管转移至磁力架,至液体完全澄清,小心移弃上清液,保留磁珠;3.5.10取下离心管,加入150μl室温的1
×
wash buffer 2(洗脱缓冲液2),吹吸打混匀;3.5.11孵育2min,涡旋30s和静置30s相互交替,确保充分混匀;3.5.12将离心管转移至磁力架,至液体完全澄清,小心移弃上清液,保留磁珠;3.5.13取下离心管,加入150μl室温的1
×
wash buffer 3(洗脱缓冲液3),吹吸混匀;3.5.14孵育2min,涡旋30s和静置30s相互交替,确保充分混匀;3.5.15将离心管转移至磁力架,至液体完全澄清,小心移弃上清液,保留磁珠;3.5.16将离心管从磁力架上取下,瞬时离心后,置于磁力架上静置,使用移液器将残存的洗脱缓冲液完全去除;3.5.17将离心管从磁力架上取下,加入20μl无核酸酶水,吹吸混匀,得到磁珠重悬液备用。
52.3.6post-pcr扩增(捕获后pcr扩增)3.6.1将library pcr master mix(2
×
)(文库pcr预混液)、illumina primer mix(10
×
)(通用测序引物混合液)取出,置于冰上融化;3.6.2按照表13中各组分配制pcr master mix(pcr预混液);表133.6.3将30 μl pcr master mix加至上述磁珠重悬液(步骤3.5.17)中,并吹吸混匀;3.6.4将上述混合液置于pcr仪中,按表14所示的程序反应。
53.表143.7ampure xp磁珠纯化3.7.1提前将ampure xp磁珠从4℃冰箱拿出,涡旋混匀,室温放置30 min;3.7.2震荡混匀ampure xp磁珠,取50 μl磁珠加入pcr产物中,使用移液器温和反复吹吸10次,使其充分混匀,室温孵育5 min;
3.7.3将离心管放置磁力架上静置5 min,待溶液澄清后移弃上清液,保留磁珠;3.7.4保持离心管在磁力架上,在反应管中加入200 μl新配制的80%的乙醇,静置30s后移弃上清液,保留磁珠;3.7.5重复上述步骤一次;3.7.6将离心管中残留的乙醇尽可能去除,置于磁力架上静置5 min至磁珠完全干燥;3.7.7向每个样本中加23 μl无核酸酶水,吹吸混匀,瞬时离心,室温孵育2 min;3.7.8将离心管放在磁力架上2-3 min,待溶液澄清;3.7.9小心吸取20 μl上清至一新的200 μl pcr管中,丢弃磁珠,取部分产物进行文库定量和质检,剩余部分-20℃保存。
54.4.上机测序4.1终文库进行片段质检和qpcr定量终文库片段质检结果如图2所示,图2显示,文库主峰349bp,符合预期,且无其他杂带。
55.4.2文库上机测序5、数据分析5.1对测序数据进行生信分析:数据量为标准数据量=目标区域
×
测序深度。单端/双端测序下机数据量偏差为标准数据量的
±
20%。双端测序读长read1(5’到3’)与双端测序读长read2(3’到5’)的数据量相比,偏差不超过标准数据量的
±
20%。碱基质量:q30(正确率99.9%)》85%,read比对率:>95%。体细胞变异平均测序深度组织>5000
×
,配对白细胞平均测序深度>1500
×
,详见表15。
56.表155.2结果分析解读检测的变异类型包括单核苷酸变异(snv)、小片段插入/缺失(indel),拷贝数变异(cnv)、基因融合(gene fusion),不包括染色体数目异常以及特殊类型的变异。
57.组织样本的snv/indel变异比例的检测下限为1%,血液样本的snv/indel变异比例的检测下限为0.5%,组织和血液样本的cnv的检出下限为1.5倍、融合的检出下限为2%:胚系变异测序深度达到30
×
以上占比99.5%。
58.5.3输出解读报告实施例3对已知msi状态的临床样本进行检测根据114个微卫星重复和5个promega(上海普洛麦格生物产品有限公司)经典微卫星位点进行比对,综合评估微卫星稳定型(mss)、微卫星低不稳定型(msi-l)和微卫星高不稳定型(ms1-h)。其中mss:微卫星不稳定性分值《0.2,msi-l:微卫星不稳定性分值(0.2,0.4),msi-h:微卫星不稳定性分值》0.4。对64例已知msi状态的临床样本(肿瘤组织及正常对照)使用所述探针池及检测方法,操作步骤参照实施例2,msi检测性能验证结果如图3所示,基于114个高质量微卫星位点计算平均js散度平方根(average square root of jensen-shannon divergence),其msi检测灵敏度(tpr)和特异性(spc)均为100%,该结果表明本发明所述ngs中型探针池及检测方法能够准确评估泛癌种msi状态,进而预测免疫治疗疗效。
59.实施例4 评估探针池及检测方法的tmb检测性能验证由于使用大型探针池评估tmb水平被业内一致认可,而用中小型探针池评估tmb水平的方法还处于探索阶段。为评估本发明所述探针池(ngs中型探针池)及检测方法的tmb检测性能,基于以下评判标准,肺癌高tmb阈值为>13.91 muts/mb,乳腺癌高tmb阈值为>6.36muts/mb,肝癌高tmb阈值为>5.28 muts/mb,胃癌高tmb阈值为>7.29 muts/mb,直肠癌高tmb阈值为≥6.27 muts/mb,胰腺癌高tmb阈值为>3.97muts/mb,宫颈癌高tmb阈值为>8.4muts/mb,头颈部鳞状细胞癌高tmb阈值为>10.83muts/mb,黑色素瘤高tmb阈值为>27.76muts/mb,默克尔细胞癌高tmb阈值为>22.62muts/mb,肾癌高tmb阈值为>3.9muts/mb,尿路上皮癌高tmb阈值为>12.44muts/mb,皮肤鳞状细胞癌高tmb阈值为>86.07muts/mb,泛癌种高tmb阈值为>10.57muts/mb。
60.通过模拟分析了200例临床样本分别使用本发明所述ngs中型探针池(1.5mb)和ngs大型探针池(2.7 mb)的头对头检测的数据,结果显示本发明所述ngs中型探针池及检测tmb结果与ngs大panel的检测结果一致性高达95%,tmb检测性能验证结果如图4所示(横坐标为ngs大型探针池的检测结果,纵坐标为本发明所述ngs中型探针池检测结果),说明本发明所述探针池作为ngs中型探针池,可用于初步评估肿瘤tmb状态,能为患者提供一个高性价比的肿瘤用药基因检测方案。
61.综上,本发明中所述泛实体瘤基因检测组合为中型基因检测组合(1.5 mb),所述中型基因检测组合对应的检测结果与ngs大型基因检测组合(2.7 mb)的结果一致性高达95%,能够满足检测的需求,同时能够进一步降低成本,在评估肿瘤tmb状态中具有重要应用价值。
62.申请人声明,以上所述仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,所属技术领域的技术人员应该明了,任何属于本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,均落在本发明的保护范围和公开范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。