1.本发明属于皮肤干细胞技术领域,尤其涉及一种降低皮肤衰老和提高皮肤损伤修复的生物制剂。
背景技术:
2.人类皮肤的衰老是一个复杂的过程,其主要是由内在机制和外在影响的相互作用导致引起的,皮肤衰老可以分为内源性衰老和外源性衰老。其中,内源性衰老是由于遗传因素导致的皮肤不可避免的生理功能性衰老,随着年龄的增长皮肤会出现皮肤粗糙、干燥、细纹增多和皮肤萎缩的情况。外源性衰老也被称之为光老化,其是由一些外界因素如客气污染、日晒等所引起的一种皮肤外源性老化现象。
3.皮肤干细胞分为表皮干细胞和毛囊干细胞,表皮干细胞是皮肤中具有自我更新和多向分化潜能的成体干细胞,在不同的诱导因素下,其可以分化为成纤维细胞、脂肪细胞、成肌细胞或神经元细胞,从而可用于修复皮肤,肌肉和器官损伤。皮肤的衰老和表皮干细胞的减少和衰老密切相关,表皮细胞可以在特定的条件下分化为皮肤成纤维细胞,进而参与皮肤组织损伤修复并降低皮肤的衰老。因此,有效的增加表皮干细胞的增殖和减缓表皮干细胞的衰老将有助于降低皮肤的衰老速度,并有助于修复皮肤损伤。
技术实现要素:
4.本发明的目的在于提供一种降低皮肤衰老和提高皮肤损伤修复的生物制剂,并提供一种白茅素的新功能。
5.为实现上述目的,本发明提供了如下的技术方案:首先,本发明提供了一种降低皮肤衰老和提高皮肤损伤修复的生物制剂,所述生物制剂含有白茅素和药学上可接受的载体,所述生物制剂促进皮肤干细胞的增殖并降低皮肤干细胞的衰老。
6.优选地,所述皮肤干细胞为表皮干细胞。
7.优选地,所述白茅素降低衰老促进蛋白p21和p16的蛋白表达,促进衰老抑制蛋白p53的蛋白表达,恢复衰老细胞的分化能力。
8.其次,本发明提供了白茅素在制备降低皮肤干细胞衰老的生物制剂中的应用。
9.优选地,所述皮肤干细胞为表皮干细胞。
10.优选地,所述生物制剂降低表皮干细胞的衰老,降低衰老促进蛋白p21和p16的蛋白表达,促进衰老抑制蛋白p53的蛋白表达,恢复衰老细胞的分化能力。
11.其次,本发明提供了白茅素在制备皮肤损伤修复的生物制剂中的应用,所述生物制剂通过促进表皮干细胞的增殖来修复皮肤损伤。
12.其次,本发明提供了白茅素在制备促进表皮干细胞增殖的生物制剂中的应用。
13.最后,本发明提供了白茅素在制备促进衰老表皮干细胞成骨分化能力恢复制剂中的应用。
14.本发明的有益效果是:本发明发现白茅素可以促进表皮干细胞的增殖,降低表皮干细胞的衰老,降低衰老促进蛋白p21和p16的蛋白表达,促进衰老抑制蛋白p53的蛋白表达,恢复衰老细胞的分化能力,从而将其用于减缓皮肤的衰老并且加快皮肤损伤修复。
附图说明
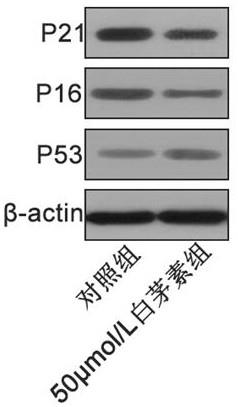
15.图1为白茅素,异甘草素,黑芥子甙,芍药糖苷对于表皮干细胞增殖的影响;图2为不同浓度的白茅素对于表皮干细胞增殖的影响;图3为50μmol/l白茅素对于表皮干细胞衰老影响的细胞图;其中(a)为对照组,(b)为50μmol/l白茅素组;图4为50μmol/l白茅素对于表皮干细胞衰老影响的统计图;图5为50μmol/l白茅素对于表皮干细胞衰老相关蛋白p21,p16和p53的影响;图6为50μmol/l白茅素对于表皮干细胞成骨分化过程中alp酶活性的影响。
具体实施方式
16.本发明所举实施例是为了更好地对本发明进行说明,但并不是本发明的内容仅局限于所举实施例。所以熟悉本领域的技术人员根据上述发明内容对实施方案进行非本质的改进和调整,仍属于本发明的保护范围。
17.实施例1检测不同植物提取物对于表皮干细胞。
18.(1)将p3代的表皮干细胞按照1000个/100μl的量接种在96孔细胞培养板中;(2)过夜培养后,去除培养基,更换为含有25μmol/l的白茅素,异甘草素,黑芥子甙,芍药糖苷培养基,和仅添加培养基的对照组,每组设置3个重复;(3)培养72h之后,加入cck-8,检测450nm的od值。
19.实验得到的结果展示于图1中,对照组的od值为0.550
±
0.013,白茅素组的od值为0.734
±
0.029,异甘草素组的od值为0.534
±
0.019,黑芥子甙的od值为0.588
±
0.031,芍药糖苷组的od值为0.633
±
0.024。
20.可以看出,芍药糖苷组和白茅素组的od值相较于对照组升高,其中白茅素组的增殖促进效果更为明显,因此,本发明选择白茅素进行后续实验。
21.实施例2检测白茅素对于表皮干细胞增殖促进的最佳浓度。
22.(1)将p3代的表皮干细胞按照1000个/100μl的量接种在96孔细胞培养板中;(2)过夜培养后,去除培养基,更换为含有6.25,12.5,25,50,100μmol/l的白茅素,和仅添加培养基的对照组,每组设置3个重复;(3) 培养72h之后,加入cck-8,检测450nm的od值。
23.实验得到的结果展示于图2中,对照组为0.555
±
0.017;6.25μmol/l白茅素组为0.595
±
0.016;12.5μmol/l白茅素组为0.633
±
0.010;25μmol/l白茅素组为0.723
±
0.014;50μmol/l白茅素组为0.782
±
0.024;100μmol/l白茅素组为0.752
±
0.020。
24.可以看出50μmol/l为白茅素用于促进表皮干细胞增殖的最适浓度。
25.实施例3检测白茅素对于表皮干细胞衰老的影响。
26.(1)将p12代的表皮干细胞接种于6孔板中,过夜培养后,对照组更换为普通培养基,实验组更换为50μmol/l白茅素;(2)培养48h后,去除培养基,加入固定液室温下固定细胞15min;(3)固定结束后,加入pbs清洗细胞2次,加入β-半乳糖苷酶染色液,然后使用封口膜将细胞培养板封闭,放入不含co2的培养箱中进行过夜孵育;(4)染色结束后,置于倒置显微镜下进行观察并计算细胞阳性率。
27.实验得到的结果展示于图3和图4中,对照组的细胞阳性率为75%,50μmol/l白茅素处理后的阳性率为47%。
28.可以看出,使用白茅素处理后可以降低细胞的衰老。
29.实施例4检测白茅素对于表皮干细胞衰老相关蛋白的影响。
30.(1)将p9代的表皮干细胞接种于6孔板中,过夜培养后,对照组更换为普通培养基,实验组更换为50μmol/l白茅素;(2)培养48h后,去除培养基,加入80ul蛋白裂解液,使用细胞刮刀经细胞刮下后,将含有细胞的裂解液转移到ep管中,使用超声波细胞破碎仪破碎细胞;(3)4℃,12000rpm条件下,离心20min,取上清至新的ep管中;(4)根据试剂盒说明书,使用bca法检测蛋白浓度,加入5
×
sds上样缓冲液使各组蛋白样品的浓度保持一致;(5)组装配胶支架,配置12%下层胶和5%上层胶,配置好后,组装电泳装置,开始电泳;(6)上层浓缩胶采取恒压80v,电泳30min,下层分离胶采取恒压120v,电泳60min左右,当溴酚蓝条带移至距离分离胶底部约1cm时停止电泳;(7)将胶置于电转夹中,按照“三明治”模型制作转膜夹,过程中需要排除所有的气泡,安装好电转装置,并置于冰盒内,倒入转膜液,采取恒流250ma,电转90min后完成转膜;(8)电转结束后,将pvdf膜取出置于5%的脱脂奶粉中,置于摇床上封闭1h;(9)根据相应的蛋白大小,孵育p21,p16, p53,β-actin,4℃摇床孵育过夜;(10)吸取一抗,pbs洗膜三次,每次5min,孵育二抗,室温1.5h;(11)弃去二抗,pbs洗膜三次,每次5min,进行显影曝光。
31.实验得到的结果展示于图5中,使用白茅素处理p9代的表皮干细胞后,细胞中衰老促进蛋白p21和p16的蛋白表达出现明显的降低,而衰老抑制蛋白p53的蛋白表达出现明显的升高。
32.上述结果说明,白茅素可以有效的抑制衰老促进蛋白p21和p16,并且促进衰老抑制蛋白p53的表达。
33.实施例5检测白茅素对于表皮干细胞成骨分化过程中alp酶活性的影响。
34.(1)将p3代表皮干细胞,p9代表皮干细胞接种于6孔板中,p3代设置3个复孔,p9代设置6个复孔;
(2)过夜培养后,p3代作为对照组更换培养基,p9代一半作为实验组1更换培养基,一半作为实验组2更换含有50μmol/l白茅素的培养基;(3)培养48h后,去除培养基,更换为成骨分化培养基进行培养;(4)培养7d后,去除培养基,使用pbs清洗细胞后,每孔加入200ul triton x-100,冰上处理30min;(5)收集裂解后的细胞,离心收集上清液,将上清加入到96孔板中,每孔加入10ul上清,50ul显色底物,40ul alp酶检测缓冲液;(6)混匀后,放入酶标仪中检测450nm od值。
35.实验得到的结果展示于图6中,其中对照组的od值为0.451
±
0.023,实验组的od值为0.224
±
0.015,实验组2的od值为0.325
±
0.016。
36.上述结果说明,使用白茅素处理后,可以提高衰老细胞在成骨分化时的alp酶活性,从而提高衰老细胞的成骨分化能力。
37.最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围当中。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
