一种病原微生物宏基因组微量dna建库的方法
技术领域
1.本发明涉及一种病原微生物宏基因组微量dna建库的方法,其属于病原微生物检测的技术领域,主要的方法在于兼顾低提取量样本的建库以及建库方法的优化解决临床样本检测问题。
背景技术:
2.近年来,造成人类的感染日益增多,主要原因来源于社会环境的大背景下有的人群长期暴露在易受感染场合、有的人群会在术后易受感染、有的人群因为基础疾病原因导致免疫力降低易受感染,尤其是儿童和老人这一些特殊人群,且感染的病原微生物日益复杂,涉及的种类繁多,由于药物的广泛使用导致耐药现象严重,致使临床的治疗出现瓶颈期,病原微生物的治疗已成为目前全球关注的焦点。临床公认的“金标准”是分离培养和生化鉴定病原菌,依赖于病原菌的培养但是具有检测周期长、有些菌难培养、依赖预假设逐一排查、检测范围存在限制及阳性率低易漏诊等缺点。
3.为解决以上问题,病原微生物宏基因组检测技术应运而生,对于感染病原菌的诊断宏基因组测序技术可直接从临床样品中提取全部微生物的dna,通过构建宏基因组文库,利用基因组学的研究策略研究样本所包含的全部微生物的遗传组成及其群落功能。它是在微生物基因组学的基础上发展起来的一种研究微生物多样性、开发新的生理活性物质(或获得新基因)的新理念和新方法。其诊断的人群主要涉及三大类,包括疑难人群(长期不明原因发热)、危重人群(重度肺炎、脑膜炎)、特殊人群(器官移植、免疫缺陷),其检测的主要优点有短时间内快速鉴定、无需培养、高通量全景检测、可检测未知病原且准确性好。其主要的实验流程设计样本的提取、文库构建、上机测序、数据分析等,其中文库构建方法众多,构建的结果也各有不同,对于高提取量样本建库后由于投入dna分子总量较高,建库中dna分子的延展性不好且与试剂结合的不够充分,导致终产物浓度均一性差,后期反馈的病原检出数据不佳,容易漏检影响病原检出的判断;对于普遍提取量较低的临床病原样本存在建库困难,方法中所涉及的dna分子建库起始投入量以及适配的扩增循环数需要摸索最适数据才会减轻对终产建库浓度的影响,提高实验结果准确性,所以急需一种解决微量dna样本建库的方法且使得建库试剂与dna分子充分结合,提高检测结果的准确性。
技术实现要素:
4.为解决上述技术问题,本发明提供了一种关于病原微生物宏基因组微量dna建库的实验方法,不仅可以解决临床低提取量样本的建库,还通过本公司的优化方法-即1-10ng低投入使得dna分子在建库中充分释放延展,建库试剂与dna分子充分结合,摸索最适的pcr循环数,整齐操作缩短实验时间,最后获得浓度均一的终产物,测序结果发现不仅可以提高普通病原的检出,还可以提高低reads病原微生物的检出,有利于辅助临床病原微生物的诊断。
5.为了实现上述目的,本发明是通过以下方案予以实现的:
6.一种病原微生物宏基因组微量dna建库的试剂盒,所述试剂盒中包括:
7.样本浓度定量试剂为dsdna测定试剂;
8.酶切试剂为dktp enzyme mix和dktp buffer;dktp enzyme mix为酶组合物,其中包含:dnase i 1-10u/ul、klwnow 1-10u/ul、taq dna聚合酶0.1-0.5u/ul、t4多聚核苷酸激酶0.15-0.5u/ul;接头连接试剂为rapid ligation buffer 3和rapid dna ligase;pcr扩增试剂为primer mix 5-10ul,pcr amplification mix 10-30ul。
9.一种关于病原微生物宏基因组微量dna建库的实验方法,包括以下步骤:
10.(1)利用现有的凯杰试剂盒抽提临床样本的dna,利用qubit仪器进行样本dna浓度的测量;
11.所述的抽提临床样本dna来源于但不限于痰液、血液、肺泡灌洗液、脑脊液、胸腔引流液、腹腔引流液、尿液、石蜡切片等;
12.所述的浓度定量试剂为dsdna测定试剂,取1ul样本进行浓度测定;所述的样本如果隔天进行二代文库的制备,则制备前需要再次进行浓度测定。
13.(2)计算样本投入体积;
14.所述的样本投入体积根据1-10ng投入量计算,兼容低提取量的样本,扩大样本操作范围;
15.(3)文库的酶切与末端修复、加polya操作;
16.所述的步骤一步完成,利用高效的dktp enzyme mix和dktp buffer上机时间为35-50min;
17.所述的dktp enzyme mix为酶组合物,其中:dnase i 1-10u/ul、klwnow 1-10u/ul、taq dna聚合酶0.1-0.5u/ul、t4多聚核苷酸激酶0.15-0.5u/ul;
18.(4)文库的接头连接;
19.所述的接头连接需根据样本起始投入量进行通用接头的稀释,稀释的范围为10ng~1ng投入按1:10~1:45稀释。
20.所述的接头连接需要用到的其他试剂为rapid ligation buffer 3和rapid dna ligase;
21.所述的接头连接时间为10-15min。
22.(5)文库的纯化;
23.所述的文库纯化所需的纯净水和磁珠要室温静置至少30min;
24.所述的文库纯化磁珠吸附dna能力较强,能高效结合dna分子;
25.所述的文库纯化磁珠体系为0.6x磁珠,所述的洗涤试剂80%的无水乙醇必须是现用现配,高效洗涤,降低dna分子的损失;
26.(6)文库的扩增;
27.所述的文库扩增确定了4-9cycle,上机时间约20min;
28.(7)文库的分选纯化;
29.所述的文库分选纯化的磁珠体系分别为50-68ul磁珠和10-20ul磁珠;
30.(8)测量文库终产物浓度
31.一种关于病原微生物宏基因组微量dna建库的实验方法:
32.所述的样本投入量计算方法为浓度*体积,体积最大投入量为30ul;
33.所述的接头连接采用双barcord连接,增加样本测序的准确性;
34.所述的接头连接后磁珠纯化体系为40-60ul。
35.所述的文库纯化的主要流程为样本与40-60ul磁珠结合混匀,室温静置3-5min,放入磁力架澄清后弃上清,用80%乙醇清洗磁珠两次,晾干后加纯净水20-30ul洗脱磁珠上的dna片段。
36.所述的文库扩增时所需的试剂为primer mix 5-10ul,pcr amplification mix 10-30ul。
37.所述的文库扩增上机主要流程为93℃预变性2-3min,96℃变性10-20s,60℃退火15-30s,72℃延伸15-30s,72℃后延伸5-9min。所述的文库分选纯化主要流程为向下机产物中补纯净水至100ul,后向上述体系中加入50-68ul磁珠,混匀后静置3-5min,放入磁力架澄清后转移上清至10-20ul磁珠体系中,混匀后静置3-5min,再用80%乙醇洗涤两次,晾干磁珠加20-30ul纯净水洗脱磁珠中的dna片段。
38.本发明的有益效果为:所述的起始dna投入量固定在1-10ng之间,而非以往的20-100ng建库;所述的pcr扩增循环数为4-9cycle,而非以往的不均一pcr循环数导致下机时间和效果参差不齐;所述文库下机浓度均一,不需要特别稀释就可以进行上机文库的pooling。
39.该方法不仅可以缩短整体的实验时间,还可获得终产物浓度均一,测序结果发现不仅可以提高普通病原的检出,还可以提高低reads病原微生物的检出,有利于辅助临床病原微生物的诊断。
40.本发明所要解决的技术问题是针对低提取量样本的建库,可通过对病原微生物宏基因组建库方法的优化来高效制备二代测序的文库,提高临床致病微生物的检出,辅助临床对患者的致病菌进行用药指导。该方法主要明确了建库起始最优投入量,其投入量区间为1-10ng,而非传统的100ng或其他数值,后续进行pcr扩增时最优循环数控制在4-9cycle,避免扩增循环数低导致的成环效率低,建库可后获得浓度均一的二代测序文库。该方法不仅可以解决低提取量样本的建库问题,还充分利用dna分子结构的特点即低投入量时dna分子延展更充分,建库效果更好,确定最优条件后可整齐操作缩短实验时间,获得浓度均一的终产物,测序结果发现不仅可以提高普通病原的检出,还可以提高低reads病原微生物的检出。。
具体实施方式
41.实施例1-痰液样本
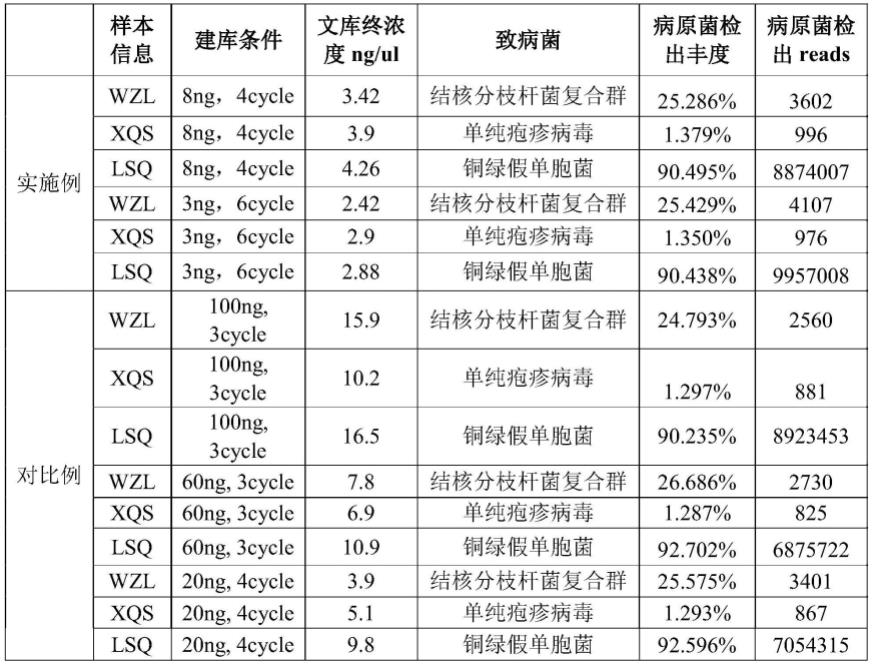
42.为了更好的说明样本起始dna投入量固定在1-10ng之间,pcr扩增循环数为4-9cycle建库效果好,特设置了实施例1和对比例1,实施例1中起始dna投入量为8ng 4循环和3ng 6循环。对比例1中起始dna投入量为100ng 3循环;60ng 3循环;20ng 4循环。
43.实施例1中:
44.(1)利用qubit仪器测量凯杰试剂盒抽提的痰液临床样本dna的浓度,并准确记录实验数据。
45.(2)计算样本投入体积;根据投入量是3ng和8ng,推算出样本的取样体积,向两个管中加水将样本总体积补至30ul。
46.(3)文库的酶切与末端修复、加polya操作;向上述两管30ul体系中加入5ul dktp enzyme mix和15ul dktp buffer,此时总体系为50ul。上机运行45min。
47.(4)文库的接头连接;按照8ng投入量1:12稀释通用接头,3ng投入量1:15稀释通用接头;稀释好的接头分别取5ul加入上述相应的两个体系管中,再分别加入30ul rapid ligation buffer 3;5ul rapid dna ligase;纯净水10ul,此时总体系达到100ul。上机温度为37℃11min。
48.(5)文库的纯化;向上述下机的产物中加入50ul提前室温放置好的磁珠,吹打混匀,室温放置5min,放入磁力架上,上清液澄清后弃掉上清,加入80%的乙醇漂洗两次,晾干磁珠,加入25ul纯净水洗脱磁珠dna。
49.(6)文库的扩增;取上述洗脱的dna产物20ul,并向管中加入primer mix 5ul,pcr amplification mix 30ul,此时总体系为55ul。上机运行程序:95℃预变性3min,96℃变性20s,60℃退火20s,72℃延伸30s,72℃后延伸6min;10ng起始投入量5个循环数,5ng起始投入量7个循环数。
50.(7)文库的分选纯化;向上述的下机产物中加入纯净水将体系补至100ul,后加入52ul磁珠吹打混匀,静置5min,放入磁力架澄清后转移全部上清至20ul磁珠中继续吹打混匀,静置5min,放入磁力架上,澄清后弃掉上清,用80%乙醇漂洗两次后晾干磁珠,加入25ul纯净水洗脱终产物dna。
51.(8)测量文库浓度。
52.对比例1中:
53.(1)利用qubit仪器测量凯杰试剂盒抽提的痰液临床样本dna的浓度,并准确记录实验数据。
54.(2)计算样本投入体积;根据投入量是100ng、60ng、20ng,推算出样本的取样体积,向两个管中加水将样本总体积补至30ul。
55.(3)文库的酶切与末端修复、加polya操作;向上述两管30ul体系中加入5ul dktp enzyme mix和15ul dktp buffer,此时总体系为50ul。上机运行37℃20min;65℃30min。
56.(4)文库的接头连接;按照100ng投入量1:2稀释通用接头,60ng投入量1:4稀释通用接头;20ng投入量1:10稀释通用接头,稀释好的接头分别取5ul加入上述相应的两个体系管中,再分别加入30ul rapid ligation buffer 3;5ul rapid dna ligase;纯净水10ul,此时总体系达到100ul。上机温度为37℃13min。
57.(5)文库的纯化;向上述下机的产物中加入50ul提前室温放置好的磁珠,吹打混匀,室温放置5min,放入磁力架上,上清液澄清后弃掉上清,加入80%的乙醇漂洗两次,晾干磁珠,加入25ul纯净水洗脱磁珠dna。
58.(6)文库的扩增;取上述洗脱的dna产物20ul,并向管中加入primer mix 5ul,pcr amplification mix 30ul,此时总体系为55ul。上机运行程序:95℃预变性3min,96℃变性20s,60℃退火20s,72℃延伸30s,72℃后延伸6min;100ng、60ng起始投入量3个循环数,20ng起始投入量4个循环数。
59.(7)文库的分选纯化;向上述的下机产物中加入纯净水将体系补至100ul,后加入52ul磁珠吹打混匀,静置5min,放入磁力架澄清后转移全部上清至20ul磁珠中继续吹打混匀,静置5min,放入磁力架上,澄清后弃掉上清,用80%乙醇漂洗两次后晾干磁珠,加入25ul
纯净水洗脱终产物dna。
60.(8)测量文库浓度。
61.实验结果:
[0062][0063]
观察实验结果,可以看出对比例中高投入量的dna分子获得的文库终浓度较实施例中浓度高且相对不均一,可能与高投入量的dna分子与建库试剂结合的充分程度有关,导致最终的实验数据误差较大,实验sop中明确文库终产浓度在2.5ng/ul时即可满足下一步操作故从实验优化上看出8ng、3ng投入量开始建库获得的终产浓度较好,不需要稀释产物,增加产物留存的稳定性,其次从致病菌的检出丰度上可以看出样本wzl关于结核分枝杆菌复合群的检出丰度60ng》20ng》3ng》8ng》100ng,但就其致病菌reads检出方面则3ng》8ng》20ng》60ng》100ng,从此处可以看出常识中的100ng投入量建库并不是最佳的建库方案,有可能高投入量后反应不充分致使检出更低;其次对于病毒的检出其丰度和reads均是8ng》3ng》100ng》20ng》60ng,可以看出前两者检出效果较好;对于细菌的检出丰度60ng》20ng》8ng》3ng》100ng,检出reads3ng》100ng》8ng》20ng》60ng。综上可以看出建库时的dna分子投入量确定在1-10ng左右,选择低投入量不仅可以满足临床样本低提取量现象,还可以满足实验中用量较少与试剂的反应更充分,结果更佳;其进行pcr扩增时循环数控制在4-9cycle,即可以满足后期的高效成环还可获得浓度较均一的二代测序文库。本发明的实验优化方法可缩短整体的实验时间,获得的终产物浓度均一,测序结果发现不仅可以提高普通病原的检出,还可以提高低reads病原微生物的检出。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。