用于减少pd-l1表达的寡核苷酸
1.本技术是中国专利申请201780017220.7的分案申请,原申请的申请日是2017年3月14日,发明名称是“用于减少pd-l1表达的寡核苷酸”。
发明领域
2.本发明涉及与程序性死亡配体-1(pd-l1)互补、导致肝脏pd-l1表达减少的寡核苷酸(寡聚体)。本发明还涉及一种缓和肝脏中因肝脏感染或癌症引起的t细胞消耗的方法。相关感染是慢性hbv、hcv和hdv和寄生物感染如疟疾和弓形虫病(例如由疟原虫属(plasmodium)原虫、尤其物种间日疟原虫(p.vivax)、三日疟原虫(p.malariae)和恶性疟原虫(p.falciparum)引起)。
背景技术:
3.已知由程序性死亡-1(pd-1)受体及其配体pd-l1(或b7-h1或cd274)组成的共刺激途径直接促成t细胞消耗,导致肝脏慢性感染期间缺少病毒控制。pd-1途径还在自身免疫性中发挥作用,因为这条途径遭破坏的小鼠形成自身免疫性疾病。
4.已经显示阻断pd-1和pd-l1之间相互作用的抗体增强t细胞应答,尤其cd8 细胞毒t细胞应答(参见barber等人2006nature vol 439p682和maier等人2007j.immunol.vol 178p 2714)。
5.wo 2006/042237描述一种通过评估肿瘤中pd-l1(b7-h1)表达诊断癌症的方法并且提出向患者递送干扰pd-1/pd-l1相互作用的物质。干扰性物质可以是抗体、抗体片段、sirna或反义寡核苷酸。关于肝脏慢性感染,尚没有这类干扰性物质的具体例子,也没有提到任何的这类干扰性物质。
6.在例如wo 2005/007855,wo 2007/084865和us 8,507,663中也已经公开了使用双链rna(dsrna、rnai或sirna)分子对pd-l1进行rna干扰介导的抑制。这些文献均未描述向肝脏靶向递送。
7.dolina等人,2013molecular therapy-nucleic acids,2e72描述了体内递送靶向pd-l1的sirna分子至枯否细胞,因而增强mcmv感染的小鼠中nk和cd8 t细胞清除作用。这篇论文得出结论,就增强cd8 t细胞效应子功能而言,递送至肝细胞的靶向pd-l1的sirna分子无效。
8.这种sirna方案明显不同于单链反义寡核苷酸方案,因为生物分布和作用模式相当不同。如xu等人2003biochem.biophys.res.comm.vol 306,第712-717页中所述,反义寡核苷酸和sirna对mrna中的靶位点具有不同的偏好性。
9.wo2016/138278描述了使用两种或更多种在其5'末端连接的单链反义寡核苷酸,对包含pd-l1的免疫检查点的抑制。该申请未提及hbv或靶向递送至肝脏。
10.本发明的目的
11.本发明鉴定在肝脏细胞中(既在实质细胞(例如肝细胞)中,又在非实质细胞如枯否细胞和肝脏窦内皮细胞(lsec)中)非常高效地减少pd-l1 mrna的新寡核苷酸和寡核苷酸
缀合物。通过减少或沉默pd-l1,寡核苷酸和寡核苷酸缀合物减少pd-1介导的抑制作用并且因而促进对被消耗的t细胞的免疫刺激作用。在肝脏慢性致病性感染中减缓t细胞消耗将导致免疫控制作用重获得并降低肝脏慢性致病性感染期间血液中病毒性抗原的水平。天然杀伤(nk)细胞和天然杀伤t(nkt)细胞也可以被本发明的寡核苷酸和寡核苷酸缀合物活化。
12.寡核苷酸缀合物确保肝脏细胞中的pd-l1局部减少并且因此降低自身免疫性副作用(如与pd-l1全身性消耗相关的肺组织炎症、非病毒性肝炎和结肠炎)的风险。
13.发明概述
14.本发明涉及靶向能够调节pd-l1表达的核酸的寡核苷酸或其缀合物并涉及与pd-l1功能相关的疾病的治疗或预防。寡核苷酸或寡核苷酸缀合物尤其可以用来治疗其中对抗传染因子的免疫应答已经被消耗的疾病。
15.因此,在第一方面,本发明提供寡核苷酸,其包含与pd-l1靶核酸至少90%互补的10至30个核苷酸长度的连续核苷酸序列。该寡核苷酸可以是反义寡核苷酸,优选地具有缺口聚物(gapmer)设计。优选地,该寡核苷酸能够通过切割靶核酸抑制pd-l1表达。优选地通过召集核酸酶实现切割。
16.在又一个方面,寡核苷酸与至少一个靶向脱唾液酸糖蛋白受体的缀合物部分(如包含至少一个n-乙酰半乳糖胺(galnac)部分的缀合物部分)缀合。缀合部分和寡核苷酸可以通过接头、尤其生物可切割接头连接在一起。
17.在又一个方面,本发明提供药物组合物,其包含本发明的寡核苷酸或寡核苷酸缀合物和可药用的稀释剂、载体、盐和/或辅助剂。
18.在又一个方面,本发明提供通过以有效量向所述细胞施用本发明的寡核苷酸或组合物,减少表达pd-l1的靶细胞中pd-l1表达的体内或在体外方法。
19.在又一个方面,本发明提供用于恢复对抗病毒或寄生物的免疫力的寡核苷酸、寡核苷酸缀合物或药物组合物。
20.在又一个方面,本发明提供用作药物的寡核苷酸、寡核苷酸缀合物或药物组合物。
21.在又一个方面,本发明提供通过向患有或易患疾病、病症或功能障碍、尤其选自肝脏病毒性感染或寄生物感染的疾病的受试者施用治疗有效量或预防有效量的本发明的寡核苷酸,用于治疗或预防疾病、病症或功能障碍的方法。
22.在又一个方面,本发明的寡核苷酸、寡核苷酸缀合物或药物组合物用于治疗或预防肝脏病毒性感染如hbv、hcv和hdv;或者寄生物感染如疟疾、弓形虫病、利什曼病和锥虫病或肝癌或肝脏中的转移灶。
23.附图简述
24.图1:显示示例性反义寡核苷酸缀合物,其中寡核苷酸表示为波浪线(a-d)或表示为“寡核苷酸”(e-h)或表示为t2(i)并且靶向脱唾液酸糖蛋白受体的缀合物部分是三价n-乙酰半乳糖胺部分。化合物a至d包含双赖氨酸分支分子peg3间隔团和三个末端galnac糖部分。在化合物a和b中,寡核苷酸在无接头的情况下直接连接至靶向脱唾液酸糖蛋白受体的缀合物部分。在化合物c和d中,寡核苷酸借助c6接头直接连接至靶向脱唾液酸糖蛋白受体的缀合物部分。化合物e-i包含长度和结构不同的三(trebler)分支分子和间隔团及三个末端galnac糖部分。
25.图2:相对于实施例2中所测试化合物在靶核酸上的位置,显示其ec
50
(a)和作为盐
水%(b)的pd-l1敲低作用的图。其中测试化合物的细胞系是thp1(
·
)和karpas
26.图3:三价galnac簇(gn2)的结构式。本发明中gn2用作缀合部分。波浪线显示该簇与例如c6氨基接头缀合或与寡核苷酸直接缀合的部位。
27.图4:cmp id no 766_2的结构式。
28.图5:cmp id no 767_2的结构式。
29.图6:cmp id no 768_2的结构式。
30.图7:cmp id no 769_2的结构式。
31.图8:cmp id no 770_2的结构式。
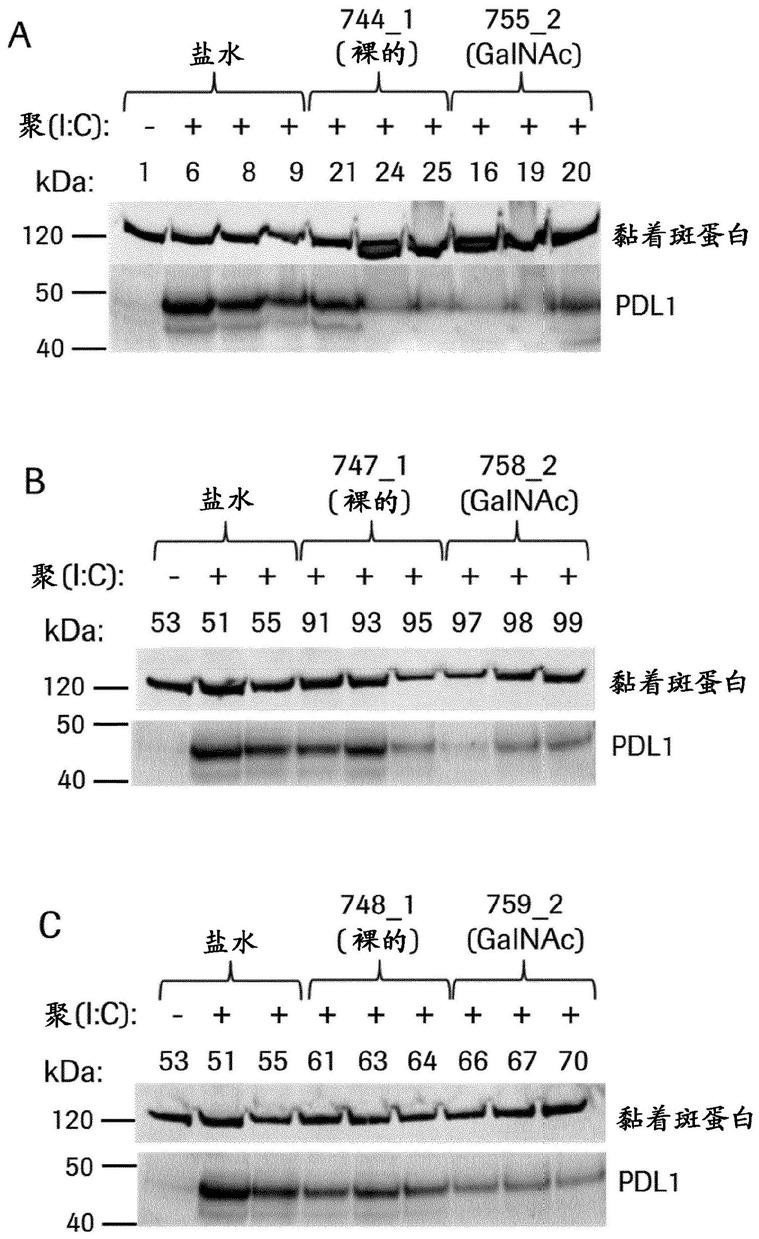
32.图9:检测用盐水和所示cmp id no处理后来自聚(ic)诱导的动物的肝脏中pd-l1蛋白表达的蛋白质印迹。每张印迹物显示裸寡核苷酸与相同寡核苷酸的galnac缀合形式,印迹物a)cmp id no 744_1和755_2,b)cmp id no 747_1和758_2,c)cmp id no 748_1和759_2,d)cmp id no 752_1和763_2和e)cmp id no 753_1和764_2。上部条带是黏着斑蛋白上样对照,下部条带是pd-l1蛋白。每张印迹物中的第一泳道显示无聚(ic)诱导的盐水处理的小鼠。这些小鼠表达非常少的pd-l蛋白。
33.图10:用
·
溶媒(vehicle)(组10和组1)、
◆
dna疫苗(组11和组2)、
○
抗pd-l1抗体(组12)、
▲
裸pd-l1 aso dna疫苗(组7)或
△
galnac缀合的pd-l1 aso dna疫苗(组8)处理后肝脏中的单个核细胞群体,对于每个组,显示各只动物并且每个组的平均数用垂线指示(参见表18)。已经评估dna疫苗组和三个处理组之间的统计显著性并且如果存在统计显著性,则它用组间*指示(*=p《0.05,***=p《0.001并且****=p《0.0001)。a)表示处理后肝脏中t细胞的数目。b)表示cd4 t细胞的分数和c)表示cd8 t细胞的分数。
34.图11:用
·
溶媒(组10和组1)、
◆
dna疫苗(组11和组2)、
○
抗pd-l1抗体(组12)、
▲
裸pd-l1 aso dna疫苗(组7)或δgalnac缀合的pd-l1 aso dna疫苗(组8)处理后,对肝脏中pd-l1阳性细胞的调节作用,对于每个组,显示各只动物并且每个组的平均数用垂线指示(参见表19)。已经评估dna疫苗组和三个处理组之间的统计显著性并且如果存在统计显著性,则它用组间*指示(*=p《0.05并且****=p《0.0001)。a)表示处理后肝脏中表达pd-l1的cd8 t细胞的百分数。b)表示处理后肝脏中表达pd-l1的cd4 t细胞的百分数并且c)表示处理后肝脏中表达pd-l1的b细胞的百分数。
35.图12:用
·
溶媒(组10和组1)、
◆
dna疫苗(组11和组2)、
○
抗pd-l1抗体(组12)、
▲
裸pd-l1 aso dna疫苗(组7)或
△
galnac缀合的pd-l1 aso dna疫苗(组8)处理后,肝脏中hbv抗原特异的分泌细胞因子的cd8 细胞,对于每个组,显示各只动物并且每个组的平均数用垂线指示(参见表20)。已经评估dna疫苗组和三个处理组之间的统计显著性并且如果存在统计显著性,则它用组间*指示(*=p《0.05)。a)表示处理后肝脏中对hbv pres2 s抗原特异的分泌ifn-γ的cd8 t细胞的百分数。b)表示处理后肝脏中对hbv核心抗原特异的分泌ifn-γ的cd8 t细胞的百分数,并且c)表示处理后肝脏中对hbv pres2 s抗原特异的分泌ifn-γ和tnf-α的cd8 t细胞的百分数。
36.图13:与溶媒(
■
)相比,用galnac缀合的pd-l1反义cmp no:759_2(
▼
)处理后aav/hbv小鼠中的hbv-dna、hbsag和hbeag。垂线表示处理结束。
37.定义
38.寡核苷酸
39.如本文所用的术语“寡核苷酸”定义为,它如技术人员通常理解那样为包含两个或更多个共价连接的核苷的分子。这类共价结合的核苷也可以称作核酸分子或寡聚体。寡核苷酸常在实验室中通过固相化学合成法产生,随后纯化。当提到寡核苷酸的序列时,指核碱基部分或其修饰物、共价连接的核苷酸或核苷的序列或顺序。本发明的寡核苷酸是人造的,并且是化学合成的,并且一般是纯化或分离的。本发明的寡核苷酸可以包含一个或多个修饰的核苷或核苷酸。
40.反义寡核苷酸
41.如本文所用的术语“反义寡核苷酸”定义为能够通过与靶核酸、尤其与靶核酸上的连续序列杂交来调节靶基因表达的寡核苷酸。反义寡核苷酸不必需是双链的并因此不必需是sirna。优选地,本发明的反义寡核苷酸是单链的。
42.连续核苷酸序列
43.术语“连续核苷酸序列”指与靶核酸互补的寡核苷酸区域。本文中该术语与术语“连续核碱基序列”和术语“寡核苷酸基序序列”互换使用。在一些实施方案中,寡核苷酸的全部核苷酸构成连续核苷酸序列。在一些实施方案中,寡核苷酸包含连续核苷酸序列并且可以任选地包含其他核苷酸,例如可以用来将官能团连接至连续核苷酸序列的核苷酸接头区。核苷酸接头区可以互补于或可以不互补于所述靶核酸。
44.核苷酸
[0045]“核苷酸”是寡核苷酸和多核苷酸的结构单位并且出于本发明目的,包括天然存在的和非天然存在的核苷酸。自然界中,核苷酸如dna和rna核苷酸包含核糖的糖部分、核碱基部分和一个或多个磷酸酯基团(它们不存在于核苷中)。核苷和核苷酸还可以可互换地称作“单位”或“单体”。
[0046]
修饰的核苷
[0047]
如本文所用的术语“修饰的核苷”或“核苷修饰”指与等同dna核苷或rna核苷相比,如通过引入一个或多个糖部分或(核)碱基部分修饰而修饰的核苷。在一个优选实施方案中,修饰的核苷包含修饰的糖部分。术语“修饰的核苷”也可以在本文中与术语“核苷类似物”或修饰的“单位”或修饰的“单体”互换使用。
[0048]
修饰的核苷间键
[0049]
术语“修饰的核苷间键”如技术人员通常理解定义为除了将二个核苷共价连接在一起的磷酸二酯(po)键之外的键。具有修饰的核苷间键的核苷酸也称作“修饰的核苷酸”。在一些实施方案中,与磷酸二酯键相比,修饰的核苷间键增加寡核苷酸的核酸酶抗性。对于天然存在的寡核苷酸,核苷间键包括在相邻核苷之间产生磷酸二酯键的磷酸酯基团。修饰的核苷间键特别可用于稳定体内使用的寡核苷酸,并且可以在本发明的寡核苷酸中的dna核苷或rna核苷的区域(例如在缺口聚物寡核苷酸的缺口区域内部)以及在修饰的核苷区域起到防范核酸酶剪切的作用。
[0050]
在一个实施方案中,寡核苷酸包含一个或多个从天然磷酸二酯修饰成例如更抵抗核酸酶攻击的键的核苷间键。可以通过在血清中温育寡核苷酸或通过使用核酸酶抗性测定法(例如蛇毒液磷酸二酯酶(svpd))确定核酸酶抗性,二者均为本领域熟知。寡核苷酸的能够增强核酸酶抗性的核苷间键称作抗核酸酶核苷间键。在一些实施方案中,寡核苷酸或其连续核苷酸序列中的至少50%核苷间键是修饰的,如寡核苷酸或其连续核苷酸序列中的至
少60%、如至少70%、如至少80或如至少90%核苷间键是修饰的。在一些实施方案中,寡核苷酸或其连续核苷酸序列的全部核苷间键均是修饰的。在一些实施方案中将认识到,将本发明的寡核苷酸与非核苷酸官能团如缀合物连接的核苷可以是磷酸二酯。在一些实施方案中,寡核苷酸或其连续核苷酸序列的全部核苷间键均是抗核酸酶核苷间键。
[0051]
修饰的核苷间键可以选自硫代磷酸酯、二硫代磷酸酯(diphosphorothioate)和硼烷磷酸酯(boranophosphate)。在一些实施方案中,修饰的核苷间键(例如硫代磷酸酯、二硫代磷酸酯或硼烷磷酸酯)与本发明的寡核苷酸的rna酶h召集作用相容。
[0052]
在一些实施方案中,核苷间键包含硫(s),如硫代磷酸酯核苷间键。
[0053]
硫代磷酸酯核苷间键特别有用,原因在于核酸酶抗性、有益的药代动力学和易于生产。在一些实施方案中,寡核苷酸或其连续核苷酸序列中的至少50%核苷间键是硫代磷酸酯,如寡核苷酸或其连续核苷酸序列中的至少60%、如至少70%、如至少80或如至少90%核苷间键是硫代磷酸酯。在一些实施方案中,寡核苷酸或其连续核苷酸序列的全部核苷间键均是硫代磷酸酯。
[0054]
在一些实施方案中,寡核苷酸包含一个或多个中性核苷间键、尤其选自磷酸三酯、甲基膦酸酯、mmi、酰胺-3、甲缩醛(formacetal)或硫代甲缩醛的核苷间键。
[0055]
其他的核苷间键在wo2009/124238公开(所述文献通过引用方式并入本文)。在一个实施方案中,核苷间键选自在wo2007/031091中公开的接头(所述文献通过引用方式并入本文)。特别地,核苷间键可以选自-o-p(o)
2-o-、-o-p(o,s)-o-、-o-p(s)
2-o-、-s-p(o)
2-o-、-s-p(o,s)-o-、-s-p(s)
2-o-、-o-p(o)
2-s-、-o-p(o,s)-s-、-s-p(o)
2-s-、-o-po(rh)-o-、0-po(och3)-0-、-o-po(nrh)-o-、-o-po(och2ch2s-r)-o-、-o-po(bh3)-o-、-o-po(nhrh)-o-、-o-p(o)
2-nr
h-、-nr
h-p(o)
2-o-、-nr
h-co-o-、-nr
h-co-nr
h-,和/或核苷间接头可以选自-o-co-o-、-o-co-nr
h-、-nr
h-co-ch
2-、-o-ch
2-co-nr
h-、-o-ch
2-ch
2-nr
h-、-co-nr
h-ch
2-、-ch
2-nrhco-、-o-ch
2-ch
2-s-、-s-ch
2-ch
2-o-、-s-ch
2-ch
2-s-、-ch
2-so
2-ch
2-、-ch
2-co-nr
h-、-o-ch
2-ch
2-nr
h-co-、-ch
2-nch
3-o-ch
2-,其中rh选自氢和c
1-4
烷基。
[0056]
抗核酸酶键如硫代磷酸酯键特别可用于与靶核酸(如缺口聚物的区域g或头聚物和尾聚物的未修饰核苷区域)形成双链体时能够召集核酸酶的寡核苷酸区域中。然而,硫代磷酸酯键还可以可用于无核酸酶召集作用的区域和/或增强亲和力的区域(如缺口聚物的区域f和f’或头聚物和尾聚物的经修饰核苷区域)中。
[0057]
然而每个设计区域可以包含除硫代磷酸酯之外的核苷间键,如磷酸二酯键,尤其在修饰的核苷(如lna)保护该键对抗核酸酶降解的区域中。纳入磷酸二酯键、尤其在修饰的核苷单位之间或与之毗邻(一般在无核酸酶召集作用的区域中)纳入,如一个或两个键,可以调节寡核苷酸的生物利用率和/或生物分布
–
参见通过引用方式并入本文的wo2008/113832。
[0058]
在一个实施方案中,寡核苷酸中的全部核苷间键均是硫代磷酸酯和/或硼烷磷酸酯键。优选地,寡核苷酸中的全部核苷间键均是硫代磷酸酯键。
[0059]
核碱基
[0060]
术语核碱基包括在核苷和核苷酸中的在核酸杂交中形成氢键的嘌呤部分(例如腺嘌呤和鸟嘌呤)和嘧啶部分(例如尿嘧啶、胸腺嘧啶和胞嘧啶)。在本发明的上下文中,术语核碱基还涵盖可以与天然存在的核碱基不同、但在核酸杂交期间有功能的修饰的核碱基。
在这种情况下,“核碱基”指天然存在的核碱基如腺嘌呤、鸟嘌呤、胞嘧啶、胸苷、尿嘧啶、黄嘌呤和次黄嘌呤,以及非天然存在的变体。这类变体例如在hirao等人(2012)accounts of chemical research vol 45,第2055页和bergstrom(2009)current protocols in nucleic acid chemistry suppl.37 1.4.1中描述。
[0061]
在一些实施方案中,通过以下方式修饰核碱基部分:将嘌呤或嘧啶变更成修饰的嘌呤或嘧啶,如取代的嘌呤或取代的嘧啶,如选自异胞嘧啶、假异胞嘧啶、5-甲基胞嘧啶、5-噻唑-胞嘧啶(5-thiozolo-cytosine)、5-炔丙基-胞嘧啶、5-炔丙基-尿嘧啶、5-溴尿嘧啶、5-噻唑-尿嘧啶、2-硫代-尿嘧啶、2’硫代-胸腺嘧啶、肌苷、二氨基嘌呤、6-氨基嘌呤、2-氨基嘌呤、2,6-二氨基嘌呤和2-氯-6-氨基嘌呤的核碱基。
[0062]
核碱基部分可以借助每相应核碱基的字母代码(例如a、t、g、c或u)指示,其中每种字母可以任选地包括功能等同的修饰的核碱基。例如,在例举的寡核苷酸中,核碱基部分选自a、t、g、c和5-甲基胞嘧啶。任选地,对于lna缺口聚物,可以使用5-甲基胞嘧啶lna核苷。
[0063]
修饰的寡核苷酸
[0064]
术语修饰的寡核苷酸描述了包含一个或多个糖修饰的核苷和/或修饰的核苷间键的寡核苷酸。术语嵌合“寡核苷酸”是已经在文献中用来描述具有修饰的核苷的寡核苷酸的术语。
[0065]
互补性
[0066]
术语“互补性”描述核苷/核苷酸的watson-crick碱基配对能力。watson-crick碱基对是鸟嘌呤(g)-胞嘧啶(c)和腺嘌呤(a)-胸腺嘧啶(t)/尿嘧啶(u)。应当理解,寡核苷酸可以包含具有修饰的核碱基的核苷,例如经常使用5-甲基胞嘧啶替代胞嘧啶,并且从而术语互补性涵盖未修饰的核碱基和修饰的核碱基之间的watson crick碱基配对(参见例如hirao等人(2012)accounts of chemical research vol 45,第2055页和bergstrom(2009)current protocols in nucleic acid chemistry suppl.37 1.4.1)。
[0067]
如本文所用,术语“%互补的”指核酸分子(例如寡核苷酸)中连续核苷酸序列以百分数计的如此核苷酸的数目,其中在给定位置,所述核苷酸与独立核酸分子(例如靶核酸)在给定位置处的连续核苷酸序列互补(即与之形成watson crick碱基对)。通过以下方式计算该百分数:(与靶序列5
’‑3’
和寡核苷酸序列从3
’‑5’
对齐时)计数两个序列之间形成配对的对齐碱基的数目,除以寡核苷酸中核苷酸的总数并乘以100。在这种比较中,未对齐(形成碱基对)的核碱基/核苷酸称作错配。
[0068]
术语“完全互补的”指100%互补性。
[0069]
以下是与靶核酸(seq id no:772)完全互补的寡核苷酸(seq id no:5)的例子。
[0070]5’
gcagtagagccaatta3’(seq id no:772)
[0071]3’
cgtcatctcggttaat5’(seq id no:5)
[0072]
同一性
[0073]
如本文所用,术语“同一性”指核酸分子(例如寡核苷酸)中连续核苷酸序列以百分数计的如此核苷酸的数目,其中在给定位置,所述核苷酸与独立核酸分子(例如靶核酸)在给定位置处的连续核苷酸序列(即在其与互补性核苷形成watson crick碱基对的能力方面)相同。通过以下方式计算该百分数:计数两个序列之间相同的对齐碱基(包括缺口)的数目,除以寡核苷酸中核苷酸的总数并乘以100。同一性百分数=(匹配x100)/比对区域(连同
缺口)的长度。
[0074]
杂交
[0075]
如本文所用,术语“杂交着”或“杂交”将理解为两条核酸链(例如寡核苷酸和靶核酸)在相对链上的碱基对之间形成氢键,因而形成双链体。两条核酸链之间结合作用的亲和力是杂交的强度。它经常用术语解链温度(tm)描述,解链温度定义为半数寡核苷酸与靶核酸形成双链体的温度。在生理条件下,tm不与亲和力严格成正比(mergny和lacroix,2003,oligonucleotides 13:515
–
537)。标准状态gibbs自由能δg
°
是结合亲和力的更精确表述并且与反应的解离常数(kd)相关,为δg
°
=-rtln(kd),其中r是气体常数并且t是绝对温度。因此,寡核苷酸和靶核酸之间反应的很低δg
°
反映了寡核苷酸和靶核酸之间强力杂交。δg
°
是与水性浓度为1m、ph是7和温度是37℃的反应相关的能量。寡核苷酸与靶核酸杂交是自发反应并且对于自发反应,δg
°
小于零。例如,通过利用如hansen等人,1965,chem.comm.36
–
38和holdgate等人,2005,drug discov today中所述的等温滴定量热法(itc)法,可以实验测量δg
°
。本领域普通技术人员将知道商业设备可用于测量δg
°
。也可以通过使用如santalucia,1998,proc natl acad sci usa.95:1460
–
1465所述的最近相邻模型,适当使用sugimoto等人,1995,biochemistry 34:11211
–
11216和mctigue等人,2004,biochemistry 43:5388
–
5405描述的热动力参数,以数值方式估计δg
°
。为了获得通过杂交调节其预期核酸靶的可能性,本发明的寡核苷酸与靶核酸以针对长度10-30个核苷酸的寡核苷酸的低于-10kcal的δg
°
估计值杂交。在一些实施方案中,依据标准状态gibbs自由能δg
°
测量杂交的程度或强度。寡核苷酸可以与靶核酸以针对长度8-30个核苷酸的寡核苷酸的低于10kcal、如低于-15kcal、如低于-20kcal和如低于-25kcal的δg
°
估计值杂交。在一些实施方案中,寡核苷酸与靶核酸以-10至-60kcal、如-12至-40kcal、如-15至-30kcal或-16至-27kcal如-18至-25kcal的δg
°
估计值杂交。
[0076]
靶核酸
[0077]
根据本发明,靶核酸是编码哺乳动物pd-l1的核酸并且可以例如是基因、rna、mrna和前mrna、成熟mrna或cdna序列。靶因此可以称作pd-l1靶核酸。本发明的寡核苷酸可以例如靶向哺乳动物pd-l1的外显子区,或可以例如靶向pd-l1前mrna中的内含子区(参见表1)。
[0078]
表1:人pd-l1外显子和内含子
[0079][0080]
适当地,靶核酸编码pd-l1蛋白,尤其哺乳动物pd-l1,如人pd-l1(参见例如表2和表3,所述表提供人、猴和小鼠pd-l1的mrna和前mrna序列的参考)。在本发明的上下文中,前
mrna也视为编码蛋白质的核酸。
[0081]
在一些实施方案中,靶核酸选自seq id no:1、2和3或其天然存在变体(例如编码哺乳动物pd-l1蛋白的序列)。
[0082]
如果在研究或诊断中使用本发明的寡核苷酸,则靶核酸可以是衍生自dna或rna的cdna或合成性核酸。
[0083]
对于体内或体外应用,本发明的寡核苷酸一般能够抑制表达pd-l1靶核酸的细胞中pd-l1靶核酸的表达。本发明的寡核苷酸的连续核碱基序列一般与pd-l1靶核酸互补,如跨寡核苷酸长度所测量,任选地例外是一个或两个错配,并且任选地不包括基于核苷酸的接头区域,所述接头区域可以将寡核苷酸连接至任选的官能团(如缀合物)或其他非互补性末端核苷酸(例如区域d’或d”)。在一些实施方案中,靶核酸可以是rna或dna,如信使rna,如成熟mrna或前mrna。在一些实施方案中,靶核酸是编码哺乳动物pd-l1蛋白(如人pd-l1)的rna或dna,例如人pd-l1前mrna序列,如作为seq id no:1公开的序列或ncbi参考编号nm_014143的人mrna序列。表2和表3中提供关于示例性靶核酸的额外信息。
[0084]
表2:跨物种pd-l1的基因组和装配信息。
[0085][0086]
fwd=正义链。基因组坐标提供前mrna序列(基因组序列)。ncbi参考序列提供mrna序列(cdna序列)。
[0087]
*美国国家生物技术信息中心参考序列数据库是综合性、一体化、非冗余、充分注释的参考序列集合,包括基因组、转录物和蛋白质。它托管于www.ncbi.nlm.nih.gov/refseq。
[0088]
表3:跨物种pd-l1的序列详情。
[0089][0090][0091]
靶序列如本文所用的术语“靶序列”指靶核酸中存在的核苷酸序列,所述核苷酸序列包含与本发明的寡核苷酸互补的核碱基序列。在一些实施方案中,靶序列由靶核酸上与本发明的寡核苷酸的连续核苷酸序列互补的区域组成。在一些实施方案中,靶序列长于单个寡核苷酸的互补序列,并且例如可以代表可以被本发明的几种寡核苷酸靶向的靶核酸优
选区域。
[0092]
靶序列可以是靶核酸的子序列。
[0093]
在一些实施方案中,子序列是选自a1-a149的序列(参见表4)。在一些实施方案中,子序列是选自人pd-l1 mrna外显子如选自e1、e2、e3、e4、e5、e6和e7的人pd-l1 mrna外显子的序列(参见上表1)。
[0094]
在一些实施方案中,子序列是选自人pd-l1 mrna内含子如选自i1、i2、i3、i4、i5和i6的人pd-l1 mrna内含子的序列(参见上表1)。
[0095]
本发明的寡核苷酸包含与靶核酸如靶核酸的子序列(如本文所述的靶序列)互补或杂交的连续核苷酸序列。
[0096]
寡核苷酸包含与靶核酸分子中存在的靶序列互补或杂交的含至少8个核苷酸的连续核苷酸序列。连续核苷酸序列(并因此为靶序列)包含至少8个连续核苷酸,如9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个连续核苷酸,如12-25个,如14-18个连续核苷酸。
[0097]
靶细胞
[0098]
如本文所用的术语“靶细胞”指表达靶核酸的细胞。在一些实施方案中,靶细胞可以是在体内或体外。在一些实施方案中,靶细胞是哺乳动物细胞如啮齿类细胞,如小鼠细胞或大鼠细胞、或灵长类细胞如猴细胞或人细胞。
[0099]
在优选的实施方案中,靶细胞表达pd-l1 mrna,如pd-l1前mrna或pd-l1成熟mrna。一般反义寡核苷酸靶向作用忽略pd-l1 mrna的聚a尾。
[0100]
天然存在的变体
[0101]
术语“天然存在的变体”指pd-l1基因或转录物的变体,它们源自与靶核酸相同的基因座,但是可以例如因造成多个密码子编码相同氨基酸的遗传密码简并性或因前mrna的可变剪接或多态性(如单核苷酸多态性)和等位变体的存在而差异。基于存在与寡核苷酸足够互补的序列,本发明的寡核苷酸因此可以靶向靶核酸及其天然存在的变体。
[0102]
在一些实施方案中,天然存在的变体与哺乳动物pd-l1靶核酸(如选自seq id no:1、2和3的靶核酸)具有至少95%如至少98%或至少99%同源性。
[0103]
在pd-l1基因中已知众多的单核苷酸多态性,例如下表中公开的那些(人前mrna起始/参考序列是seq id no:2)
[0104]
[0105][0106]
对表达的调节
[0107]
如本文所用的术语“对表达的调节”将理解为针对与施用寡核苷酸前pd-l1的数量相比时,寡核苷酸改变pd-l1数量的能力的总体术语。备选地,可以通过参考对照实验确定对表达的调节。通常理解,对照是用盐水组合物处理的个体或靶细胞或用非靶向性寡核苷酸(模拟)处理的个体或靶细胞。然而它还可以是用标准护理处理的个体。
[0108]
一个类型的调节作用是寡核苷酸例如通过降解mrna或阻断转录来抑制、下调、减少、阻抑、移除、停止、阻断、阻止、减弱、降低、避免或终止pd-l1表达的能力。另一个类型的调节作用是寡核苷酸例如通过修复剪接位点或阻止剪接过程或移除或阻断抑制性机制如微rna阻抑作用而恢复、增加或增强pd-l1表达的能力。
[0109]
高亲和力修饰的核苷
[0110]
高亲和力修饰的核苷是当并入寡核苷酸中时,增强寡核苷酸对互补靶的亲和力(例如如通过解链温度(tm)所测量)的修饰的核苷酸。本发明的高亲和力修饰的核苷优选地导致解链温度增幅为每个修饰的核苷 0.5至 12℃之间、更优选地在 1.5至 10℃之间并且
最优选地 3至 8℃之间。众多高亲和力修饰的核苷是本领域已知的并且例如包括许多2’取代的核苷以及锁核酸(lna)(参见,例如freier和altmann;nucl.acid res.,1997,25,4429-4443和uhlmann;curr.opinion in drug development,2000,3(2),293-213)。
[0111]
糖修饰
[0112]
与dna和rna中存在的核糖糖部分相比时,本发明的寡聚体可以包含一个或多个具有修饰的糖部分(即糖部分修饰)的核苷。
[0113]
已经产生了众多具有核糖糖部分修饰的核苷,主要目的在于改善寡核苷酸的某些特性,如亲和力和/或核酸酶抗性。
[0114]
这类修饰包括这样的修饰,其中例如通过用以下进行置换而修饰核糖环结构:己糖环(hna)或一般在核糖环上c2和c4碳之间具有双基桥的双环状环(lna)或一般在c2碳和c3碳之间缺少键的非连接核糖环(例如una)。糖修饰的其他核苷例如包括双环己糖核酸(wo2011/017521)或三环核酸(wo2013/154798)。修饰的核苷还包括其中糖部分由非糖部分置换的核苷,例如在肽核酸(pna)或吗啉代核酸的情况下。
[0115]
糖修饰还包括通过将核糖环上的取代基变成氢之外的基团或dna核苷和对rna核苷中天然存在的2
’‑
oh基团所做出的修饰。可以例如在2’、3’、4’或5’位置引入取代基。具有修饰的糖部分的核苷还包括2’修饰的核苷,如2’取代的核苷。实际上,多数注意力已经投入开发2’取代的核苷,并且已经发现众多2’取代的核苷在并入寡核苷酸中时具有有益的特性,如核苷抗性增强和亲和力增强。
[0116]2’
修饰的核苷
[0117]2’
糖修饰的核苷是在2’位置具有除h或
–
oh之外取代基的核苷(2’取代的核苷)或包含2’连接的双基,并且包括2’取代的核苷和lna(2
’–4’
双基桥接的)核苷。例如,2’修饰的糖可以向寡核苷酸提供增强的结合亲和力和/或增加的核酸酶抗性。2’取代的修饰的核苷例子是2
’‑
o-烷基-rna、2'-o-甲基-rna、2
’‑
烷氧基-rna、2
’‑
o-甲氧乙基-rna(moe)、2
’‑
氨基-dna、2'-氟-rna和2
’‑
f-ana核苷。对于其他例子,请参见例如freier和altmann;nucl.acid res.,1997,25,4429-4443和uhlmann;curr.opinion in drug development,2000,3(2),293-213及deleavey和damha,chemistry and biology 2012,19,937。下文展示了一些2’取代的修饰的核苷。
[0118][0119]
锁核酸核苷(lna)
[0120]“lna核苷”是在核苷酸的c2’和c4’核糖糖环之间包含接头基团(称作双基或桥)的修饰的核苷。在文献中这些核苷也称作桥接核酸或双环核酸(bna)。
[0121]
在一些实施方案中,本发明寡聚体的修饰的核苷或lna核苷具有式i或ii的一般结构:
[0122][0123]
其中w选自-o-、-s-、-n(ra)-、-c(rarb)-,如在一些实施方案中
–
o-;
[0124]
b指核碱基或修饰的核碱基部分;
[0125]
z指至相邻核苷的核苷间键或5'末端基团;
[0126]
z*指至相邻核苷的核苷间键或3'末端基团;
[0127]
x指选自-c(rarb)-、-c(ra)=c(rb)-、-c(ra)=n-、-o-、-si(ra)
2-、-s-、-so
2-、-n(ra)-和》c=z的基团。
[0128]
在一些实施方案中,x选自:
–
o-、-s-、nh-、nrarb、-ch
2-、crarb、-c(=ch2)-和-c(=crarb)-。
[0129]
在一些实施方案中,x是-o-。
[0130]
y指选自-c(rarb)-、-c(ra)=c(rb)-、-c(ra)=n-、-o-、-si(ra)
2-、-s-、-so
2-、-n(ra)-和》c=z的基团。
[0131]
在一些实施方案中,y选自:
–
ch
2-、-c(rarb)-、
–
ch2ch
2-、-c(rarb)-c(rarb)-、
–
ch2ch2ch
2-、-c(rarb)c(rarb)c(rarb)-、-c(ra)=c(rb)-和-c(ra)=n-。
[0132]
在一些实施方案中,y选自:-ch
2-、-chr
a-、-chch
3-、crar
b-,
[0133]
或者-x-y-共同指双价接头基团(也称作原子团),共同指由1个、2个、3个或4个选自-c(rarb)-、-c(ra)=c(rb)-、-c(ra)=n-、-o-、-si(ra)
2-、-s-、-so
2-、-n(ra)-和》c=z的基团/原子组成的双价接头基团。
[0134]
在一些实施方案中,-x-y-指双基,所述双基选自:-x-ch
2-、-x-crar
b-、-x-chr
a-、-x-c(hch3)-、-o-y-、-o-ch
2-、-s-ch
2-、-nh-ch
2-、-o-chch
3-、-ch
2-o-ch2、-o-ch(ch3ch3)-、-o-ch
2-ch
2-、och
2-ch
2-ch
2-,-o-ch2och
2-、-o-nch
2-、-c(=ch2)-ch
2-、-nr
a-ch
2-、n-o-ch2、-s-crar
b-和-s-chr
a-。
[0135]
在一些实施方案中,
–
x-y-指
–
o-ch
2-或
–
o-ch(ch3)-,
[0136]
其中z选自-o-、-s-和-n(ra)-[0137]
并且ra和当存在rb时,各自独立地选自氢、任选取代的c
1-6-烷基、任选取代的c
2-6-链烯基、任选取代的c
2-6-炔基、羟基、任选取代的c
1-6-烷氧基、c
2-6-烷氧烷基、c
2-6-链烯氧基、羧基、c
1-6-烷氧羰基、c
1-6-烷基羰基、甲酰基、芳基、芳氧基-羰基、芳氧基、芳基羰基、杂芳基、杂芳氧基-羰基、杂芳氧基、杂芳基羰基、氨基、单和双(c
1-6-烷基)氨基、氨甲酰基、单和双(c
1-6-烷基)氨基-羰基、氨基-c
1-6-烷基-氨羰基、单和双(c
1-6-烷基)氨基-c
1-6-烷基-氨羰基、c
1-6-烷基-羰氨基、脲基、c
1-6-烷酰氧基、砜基(sulphono)、c
1-6-烷基磺酰氧基、硝基、叠氮基、硫烷基、c
1-6-烷硫基、卤素,其中芳基和杂芳基可以是任选取代的并且其中二个孪位取代基ra和rb一起可以指任选取代的亚甲基(=ch2),其中全部手性中心、非对称基团可以按r或s取向存在,
[0138]
其中r1、r2、r3、r5和r
5*
独立地选自:氢、任选取代的c
1-6-烷基、任选取代的c
2-6-链烯基、任选取代的c
2-6-炔基、羟基、c
1-6-烷氧基、c
2-6-烷氧烷基、c
2-6-链烯氧基、羧基、c
1-6-烷氧羰基、c
1-6-烷基羰基、甲酰基、芳基、芳氧基-羰基、芳氧基、芳基羰基、杂芳基、杂芳氧基-羰基、杂芳氧基、杂芳基羰基、氨基、单和双(c
1-6-烷基)氨基、氨甲酰基、单和双(c
1-6-烷基)氨基-羰基、氨基-c
1-6-烷基-氨羰基、单和双(c
1-6-烷基)氨基-c
1-6-烷基-氨羰基、c
1-6-烷基-羰氨基、脲基、c
1-6-烷酰氧基、砜基(sulphono)、c
1-6-烷基磺酰氧基、硝基、叠氮基、硫烷基、c
1-6-烷硫基、卤素,其中芳基和杂芳基可以是任选取代的并且其中二个孪位取代基一起可以指氧代、硫代、亚胺基或任选取代的亚甲基。
[0139]
在一些实施方案中,r1、r2、r3、r5和r
5*
独立选自c
1-6
烷基(如甲基)和氢。
[0140]
在一些实施方案中,r1、r2、r3、r5和r
5*
均是氢。
[0141]
在一些实施方案中,r1、r2、r3均是氢并且r5和r
5*
之一也是氢并且r5和r
5*
的另一个是除氢之外,如c
1-6
烷基如甲基。
[0142]
在一些实施方案中,ra是氢或甲基。在一些实施方案中,当存在时,rb是氢或甲基。
[0143]
在一些实施方案中,ra和rb一者或二者是氢。
[0144]
在一些实施方案中,ra和rb之一是氢并且另一个是除氢之外。
[0145]
在一些实施方案中,ra和rb之一是甲基并且另一个是氢。
[0146]
在一些实施方案中,ra和rb均是甲基。
[0147]
在一些实施方案中,双基
–
x-y-是
–
o-ch
2-,w是o并且r1、r2、r3、r5和r
5*
全部均是氢。
这类lna核苷在wo99/014226、wo00/66604、wo98/039352和wo2004/046160中公开,所述文献均因而通过引用的方式并入,并且包括所通称的β-d-氧基lna和α-l-氧基lna核苷。
[0148]
在一些实施方案中,双基
–
x-y-是
–
s-ch
2-,w是o并且r1、r2、r3、r5和r
5*
全部均是氢。这类硫代lna核苷在wo99/014226和wo2004/046160中公开,所述文献因而通过引用的方式并入。
[0149]
在一些实施方案中,双基
–
x-y-是
–
nh-ch
2-,w是o并且r1、r2、r3、r5和r
5*
全部均是氢。这类氨基lna核苷在wo99/014226和wo2004/046160中公开,所述文献因而通过引用的方式并入。
[0150]
在一些实施方案中,双基
–
x-y-是
–
o-ch
2-ch
2-或
–
o-ch
2-ch
2-ch
2-,w是o并且r1、r2、r3、r5和r
5*
全部均是氢。这类lna核苷在wo00/047599和morita等人,bioorganic&med.chem.lett.12 73-76中公开,所述文献均因而通过引用的方式并入,并且包括所通称的2
’‑
o-4’c-乙烯桥接核酸(ena)。
[0151]
在一些实施方案中,双基
–
x-y-是
–
o-ch
2-,w是o,且r1、r2、r3全部和r5和r5*之一是氢并且r5和r5*的另一个是除氢之外如c
1-6
烷基,如甲基。这类5’取代的lna核苷在wo2007/134181中公开,所述文献因而通过引用的方式并入。
[0152]
在一些实施方案中,双基
–
x-y-是
–
o-crar
b-,其中ra和rb中一者或二者是除氢之外如甲基,w是o,且r1、r2、r3全部和r5和r5*之一是氢并且r5和r5*的另一个是除氢之外如c
1-6
烷基,如甲基。这类双修饰的lna核苷在wo2010/077578中公开,所述文献因而通过引用的方式并入。
[0153]
在一些实施方案中,双基
–
x-y-指双价接头基团
–
o-ch(ch2och3)-(2’o-甲氧乙基双环核酸-seth等人,2010,j.org.chem.vol 75(5)第1569-81页)。在一些实施方案中,双基
–
x-y-指双价接头基团
–
o-ch(ch2ch3)-(2’o-乙基双环核酸-seth等人,2010,j.org.chem.vol 75(5)第1569-81页)。在一些实施方案中,双基
–
x-y-是
–
o-chr
a-,w是o并且r1、r2、r3、r5和r
5*
全部均是氢。这类6’取代的lna核苷在wo10036698和wo07090071中公开,所述文献均因而通过引用的方式并入。
[0154]
在一些实施方案中,双基
–
x-y-是
–
o-ch(ch2och3)-,w是o并且r1、r2、r3、r5和r
5*
全部均是氢。这类lna核苷在本领域中也称作环状的moe(cmoe)并在wo07090071中公开。
[0155]
在一些实施方案中,双基
–
x-y-指处于r构型或s构型的双价接头基团
–
o-ch(ch3)-。在一些实施方案中,双基
–
x-y-一起指双价接头基团
–
o-ch
2-o-ch
2-(seth等人,2010,j.org.chem)。在一些实施方案中,双基
–
x-y-是
–
o-ch(ch3)-,w是o并且r1、r2、r3、r5和r
5*
全部均是氢。这类6’甲基lna核苷在本领域也称作cet核苷并且可以是(s)cet或(r)cet立体异构体,如wo07090071(β-d)和wo2010/036698(α-l)中公开,所述文献均因而通过引用的方式并入。
[0156]
在一些实施方案中,双基
–
x-y-是
–
o-crar
b-,其中ra或rb均不是氢,w是o并且r1、r2、r3、r5和r
5*
全部均是氢。在一些实施方案中,ra和rb均是甲基。这类6’双取代的lna核苷在wo 2009006478中公开,所述文献因而通过引用的方式并入。
[0157]
在一些实施方案中,双基
–
x-y-是
–
s-chr
a-,w是o并且r1、r2、r3、r5和r
5*
全部均是氢。这类6’取代的硫代lna核苷在wo11156202中公开,所述文献因而通过引用的方式并入。在一些6’取代的硫代lna实施方案中,ra是甲基。
[0158]
在一些实施方案中,双基
–
x-y-是
–
c(=ch2)-c(rarb)-,如
–
c(=ch2)-ch
2-或
–
c(=ch2)-ch(ch3)-,w是o并且r1、r2、r3、r5和r
5*
全部均是氢。这类乙烯基羰lna核苷在wo08154401和wo09067647中公开,所述文献均因而通过引用的方式并入。
[0159]
在一些实施方案中,双基
–
x-y-是
–
n(-ora)-,w是o并且r1、r2、r3、r5和r
5*
全部均是氢。在一些实施方案中,ra是c
1-6
烷基如甲基。这类lna核苷也称作n取代的lna并且在wo2008/150729中公开,所述文献因而通过引用的方式并入。在一些实施方案中,双基
–
x-y-一起指双价接头基团
–
o-nr
a-ch
3-(seth等人,2010,j.org.chem)。在一些实施方案中,双基
–
x-y-是
–
n(ra)-,w是o并且r1、r2、r3、r5和r
5*
全部均是氢。在一些实施方案中,ra是c
1-6
烷基如甲基。
[0160]
在一些实施方案中,r5和r5*中一者或二者是氢并且当取代时,r5和r5*的另一个是c
1-6
烷基如甲基。在这个实施方案中,r1、r2、r3可以全部是氢并且双基
–
x-y-可以选自
–
o-ch
2-或
–
o-c(hcra)-如
–
o-c(hch3)-。
[0161]
在一些实施方案中,双基是
–
crar
b-o-crar
b-,如ch
2-o-ch
2-,w是o并且r1、r2、r3、r5和r
5*
全部均是氢。在一些实施方案中,ra是c
1-6
烷基如甲基。这类lna核苷也称作构象限制的核苷酸(crn)并且在wo2013036868中公开,所述文献因而通过引用的方式并入。
[0162]
在一些实施方案中,双基是
–
o-crar
b-o-crar
b-,如o-ch
2-o-ch
2-,w是o并且r1、r2、r3、r5和r
5*
全部均是氢。在一些实施方案中,ra是c
1-6
烷基如甲基。这类lna核苷也称作coc核苷酸并且在mitsuok等人,nucleic acids research 2009 37(4),1225-1238中公开,所述文献因而通过引用的方式并入。
[0163]
将认识到,除非具体说明,否则lna核苷可以处于β-d或α-l立体同工型。
[0164]
方案1中展示lna核苷的某些例子。
[0165]
方案1
[0166][0167]
如例子中所示,在本发明的一些实施方案中,寡核苷酸中的lna核苷是β-d-氧基-lna核苷。
[0168]
核酸酶介导的降解
[0169]
核酸酶介导的降解涉及这样的寡核苷酸,其与互补性核苷酸序列形成双链体时,能够介导互补性核苷酸序列降解。
[0170]
在一些实施方案中,寡核苷酸可以借助核酸酶介导的靶核酸降解过程发挥作用,其中本发明的寡核苷酸能够召集核酸酶、尤其核酸内切酶、优选地核糖核酸内切酶(rna酶),如rna酶h。通过核酸酶介导的机制发挥作用的寡核苷酸设计的例子是一般包含具有至少5个或6个dna核苷的区域并且在一侧或两侧旁侧分布有增强亲和力的核苷的寡核苷酸,例如缺口聚物、头聚物(headmers)和尾聚物(tailmers)。
[0171]
rna酶h活性和召集
[0172]
反义寡核苷酸的rna酶h活性指反义寡核苷酸与互补性rna分子形成双链体时召集rna酶h的能力。wo01/23613提供用于确定rna酶h活性的体外方法,所述方法可以用来确定召集rna酶h的能力。如果以下情况出现,则一般认定寡聚体能够召集rna酶h:向rna酶h提供互补性靶核酸序列时,其具有如以pmol/l/分钟计量的如此初始速率,所述初始速率是使用
下述寡核苷酸并使用wo01/23613的实施例91-95(所述文献因而通过引用的方式并入)提供的方法所确定的初始速率的至少5%如至少10%或超过20%,其中所述寡核苷酸具有与受检的修饰寡核苷酸相同的碱基序列,但仅含有dna单体,同时寡核苷酸的全部单体之间均为硫代磷酸酯键。
[0173]
缺口聚物
[0174]
如本文所用的术语缺口聚物指反义寡核苷酸,其包含召集rna酶h的寡核苷酸(缺口)的区域,所述区域在5’和3’旁侧分布有包含一个或多个增强亲和力的修饰的核苷的区域(侧翼或翼部)。本文中描述了多种缺口聚物设计并且其特征在于它们召集rna酶h的能力。头聚物和尾聚物是其中一个侧翼丢失的能够召集rna酶h的寡核苷酸,即仅寡核苷酸的一个末端包含增强亲和力的修饰的核苷。对于头聚物,3’侧翼丢失(即5’侧翼包含增强亲和力的修饰的核苷)并且对于尾聚物,5’侧翼丢失(即3’侧翼包含增强亲和力的修饰的核苷)。
[0175]
lna缺口聚物
[0176]
术语lna缺口聚物是指增强亲和力的修饰的核苷至少之一是lna核苷的缺口聚物寡核苷酸。
[0177]
混合型翼部缺口聚物
[0178]
术语混合型翼部缺口聚物或混合型侧翼缺口聚物指这样的lna缺口聚物,其中侧翼区域至少之一包含至少一个lna核苷和至少一个非lna修饰的核苷,如至少一个2’取代的修饰的核苷,例如,2
’‑
o-烷基-rna、2'-o-甲基-rna、2
’‑
烷氧基-rna、2
’‑
o-甲氧乙基-rna(moe)、2
’‑
氨基-dna、2'-氟-rna和2
’‑
f-ana核苷。在一些实施方案中,混合型翼部缺口聚物具有一个仅包含lna核苷(例如5’或3’)的侧翼并且另一个侧翼(各自3’或5’)包含2’取代的修饰的核苷和任选地lna核苷。
[0179]
缺口破坏者
[0180]
相对于缺口聚物来使用术语“缺口破坏寡核苷酸”,所述缺口聚物在即便缺口区域受到无rna酶h召集作用的核苷(缺口破坏核苷,e)破坏,从而缺口区域包含不到5个连续dna核苷时,仍能够维持rna酶h召集作用。无rna酶h召集作用的核苷例如是处于3’内切构象的核苷,如lna,其核苷的c2’和c4’核糖糖环之间的桥处于β构象,如β-d-氧基lna或scet核苷。缺口破坏寡核苷酸召集rna酶h的能力一般具有序列特异性或甚至化合物特异性
–
参见rukov等人.2015nucl.acids res.vol.43第8476-8487页,所述文献公开了在一些情况下提供更特异的靶rna切割作用的召集rna酶h的“缺口破坏者”寡核苷酸。
[0181]
在一些实施方案中,本发明的寡核苷酸是缺口破坏寡核苷酸。在一些实施方案中,缺口破坏寡核苷酸包含5
’‑
侧翼(f)、缺口(g)和3
’‑
侧翼(f’),其中缺口受到无rna酶h召集作用的核苷(缺口破坏核苷,e)破坏,从而缺口含有至少3或4个连续dna核苷。在一些实施方案中,缺口破坏核苷(e)是这样的lna核苷,其中核苷的c2’和c4’核糖糖环之间的桥处于β构象并且位于缺口区域内部,从而lna缺口破坏核苷在5’和3’旁侧分布有至少3个(5’)和3个(3’)或至少3个(5’)和4(3’)或至少4个(5’)和3个(3’)dna核苷,并且其中寡核苷酸能够召集rna酶h。
[0182]
缺口破坏寡核苷酸可以用下式代表:
[0183]
f-g-e-g-f’;尤其f
1-7-g
3-4-e
1-g
3-4-f’1-7
[0184]d’‑
f-g-f’,尤其d’1-3-f
1-7-g
3-4-e
1-g
3-4-f’1-7
[0185]
f-g-f
’‑
d”,尤其f
1-7-g
3-4-e
1-g
3-4-f’1-7-d”1-3
[0186]d’‑
f-g-f
’‑
d”,尤其d’1-3-f
1-7-g
3-4-e
1-g
3-4-f’1-7-d”1-3
[0187]
其中区域d’和d”如章节“缺口聚物设计”中所述。
[0188]
在一些实施方案中,缺口破坏核苷(e)是β-d-氧基lna或scet或方案1中所显示的另一个β-lna核苷。
[0189]
缀合物
[0190]
如本文所用的术语缀合物指与非核苷酸部分(缀合物部分或区域c或第三区域)共价连接的寡核苷酸,也称作寡核苷酸缀合物。
[0191]
本发明的寡核苷酸与一个或多个非核苷酸部分的缀合可以例如通过影响寡核苷酸的活性、细胞分布、细胞摄取或稳定性,改善寡核苷酸的药理学。在一些实施方案中,缀合物部分导引寡核苷酸至肝脏。同时,缀合物起到减少寡核苷酸在非靶细胞类型、组织或器官中活性(例如脱靶活性)或在非靶细胞类型、组织或器官中活性的作用。在本发明的一个实施方案中,与未缀合的寡核苷酸相比时,本发明的寡核苷酸缀合物在靶细胞中显示改善的pd-l1抑制作用。在另一个实施方案中,与未缀合的寡核苷酸相比时,本发明的寡核苷酸缀合物在肝脏和其他器官如脾或肾之间具有改善的细胞分布(即相较于脾或肾,更多的缀合寡核苷酸走向肝脏)。在另一个实施方案中,与未缀合的寡核苷酸相比时,本发明的寡核苷酸缀合物显示寡核苷酸缀合物向肝脏的细胞摄取改善。
[0192]
wo 93/07883和wo2013/033230提供了合适的缀合物部分,所述文献因而通过引用的方式并入。其他的合适缀合物部分是能够与脱唾液酸糖蛋白受体(asgpr)结合的那些。特别地,三价n-乙酰半乳糖胺缀合物部分适于与asgpr结合,参见例如wo 2014/076196、wo 2014/207232和wo 2014/179620(所述文献因而通过引用的方式并入)。缀合物部分实质上是不由核酸组成的反义寡核苷酸缀合物的组成部分。
[0193]
寡核苷酸缀合物和它们的合成也已经在以下文献中报道:manoharan的综合述评,引自antisense drug technology,principles,strategies,and applications,s.t.crooke编著,ch.16,marcel dekker,inc.,2001和manoharan,antisense and nucleic acid drug development,2002,12,103,所述文献的每一篇通过引用方式完整地并入本文。
[0194]
在一个实施方案中,非核苷酸部分(缀合物部分)选自糖、细胞表面受体配体、药物、激素、亲脂物质、聚合物、蛋白质、肽、毒素(例如细菌毒素)、维生素、病毒蛋白(例如衣壳)或其组合。
[0195]
接头
[0196]
键或接头是在两个原子之间借助一个或多个共价键将一个目的化学基团或区段与另一个目的化学基团或区段结合的连接。缀合物部分可以与寡核苷酸直接连接或通过连接部分(例如接头或系链)连接。接头起到的作用是将第三区域例如缀合物部分(区域c)共价连接至第一区域,例如与所述靶核酸(区域a)互补的寡核苷酸或连续核苷酸序列。
[0197]
在本发明的一些实施方案中,本发明的缀合物或寡核苷酸缀合物可以任选地包含位于互补于所述靶核酸(区域a或第一区域)的寡核苷酸或连续核苷酸序列和缀合物部分(区域c或第三区域)之间的接头区(第二区域或区域b和/或区域y)。
[0198]
区域b指生物可切割接头,其包含在哺乳动物身体内部通常遇到的条件或与哺乳动物身体内部遇到的那些条件类似的条件下可切割的生理不稳定键或由其组成。生理不稳
定接头发生化学转化(例如,切割)的条件包括在哺乳动物细胞中存在或与哺乳动物细胞中遇到的那些类似的化学条件如ph、温度、氧化或还原条件或物质以及盐浓度。哺乳动物胞内条件还包括存在哺乳动物细胞中正常出现的酶活性,如来自蛋白酶解酶或水解酶或核酸酶。在一个实施方案中,生物可切割接头易遭s1核酸酶切割。在一个优选实施方案中,核酸酶敏感接头包含1和10个之间的核苷,如1、2、3、4、5、6、7、8、9或10个核苷,更优选地2和6个之间的核苷和最优选地2和4个之间连接的核苷,所述核苷包含至少两个连续磷酸二酯键,如至少3或4或5个连续磷酸二酯键。优选地,核苷是dna或rna。wo 2014/076195中更详细地描述了含有磷酸二酯的生物可切割接头(所述文献因而通过引用的方式并入)。
[0199]
区域y指这样的接头,所述接头不必是生物可切割的,但主要起到以下作用:将缀合物部分(区域c或第三区域)共价连接至与所述靶核酸互补的寡核苷酸或连续核苷酸序列(区域a或第一区域)。区域y接头可以包含重复单位如乙二醇、氨基酸单位或氨基烷基的链结构或低聚物。本发明的寡核苷酸缀合物可以由以下区域元件a-c、a-b-c、a-b-y-c、a-y-b-c或a-y-c构成。在一些实施方案中,接头(区域y)是氨基烷基,如c2
–
c36氨基烷基,例如包括c6至c12氨基烷基。在一个优选实施方案中,接头(区域y)是c6氨基烷基。
[0200]
治疗
[0201]
如本文所用的术语’治疗’指治疗现有疾病(例如本文中提到的疾病或病症)或防止疾病即预防。因此将认识到如本文提到的治疗可以在一些实施方案中是预防性的。
[0202]
恢复针对病原体的免疫应答
[0203]
免疫应答分成天然免疫应答和适应性免疫应答。天然免疫系统提供迅速、但非特异性应答。适应性免疫应答由先天免疫应答激活并且对特定病原体具有高度特异性。一旦病原体衍生的抗原呈递在抗原呈递细胞的表面上,适应性免疫应答的免疫细胞(即t和b淋巴细胞)由其抗原特异性受体活化,导致病原体特异性免疫应答和免疫记忆形成。慢性病毒性感染,如hbv和hcv,与表征为无病毒特异性t细胞应答的t细胞消耗相关。充分研究了t细胞消耗,综述参见例如yi等人2010immunology129,474-481。慢性病毒性感染还与作为天然免疫细胞的nk细胞的功能降低相关。增强病毒免疫应答对清除慢性感染重要。可以通过测量增殖、细胞因子分泌和溶细胞功能,评估t细胞和nk细胞介导的针对病原体的免疫应答恢复(dolina等人.2013molecular therapy-nucleic acids,2e72和本文实施例6)。
[0204]
发明详述
[0205]
本发明涉及反义寡核苷酸及其缀合物和包含它们的药物组合物恢复对抗已经感染动物、尤其人的病原体的免疫应答的用途。本发明的反义寡核苷酸缀合物特别用于对抗已经感染肝脏、尤其肝脏慢性感染如hbv的病原体。缀合物允许寡核苷酸定向分布并防止靶核酸的全身性敲低。
[0206]
本发明的寡核苷酸
[0207]
本发明涉及能够调节pd-l1表达的寡核苷酸。可以通过与编码pd-l1或参与调节pd-l1的靶核酸杂交,实现调节作用。靶核酸可以是哺乳动物pd-l1序列,如选自seq id no:1、seq id no:2和/或seq id no:3的序列。靶核酸可以是从支持pd-l1表达或调节作用的哺乳动物细胞表达的前mrna、mrna或任何rna序列。
[0208]
本发明的寡核苷酸是靶向pd-l1的反义寡核苷酸。
[0209]
在本发明的一个方面,本发明的寡核苷酸与缀合物部分、尤其靶向脱唾液酸糖蛋
白受体的缀合物部分缀合。
[0210]
在一些实施方案中,本发明的反义寡核苷酸能够通过抑制或下调靶,调节靶的表达。优选地,与靶的正常表达水平相比,这种调节作用抑制表达至少20%,更优选地与靶的正常表达水平相比,抑制表达至30%、40%、50%、60%、70%、80%或90%。优选地,当细胞或生物遭受传染因子攻击或用模拟传染因子攻击的物质(例如聚i:c或lps)处理时,与靶的表达水平相比,这种调节作用抑制表达至少20%,更优选地当细胞或生物遭受传染因子攻击或用模拟传染因子攻击的物质(例如聚i:c或lps)处理时,与靶的表达水平相比,抑制表达至30%、40%、50%、60%、70%、80%或90%。在一些实施方案中,体外使用karpas-299或thp1细胞时,本发明的寡核苷酸可以有能力抑制pd-l1 mrna的表达水平至少60%或70%。在一些实施方案中,体外使用karpas-299或thp1细胞时,本发明的化合物可以有能力抑制pd-l1蛋白的表达水平至少50%。适当地,实施例提供了可以用来测量pd-l1 rna的测定法(例如实施例1)。靶调节作用由寡核苷酸的连续核苷酸序列和靶核酸之间的杂交触发。在一些实施方案中,本发明的寡核苷酸包含寡核苷酸和靶核酸之间的错配。即便错配,与靶核酸的杂交仍可能足以显示所需的对pd-l1表达的调节。可以通过增加寡核苷酸中核苷酸的数目和/或增加寡核苷酸序列内部存在的能够提高对靶的结合亲和力的修饰核苷(如2’修饰的核苷,包括lna)的数目,有利地代偿因错配产生的结合亲和力降低。
[0211]
在一些实施方案中,本发明的反义寡核苷酸能够恢复病原体特异性t细胞。在一些实施方案中,与未处理的对照或标准护理处理的对照相比时,本发明的寡核苷酸能够增加病原体特异性t细胞至少40%、50%、60%或70%。在一个实施方案中,与未处理的对照或标准护理处理的对照相比时,本发明的反义寡核苷酸或缀合物能够增加hbv特异性t细胞。适当地,实施例提供了可以用来测量hbv特异性t细胞的测定法(例如t细胞增殖、细胞因子分泌和溶细胞活性)。在另一个实施方案中,与未处理的对照或标准护理处理的对照相比时,本发明的反义寡核苷酸或缀合物能够增加hcv特异性t细胞。在另一个实施方案中,与未处理的对照或标准护理处理的对照相比时,本发明的反义寡核苷酸或缀合物能够增加hdv特异性t细胞。
[0212]
在一些实施方案中,本发明的反义寡核苷酸能够降低动物或人类中的hbsag水平。在一些实施方案中,与处理前水平相比时,本发明的寡核苷酸能够降低hbsag水平至少40%、50%、60%或70%、更优选地至少80%、90%或95%。最优选地,本发明的寡核苷酸能够在hbv感染的动物或人类中实现hbsag的血清转换。
[0213]
本发明的一个方面涉及反义寡核苷酸,其包含与pd-l1靶核酸至少90%互补的10至30个核苷酸长度的连续核苷酸序列。
[0214]
在一些实施方案中,该寡核苷酸包含与靶核酸的区域至少90%互补,如至少91%、如至少92%、如至少93%、如至少94%、如至少95%、如至少96%、如至少97%、如至少98%或100%互补的连续序列。
[0215]
在一个优选实施方案中,本发明的寡核苷酸或其连续核苷酸序列与靶核酸的区域完全互补(100%互补),或在一些实施方案中可以包含寡核苷酸和靶核酸之间的一个或两个错配。
[0216]
在一些实施方案中,寡核苷酸包含与seq id no:1或seq id no:2中存在的靶核酸区域至少90%互补如完全(或100%)互补的10至30个核苷酸长度的连续核苷酸序列。在一
些实施方案中,寡核苷酸序列与seq id no:1和seq id no:2中存在的相应靶核酸区域100%互补。在一些实施方案中,寡核苷酸序列与seq id no:1和seq id no:3中存在的相应靶核酸区域100%互补。
[0217]
在一些实施方案中,寡核苷酸或寡核苷酸缀合物包含与相应靶核酸区域至少90%互补(如100%互补)的10至30个核苷酸长度的连续核苷酸序列,其中连续核苷酸序列与选自seq id no:1上的位置371-3068、5467-12107和15317-19511的靶核酸的子序列互补。在又一个实施方案中,靶核酸的子序列选自seq id no:1上的位置371-510、822-1090、1992-3068、5467-5606、6470-12107、15317-15720、15317-18083、18881-19494和1881-19494。在一个优选实施方案中,靶核酸的子序列选自seq id no:1上的位置7300-7333、8028-8072、9812-9859、11787-11873和15690-15735。
[0218]
在一些实施方案中,寡核苷酸或寡核苷酸缀合物包含与seq id no:1上存在的相应靶核酸区域至少90%互补(如100%互补)的10至30个核苷酸长度的连续核苷酸序列,其中靶核酸区域选自表4中的区域a1至a449。
[0219]
表4:seq id no 1中可以使用本发明的寡核苷酸靶向的区域
[0220]
[0221]
[0222]
[0223]
[0224][0225]
在一些实施方案中,寡核苷酸或连续核苷酸序列与靶核酸的区域互补,其中靶核酸区域选自a7、a26、a43、a119、a142、a159、a160、a163、a169、a178、a179、a180、a189、a201、a202、a204、a214、a221、a224、a226、a243、a254、a258、269、a274、a350、a360、a364、a365、a370、a372、a381、a383、a386、a389、a400、a427、a435和a438。
[0226]
在一个优选实施方案中,寡核苷酸或连续核苷酸序列与靶核酸的区域互补,其中靶核酸区域选自a160、a180、a221、a269和a360。
[0227]
在一些实施方案中,本发明的寡核苷酸包含8至35个核苷酸长度、如9至30、如10至22、如11至20、如12至18、如13至17或14至16个连续核苷酸长度或由其组成。在一个优选实施方案中,寡核苷酸包含16至20个核苷酸长度或由其组成。应当理解本文中给出的任何范围包括范围终点。因此,如果寡核苷酸据称包含10至30个核苷酸,则包括10个和30个核苷酸。
[0228]
在一些实施方案中,连续核苷酸序列包含8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个连续核苷酸长度或由其组成。在一个优选实施方案中,寡核苷酸包含16、17、18、19或20个核苷酸长度或由其组成。
[0229]
在一些实施方案中,寡核苷酸或连续核苷酸序列包含选自表5中所列序列中的序列或由其组成。
[0230]
在一些实施方案中,反义寡核苷酸或连续核苷酸序列包含与选自seq id no:5至743的序列(参见表5中所列的基序序列)具有至少90%同一性、优选地100%同一性的10至30个核苷酸长度或由其组成。
[0231]
在一些实施方案中,反义寡核苷酸或连续核苷酸序列包含与选自seq id no:5至743和771的序列具有至少90%同一性、优选地100%同一性的10至30个核苷酸长度或由其组成。
[0232]
在一些实施方案中,反义寡核苷酸或连续核苷酸序列包含与选自seq id no:6、8、
9、13、41、42、58、77、92、111、128、151、164、166、169、171、222、233、245、246、250、251、252、256、272、273、287、292、303、314、318、320、324、336、342、343、344、345、346、349、359、360、374、408、409、415、417、424、429、430、458、464、466、474、490、493、512、519、519、529、533、534、547、566、567、578、582、601、619、620、636、637、638、640、645、650、651、652、653、658、659、660、665、678、679、680、682、683、684、687、694、706、716、728、733、734和735的序列具有至少90%同一性、优选地100%同一性的10至30个核苷酸长度或由其组成。
[0233]
在一些实施方案中,反义寡核苷酸或连续核苷酸序列包含与seq id no:287具有至少90%同一性、优选地100%同一性的10至30个核苷酸长度或由其组成。
[0234]
在一些实施方案中,反义寡核苷酸或连续核苷酸序列包含与seq id no:342具有至少90%同一性、优选地100%同一性的10至30个核苷酸长度或由其组成。
[0235]
在一些实施方案中,反义寡核苷酸或连续核苷酸序列包含与seq id no:640具有至少90%同一性、优选地100%同一性的10至30个核苷酸长度或由其组成。
[0236]
在一些实施方案中,反义寡核苷酸或连续核苷酸序列包含与seq id no:466具有至少90%同一性、优选地100%同一性的10至30个核苷酸长度或由其组成。
[0237]
在一些实施方案中,反义寡核苷酸或连续核苷酸序列包含与seq id no:566具有至少90%同一性、优选地100%同一性的10至30个核苷酸长度或由其组成。
[0238]
在寡核苷酸长于连续核苷酸序列(其互补于靶核酸)的实施方案中,表5中的基序序列形成本发明反义寡核苷酸的连续核苷酸序列部分。在一些实施方案中,寡核苷酸的序列等同于连续核苷酸序列(例如,如果未添加生物可切割接头)。
[0239]
可以理解,可以修饰连续核碱基序列(基序序列),以例如增加核酸酶抗性和/或对靶核酸的结合亲和力。在定义和“寡核苷酸设计”章节中描述了修饰。表5列出了每个基序序列的优选设计。
[0240]
寡核苷酸设计
[0241]
寡核苷酸设计指寡核苷酸序列中核苷糖修饰的样式。本发明的寡核苷酸包含糖修饰的核苷并且还可以包含dna核苷或rna核苷。在一些实施方案中,寡核苷酸包含糖修饰的核苷和dna核苷。修饰的核苷掺入本发明的寡核苷酸增强了寡核苷酸对靶核酸的亲和力。在这种情况下,修饰的核苷可以称作增强亲和力的修饰的核苷酸,修饰的核苷也可以称作单位。
[0242]
在一个实施方案中,寡核苷酸包含至少1个修饰的核苷,如至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个、至少11个、至少12个、至少13个、至少14个、至少15个或至少16个修饰的核苷。在一个实施方案中,寡核苷酸包含1至10个修饰的核苷,如2至8个修饰的核苷,如3至7个修饰的核苷,如4至6个修饰的核苷,如3、4、5、6或7个修饰的核苷。
[0243]
在一个实施方案中,寡核苷酸包含一个或多个糖修饰的核苷,如2’糖修饰的核苷。优选地,本发明的寡核苷酸包含一个或多个2’糖修饰的核苷,其独立选自2
’‑
o-烷基-rna、2'-o-甲基-rna、2
’‑
烷氧基-rna、2
’‑
o-甲氧乙基-rna、2
’‑
氨基-dna、2'-氟-dna、阿糖核酸(ana)、2'-氟-ana和lna核苷。甚至更优选地,一个或多个修饰的核苷是锁核酸(lna)。
[0244]
在又一个实施方案中,寡核苷酸包含至少一个修饰的核苷间键。在一个优选实施方案中,连续核苷酸序列内部的全部核苷间键均是硫代磷酸酯或硼烷磷酸酯核苷间键。在
一些实施方案中,寡核苷酸的连续序列中的全部核苷酸间键均是硫代磷酸酯键。
[0245]
在一些实施方案中,本发明的寡核苷酸包含至少一个lna核苷,如1、2、3、4、5、6、7或8个lna核苷,如2至6个lna核苷,如3至7个lna核苷,4至6个lna核苷或3、4、5、6或7个lna核苷。在一些实施方案中,寡核苷酸中至少75%的修饰的核苷是lna核苷,如80%、如85%、如90%的修饰的核苷是lna核苷。在又一个实施方案中,寡核苷酸中全部修饰的核苷均是lna核苷。在又一个实施方案中,寡核苷酸可以包含β-d-氧基-lna和以下一种或多种lna核苷:处于β-d构型或α-l构型的硫代-lna、氨基-lna、氧基-lna和/或ena或其组合。在又一个实施方案中,全部lna胞嘧啶单位均是5-甲基-胞嘧啶。在一个优选实施方案中,寡核苷酸或连续核苷酸序列具有至少1个在核苷酸序列5'末端的lna核苷和至少2个在3'末端的lna核苷。
[0246]
在一些实施方案中,本发明的寡核苷酸包含至少一个作为2
’‑
moe-rna核苷的修饰的核苷,如2、3、4、5、6、7、8、9或10个2
’‑
moe-rna核苷。在一些实施方案中,所述修饰的核苷中至少一个是2'-氟dna,如2、3、4、5、6、7、8、9或10个2'-氟-dna核苷。
[0247]
在一些实施方案中,本发明的寡核苷酸包含至少一个lna核苷和至少一个2’取代的修饰的核苷。
[0248]
在本发明的一些实施方案中,寡核苷酸包含2’糖修饰的核苷和dna单位。优选地,寡核苷酸包含lna核苷和dna核苷(单位)。优选地,lna单位和dna单位的合并总数是8-30,如10
–
25、优选地12-22,如12
–
18、甚至更优选地11-16个。在本发明的一些实施方案中,寡核苷酸的核苷酸序列,如连续核苷酸序列,由至少一个或二个lna核苷组成并且剩余的核苷是dna单位。在一些实施方案中,寡核苷酸仅包含lna核苷和天然存在的核苷(如rna或dna、最优选地dna核苷)、任选地具有修饰的核苷间键如硫代磷酸酯。
[0249]
在本发明的一个实施方案中,本发明的寡核苷酸能够召集rna酶h。
[0250]
本发明的寡核苷酸的结构设计可以选自缺口聚物、缺口破坏者、头聚物和尾聚物。
[0251]
缺口聚物设计
[0252]
在一个优选实施方案中,本发明的寡核苷酸具有缺口聚物设计或结构,本文中又仅称作“缺口聚物”。在缺口聚物结构中,寡核苷酸按
‘
5-》3’取向包含至少三个不同的结构区5
’‑
侧翼、缺口和3
’‑
侧翼,即f-g-f’。在这种设计中,侧翼区f和f’(也称作翼区)包含一段连续的修饰的核苷,所述修饰的核苷互补于pd-l1靶核酸,而缺口区域g包含一段连续的核苷酸,所述核苷酸能够在寡核苷酸与靶核酸处于双链体时召集核酸酶、优选地核酸内切酶如rna酶,例如rna酶h。能够召集核酸酶、尤其rna酶h的核苷可以选自dna、α-l-氧基-lna、2
’‑
氟-ana和una。分布于区域g的5’和3’末端旁侧的区域f和f’优选地包含无核酸酶召集作用的核苷(具有3’内切结构(endo structure)的核苷)、更优选地一个或多个增强亲和力的修饰的核苷。在一些实施方案中,3’侧翼包含至少一个lna核苷、优选地至少2个lna核苷。在一些实施方案中,5’侧翼包含至少一个lna核苷。在一些实施方案中,5’和3’侧翼区均包含lna核苷。在一些实施方案中,侧翼区中的全部核苷均是lna核苷。在其他实施方案中,侧翼区可以包含lna核苷和其他核苷(混合型侧翼),如dna核苷和/或非lna修饰的核苷,如2’取代的核苷。在这种情况下,缺口定义为具有至少5个召集rna酶h的核苷(具有2’内切结构的核苷、优选地dna)的连续序列,其在5’和3’末端旁侧分布有增强亲和力的修饰的核苷、优选地lna,如β-d-氧基-lna。因此,5’侧翼区和3’侧翼区的毗邻缺口区域的核苷是修饰的核苷、优选地无核酸酶召集作用的核苷。
[0253]
区域f
[0254]
与区域g的5'末端连接的区域f(5’侧翼或5’翼部)包含、含有至少一个修饰的核苷如至少2、至少3、至少4、至少5、至少6、至少7个修饰的核苷或由其组成。在一个实施方案中,区域f包含1至7个修饰的核苷,如2至6个修饰的核苷,如2至5个修饰的核苷,如2至4个修饰的核苷,如1至3个修饰的核苷,如1、2、3或4个修饰的核苷或由其组成。f区域由该区域5'端和3'端处具有至少一个修饰的核苷定义。
[0255]
在一些实施方案中,区域f中修饰的核苷具有3’内切结构。
[0256]
在一个实施方案中,区域f中一个或多个修饰的核苷是2’修饰的核苷。在一个实施方案中,区域f中的全部核苷均是2’修饰的核苷。
[0257]
在另一个实施方案中,区域f除包含2’修饰的核苷之外还包含dna和/或rna。包含dna和/或rna的侧翼以f区域5'末端和3’末端(与g区域毗邻)处具有2’修饰的核苷为特征。在一个实施方案中,区域f包含dna核苷,如1至3个连续dna核苷,如1至3或1至2个连续dna核苷。侧翼中的dna核苷应当优选地不能够召集rna酶h。在一些实施方案中,f区域中的2’修饰的核苷和dna和/或rna核苷与1至3个2’修饰的核苷和1至3个dna和/或rna核苷轮替存在。这类侧翼也可以是称作交替性侧翼。具有交替性侧翼的寡核苷酸中5’侧翼(区域f)的长度可以是4至10个核苷,如4至8个,如4至6个核苷,如4、5、6或7个修饰的核苷。在一些实施方案中,仅寡核苷酸的5’侧翼是交替的。具有交替性核苷的区域f的具体例子是
[0258]2’
1-3-n’1-4-2’1-3
[0259]2’
1-2-n’1-2-2’1-2-n’1-2-2’1-2
[0260]
其中2’表示修饰的核苷并且n’是rna或dna。在一些实施方案中,交替性侧翼中全部修饰的核苷均是lna和n’是dna。在又一个实施方案中,区域f中一个或多个2’修饰的核苷选自2
’‑
o-烷基-rna单位、2'-o-甲基-rna、2
’‑
氨基-dna单位、2'-氟-dna单位、2
’‑
烷氧基-rna、moe单位、lna单位、阿糖核酸(ana)单位和2'-氟-ana单位。
[0261]
在一些实施方案中,f区域包含lna和2’取代的修饰的核苷。这些经常称作混合型翼部或混合型侧翼寡核苷酸。
[0262]
在本发明的一个实施方案中,区域f中全部修饰的核苷均是lna核苷。在又一个实施方案中,区域f中全部核苷均是lna核苷。在又一个实施方案中,区域f中的lna核苷独立地选自处于β-d构型或α-l构型或其组合的氧基-lna、硫代-lna、氨基-lna、cet和/或ena。在一个优选实施方案中,区域f在连续序列的5'端包含至少1个β-d-氧基lna单位。
[0263]
区域g
[0264]
区域g(缺口区域)优选地包含、含有能够召集前述核酸酶、尤其rna酶h的至少4个、如至少5个、如至少6个、至少7个、至少8个、至少9个、至少10个、至少11个、至少12个、至少13个、至少14个、至少15个或至少16个连续核苷或由其组成。在又一个实施方案中,区域g包含、含有能够召集前述核酸酶的5至12个、或6至10个或7至9个如8个连续核苷酸单位或由其组成。
[0265]
在一个实施方案中,区域g中能够召集核酸酶的核苷单位选自dna、α-l-lna、c4’烷基化dna(如pct/ep2009/050349和vester等人,bioorg.med.chem.lett.18(2008)2296
–
2300中所述,二者均通过引用方式并入本文)、阿拉伯糖衍生核苷如ana和2'f-ana(mangosr等人2003j.am.chem.soc.125,654-661)、una(非锁核酸)(如fluiter等人,mol.biosyst.,
2009,10,1039中所述,所述文献通过引用方式并入本文)。una是非锁定核酸,一般其中核糖的c2和c3之间的键已经移除,形成非锁的“糖”残基。
[0266]
在又一个实施方案中,区域g中的至少一个核苷单位是dna核苷单位,如1至18个dna单位,如2、3、4、5、6、7、8、9、10、11、12、13、14、15、16或17个dna单位,优选地2至17个dna单位,如3至16个dna单位,如4至15个dna单位,如5至14个dna单位,如6至13个dna单位,如7至12个dna单位,如8至11个dna单位,更优选地8至17个dna单位,或9至16个dna单位,10至15个dna单位或11至13个dna单位,如8、9、10、11、12、13、14、15、16、17个dna单位。在一些实施方案中,区域g由100%的dna单位组成。
[0267]
在其他实施方案中,区域g可以由dna和能够介导rna酶h切割的其他核苷的混合物组成。区域g可以由至少50%的dna、更优选地60%、70%或80%dna和甚至更优选地90%或95%的dna组成。
[0268]
在又一个实施方案中,区域g中的至少一个核苷单位是α-l-lna核苷单位,如至少一个α-l-lna,如2、3、4、5、6、7、8或9个α-l-lna。在又一个实施方案中,区域g包含至少一个作为α-l-氧基-lna的α-l-lna。在又一个实施方案中,区域g包含dna和α-l-lna核苷单位的组合。
[0269]
在一些实施方案中,区域g中的核苷具有2’内切结构。
[0270]
在一些实施方案中,区域g可以包含缺口破坏核苷,从而产生能够召集rna酶h的缺口破坏寡核苷酸。
[0271]
区域f’[0272]
与区域g的3'末端连接的区域f’(3’侧翼或3’翼部)包含、含有至少一个修饰的核苷如至少2、至少3、至少4、至少5、至少6、至少7个修饰的核苷或由其组成。在一个实施方案中,区域f’包含1至7个修饰的核苷,如2至6个修饰的核苷,如2至4个修饰的核苷,如1至3个修饰的核苷,如1、2、3或4个修饰的核苷由其组成。f’区域由该区域5'端和3'端处具有至少一个修饰的核苷定义。
[0273]
在一些实施方案中,区域f’中修饰的核苷具有3’内切结构。
[0274]
在一个实施方案中,区域f’中一个或多个修饰的核苷是2’修饰的核苷。在一个实施方案中,区域f’中的全部核苷均是2’修饰的核苷。
[0275]
在一个实施方案中,区域f’中一个或多个修饰的核苷是2’修饰的核苷。
[0276]
在一个实施方案中,区域f’中的全部核苷均是2’修饰的核苷。在另一个实施方案中,区域f’除包含2’修饰的核苷之外还包含dna或rna。包含dna或rna的侧翼以f’区域5'末端(与g区域毗邻)和3’末端处具有2’修饰的核苷为特征。在一个实施方案中,区域f’包含dna核苷,如1至4个连续dna核苷,如1至3或1至2个连续dna核苷。侧翼中的dna核苷应当优选地不能够召集rna酶h。在一些实施方案中,f区域中的2’修饰的核苷和dna和/或rna核苷与1至3个2’修饰的核苷和1至3个dna和/或rna核苷轮替存在,这类侧翼也可以是称作交替性侧翼。具有交替性侧翼的寡核苷酸中3’侧翼(区域f’)的长度可以是4至10个核苷,如4至8个,如4至6个核苷,如4、5、6或7个修饰的核苷。在一些实施方案中,仅寡核苷酸的3’侧翼是交替的。具有交替性核苷的区域f’的具体例子是
[0277]2’
1-2-n’1-4-2’1-4
[0278]2’
1-2-n’1-2-2’1-2-n’1-2-2’1-2
[0279]
其中2’表示修饰的核苷并且n’是rna或dna。在一些实施方案中,交替性侧翼中全部修饰的核苷均是lna和n’是dna。在又一个实施方案中,区域f’中修饰的核苷选自2
’‑
o-烷基-rna单位、2'-o-甲基-rna、2
’‑
氨基-dna单位、2'-氟-dna单位、2
’‑
烷氧基-rna、moe单位、lna单位、阿糖核酸(ana)单位和2'-氟-ana单位。
[0280]
在一些实施方案中,f’区域包含lna和2’取代的修饰的核苷。这些经常称作混合型翼部或混合型侧翼寡核苷酸。
[0281]
在本发明的一个实施方案中,区域f’中全部修饰的核苷均是lna核苷。在又一个实施方案中,区域f’中全部核苷均是lna核苷。在又一个实施方案中,区域f’中的lna核苷独立地选自处于β-d构型或α-l构型或其组合的氧基-lna、硫代-lna、氨基-lna、cet和/或ena。在一个优选实施方案中,区域f’在连续序列的3'端具有至少2个β-d-氧基lna单位。
[0282]
区域d’和d”[0283]
区域d’和d”可以分别与区域f的5'末端或区域f’的3’末端连接。区域d’或d”是任选的。
[0284]
区域d’或d”可以独立地包含0至5个、如1至5个、如2至4个、如0、1、2、3、4或5个可以与靶核酸互补或非互补的额外核苷酸。在这个方面,在一些实施方案中,本发明的寡核苷酸可以包含能够调节靶的连续核苷酸序列,所述连续核苷酸序列在5’和或3’旁侧分布有额外的核苷酸。这类额外的核苷酸可以充当核酸酶不稳定性生物可切割接头(参见接头的定义)。在一些实施方案中,额外的5’和/或3’末端核苷与磷酸二酯键连接并且可以是dna或rna。在另一个实施方案中,额外的5’和/或3’末端核苷是修饰的核苷,可以例如纳入所述修饰的核苷以增强核酸酶稳定性或便于合成。在一个实施方案中,本发明的寡核苷酸在连续核苷酸序列的5’或3’末端包含区域d’和/或d”。在又一个实施方案中,d’和/或d”区域包含磷酸二酯连接的1至5个不互补于所述靶核酸的dna核苷或rna核苷。
[0285]
本发明的缺口聚物寡核苷酸可以用下式代表:
[0286]5’‑
f-g-f
’‑3’
;尤其f
1-7-g
4-12-f’1-7
[0287]5’‑d’‑
f-g-f
’‑3’
,尤其d’1-3-f
1-7-g
4-12-f’1-7
[0288]5’‑
f-g-f
’‑d”‑3’
,尤其f
1-7-g
4-12-f’1-7-d”1-3
[0289]5’‑d’‑
f-g-f
’‑d’‑
3”,尤其d’1-3-f
1-7-g
4-12-f’1-7-d”1-3
[0290]
上文已经描述了区域f、g和f’、d’和d”中优选的核苷数目和类型。本发明的寡核苷酸缀合物具有与寡核苷酸、尤其上文提到的缺口聚物寡核苷酸的5’或3’末端共价连接的区域c。
[0291]
在一个实施方案中,本发明的寡核苷酸缀合物包含具有式5
’‑d’‑
f-g-f
’‑3’
或5
’‑
f-g-f
’‑d”‑3’
的寡核苷酸,其中区域f和f’独立地包含1-7个修饰的核苷,g是能够召集rna酶h的具有6个和16个核苷之间的区域,并且区域d’或d”包含磷酸二酯连接的1-5个核苷。优选地,区域d’或d”存在于其中当构思与缀合物部分缀合时的寡核苷酸末端中。
[0292]
具有交替性侧翼的寡核苷酸的例子可以用下式代表:
[0293]2’
1-3-n’1-4-2’1-3-g
6-12-2’1-2-n’1-4-2’1-4
[0294]2’
1-2-n’1-2-2’1-2-n’1-2-2’1-2-g
6-12-2’1-2-n’1-2-2’1-2-n’1-2-2’1-2
[0295]
f-g
6-12-2’1-2-n’1-4-2’1-4
[0296]
f-g
6-12-2’1-2-n’1-2-2’1-2-n’1-2-2’1-2
[0297]2’
1-3-n’1-4-2’1-3-g
6-12-f’[0298]2’
1-2-n’1-2-2’1-2-n
1-2-2’1-2-g
6-12-f’[0299]
当其中侧翼用f或f’指示的情况下,它仅含有2’修饰的核苷,如lna核苷。上文已经描述了交替性区域中和区域f、g和f’、d’和d”中优选的核苷数目和类型。
[0300]
在一些实施方案中,寡核苷酸是由长度16、17、18、19、20、21、22个核苷酸组成的缺口聚物,其中区域f和f’每者独立地由互补于pd-l1靶核酸的1、2、3或4个修饰的核苷单位组成并且区域g由与pd-l1靶核酸形成双链体时能够召集核酸酶的8、9、10、11、12、13、14、15、16、17个核苷单位组成,并且区域d’由磷酸二酯连接的2个dna组成。
[0301]
在又一个实施方案中,寡核苷酸是这样的缺口聚物,其中区域f和f’每者独立地由3、4、5或6个修饰的核苷单位(如含有2
’‑
o-甲氧乙基-核糖糖(2
’‑
moe)的核苷单位或含有2'-氟-脱氧核糖糖的核苷单位和/或lna单位)组成,并且区域g由8、9、10、11、12、13、14、15、16或17个核苷单位如dna单位或其他召集核酸酶的核苷如α-l-lna或dna和召集核酸酶的核苷的混合物组成。
[0302]
在又一个具体实施方案中,寡核苷酸是这样的缺口聚物,其中区域f和f’每者各自由二个lna单位组成,并且区域g由12、13、14个核苷单位、优选地dna单位组成。这种性质的具体缺口聚物设计包括2-12-2、2-13-2和2-14-2。
[0303]
在又一个具体实施方案中,寡核苷酸是这样的缺口聚物,其中区域f和f’每者独立地由三个lna单位组成,并且区域g由8、9、10、11、12、13或14个核苷单位、优选地dna单位组成。这种性质的具体缺口聚物设计包括3-8-3、3-9-3、3-10-3、3-11-3、3-12-3、3-13-3和3-14-3。
[0304]
在又一个具体实施方案中,寡核苷酸是这样的缺口聚物,其中区域f和f’每者各自由四个lna单位组成,并且区域g由8或9、10、11或12个核苷单位、优选地dna单位组成。这种性质的具体缺口聚物设计包括4-8-4、4-9-4、4-10-4、4-11-4和4-12-4。
[0305]
这种性质的具体缺口聚物设计包括从具有6个核苷的缺口和翼部内独立地具有1至4个修饰的核苷选择的f-g-f’设计,包括1-6-1、1-6-2、2-6-1、1-6-3、3-6-1、1-6-4、4-6-1、2-6-2、2-6-3、3-6-2 2-6-4、4-6-2、3-6-3、3-6-4和4-6-3缺口聚物。
[0306]
这种性质的具体缺口聚物设计包括从具有7个核苷的缺口和翼部内独立地具有1至4个修饰的核苷选择的f-g-f’设计,包括1-7-1、2-7-1、1-7-2、1-7-3、3-7-1、1-7-4、4-7-1、2-7-2、2-7-3、3-7-2、2-7-4、4-7-2、3-7-3、3-7-4、4-7-3和4-7-4缺口聚物。
[0307]
这种性质的具体缺口聚物设计包括从具有8个核苷的缺口和翼部内独立地具有1至4个修饰的核苷选择的f-g-f’设计,包括1-8-1、1-8-2、1-8-3、3-8-1、1-8-4、4-8-1、2-8-1、2-8-2、2-8-3、3-8-2、2-8-4、4-8-2、3-8-3、3-8-4、4-8-3和4-8-4缺口聚物。
[0308]
这种性质的具体缺口聚物设计包括从具有9个核苷的缺口和翼部内独立地具有1至4个修饰的核苷选择的f-g-f’设计,包括1-9-1、2-9-1、1-9-2、1-9-3、3-9-1、1-9-4、4-9-1、2-9-2、2-9-3、3-9-2、2-9-4、4-9-2、3-9-3、3-9-4、4-9-3和4-9-4缺口聚物。
[0309]
这种性质的具体缺口聚物设计包括从具有10个核苷的缺口选择的f-g-f’设计,包括1-10-1、2-10-1、1-10-2、1-10-3、3-10-1、1-10-4、4-10-1、2-10-2、2-10-3、3-10-2、2-10-4、4-10-2、3-10-3、3-10-4、4-10-3和4-10-4缺口聚物。
[0310]
这种性质的具体缺口聚物设计包括从具有11个核苷的缺口选择的f-g-f’设计,包
括1-11-1、2-11-1、1-11-2、1-11-3、3-11-1、1-11-4、4-11-1、2-11-2、2-11-3、3-11-2、2-11-4、4-11-2、3-11-3、3-11-4、4-11-3和4-11-4缺口聚物。
[0311]
这种性质的具体缺口聚物设计包括从具有12个核苷的缺口选择的f-g-f’设计,包括1-12-1、2-12-1、1-12-2、1-12-3、3-12-1、1-12-4、4-12-1、2-12-2、2-12-3、3-12-2、2-12-4、4-12-2、3-12-3、3-12-4、4-12-3和4-12-4缺口聚物。
[0312]
这种性质的具体缺口聚物设计包括从具有13个核苷的缺口选择的f-g-f’设计,包括1-13-1、2-13-1、1-13-2、1-13-3、3-13-1、1-13-4、4-13-1、2-13-2、2-13-3、3-13-2、2-13-4、4-13-2、3-13-3、3-13-4、4-13-3和4-13-4缺口聚物。
[0313]
这种性质的具体缺口聚物设计包括从具有14个核苷的缺口选择的f-g-f’设计,包括1-14-1、2-14-1、1-14-2、1-14-3、3-14-1、1-14-4、4-14-1、2-14-2、2-14-3、3-14-2、2-14-4、4-14-2、3-14-3、3-14-4、4-14-3和4-14-4缺口聚物。
[0314]
这种性质的具体缺口聚物设计包括从具有15个核苷的缺口选择的f-g-f’设计,包括1-15-1、2-15-1、1-15-2、1-15-3、3-15-1、1-15-4、4-15-1、2-15-2、2-15-3、3-15-2、2-15-4、4-15-2和3-15-3缺口聚物。
[0315]
这种性质的具体缺口聚物设计包括从具有16个核苷的缺口选择的f-g-f’设计,包括1-16-1、2-16-1、1-16-2、1-16-3、3-16-1、1-16-4、4-16-1、2-16-2、2-16-3、3-16-2、2-16-4、4-16-2和3-16-3缺口聚物。
[0316]
这种性质的具体缺口聚物设计包括从具有17个核苷的缺口选择的f-g-f’设计,包括1-17-1、2-17-1、1-17-2、1-17-3、3-17-1、1-17-4、4-17-1、2-17-2、2-17-3和3-17-2缺口聚物。
[0317]
在全部情况下,f-g-f’设计均可以还包括区域d’和/或d”,所述区域可以具有1、2或3个核苷单位,如dna单位,如磷酸二酯连接的2个dna单位。优选地,区域f和f’中的核苷是修饰的核苷,而区域g中的核苷优选地是未修饰的核苷。
[0318]
在每种设计中,优选的修饰的核苷是lna。
[0319]
在另一个实施方案中,缺口聚物的缺口中全部核苷间键均是硫代磷酸酯和/或硼烷磷酸酯键。在另一个实施方案中,缺口聚物的侧翼(f和f’区域)中全部核苷间键均是硫代磷酸酯和/或硼烷磷酸酯键。在另一个优选实施方案中,缺口聚物的d’和d”区域中全部核苷间键均是磷酸二酯键。
[0320]
对于如本文中公开的具体缺口聚物,当胞嘧啶(c)残基注释为5-甲基-胞嘧啶,在多个实施方案中,寡核苷酸中存在的一个或多个c可以是未修饰的c残基。
[0321]
在一个具体实施方案中,缺口聚物是如通过引用方式并入本文的wo2008/113832中所述的所谓短聚物(shortmer)。
[0322]
在wo2004/046160、wo2007/146511中公开并通过引用的方式并入其他缺口聚物设计。
[0323]
对于本发明的某些实施方案,寡核苷酸选自具有cmp-id-no:5_1至743_1和771_1的寡核苷酸化合物。
[0324]
对于本发明的某些实施方案,寡核苷酸选自具有cmp-id-no:6_1、8_1、9_1、13_1、41_1、42_1、58_1、77_1、92_1、111_1、128_1、151_1、164_1、166_1、169_1、171_1、222_1、233_1、245_1、246_1、250_1、251_1、252_1、256_1、272_1、273_1、287_1、292_1、303_1、314_1、
318_1、320_1、324_1、336_1、342_1、343_1、344_1、345_1、346_1、349_1、359_1、360_1、374_1、408_1、409_1、415_1、417_1、424_1、429_1、430_1、458_1、464_1、466_1、474_1、490_1、493_1、512_1、519_1、519_1、529_1、533_1、534_1、547_1、566_1、567_1、578_1、582_1、601_1、619_1、620_1、636_1、637_1、638_1、640_1、645_1、650_1、651_1、652_1、653_1、658_1、659_1、660_1、665_1、678_1、679_1、680_1、682_1、683_1、684_1、687_1、694_1、706_1、716_1、728_1、733_1、734_1和735_1的寡核苷酸化合物。
[0325]
在本发明的一个优选实施方案中,寡核苷酸是cmp-id-no:287_1。
[0326]
在本发明的另一个优选实施方案中,寡核苷酸是cmp-id-no:342_1。
[0327]
在本发明的另一个优选实施方案中,寡核苷酸是cmp-id-no:640_1。
[0328]
在本发明的另一个优选实施方案中,寡核苷酸是cmp-id-no:466_1。
[0329]
在本发明的另一个优选实施方案中,寡核苷酸是cmp-id-no:566_1。
[0330]
在本发明的又一个实施方案中,本发明的寡核苷酸基序和寡核苷酸化合物的连续核苷酸序列在连续核苷酸序列的5'端(例如区域d’)包含磷酸二酯连接的二至四个额外的核苷。在一个实施方案中,这些核苷充当生物可切割接头(参见章节生物可切割接头)。在一个优选实施方案中,ca(胞苷-腺苷)二核苷酸借助磷酸二酯键与连续核苷酸序列(即表5中所列基序序列或寡核苷酸化合物的任一者)的5'末端连接。在优选的实施方案中,该ca二核苷酸在连续核苷酸的其余部分互补的位置不与靶序列互补。
[0331]
在本发明的一些实施方案中,寡核苷酸或连续核苷酸序列选自具有seq id no:766、767、768、769和770的核苷酸基序序列。
[0332]
在本发明的一些实施方案中,寡核苷酸选自具有cmp-id-no:766_1、767_1、768_1、769_1和770_1的寡核苷酸化合物。
[0333]
糖缀合物部分
[0334]
糖缀合物部分包括但不限于半乳糖、乳糖、n-乙酰半乳糖胺、甘露糖和甘露糖-6-磷酸。糖缀合物可以用来增强在一系列组织如肝脏和/或肌肉中的递送或活性。参见,例如ep1495769、wo99/65925、yang等人,bioconjug chem(2009)20(2):213-21;zatsepin和oretskaya chem biodivers.(2004)1(10):1401-17。
[0335]
在一些实施方案中,糖缀合物部分是多价,例如可以与寡核苷酸(任选地借助一个接头或多个接头)共价接合的2、3或4个相同或不相同的糖部分。在一些实施方案中,本发明提供包含本发明的寡核苷酸和糖缀合物部分的缀合物。
[0336]
在一些实施方案中,缀合物部分是或可以包含甘露糖或甘露糖-6-磷酸。这特别可用于靶向肌肉细胞,参见例如us 2012/122801。
[0337]
能够与脱唾液酸糖蛋白受体(asgpr)结合的缀合物部分特别可用于靶向肝脏中的肝细胞。在一些实施方案中,本发明提供包含本发明的寡核苷酸和靶向脱唾液酸糖蛋白受体的缀合物部分的寡核苷酸缀合物。靶向脱唾液酸糖蛋白受体的缀合物部分包含一个或多个能够以等于或大于对半乳糖亲和力的亲和力与脱唾液酸糖蛋白受体结合的糖部分(结合aspgr的糖部分)。已经研究(参见例如:jobst,s.t.和drickamer,k.jb.c.1996,271,6686)或使用本领域常见的方法轻易地测定了许多半乳糖衍生物对脱唾液酸糖蛋白受体的亲和力。
[0338]
本发明的一个方面是反义寡核苷酸缀合物,包含a)包含与pd-l1靶核酸至少90%
互补的10至30个核苷酸长度的连续核苷酸序列的寡核苷酸(区域a);和b)与a)的寡核苷酸共价连接的至少一个靶向脱唾液酸糖蛋白受体的缀合物部分(区域c))。寡核苷酸或连续核苷酸序列可以如章节“本发明的寡核苷酸”、“寡核苷酸设计”和“缺口聚物设计”中任一者中所述。
[0339]
在一些实施方案中,靶向脱唾液酸糖蛋白受体的缀合物部分包含至少一个选自半乳糖、半乳糖胺、n-甲酰半乳糖胺、n-乙酰半乳糖胺、n-丙酰半乳糖胺、n-正丁酰半乳糖胺和n-异丁酰半乳糖胺的结合aspgr的糖部分。在一些实施方案中,靶向脱唾液酸糖蛋白受体的缀合物部分是单价、二价、三价或四价的(即含有1、2、3或4个能够与脱唾液酸糖蛋白受体结合的末端糖部分)。优选地,靶向脱唾液酸糖蛋白受体的缀合物部分是二价的,甚至更优选地,它是三价的。在一个优选实施方案中,靶向脱唾液酸糖蛋白受体的缀合物部分包含1至3个n-乙酰半乳糖胺(galnac)部分(也称作galnac缀合物)。在一些实施方案中,寡核苷酸缀合物包含作为三价n-乙酰半乳糖胺(galnac)部分的靶向脱唾液酸糖蛋白受体的缀合物部分。galnac缀合物已经与磷酸二酯、甲基膦酸酯和pna反义寡核苷酸(例如us 5,994517和hangeland等人,bioconjug chem.1995nov-dec;6(6):695-701;biessen等人1999biochem j.340,783-792和maier等人2003bioconjug chem 14,18-29)及sirna(例如wo 2009/126933、wo 2012/089352和wo 2012/083046)使用以及与lna和2'-moe修饰的核苷(wo 2014/076196 wo 2014/207232和wo 2014/179620)(本文中引用作为参考)使用。
[0340]
为了产生靶向脱唾液酸糖蛋白受体的缀合物部分,结合aspgr的糖部分(优选地galnac)通过糖的c-l碳与分支分子连接。结合aspgr的糖部分优选地借助间隔团与分支分子连接。优选的间隔团是柔性亲水间隔团(美国专利5885968;biessen等人,j.med.chern.1995vol.39p.1538-1546)。优选的柔性亲水间隔团是peg间隔团。优选的peg间隔团是peg3间隔团(三个亚乙基单位)。分支分子可以是允许连接二或三个末端结合aspgr的糖部分并进一步允许分支点与寡核苷酸连接的任何小分子。一种示例性分支分子是双赖氨酸。双赖氨酸分子含有可以连接三个结合aspgr的糖部分的三个胺基和可以与寡核苷酸连接的羧基反应基团。替代性分支分子可以是二分的(doubler)或三分的(trebler),如glen research供应的那些。在一些实施方案中,分支物可以选自1,3-双-[5-(4,4'-二甲氧基三苯甲氧基)戊基酰氨基]丙基-2-[(2-氰基乙基)-(n,n-二异丙基)]磷酰亚胺(glen research目录号:10-1920-xx)、三-2,2,2-[3-(4,4'-二甲氧基三苯甲氧基)丙氧甲基]乙基-[(2-氰基乙基)-(n,n-二异丙基)]-磷酰亚胺(glen research目录号:10-1922-xx)、三-2,2,2-[3-(4,4'-二甲氧基三苯甲氧基)丙氧甲基]亚甲氧基丙基-[(2-氰基乙基)-(n,n-二异丙基)]-磷酰亚胺和1-[5-(4,4'-二甲氧基-三苯甲氧基)戊基酰氨基]-3-[5-芴甲氧基-羰基-氧基-戊基酰氨基]-丙基-2-[(2-氰基乙基)-(n,n-二异丙基)]-磷酰亚胺(glen research目录号:10-1925-xx)。wo 2014/179620和pct申请号pct/ep2015/073331描述了多种galnac缀合物部分的产生(所述文献因而通过引用的方式并入)。一个或多个接头可以插在分支分子和寡核苷酸之间。在一个优选实施方案中,接头是生物可切割接头。接头可以选自章节“接头”和其子部分中描述的接头。
[0341]
使用本领域已知的方法,可以将靶向脱唾液酸糖蛋白受体的缀合物部分,尤其galnac缀合物部分连接至寡核苷酸的3'末端或5'末端。在优选的实施方案中,靶向脱唾液酸糖蛋白受体的缀合物部分连接至寡核苷酸的5'末端。
[0342]
已经在wo 2012/083046中描述与sirna递送有关的药代动力学调节物(所述文献因而通过引用的方式并入)。在一些实施方案中,糖缀合物部分包含药代动力学调节物,所述药代动力学调节物选自具有16个或更多个碳原子的疏水基团、具有16-20个碳原子的疏水基团、棕榈酰基、十六碳-8-烯酰基、油基、(9e,12e)-十八碳-9,12-二烯酰基、二辛酰基和c16-c20酰基以及胆固醇。在一个优选实施方案中,含有药代动力学调节物的糖缀合物部分是galnac缀合物。
[0343]
优选的糖缀合物部分包含一个至三个末端结合aspgr的糖部分,优选地n-乙酰半乳糖胺部分。在一些实施方案中,糖缀合物部分包含三个借助间隔团与分支分子连接的结合aspgr的糖部分、优选地n-乙酰半乳糖胺部分。间隔分子的长度可以在8和30个原子之间。优选的糖缀合物部分包含三个借助peg间隔团与双赖氨酸分支分子连接的末端galnac部分。优选地,peg间隔团是3个peg间隔团。图1中显示合适的靶向脱唾液酸糖蛋白受体的缀合物部分。图3中显示优选的靶向脱唾液酸糖蛋白受体的缀合物部分。
[0344]
其他galnac缀合物部分可以例如包括连接有galnac部分的小肽如tyr-glu-glu-(氨基己基galnac)3(yee(ahgalnac)3;与肝细胞上脱唾液酸糖蛋白受体结合的糖三肽,参见例如duff等人,methods enzymol,2000,313,297);基于赖氨酸的半乳糖簇(例如,l3g4;biessen等人,cardovasc.med.,1999,214);和基于胆烷的半乳糖簇(例如,脱唾液酸糖蛋白受体的糖识别基序)。
[0345]
在本发明的一些实施方案中,反义寡核苷酸缀合物选自以下cpm id no:766_2、767_2、768_2、769_2和770_2。
[0346]
在一个优选实施方案中,反义寡核苷酸缀合物对应于图4中代表的化合物。
[0347]
在另一个优选实施方案中,反义寡核苷酸缀合物对应于图5中代表的化合物。
[0348]
在另一个优选实施方案中,反义寡核苷酸缀合物对应于图6中代表的化合物。
[0349]
在另一个优选实施方案中,反义寡核苷酸缀合物对应于图7中代表的化合物。
[0350]
在另一个优选实施方案中,反义寡核苷酸缀合物对应于图8中代表的化合物。
[0351]
接头
[0352]
生物可切割接头(区域b)
[0353]
缀合物的用途经常与增强的药代动力学或药物动力学的动力学特性相关。但是,缀合物部分的存在可能干扰寡核苷酸对其预期靶的活性,例如因空间位阻阻止杂交或召集核酸酶(例如rna酶h)所致。在寡核苷酸(区域a或第一区域)和缀合物部分(区域c或第三区域)之间使用生理不稳定键(生物可切割接头),因缀合物部分的存在而允许改善特性,同时确保一旦在靶组织中,缀合物基团不阻止寡核苷酸的有效活性。
[0354]
当含有不稳定键的分子抵达适宜的胞内和/或胞外环境时,生理不稳定键的切割自发出现。例如,当分子进入酸化内体时,可以切割ph不稳定键。因此,可以将ph不稳定键视为一种内体可切割键。当暴露于酶如内体或溶酶体中或在细胞质中存在的那些酶时,酶可切割键可以被切割。当分子进入还原型更强的细胞胞质环境时,二硫键可以被切割。因此,可以将二硫键视为一种胞质可切割键。如本文所用,ph不稳定键是在酸性条件(ph《7)下选择性断裂的不稳定键。这类键也可以称作内体不稳定键,因为细胞内体和溶酶体具有小于7的ph。
[0355]
对于与用于靶向递送的缀合物部分结合的生物可切割接头,优选在靶组织(例如
肌肉、肝、肾或肿瘤)中所见的切割速率大于血清中观察到的切割速率。在“材料和方法”章节中描述了相对于血清或s1核酸酶切割作用,确定靶组织中切割水平(%)的适合方法。在一些实施方案中,与标准品比较时,本发明缀合物中的生物可切割接头(也称作生理不稳定接头、核酸酶敏感接头或区域b)至少约20%被切割、如至少约30%被切割、如至少约40%被切割、如至少约50%被切割、如至少约60%被切割、如至少约70%被切割、如至少约75%被切割。
[0356]
在一些实施方案中,本发明的寡核苷酸缀合物包含三个区域:i)第一区域(区域a),其包含10
–
25个与所述靶核酸互补的连续核苷酸;ii)包含生物可切割接头的第二区域(区域b)和iii)包含缀合物部分如靶向脱唾液酸糖蛋白受体的缀合物部分的第三区域(区域c),其中第三区域与共价连接至第一区域的第二区域共价连接。
[0357]
在本发明的一个实施方案中,寡核苷酸缀合物在连续核苷酸序列(区域a)和靶向脱唾液酸糖蛋白受体的缀合物部分(区域c)之间包含生物可切割接头(区域b)。
[0358]
在一些实施方案中,生物可切割接头可以位于与靶核酸互补的连续核苷酸(区域a)的5'末端和/或3’末端。在一个优选实施方案中,生物可切割接头在5'末端。
[0359]
在一些实施方案中,可切割接头对可以例如在靶细胞中表达的核酸酶敏感。在一些实施方案中,生物可切割接头包含2至5个连续磷酸二酯键。接头可以是磷酸二酯连接的短(例如1
–
10个,如接头的定义中详述)核苷区域。在一些实施方案中,生物可切割接头区域b中的核苷(任选独立地)选自dna和rna或其不干扰核酸酶切割的修饰物。不干扰核酸酶切割的dna和rna核苷修饰物可以是非天然存在的核碱基。某些糖修饰的核苷还可以允许核酸酶切割,如α-l-氧基-lna。在一些实施方案中,区域b的全部核苷(任选独立地)包含2
’‑
oh核糖(rna)或2
’‑
h糖,即rna或dna。在一个优选实施方案中,区域b的至少两个连续核苷是dna核苷或rna核苷(如至少3个或4个或5个连续的dna核苷或rna核苷)。在一个甚至更优选的实施方案中,区域b的核苷是dna核苷。优选地,区域b由磷酸二酯连接的1至5个或1至4个之间如2、3、4个连续dna核苷组成。在优选的实施方案中,区域b如此短,以至它不召集rna酶h。在一些实施方案中,区域b包含磷酸二酯连接的不多于3个或不多于4个连续dna和/或rna核苷(如dna核苷)。
[0360]
在区域b由磷酸二酯连接的核苷组成的情况下,区域a和区域b可以共同形成与区域c连接的寡核苷酸。在这种情况下,区域a可以不同于区域b,在于区域a始于至少一个、优选地至少两个对靶核酸的结合亲和力增加的修饰的核苷(例如lna或具有2’取代的糖部分的核苷)并且区域a本身能够调节有关细胞系中靶核酸的表达。另外,如果区域a包含dna核苷或rna核苷,则这些核苷用核酸酶抗性核苷间键如硫代磷酸酯或硼烷磷酸酯连接。在另一方面,区域b在dna核苷或rna核苷之间包含磷酸二酯键。在一些实施方案中,区域b不与靶核酸互补或相对于靶核酸包含至少50%错配。
[0361]
在一些实施方案中,区域b不与靶核酸序列互补或不与区域a中互补于靶核酸的连续核苷酸互补。
[0362]
在一些实施方案中,区域b与靶核酸序列互补。在这个方面,区域a和区域b在一起可以形成与靶序列互补的单一连续序列。
[0363]
在本发明的一些方面,第一区域(区域a)和第二区域(区域b)之间的核苷间键可以视为第二区域的部分。
[0364]
在一些实施方案中,基于靶组织或细胞或亚细胞区室中存在的优势核酸内切酶、切割酶,选择区域b中碱基的序列以提供最佳核酸内切酶切割位点。在这个方面,通过从靶组织和非靶组织分离细胞提取物,与非靶细胞(例如肾)相比,可以基于目的靶细胞(例如肝脏/肝细胞)中的偏好性切割活性,选择用于区域b中的核酸内切酶切割序列。在这个方面,化合物用于目标下调的效力可以针对目的组织/细胞进行优化。
[0365]
在一些实施方案中,区域b包含序列为aa、at、ac、ag、ta、tt、tc、tg、ca、ct、cc、cg、ga、gt、gc或gg的二核苷酸,其中c可以是5-甲基胞嘧啶,和/或t可以替换为u。优选地,核苷间键是磷酸二酯键。在一些实施方案中,区域b包含序列为aaa、aat、aac、aag、ata、att、atc、atg、aca、act、acc、acg、aga、agt、agc、agg、taa、tat、tac、tag、tta、ttt、ttc、tag、tca、tct、tcc、tcg、tga、tgt、tgc、tgg、caa、cat、cac、cag、cta、ctg、ctc、ctt、cca、cct、ccc、ccg、cga、cgt、cgc、cgg、gaa、gat、gac、cag、gta、gtt、gtc、gtg、gca、gct、gcc、gcg、gga、ggt、ggc和ggg的三核苷酸,其中c可以是5-甲基胞嘧啶和/或t可以替换为u。优选地,核苷间键是磷酸二酯键。在一些实施方案中,区域b包含序列为aaax、aatx、aacx、aagx、atax、attx、atcx、atgx、acax、actx、accx、acgx、agax、agtx、agcx、aggx、taax、tatx、tacx、tagx、ttax、tttx、ttcx、tagx、tcax、tctx、tccx、tcgx、tgax、tgtx、tgcx、tggx、caax、catx、cacx、cagx、ctax、ctgx、ctcx、cttx、ccax、cctx、cccx、ccgx、cgax、cgtx、cgcx、cggx、gaax、gatx、gacx、cagx、gtax、gttx、gtcx、gtgx、gcax、gctx、gccx、gcgx、ggax、ggtx、ggcx和gggx的四核苷酸,其中x可以选自a、t、u、g、c及它们的类似物,其中c可以是5-甲基胞嘧啶和/或t可以替换为u。优选地,核苷间键是磷酸二酯键。将认识到,当提到(天然存在的)核碱基a、t、u、g、c时,这些核碱基可以用作为等同的天然核碱基发挥作用(例如与互补核苷发生碱基配对)的核碱基类似物置换。
[0366]
其他接头(区域y)
[0367]
接头可以具有至少两个官能团,一个官能团用于连接至寡核苷酸并且另一个官能团用于连接至缀合物部分。示例接头官能团可以是亲电的,以与寡核苷酸或缀合物部分上的亲核基团反应,或是亲核的,以与亲电基团反应。在一些实施方案中,接头官能团包括氨基、羟基、羧酸、巯基、磷酰胺酯、硫代磷酸酯、磷酸酯、亚磷酸酯、不饱和键(例如,双键或叁键)等。一些接头(区域y)的例子包括8-氨基-3,6-二氧杂辛酸(ado)、琥珀酰亚胺基4-(n-马来酰亚胺甲基)环己烷-1-羧酸酯(smcc)、6-氨基己酸(ahex或aha)、6-氨基己氧基、4-氨基丁酸、4-氨基环己基羧酸、琥珀酰亚胺基4-(n-马来酰亚胺甲基)环己烷-1-羧基-(6-酰氨基-己酸盐)(lcsmcc)、琥珀酰亚胺基间马来酰亚胺基-苯甲酸酯(mbs)、琥珀酰亚胺基n-表-马来酰亚胺基-己酸酯(emcs)、琥珀酰亚胺基6-(β-马来酰亚胺基丙酰氨基)己酸酯(smph)、琥珀酰亚胺基n-(α-马来酰亚胺基乙酸酯)(amas)、琥珀酰亚胺基4-(对马来酰亚胺基苯基)丁酸酯(smpb)、β-丙氨酸(β-ala)、苯基甘氨酸(phg)、4-氨基环己酸(achc)、β-(环丙基)丙氨酸(β-cypr)、氨基十二烷酸(adc)、烯化二醇(alylene diol)、聚乙二醇、氨基酸等。在一些实施方案中,接头(区域y)是氨基烷基,如c2
–
c36氨基烷基,例如包括c6至c12氨基烷基。在一个优选实施方案中,接头(区域y)是c6氨基烷基。作为标准寡核苷酸合成的部分,例如使用(例如保护的)氨基烷基磷酰亚胺,可以将氨基烷基添加至寡核苷酸(区域a或区域a-b)。氨基烷基和寡核苷酸之间的连接基团可以例如是硫代磷酸酯或磷酸二酯,或本文中提及的其他核苷连接基团之一。氨基烷基共价连接至寡核苷酸的5’或3’末端。市售氨基烷基
接头例如是用于寡核苷酸3'末端处键接的3'-氨基修饰试剂并且对于寡核苷酸5'末端处键的键接,5'-氨基修饰剂c6可获得。这些试剂从glen research corporation(sterling,va.)可获得。这些化合物或相似的化合物由krieg等人,antisense research and development 1991,1,161用来将荧光素与寡核苷酸5'-末端连接。多种类型的其他接头基团是本领域已知的并且可以用于将缀合物部分接合至寡核苷酸。多种可用接头基团的综述可以在例如antisense research and applications,s.t.crooke和b.lebleu编著,crc press,boca raton,fla.,1993,第303-350页中找到。其他化合物如吖啶已经借助多亚甲基键与寡核苷酸3'-末端磷酸酯基团连接(asseline等人,proc.natl.acad.sci.usa 1984,81,3297)。前述任一基团可以作为单一接头(区域y)使用或与一个或多个其他接头(区域y-y’或区域y-b或b-y)组合使用。
[0368]
在本领域充分提供了接头和它们在制备寡核苷酸的缀合物中的用途,如提供于以下文献中:wo 96/11205和wo 98/52614和美国专利号4,948,882;5,525,465;5,541,313;5,545,730;5,552,538;5,580,731;5,486,603;5,608,046;4,587,044;4,667,025;5,254,469;5,245,022;5,112,963;5,391,723;5,510475;5,512,667;5,574,142;5,684,142;5,770,716;6,096,875;6,335,432和6,335,437、wo 2012/083046,所述文献各自通过引用的方式完整并入。
[0369]
制造方法
[0370]
在又一个方面,本发明提供用于制造本发明的寡核苷酸的方法,所述方法包括使核苷酸单位反应并且因而形成包含于寡核苷酸中的共价连接的连续核苷酸单位。优选地,该方法使用磷酰亚胺化学(参见例如,1987,methods in enzymology vol.154,第287-313页)。在又一个实施方案中,该方法还包括使连续核苷酸序列与缀合部分(配体)反应。在又一个方面,提供一种制造本发明组合物的方法,所述方法包括将本发明的寡核苷酸或缀合寡核苷酸与可药用的稀释剂、溶剂、载体、盐和/或辅助剂混合。
[0371]
药物组合物
[0372]
在又一个方面,本发明提供药物组合物,其包含前述的任何寡核苷酸和/或寡核苷酸缀合物和可药用的稀释剂、溶剂、载体、盐和/或辅助剂。可药用的稀释剂包括磷酸盐缓冲盐水(pbs)并且可药用的盐包括但不限于钠盐和钾盐。在一些实施方案中,可药用的稀释剂是无菌磷酸盐缓冲盐水。在一些实施方案中,寡核苷酸以50-300μm溶液的浓度用于可药用的稀释剂中。
[0373]
用于本发明中的合适制剂存在于mack publishing company,philadelphia,pa.,第17版,1985中。关于药物递送方法的简要综述,参见例如langer(science 249:1527-1533,1990)。wo 2007/031091进一步提供可药用稀释剂、载体和辅剂的适用和优选示例(所述文献因而通过引用的方式并入)。还在wo2007/031091中提供合适的剂量、制剂、施用途径、组合物、剂型、与其他治疗药组合、前药制剂。
[0374]
本发明的寡核苷酸或寡核苷酸缀合物可以与可药用的活性物质或惰性物质混合以制备药物组合物或制剂。组合物和用于配制药物组合物的方法取决于众多标准,包括但不限于施用途径、疾病程度或待施用剂量。
[0375]
这些组合物可以通过常规消毒技术消毒,或可以进行无菌过滤。可以将所产生的水溶液包装原样使用或冻干,冻干的制备物在施用之前与无菌含水载体组合。制备物的ph
一般将在3和11之间,更优选地在5和9之间或在6和8之间,并且最优选地在7和8之间,如7至7.5。所得到的固体形式的组合物可以按多个单剂量单位包装,每个单剂量单位含有在片剂或胶囊剂的密封包装物中固定量的上文提到的一种药剂或多种药剂。固体形式的组合物也可以包装在可变量的容器中,如包装在设计用于局部可施加乳膏剂或油膏剂的可挤压管中。
[0376]
在一些实施方案中,本发明的寡核苷酸或寡核苷酸缀合物是前药。特别相对于寡核苷酸缀合物,一旦递送前药至作用部位,例如靶细胞,则缀合物部分从寡核苷酸上切下。
[0377]
应用
[0378]
本发明的寡核苷酸或寡核苷酸缀合物可以作为研究试剂用于例如诊断、治疗和预防。
[0379]
在研究中,这类寡核苷酸或寡核苷酸缀合物可以用来特异性调节细胞和实验动物中pd-l1蛋白的合成,因而促进对靶的功能分析或评价其作为治疗性干预用靶的效能。一般,通过降解或抑制产生所述蛋白质的mrna,因而阻止蛋白质形成,或通过降解或抑制产生蛋白质的基因或mrna的调节物,实现靶调节作用。
[0380]
如果在研究或诊断中使用本发明的寡核苷酸,则靶核酸可以是衍生自dna或rna的cdna或合成性核酸。
[0381]
本发明提供调节表达pd-l1的靶细胞中pd-l1表达的体内或体外方法,所述方法包括以有效量向所述细胞施用本发明的寡核苷酸或寡核苷酸缀合物。
[0382]
在一些实施方案中,靶细胞是哺乳动物细胞,尤其人细胞。靶细胞可以是体外细胞培养物或在哺乳动物中形成组织构成部分的体内细胞。在优选的实施方案中,靶细胞存在于肝脏中。肝脏靶细胞可以选自实质细胞(例如肝细胞)和非实质细胞如枯否细胞、lsec、星状细胞(或ito细胞)、胆管上皮细胞和肝脏相关的白细胞(包括t细胞和nk细胞)。在一些实施方案中,靶细胞是抗原呈递细胞。抗原呈递细胞在其表面上展示与主要组织相容性复合体(mhc)i类或ii类复合的外来抗原。在一些实施方案中,抗原呈递细胞表达mhc ii类(即专职抗原呈递细胞如树状细胞、巨噬细胞和b细胞)。
[0383]
在诊断学中,寡核苷酸可以用来通过rna印迹、原位杂交或相似的技术,检测和定量细胞和组织中pd-l1的表达。
[0384]
对于治疗,本发明的寡核苷酸或寡核苷酸缀合物或其药物组合物可以施用至疑似患有疾病或病症的动物或人,其中可以通过减少pd-l1表达、尤其通过减少肝脏靶细胞中pd-l1的表达,减轻或治疗所述疾病或病症。
[0385]
本发明提供治疗或预防疾病的方法,所述方法包括向患有或易患疾病的受试者施用治疗有效量或预防有效量的本发明的寡核苷酸、寡核苷酸缀合物或药物组合物。
[0386]
本发明还涉及用作药物的本发明的寡核苷酸、寡核苷酸缀合物或药物组合物。
[0387]
本发明的寡核苷酸、寡核苷酸缀合物或药物组合物一般以有效量施用。
[0388]
本发明也提供如所述的本发明的寡核苷酸或寡核苷酸缀合物或药物组合物的用途,用于制造治疗如本文提到的疾病或病症的药物。在一个实施方案中,疾病选自a)肝脏病毒性感染如hbv、hcv和hdv;b)寄生物感染如疟疾、弓形虫病、利什曼病和锥虫病;和c)肝脏中的肝癌或转移灶。
[0389]
在一个实施方案中,本发明涉及用于治疗选自病毒或寄生物感染的疾病或病症的
寡核苷酸、寡核苷酸缀合物或药物组合物。在又一个实施方案中,疾病选自a)肝脏病毒性感染如hbv、hcv和hdv;b)寄生物感染如疟疾、弓形虫病、利什曼病和锥虫病;和c)肝脏中的肝癌或转移灶。
[0390]
如本文提到,疾病或病症与免疫消耗相关。具体地说,疾病或病症与病毒特异性t细胞应答耗竭相关。在一些实施方案中,可以通过减少pd-l1表达来减轻或治疗疾病或病症。
[0391]
本发明的方法优选地用于治疗或预防与免疫消耗相关的疾病。
[0392]
在本发明的一个实施方案中,本发明的寡核苷酸、寡核苷酸缀合物或药物组合物用于恢复肝脏中针对肝癌或转移灶的免疫应答。
[0393]
在本发明的一个实施方案中,本发明的寡核苷酸、寡核苷酸缀合物或药物组合物用于恢复针对病原体的免疫应答。在一些实施方案中,病原体可以存在于肝脏中。病原体可以是病毒或寄生物,尤其本文所述的那些。在一个优选实施方案中,病原体是hbv。
[0394]
本发明还涉及如本文定义的寡核苷酸、寡核苷酸缀合物或药物组合物的用途,用于制造恢复针对如本文提到的病毒感染或寄生物感染的免疫力的药物。
[0395]
本发明的寡核苷酸或寡核苷酸缀合物或药物组合物可以用于治疗病毒性感染、尤其pd-1途径受累的肝脏中的病毒性感染(例如参见kapoor和kottilil 2014future virol vol.9第565-585页和salem和el-badawy 2015world j hepatol vol.7第2449-2458页)。肝脏病毒性感染可以选自肝炎病毒、尤其hbv、hcv和hdv,尤其这些感染的慢性形式。在一个实施方案中,本发明的寡核苷酸或寡核苷酸缀合物或药物组合物用来治疗hbv、尤其慢性hbv。慢性hbv感染的指标是循环中高水平的病毒载量(hbv dna)和甚至更高水平的空hbsag粒子(超过病毒粒》100倍)。
[0396]
本发明的寡核苷酸或寡核苷酸缀合物也可以用来治疗作为hiv共感染发生的肝脏病毒性感染。可以用本发明的寡核苷酸或寡核苷酸缀合物或药物组合物治疗的其他病毒性感染是lcmv(淋巴细胞性脉络丛脑膜炎病毒)和作为单一感染的hiv、hsv-1和-2和其他疱疹病毒。这些病毒无嗜肝性,然而它们可能对pdl1下调敏感。
[0397]
在一些实施方案中,恢复免疫力或免疫应答涉及t细胞和/或nk细胞应答的改善和/或t细胞消耗减轻,尤其hbv特异性t细胞应答、hcv-特异性t细胞应答和或hdv特异性t细胞应答恢复。t细胞应答改善可以例如评定为与对照相比(例如治疗前的水平或溶媒处理的受试者中的水平)时,肝脏中t细胞增加、尤其cd8 和/或cd4 t细胞增加。在又一个实施方案中,它是与对照相比时,病毒特异性cd8 t细胞恢复或增加,尤其与对照相比时,hbv特异性cd8 t细胞或hcv特异性cd8 t细胞或hdv特异性cd8 t细胞恢复或增加。在一个优选实施方案中,与对照相比,用本发明的寡核苷酸、寡核苷酸缀合物或药物组合物治疗的受试者中,对hbv s抗原(hbsag)特异的cd8 t细胞和/或对hbv e抗原(hbeag)特异的cd8 t细胞和/或对hbv核心抗原(hbcag)特异的cd8 t细胞增加。优选地,hbv抗原特异性cd8 t细胞产生一种或多种细胞因子,如干扰素-γ(ifn-γ)或肿瘤坏死因子α(tnf-α)。尤其在肝脏中观察到上文描述的cd8 t细胞增加。本文所述的增加应当与对照相比时是统计显著的。优选地,与对照相比时,增加至少20%,如25%,如50%,如75%。在另一个实施方案中,天然杀伤(nk)细胞和/或天然杀伤t(nkt)细胞由本发明的寡核苷酸或寡核苷酸缀合物活化。
[0398]
本发明的寡核苷酸或寡核苷酸缀合物或药物组合物可以用于治疗寄生物感染,尤
其pd-1途径受累的寄生物感染(例如参见bhadra等人2012j infect dis vol 206第125-134页;bhadra等人2011proc natl acad sci u s a vol.108第9196-9201页;esch等人j immunol vol 191第5542-5550页;freeman和sharpe 2012nat immunol vol 13第113-115页;gutierrez等人2011 infect immun vol 79第1873-1881页;joshi等人2009plos pathog vol 5e1000431;liang等人2006eur j immunol vol.36第58-64页;wykes等人2014front microbiol vol 5pp 249)。寄生物感染可以选自疟疾、弓形虫病、利什曼病和锥虫病。疟疾感染由疟原虫属(plasmodium)原虫、尤其物种间日疟原虫、三日疟原虫和恶性疟原虫引起。弓形虫病是刚地弓形虫(toxoplasma gondii)引起的寄生虫病。利什曼病是利什曼属(leishmania)原生动物寄生物引起的疾病。锥虫病由锥虫属(trypanosoma)原生动物引起。南美锥虫病是枯氏锥虫(trypanosoma cruzi)引起的热带形式由,并且睡眠病由布氏锥虫(trypanosoma brucei)引起。
[0399]
在一些实施方案中,恢复免疫力包括恢复寄生物特异性t细胞和nk细胞应答、尤其疟原虫属特异性t细胞应答、刚地弓形虫(toxoplasma gondii)特异性t细胞和nk细胞应答、利什曼属(leishmania)特异性t细胞和nk细胞应答、枯氏锥虫特异性t细胞和nk细胞应答或布氏锥虫特异性t细胞和nk细胞应答。在又一个实施方案中,恢复寄生物特异性cd8 t细胞应答和nk细胞应答。
[0400]
施用
[0401]
本发明的寡核苷酸或药物组合物可以局部(如,施用至皮肤、吸入、眼部或耳)或肠内(如,口服或通过胃肠道)或肠胃外(如,静脉内、皮下、肌内、脑内、脑室内或鞘内)施用。
[0402]
在一个优选实施方案中,通过肠胃外途径施用本发明的寡核苷酸或药物组合物,所述肠胃外途径包括静脉内、动脉内、皮下、腹膜内或肌内注射或输注、鞘内或颅内例如脑内或脑室内、玻璃体内施用。在一个实施方案中,静脉内施用有活性的寡核苷酸或寡核苷酸缀合物。在另一个实施方案中,皮下施用活性的寡核苷酸或寡核苷酸缀合物。
[0403]
在一些实施方案中,本发明的寡核苷酸、寡核苷酸缀合物或药物组合物按照0.1
–
15mg/kg,如0.1
–
10mg/kg,如0.2
–
10mg/kg,如0.25
–
10mg/kg,如0.1
–
5mg/kg,如0.2
–
5mg/kg,如0.25
–
5mg/kg的剂量施用。施用可以是一周一次、每2周、每三周或甚至每月一次。
[0404]
联合疗法
[0405]
在一些实施方案中,本发明的寡核苷酸、寡核苷酸缀合物或药物组合物用于与另一种治疗药的联合治疗中。治疗药可以例如是用于上描疾病或病症的标准护理。
[0406]
为了治疗慢性hbv感染,推荐抗病毒药物和免疫系统调节物的组合作为标准护理。有效对抗hbv的抗病毒药物是例如核苷(酸)类似物。存在五类注册用于治疗hbv的核苷(酸)类似物,即拉米夫定(epivir)、阿德福韦(hepsera)、替诺福韦(viread)、替比夫定(tyzeka)、恩替卡韦(baraclude)。这些类似物有效阻抑病毒复制(hbv dna),但不影响hbsag水平。其他抗病毒药物包括利巴韦林和(单克隆或多克隆)hbv抗体疗法。免疫系统调节物可以例如是干扰素α-2a和peg化干扰素α-2a(pegasys)或tlr7激动剂(例如gs-9620)或治疗性疫苗。ifn-α治疗仅显示非常轻微的减少病毒载量的效果,但导致hbsag的某种下降,即便很没有效率(48周治疗后《10%)。
[0407]
本发明的寡核苷酸或寡核苷酸缀合物也可以与有效对抗hbv的其他抗病毒药物如wo2012/145697和wo 2014/179629中描述的反义寡核苷酸或wo 2005/014806,wo 2012/
024170、wo 2012/2055362、wo 2013/003520和wo 2013/159109中描述的sirna分子组合。
[0408]
当本发明的寡核苷酸或寡核苷酸缀合物在联合疗法中与其他药物一起施用时,它们可以依次或同时施用至个体。备选地,本发明的药物组合物可以由本发明的寡核苷酸或寡核苷酸缀合物结合如本文所述的可药用溶媒和本领域已知的另一个治疗药或预防药的组合组成。
[0409]
实施方案
[0410]
本发明的以下实施方案可以与本文所述的任何其他实施方案组合使用。
[0411]
1.反义寡核苷酸,其包含能够减少pd-l1表达的10至30个核苷酸长度的连续核苷酸序列或由其组成。
[0412]
2.实施方案1的寡核苷酸,其中连续核苷酸序列与pd-l1靶核酸至少90%互补。
[0413]
3.实施方案1或2的寡核苷酸,其中连续核苷酸序列与选自seq id no:1、seq id no:2和/或seq id no:3的靶核酸互补。
[0414]
4.实施方案1至3的寡核苷酸,其中连续核苷酸序列与seq id no:1上位置1和15720范围内的区域互补。
[0415]
5.实施方案1至4的寡核苷酸,其中寡核苷酸能够与选自seq id no:1、seq id no:2和/或seq id no:3的靶核酸以低于-10kcal的δg
°
杂交。
[0416]
6.实施方案1至5的寡核苷酸,其中连续核苷酸序列与靶核酸的子序列互补,其中子序列选自seq id no:1上的位置371-3068、5467-12107、15317-15720、15317-18083、15317-19511和18881-19494。
[0417]
7.实施方案6的寡核苷酸,其中子序列选自seq id no:1上的位置7300-7333、8028-8072、9812-9859、11787-11873和15690-15735。
[0418]
8.实施方案2至7的寡核苷酸,其中靶核酸是rna。
[0419]
9.实施方案8的寡核苷酸,其中rna是mrna。
[0420]
10.实施方案9的寡核苷酸,其中mrna是前mrna或成熟mrna。
[0421]
11.实施方案1-10的寡核苷酸,其中连续核苷酸序列包含至少14个连续核苷酸、尤其15、16、17、18、19、20、21、22、23或24个连续核苷酸或由其组成。
[0422]
12.实施方案1-10的寡核苷酸,其中连续核苷酸序列包含16至20个核苷酸或由其组成。
[0423]
13.实施方案1-10的寡核苷酸,其中寡核苷酸包含14至35个核苷酸长度或由其组成。
[0424]
14.实施方案13的寡核苷酸,其中寡核苷酸包含18至22个核苷酸长度或由其组成。
[0425]
15.实施方案1-14的寡核苷酸,其中寡核苷酸或连续核苷酸序列是单链。
[0426]
16.实施方案1-15的寡核苷酸,其中连续核苷酸序列与靶核酸的子序列互补,其中子序列选自a7、a26、a43、a119、a142、a159、a160、a163、a169、a178、a179、a180、a189、a201、a202、a204、a214、a221、a224、a226、a243、a254、a258、269、a274、a350、a360、a364、a365、a370、a372、a381、a383、a386、a389、a400、a427、a435和a438。
[0427]
17.实施方案16的寡核苷酸,其中子序列选自a221、a360、a180、a160和a269。
[0428]
18.实施方案1-17的寡核苷酸,其中寡核苷酸不是sirna并且不自身互补。
[0429]
19.实施方案1-18的寡核苷酸,其中连续核苷酸序列包含选自seq id no:5至743
或771的序列或由其组成。
[0430]
20.实施方案1-19的寡核苷酸,其中连续核苷酸序列包含选自seq id no:6、8、9、13、41、42、58、77、92、111、128、151、164、166、169、171、222、233、245、246、250、251、252、256、272、273、287、292、303、314、318、320、324、336、342、343、344、345、346、349、359、360、374、408、409、415、417、424、429、430、458、464、466、474、490、493、512、519、519、529、533、534、547、566、567、578、582、601、619、620、636、637、638、640、645、650、651、652、653、658、659、660、665、678、679、680、682、683、684、687、694、706、716、728、733、734和735的序列或由其组成。
[0431]
21.实施方案1-20的寡核苷酸,其中连续核苷酸序列包含选自seq id no:466、640、342、287和566的序列或由其组成。
[0432]
22.实施方案1-21的寡核苷酸,其中相比与之互补的靶核酸,连续核苷酸序列具有零至三个错配。
[0433]
23.实施方案22的寡核苷酸,其中与靶核酸相比,连续核苷酸序列具有一个错配。
[0434]
24.实施方案22的寡核苷酸,其中与靶核酸相比,连续核苷酸序列具有二个错配。
[0435]
25.实施方案22的寡核苷酸,其中连续核苷酸序列与靶核酸序列完全互补。
[0436]
26.实施方案1-25的寡核苷酸,包含一个或多个修饰的核苷。
[0437]
27.实施方案26的寡核苷酸,其中一个或多个修饰的核苷是高亲和力修饰的核苷。
[0438]
28.实施方案26或27的寡核苷酸,其中一个或多个修饰的核苷是2’糖修饰的核苷。
[0439]
29.实施方案28的寡核苷酸,其中一个或多个2’糖修饰的核苷独立地选自2
’‑
o-烷基-rna、2'-o-甲基-rna、2
’‑
烷氧基-rna、2
’‑
o-甲氧乙基-rna、2
’‑
氨基-dna、2'-氟-dna、2'-氟-ana和lna核苷。
[0440]
30.实施方案28的寡核苷酸,其中一个或多个修饰的核苷是lna核苷。
[0441]
31.实施方案30的寡核苷酸,其中修饰的lna核苷是氧基-lna。
[0442]
32.实施方案31的寡核苷酸,其中修饰的核苷是β-d-氧基-lna。
[0443]
33.实施方案30的寡核苷酸,其中修饰的核苷是硫代-lna。
[0444]
34.实施方案30的寡核苷酸,其中修饰的核苷是氨基-lna。
[0445]
35.实施方案30的寡核苷酸,其中修饰的核苷是cet。
[0446]
36.实施方案30的寡核苷酸,其中修饰的核苷是ena。
[0447]
37.实施方案30的寡核苷酸,其中修饰的lna核苷选自β-d-氧基-lna、α-l-氧基-lna、β-d-氨基-lna、α-l-氨基-lna、β-d-硫代-lna、α-l-硫代-lna、(s)cet、(r)cetβ-d-ena和α-l-ena。
[0448]
38.实施方案30-37的寡核苷酸,其中除修饰的lna核苷之外还存在至少一个2’取代的修饰的核苷。
[0449]
39.实施方案38的寡核苷酸、其中2’取代的修饰的核苷选自2
’‑
o-烷基-rna、2'-o-甲基-rna、2
’‑
烷氧基-rna、2
’‑
o-甲氧乙基-rna(moe)、2
’‑
氨基-dna、2'-氟-dna、2'-氟-ana。
[0450]
40.实施方案1-39中任一个实施方案的寡核苷酸,其中寡核苷酸包含至少一个修饰的核苷间键。
[0451]
41.实施方案40的寡核苷酸,其中修饰的核苷间键是抗核酸酶的。
[0452]
42.实施方案40或41的寡核苷酸,其中连续核苷酸序列内部至少50%的核苷间键是硫代磷酸酯核苷间键或硼烷磷酸酯核苷间键。
[0453]
43.实施方案40或41的寡核苷酸,其中连续核苷酸序列内部的全部核苷间键均是硫代磷酸酯核苷间键。
[0454]
44.实施方案1-43的寡核苷酸,其中寡核苷酸能够召集rna酶h。
[0455]
45.实施方案44的寡核苷酸,其中寡核苷酸是缺口聚物。
[0456]
46.实施方案44或45的寡核苷酸,其中寡核苷酸是式5
’‑
f-g-f
’‑3’
的缺口聚物,其中区域f和f’独立地包含1-7个修饰的核苷或由其组成并且g是能够召集rna酶h的具有6个和16个核苷之间的区域。
[0457]
47.实施方案44或45的寡核苷酸,其中缺口聚物具有式5
’‑d’‑
f-g-f
’‑3’
或5
’‑
f-g-f
’‑d”‑3’
,其中区域f和f’独立地包含1-7个修饰的核苷,g是能够召集rna酶h的具有6个和16个核苷之间的区域,并且区域d’或d”包含磷酸二酯连接的1-5个核苷。
[0458]
48.实施方案47的寡核苷酸,其中d’或d”是任选的。
[0459]
49.实施方案47的寡核苷酸,其中区域d’由磷酸二酯连接的二个核苷组成。
[0460]
50.实施方案49的寡核苷酸,其中磷酸二酯连接的核苷是ca(胞苷-腺苷)。
[0461]
51.实施方案46或47的寡核苷酸,其中修饰的核苷是独立选自2
’‑
o-烷基-rna、2'-o-甲基-rna、2
’‑
烷氧基-rna、2
’‑
o-甲氧乙基-rna、2
’‑
氨基-dna、2'-氟-dna、阿糖核酸(ana)、2'-氟-ana和lna核苷的2’糖修饰的核苷。
[0462]
52.实施方案46至51的寡核苷酸,其中区域f和f’中的一个或多个修饰的核苷在是lna核苷。
[0463]
53.实施方案52的寡核苷酸,其中区域f和f’中全部修饰的核苷均是lna核苷。
[0464]
54.实施方案53的寡核苷酸,其中区域f和f’由lna核苷组成。
[0465]
55.实施方案52-54的寡核苷酸,其中区域f和f’中全部修饰的核苷均是氧基-lna核苷。
[0466]
56.实施方案52的寡核苷酸,其中区域f或f’至少之一还包含至少一个独立选自2
’‑
o-烷基-rna、2'-o-甲基-rna、2
’‑
烷氧基-rna、2
’‑
o-甲氧乙基-rna、2
’‑
氨基-dna和2'-氟-dna的2’取代的修饰的核苷。
[0467]
57.实施方案46-56的寡核苷酸,其中区域g中的rna酶h召集核苷独立选自dna、α-l-lna、c4’烷基化dna、ana和2'f-ana和una。
[0468]
58.实施方案57的寡核苷酸,其中区域g中的核苷是dna和/或α-l-lna核苷。
[0469]
59.实施方案57或58的寡核苷酸,其中区域g由至少75%的dna核苷组成。
[0470]
60.实施方案1-59的寡核苷酸,其中寡核苷酸选自cmp id no:5_1至743_1和771_1的任一者(表5)。
[0471]
61.实施方案1-60的寡核苷酸,其中寡核苷酸选自cmp id no:6_1、8_1、9_1、13_1、41_1、42_1、58_1、77_1、92_1、111_1、128_1、151_1、164_1、166_1、169_1、171_1、222_1、233_1、245_1、246_1、250_1、251_1、252_1、256_1、272_1、273_1、287_1、292_1、303_1、314_1、318_1、320_1、324_1、336_1、342_1、343_1、344_1、345_1、346_1、349_1、359_1、360_1、374_1、408_1、409_1、415_1、417_1、424_1、429_1、430_1、458_1、464_1、466_1、474_1、490_1、493_1、512_1、519_1、519_1、529_1、533_1、534_1、547_1、566_1、567_1、578_1、582_1、601_
1、619_1、620_1、636_1、637_1、638_1、640_1、645_1、650_1、651_1、652_1、653_1、658_1、659_1、660_1、665_1、678_1、679_1、680_1、682_1、683_1、684_1、687_1、694_1、706_1、716_1、728_1、733_1、734_1和735_1。
[0472]
62.实施方案1-61的寡核苷酸,其中寡核苷酸选自cmp id no:287_1、342_1、466_1、640_1、566_1、766_1、767_1、768_1、769_1和770_1。
[0473]
63.反义寡核苷酸缀合物,包含
[0474]
a.根据权利要求1-62中任一项所述的寡核苷酸(区域a);和
[0475]
b.至少一个与所述寡核苷酸共价连接的缀合物部分(区域c)。
[0476]
64.实施方案63的寡核苷酸缀合物,其中缀合物部分选自糖、细胞表面受体配体、药物、激素、亲脂物质、聚合物、蛋白质、肽、毒素、维生素、病毒蛋白或其组合。
[0477]
65.实施方案63或64的寡核苷酸缀合物,其中缀合物部分是含有糖的部分。
[0478]
66.实施方案65的寡核苷酸缀合物,其中糖缀合物部分包含至少一个与根据权利要求1-62中任一项所述的寡核苷酸共价连接的靶向脱唾液酸糖蛋白受体的部分。
[0479]
67.实施方案66的寡核苷酸缀合物,其中靶向脱唾液酸糖蛋白受体的缀合物部分包含至少一个选自半乳糖、半乳糖胺、n-甲酰半乳糖胺、n-乙酰半乳糖胺、n-丙酰半乳糖胺、n-正丁酰半乳糖胺和n-异丁酰半乳糖胺的糖部分。
[0480]
68.实施方案66或67的寡核苷酸缀合物,其中靶向脱唾液酸糖蛋白受体的缀合物部分是单价、二价、三价或四价的。
[0481]
69.寡聚体缀合物实施方案68,其中靶向脱唾液酸糖蛋白受体的缀合物部分由二至四个末端galnac部分组成,peg间隔团将每个galnac部分与分支分子连接。
[0482]
70.实施方案66至69的寡核苷酸缀合物,其中靶向脱唾液酸糖蛋白受体的缀合物部分是三价n-乙酰半乳糖胺(galnac)部分。
[0483]
71.实施方案66至70的寡核苷酸缀合物,其中缀合物部分选自图1中的三价galnac部分之一。
[0484]
72.实施方案71的寡核苷酸缀合物,其中缀合物部分是图3中的三价galnac部分。
[0485]
73.实施方案63-72的寡核苷酸缀合物,其中接头存在于寡核苷酸或连续寡核苷酸序列和缀合物部分之间。
[0486]
74.实施方案73的寡核苷酸缀合物,其中接头是生理不稳定接头(区域b)。
[0487]
75.实施方案74的寡核苷酸缀合物,其中生理不稳定接头是核酸酶敏感接头。
[0488]
76.实施方案74或75的寡核苷酸缀合物,其中生理不稳定接头由2至5个连续磷酸二酯键组成。
[0489]
77.实施方案76的寡核苷酸缀合物,其中生理不稳定接头等同于实施方案47至50中提出的区域d’或d”。
[0490]
78.实施方案63-77中任一个实施方案的寡核苷酸缀合物,其中寡核苷酸缀合物选自cmp id no:766_2、767_2、768_2、769_2和770_2。
[0491]
79.实施方案78的寡核苷酸缀合物,其中寡核苷酸缀合物选自图4、图5、图6、图7和图8中代表的寡核苷酸缀合物。
[0492]
80.实施方案63-76的寡核苷酸缀合物,如与未缀合的寡核苷酸相比,所述寡核苷酸缀合物显示靶细胞中对pd-l1的抑制作用改善或肝脏和脾之间的细胞分布改善或寡核苷
酸缀合物向肝脏的细胞摄取改善。
[0493]
81.药物组合物,包含实施方案1-62的寡核苷酸或实施方案63-80的缀合物和可药用的稀释剂、载体、盐和/或辅助剂。
[0494]
82.用于制造实施方案1-62的寡核苷酸的方法,包括使核苷酸单位反应,因而形成包含于寡核苷酸中的共价连接的连续核苷酸单位。
[0495]
83.实施方案82的方法,还包括使连续核苷酸序列与非核苷酸缀合部分反应。
[0496]
84.用于制造实施方案81的组合物方法,包括将寡核苷酸与可药用的稀释剂、载体、盐和/或辅助剂混合。
[0497]
85.调节表达pd-l1的靶细胞中pd-l1表达的体内或体外方法,所述方法包括以有效量向所述细胞施用实施方案1-62的寡核苷酸或实施方案63-80的缀合物或实施方案81的药物组合物。
[0498]
86.治疗或预防疾病的方法,包括向患有或易患疾病的受试者施用治疗有效量或预防有效量的实施方案1-62的寡核苷酸或实施方案63-80的缀合物或实施方案81的药物组合物。
[0499]
87.恢复针对病毒或寄生物的免疫力的方法,包括向病毒或寄生物感染的受试者施用治疗有效量或预防有效量的实施方案1-62的寡核苷酸或实施方案63-80的缀合物或实施方案81的药物组合物。
[0500]
88.实施方案87的方法,免疫力恢复是与对照相比时,肝脏中对一种或多种hbv抗原特异的cd8 t细胞增加。
[0501]
89.实施方案1-62的寡核苷酸或实施方案63-80的缀合物或实施方案81的药物组合物,用作治疗或预防受试者中疾病的药物。
[0502]
90.实施方案1-62的寡核苷酸或实施方案63-80的缀合物的用途,用于制备治疗或预防受试者中疾病的药物。
[0503]
91.实施方案1-62的寡核苷酸或实施方案63-80的缀合物或实施方案81的药物组合物,用于恢复针对病毒或寄生物的免疫力。
[0504]
92.实施方案91的用途,其中免疫力恢复是与对照相比时,肝脏中对一种或多种hbv抗原特异的cd8 t细胞增加。
[0505]
93.实施方案92的用途,其中hbv抗原是hbsag。
[0506]
94.实施方案86-93的方法、寡核苷酸或用途,其中疾病与pd-l1的体内活性相关。
[0507]
95.实施方案86-94的方法、寡核苷酸或用途,其中疾病与抗原呈递细胞中pd-l1的表达增加相关。
[0508]
96.实施方案95的方法、寡核苷酸或用途,其中与不用实施方案1-62的寡核苷酸或实施方案63-80的缀合物或实施方案81的药物组合物处理的情况下或用其处理前的表达相比,pd-l1减少至少30%、或至少40%、或至少50%、或至少60%、或至少70%、或至少80%、或至少90%、或至少95%。
[0509]
97.实施方案86-95的方法、寡核苷酸或用途,其中疾病选自肝脏病毒性感染或寄生物感染。
[0510]
98.实施方案98的方法、寡核苷酸或用途,其中病毒性感染是hbv、hcv或hdv。
[0511]
99.实施方案86-95的方法、寡核苷酸或用途,其中疾病是慢性hbv。
[0512]
100.实施方案98的方法、寡核苷酸或用途,其中寄生物感染是疟疾、弓形虫病、利什曼病或锥虫病。
[0513]
101.实施方案86-100的方法、寡核苷酸或用途,其中受试者是哺乳动物。
[0514]
102.实施方案101的方法、寡核苷酸或用途,其中哺乳动物是人。
实施例
[0515]
材料和方法
[0516]
基序序列和寡核苷酸化合物
[0517]
表5:靶向人pd-l1转录物(seq id no:1)的寡核苷酸基序序列(用seq id no表示)、它们的设计以及基于该基序序列设计的特定反义寡核苷酸化合物(用cmp id no表示)的列表。
[0518]
[0519]
[0520]
[0521]
[0522]
[0523]
[0524]
[0525]
[0526]
[0527]
[0528]
[0529]
[0530]
[0531]
[0532]
[0533]
[0534]
[0535]
[0536][0537]
基序序列代表寡核苷酸中存在的连续核碱基序列。
[0538]
设计指缺口聚物设计f-g-f’,其中每个数字表示连续的修饰的核苷的数目,例如,2’修饰的核苷(第一个数字=5’侧翼),随后是dna核苷的数目(第二个数字=缺口区域),随后是修饰的核苷的数目,例如2’修饰的核苷(第三个数字=3’侧翼),任选地前置有或跟随其他的dna和lna重复区域,这些区域并不必然是与靶核酸互补的连续序列的部分。
[0539]
寡核苷酸化合物代表特定的基序序列设计。大写字母代表β-d-氧基lna核苷,小写字母代表dna核苷,全部lna c均是5-甲基胞嘧啶,全部核苷间键均是硫代磷酸酯核苷间键
[0540]
表6:靶向小鼠pd-l1转录物(seq id no:4)的寡核苷酸、它们的设计以及基于该基序序列设计的特定寡核苷酸化合物(用cmp id no表示)的列表。
[0541]
[0542][0543]
基序序列代表寡核苷酸中存在的连续核碱基序列。
[0544]
设计指缺口聚物设计f-g-f’,其中每个数字表示连续的修饰的核苷的数目,例如,2’修饰的核苷(第一个数字=5’侧翼),随后是dna核苷的数目(第二个数字=缺口区域),随后是修饰的核苷的数目,例如2’修饰的核苷(第三个数字=3’侧翼),任选地前置有或跟随其他的dna和lna重复区域,这些区域并不必然是与靶核酸互补的连续序列的部分。
[0545]
寡核苷酸化合物代表特定的基序序列设计。大写字母代表β-d-氧基lna核苷,小写字母代表dna核苷,全部lna c均是5-甲基胞嘧啶,全部核苷间键均是硫代磷酸酯核苷间键
[0546]
表7:具有5’ca生物可切割接头的寡核苷酸基序序列和反义化合物。
[0547][0548][0549]
大写字母代表β-d-氧基lna核苷,小写字母代表dna核苷,全部lna c均是5-甲基胞嘧啶,下标o代表磷酸二酯核苷间键,并且如果不另外指出,则其他的核苷间键是硫代磷酸酯核苷间键。
[0550]
表8:galnac缀合的反义寡核苷酸化合物
[0551]
反义寡核苷酸缀合物cmp id no
gn2-c6
ocoao
agtttacattttctgc755_2gn2-c6
ocoao
tatgtgaagaggagag756_2gn2-c6
ocoao
cacctttaaaacccca757_2gn2-c6
ocoao
tcctttataatcacac758_2gn2-c6
ocoao
acggtattttcacagg759_2gn2-c6
ocoao
gacactacaatgagga760_2gn2-c6
ocoao
tggtttttaggactgt761_2gn2-c6
ocoao
cgacaaattctatcct762_2gn2-c6
ocoao
tgatatacaatgctac763_2gn2-c6
ocoao
tcgttgggtaaattta764_2gn2-c6
ocoao
tgctttataaatggtg765_2gn2-c6
ocoao
acaaataatggttactct766_2gn2-c6
ocoao
cagattgatggtagtt767_2gn2-c6
ocoao
cctatttaacatcagac768_2gn2-c6
ocoao
ctaattgtagtagtactc769_2gn2-c6
ocoao
ataaacatgaatctctcc770_2
[0552]
gn2表示图3中显示的三价galnac簇,c6表示具有6个碳的氨基烷基,大写字母代表β-d-氧基lna核苷,小写字母代表dna核苷,全部lna c均是5-甲基胞嘧啶,下标o代表磷酸二酯核苷键并且除非另外说明,否则核苷间键是硫代磷酸酯核苷间键。图4至图8中显示代表某些分子的化学绘图。
[0553]
aav/hbv小鼠模型
[0554]
巴斯德模型:
[0555]
在巴斯德研究所产生并繁育hla-a2.1-/hla-dr1-转基因h-2i类-/ii类-敲除(本文称作hla-a2/dr1)小鼠。这些小鼠代表对小鼠mhc应答没有任何干扰的用于人免疫功能研究的体内实验模型(pajot等人2004eur j immunol.34(11):3060-9)。
[0556]
这些研究中使用携带复制型hbv dna基因组的aav血清型2/8腺相关病毒(aav)载体。将aav-hbv载体(批次gvpn#6163)稀释于无菌磷酸盐缓冲盐水(pbs)中以实现滴度5x10
11
vg/ml。将小鼠用100μl这种稀释的溶液(剂量/小鼠:5x10
10
vg)在尾静脉中静脉内注射(i.v.)。在hbv携带小鼠的血液中检出含有hbv dna的完整病毒粒子。检出肝脏中的hbcag连同血液中的hbv循环型蛋白质hbeag和hbsag长达一年。在aav2/8-hbv转导的全部小鼠中,hbsag、hbeag和hbv dna持续存在于血清中至少一年(dion等人2013j virol 87:5554-5563)。
[0557]
上海模型:
[0558]
在这个模型中,携带hbv基因组的重组腺相关病毒(aav)(aav/hbv)感染的小鼠维持稳定的病毒血症及抗原血症超过30周(dan yang等人,2014cellular&molecular immunology 11,71
–
78)。
[0559]
无特定病原体的雄性c57bl/6小鼠(4-6周龄)购自slac(中国科学院上海实验动物中心)并且圈养在动物护理设施中独立通风的笼内。遵循如wuxi iacuc所示的动物护理和使用指南(研究机构动物护理和使用委员会,wuxi iacuc研究方案编号r20131126-小鼠)。
允许小鼠适应新环境3天并将其根据实验设计分组。
[0560]
将重组aav-hbv稀释于pbs中,每次注射200μl。这种重组病毒携带1.3拷贝的hbv基因组(基因型d,血清型ayw)。
[0561]
在第0日,用200μl aav-hbv通过尾静脉注射全部小鼠。在aav注射后第6、第13和第20日,对全部小鼠进行下颌下放血(0.1ml血液/小鼠)以采集血清。在注射后第22天,具有稳定病毒血症的小鼠为寡核苷酸处理做好准备。寡核苷酸可以是未缀合的或是galnac缀合的。
[0562]
dna疫苗
[0563]
质粒dna是无内毒素的并由plasmid-factory生产(德国)。pcmv-s2.s ayw编码hbsag(基因型d)的前s2结构域和s结构域,并且其表达受巨细胞病毒立即早期基因启动子控制(michel等人1995proc natl acad sci u s a 92:5307-5311)。pcmv-hbc编码携带肝炎核心(hbc)ag的hbv衣壳(dion等人2013j virol 87:5554-5563)。
[0564]
如本文所述那样实施dna疫苗处理。免疫接种前五天,将心脏毒素(cardiotoxine)(catx,latoxan refl81-02,50μl/肌肉)注入小鼠的肌肉。catx使肌肉纤维去极化,以诱导细胞变性,注射后5天,新肌肉纤维将出现并且将接受dna疫苗以获得更好转染效力。将pcmv-s2.s ayw和pcmvcore各自按1mg/ml等量混合并且通过麻醉(100μl 12.5mg/ml氯胺酮,1.25mg/ml赛拉嗪)下,如先前michel等人1995proc natl acad sci u s a 92:5307-5311中所述那样双侧肌内注入心脏毒素处理胫前肌,每只小鼠接受总计100μg。
[0565]
抗pd-l1抗体
[0566]
这是genetech内部产生的小鼠抗小鼠pd-l1 igg1抗体克隆6e11。它是交叉阻断阿特朱单抗并且与roche内部生产的阿特朱单抗具有相似体外阻断活性的代用抗体。通过腹膜内(i.p.)按剂量12.5μg/g注射,施用抗体。
[0567]
寡核苷酸合成
[0568]
本领域公知寡核苷酸合成。下文是可以应用的方案。可以通过就所用装置、支持物和浓度而言略微不同的方法产生本发明的寡核苷酸。
[0569]
在oligomaker 48上按1μmol规模,在尿苷通用支持物上使用磷酰亚胺方案合成寡核苷酸。在合成结束时,使用氨水在60℃持续5-16小时,从固相支持物切下寡核苷酸。通过反相hplc(rp-hplc)或通过固相提取纯化寡核苷酸并通过uplc表征,并且通过esi-ms进一步确认分子质量。
[0570]
寡核苷酸的延伸:
[0571]
通过使用乙腈中0.1m 5
’‑
o-dmt保护的亚酰胺溶液和乙腈中的dci(4,5
–
二氰基咪唑)(0.25m)作为激活物,进行β-氰基乙基-磷酰亚胺的偶联(dna-a(bz)、dna-g(ibu)、dna-c(bz)、dna-t、lna-5-甲基-c(bz)、lna-a(bz)、lna-g(dmf)或lna-t)。对于最终循环,可以使用具有目的修饰的磷酰亚胺,例如用于连接缀合物基团的c6接头或缀合物基团本身。通过使用氢化黄原素(xanthane hydride)(乙腈/吡啶9:1中0.01m),实施用于引入硫代磷酸酯键的硫化。可以使用thf/吡啶/水7:2:1中的0.02m碘,引入磷酸二酯键。其余试剂是一般用于寡核苷酸合成的那些试剂。
[0572]
对于固相合成后缀合,一种市售c6氨基接头磷酰亚胺可以用于固相合成的最后循环,并且在脱保护和从固相支持物切下后,分离氨基连接的去保护的寡核苷酸。使用标准合
成方法,借助官能团的活化引入缀合物。
[0573]
备选地,通过使用如pct/ep2015/073331中或欧洲申请号15194811.4中所述的galnac-或galnac-簇磷酰亚胺,可以将缀合物部分在仍位于固相支持物上时添加至寡核苷酸。
[0574]
rp-hplc纯化:
[0575]
在phenomenex jupiter c18 10μ150x10mm柱上通过制备性rp-hplc纯化粗制化合物。以流速5ml/分钟使用0.1m乙酸铵ph 8和乙腈作为缓冲液。将收集的级分冻干以产生一般作为白色固体的纯化化合物。
[0576]
缩写:
[0577]
dci:4,5-二氰基咪唑
[0578]
dcm:二氯甲烷
[0579]
dmf:二甲基甲酰胺
[0580]
dmt:4,4
’‑
二甲氧基三苯甲基
[0581]
thf:四氢呋喃
[0582]
bz:苯甲酰基
[0583]
ibu:异丁酰基
[0584]
rp-hplc:反相高效液相色谱
[0585]
tm测定法
[0586]
将寡核苷酸和rna靶(磷酸酯连接的,po)双链体在500ml无rna酶水中稀释至3mm并与500ml 2x t
m-缓冲液(200mm nacl,0.2mm edta,20mm磷酸钠,ph 7.0)混合。将溶液加热到95℃持续3分钟并且随后允许在室温复性30分钟。在配备了使用pe templab软件的peltier温度编程器ptp6的lambda 40uv/vis分光光度计(perkin elmer)上测量双链体解链温度(tm)。温度从20℃斜升至95℃并且随后下调到25℃,记录在260nm的吸收。解链和复性的一阶导数和局部最大值用来评估双链体tm。
[0587]
组织特异性体外接头切割测定法
[0588]
使用有关组织(例如肝或肾)的匀浆和血清,对具有待测试生物可切割接头(例如dna磷酸二酯接头(po接头))的fam标记的寡核苷酸进行体外切割。
[0589]
从合适的动物(例如小鼠、猴、猪或大鼠)采集组织样品和血清样品并且在匀浆缓冲液(0.5%igepal ca-630、25mm tris ph 8.0,100mm nacl,ph 8.0(用1n naoh调节)中匀浆。将组织匀浆和血清掺入寡核苷酸至浓度200μg/g组织。将样品在37℃温育24小时并且此后将样品用酚-氯仿提取。随后使用dionex dnapac p-100柱和范围从ph 7.5 10mm
–
1m高氯酸钠的梯度,将溶液在dionex ultimate 3000上进行aie hplc分析。使用荧光检测器在615nm和紫外检测器在260nm,相对于标准物,测定切割的和未切割的寡核苷酸的含量。
[0590]
s1核酸酶切割测定法
[0591]
fam标记的具有s1核酸酶敏感接头(例如dna磷酸二酯接头(po接头))的寡核苷酸在s1核酸酶提取物或血清中接受体外切割。
[0592]
将100μm寡核苷酸在核酸酶缓冲液(60u pr.100μl)中接受s1核酸酶体外切割20分钟和120分钟。通过向缓冲溶液添加edta终止酶活性。随后使用dionex dnapac p-100柱和范围从ph 7.5 10mm
–
1m高氯酸钠的梯度,将溶液在dionex ultimate 3000上进行aie hplc
biosciences 554418)的抗体在4℃于黑暗下进行胞内细胞因子染色30分钟。在通过流式细胞术使用macsquant分析仪分析之前,将细胞用perm/wash洗涤并重悬于含有1%甲醛的pbs facs中。
[0602]
对活的cd3 cd8 cd4-细胞和cd3 cd8-cd4 细胞设门并以点图展示。对每种细胞因子,确定两个区域对阳性细胞设门。这些门中存在的事件的数目除以亲本群体中事件的总数以产生反应t细胞的百分数。对于每只小鼠,仅用培养基时所获得的百分数视为背景并且从肽刺激时所获得的百分数扣除。
[0603]
根据实验背景确定阳性阈值,即仅培养基条件下对每个组获得的平均染色细胞百分数加二个标准偏差。仅将代表至少5个事件的细胞因子百分数视为阳性。
[0604]
表9:hbv核心蛋白和hbsag(s2 s)的包膜结构域中所含的hla-a2/dr1限制性表位。
[0605]
[0606][0607]
实施例1测试体外效力
[0608]
主要使用16聚至20聚缺口聚物,跨人pd-l1转录物进行基因步行。在体外实验中在人白血病单核细胞系thp1中和在人非霍奇金k淋巴瘤细胞系(karpas-299)中进行效力检验。
[0609]
细胞系
[0610]
thp1和karpas-299细胞系最初购自欧洲认证细胞培养物保藏中心(ecacc)并且如供应商推荐在37℃含5%co2的增湿培养箱中维持。
[0611]
寡核苷酸效力
[0612]
将thp-1细胞(rpmi-glutamax,10%fbs,1%pen-strep(thermo fisher scientific)中的3x 104个)添加至寡核苷酸(4-5ul),加入96孔圆底板并且以终体积100μl/孔培养6天。以一个单一浓度(20μm)及在25μm至0.004μm的剂量-范围浓度(水中1:3稀释)筛选寡核苷酸。根据生产商的说明,使用magna pure 96细胞rna大体积试剂盒在magna pure 96系统(roche diagnostics)上提取总mrna。对于基因表达分析,使用taqman rna-to-ct一步法试剂盒(thermo fisher scientific)在quantstudio仪(applied biosystems)上,用预先设计的靶向人pdl1的taqman引物和作为内源对照使用的actb(thermo fisher scientific)进行rt-qpcr。与对照样品(未处理的细胞)相比,使用2(-δδc(t))法计算pd-l1 mrna相对表达水平并且将抑制百分数作为%计算。
[0613]
在rpmi 1640、2mm谷氨酰胺和20%fbs(sigma)中培养karpas-299细胞。将细胞按10000个细胞/孔在96孔板中铺种,温育24小时,之后添加溶解于pbs中的寡核苷酸。寡核苷酸的终浓度在单次剂量中是5μm,在最终培养物体积中是100μl/孔,或在100μl培养体积中按照50μm、15.8μm、5.0μm、1.58μm、0.5μm、0.158μm、0.05μm至0.0158μm的剂量反应添加。在添加寡核苷酸化合物后3天收获细胞并根据生产商的说明,使用purelink pro 96rna纯化试剂盒(ambion)提取rna。根据生产商的说明书,使用m-mlt逆转录酶、随机十聚物retroscript、rna酶抑制剂(ambion)和100mm dntp套装(invitrogen,pcr级)合成cdna。对于基因表达分析,使用taqman fast advanced master混合物(2x)(ambion),在采用针对pd-l1(applied biosystems;hs01125299_m1)和tbp(applied biosystems;4325803)的taqman引物测定法建立的双链体中进行qpcr。pd-l1 mrna相对表达水平在表10中显示为对照样品(pbs处理的细胞)的%。
[0614]
表10:thp1和karpas-299细胞系中抗pd-l1化合物的体外效力(来自n=3次实验的平均数)。pd-l1 mrna水平对karpas-299细胞中的tbp或thp1细胞中的actb归一化并且显示为对照(pbs处理的细胞)的%。
[0615]
[0616]
[0617]
[0618]
[0619]
[0620]
[0621]
[0622]
[0623]
[0624]
[0625]
[0626]
[0627]
[0628]
[0629]
[0630]
[0631]
[0632]
[0633][0634]
实施例2-在剂量反应曲线中检验体外效力
[0635]
使用pbs中的半对数连续稀释(50μm、15.8μm、5.0μm、1.58μm、0.5μm、0.158μm、0.05μm至0.0158μm寡核苷酸)以实施例1描述的体外效力测定法在karpas-299细胞中检验来自表10的寡核苷酸选择。评估寡核苷酸的ic
50
和最大抑制作用%(残余pd-l1表达%)。
[0636]
在graphpad prism6中执行ec
50
计算。将ic
50
和pd-l1最大敲低水平在表11中显示
为对照(pbs)处理的细胞的%。
[0637]
表11:karpas-299细胞系中表示为盐水%的最大抑制作用和ec
50
。
[0638]
[0639]
[0640][0641]
使用水中25μm至0.004μm的1:3连续稀释以实施例1描述的体外效力测定法在thp-1细胞中检验来自表6的寡核苷酸选择。评估寡核苷酸的ic
50
和最大抑制作用%(残余pd-l1表达百分数)。
[0642]
在graphpad prism6中执行ec
50
计算。将ic
50
和pd-l1最大敲低水平在表12中显示为对照(pbs)处理的细胞的%。
[0643]
表12:thp1细胞系中表示为盐水%的最大抑制作用和ec
50
。
[0644][0645]
表7和表8中的结果还在图2中相对于它们靶向seq id no:1的pd-l1前mrna的位置显示。
[0646]
由此可见,几乎全部化合物具有低于1μm的ec
50
值和在(盐水处理的)的对照细胞中pd-l1表达水平的靶敲低作用,低于25%。
[0647]
实施例3
–
使用裸pd-l1反义寡核苷酸和galnac缀合的pd-l1反义寡核苷酸时聚(i:
c)诱导的小鼠中的体外效能和效力、以及体内pd-l1减少作用
[0648]
在剂量-反应研究的体外实验中在mcp-11细胞中使用表6中的寡核苷酸进行效力和效能检验。在聚(i:c)诱导的c57bl/6j雌性小鼠中对相同的寡核苷酸以及galnac缀合形式(表8,cmp id no:755_2
–
765_2)体内检验其减少pd-l1 mrna和蛋白质表达的能力。
[0649]
体外测定法
[0650]
将悬浮于补充了10%马血清、2mm l-谷氨酰胺、0.025mg/ml庆大霉素和1mm丙酮酸钠的dmem(sigma目录号d0819)中的mcp-11细胞(最初购自atcc)以密度8000个细胞/孔添加至96孔圆底板中的寡核苷酸(10μl)并且按终体积200μl/孔在37℃含5%co2的增湿培养箱中培养3天。在剂量-范围浓度(50μm、15.8μm、5.0μm、1.58μm、0.5μm、0.158μm、0.05μm和0.0158μm)内筛查寡核苷酸。
[0651]
根据生产商的说明,使用purelink pro 96rna纯化试剂盒(ambion)提取总mrna。根据生产商的说明书,使用m-mlt逆转录酶、随机十聚物retroscript、rna酶抑制剂(ambion)和100mm dntp套装(invitrogen,pcr级)合成cdna。对于基因表达分析,使用taqman fast高级主混合物(2x)(ambion),在采用针对pd-l1(thermo fisher scientific;fam-mgb mm00452054-m1)和gusb(thermo fisher scientific;vic-mgb-pl mm01197698-m1)的taqman引物测定法建立的双链体中进行qpcr。pd-l1 mrna相对表达水平在表9中显示为pbs对照样品(pbs处理的细胞)的%中残余pd-l1表达的%。在graphpad prism6中执行ec
50
计算。将ec
50
和pd-l1最大敲低水平在表13中显示为对照(pbs)细胞的%。
[0652]
体内测定法
[0653]
向c57bl/6j雌性小鼠(20-23g;每组5小鼠)皮下注射5mg/kg针对小鼠pd-l1的未缀合的寡核苷酸或2.8mg/kg针对小鼠pd-l1的galnac-缀合寡核苷酸。三天后,向小鼠静脉内注射10mg/kg聚(i:c)(lwm,invivogen)。在聚(i:c)注射后5小时处死小鼠并将肝脏样品置于rnalater(thermo fisher scientific)以提取rna或在干冰上冷冻以提取蛋白质。
[0654]
根据生产商的说明,使用purelink pro 96rna纯化试剂盒(ambion)从均化的肝脏样品提取总mrna。根据生产商的说明书,使用m-mlt逆转录酶、随机十聚物retroscript、rna酶抑制剂(ambion)和100mm dntp套装(invitrogen,pcr级)合成cdna。对于基因表达分析,使用fast高级主混合物taqman fast高级主混合物(2x)(ambion),在采用针对pd-l1 mrna(thermo fisher scientific;fam-mgb mm00452054-m1)和tbp(thermo fisher scientific;vic-mgb-pl mm00446971_m1)的taqman引物测定法建立的双链体中进行qpcr。pd-l1 mrna相对表达水平在表13中显示为来自注射盐水和聚(i:c)的小鼠的对照样品的%。
[0655]
通过在100mg组织2ml与无edta的1x halt蛋白酶抑制剂混合物(thermo fisher scientific)混合的组织蛋白质提取试剂(thermo fisher scientific)中均化肝脏样品,制备肝脏匀浆。根据生产商的说明,使用coomassie plus(bradford)分析试剂(thermo scientific)测量肝脏匀浆中的蛋白质浓度。将肝脏匀浆(40μg蛋白质)在1x mops运行缓冲液中的4-12%bis-tris plus聚丙烯酰胺凝胶(thermo fisher scientific)上分离并根据生产商的说明,使用iblot干法印迹系统(thermo fisher scientific)转移至硝酸纤维素膜。每条印迹物在64kda条带水平切割成两部分。在含有5%脱脂乳和0.05%吐温20的tbs中封闭后,将膜在4℃与含有5%脱脂乳和0.05%吐温20的tbs中1:10000稀释的兔
单克隆抗黏着斑蛋白(abcam目录号ab129002)(上方膜)或前述tbs中1:1000稀释的山羊多克隆抗mpd-l1(r&d systems目录号af1019)(下方膜)温育过夜。将膜在含有0.05%吐温20的tbs中洗涤并且在室温与含有5%脱脂乳和0.05%吐温20的tbs中1:3000稀释的hrp缀合的猪抗兔igg(dako)(上方膜)或前述tbs中1:2000稀释的hrp缀合的兔抗山羊igg(dako)暴露1小时。在洗涤膜后,使用ecl select(amersham ge healthcare)检测反应性。对于寡核苷酸处理的每组小鼠,通过与注射盐水和聚(i:c)的小鼠(对照)的pd-l1/黏着斑蛋白条带强度比较,相对于黏着斑蛋白条带评价pd-l1条带的强度。表13中显示结果,并且图9a-e中显示具有成对的裸寡核苷酸和缀合寡核苷酸的蛋白质印迹物。
[0656]
表13:针对小鼠pd-l1的寡核苷酸的体外和体内效力
[0657][0658]
:类似于对照的pd-l1/黏着斑蛋白条带强度; :弱于对照的pd-l1/黏着斑蛋白条带强度; :比对照的pd-l1/黏着斑蛋白条带强度弱得多;nd=未测定。
[0659]
从表13中的数据,可以见到galnac缀合的寡核苷酸明显改善体内pd-l1减少。mrna减少通常与pd-l1蛋白减少相关。除cmp id no:754_1之外,一旦寡核苷酸与galnac缀合,体外ec
50
值低通常反映良好的体内pd-l1 mrna减少。
[0660]
实施例4
–
来自聚(i:c)诱导的小鼠中分选的肝细胞和非实质细胞的体内pk/pd
[0661]
在分离自聚(i:c)诱导的小鼠的肝细胞和非实质细胞中研究裸寡核苷酸和galnac缀合的寡核苷酸的分布以及pd-l1 mrna减少。
[0662]
向c57bl/6j雌性小鼠(每组n=3)皮下注射5mg/kg未缀合的寡核苷酸(748_1)或7mg/kg galnac缀合的靶向小鼠pd-l1 mrna的寡核苷酸(759_2)。两天后,向小鼠腹膜内注射15mg/kg聚(i:c)(lwm,invivogen)。在注射聚(i:c)后18-20小时,令小鼠安乐死,并将肝
脏以流速7ml/分钟,经腔静脉使用含有15mm hepes和0.38mm egta的hank's平衡盐溶液灌注5分钟,随后使用胶原蛋白酶溶液(含有0.17mg/ml胶原蛋白酶2型(worthington 4176)、0.03%bsa、3.2mm cacl2和1.6g/l nahco3的hank's平衡盐溶液)灌注12分钟。在灌注后,取出肝脏并打开肝包膜(liver capsule),使用williams e培养基,经70μm细胞滤网过滤肝脏悬液,并且取出等份量的细胞悬液(=混合的肝脏细胞)供稍后分析。将其余的细胞悬液以50xg离心3分钟。收集上清液供稍后纯化非实质细胞。将沉淀物重悬于25ml william e培养基(sigma目录号w1878,补充有1x青/链霉素、2mm l-谷氨酰胺和10%fbs(atcc#30-2030))中,与25ml含有90%percoll的william e培养基混合,并且通过50x g离心10分钟,使肝细胞沉淀。在william e培养基中洗涤2次后,将沉淀的肝细胞重悬于williams e培养基中。将含有非实质细胞的上清液以500xg离心7分钟并且将细胞重悬于4ml rpmi培养基中并以1800xg穿过两层percoll(25%和50%percoll)离心30分钟。在采集二个percoll层之间的非实质细胞后,洗涤细胞并重悬于rpmi培养基中。
[0663]
根据生产商的说明,使用purelink pro 96rna纯化试剂盒(ambion)从纯化的肝细胞、非实质细胞和总肝脏悬液(未分级的肝脏细胞)提取总mrna。根据生产商的说明书,使用m-mlt逆转录酶、随机十聚物retroscript、rna酶抑制剂(ambion)和100mm dntp套装(invitrogen,pcr级)合成cdna。对于基因表达分析,使用taqman fast高级主混合物(2x)(ambion),在采用针对pd-l1(thermo fisher scientific;fam-mgb mm00452054-m1)和tbp(thermo fisher scientific;vic-mgb-pl mm00446971_m1)的taqman引物测定法建立的双链体中进行qpcr。pd-l1 mrna相对表达水平在表10中显示为来自注射盐水和聚(i:c)的小鼠的对照样品的%。
[0664]
使用序列为5
′‑
taccgt-s-bio-3
′
的生物素酰化捕获探针和序列为5
′‑
dig-c12-s1-cctgtg
–3′
的洋地黄甙缀合的检测探针,使用elisa进行寡核苷酸含量分析。探针仅由具有磷酸二酯主链的lna组成。将肝脏样品(大约50mg)在含有一粒5mm不锈钢珠的2ml微量离心管中的1.4ml magna纯裂解缓冲液(roche目录号03604721001)内均化。在retsch mm400均化器(merck eurolab)上均化样品直至获得均一裂解物。在室温温育样品30分钟。通过将未缀合的反义寡核苷酸化合物(cmp id no:748_1)以定义的浓度加标入未处理的肝脏样品并且将它们如同样品那样处理,产生标准品。选择加标的浓度以匹配预期的样品寡聚物含量(在约10倍范围内)。
[0665]
将均化的样品在5x ssct缓冲液(750mm nacl,和75mm柠檬酸钠,含有0.05%(v/v)吐温20,ph 7.0)中最少10倍稀释,并且使用捕获-检测溶液(5xssct缓冲液中的35nm捕获探针和35nm检测探针)制备6
×
2倍稀释的系列稀释物并在室温温育30分钟。将样品转移至链霉亲和素包被的96孔平板(nunc目录号436014),每个孔中100μl。将平板在室温温育1小时,伴以温和振荡。用2x ssct缓冲液洗涤三次并将pbst(磷酸盐缓冲盐水,含有0.05%(v/v)吐温-20,ph 7.2,新鲜制备)中1:4000稀释的100μl抗dig-ap fab片段(roche applied science,目录号11 093 274 910)添加至每个孔并在温和振荡下室温温育1小时。用2x ssct缓冲液洗涤三次并且添加100μl碱性磷酸酶(ap)底物溶液(blue phos底物,kpl产品代码50-88-00,新鲜配制)。温和振荡下温育30分钟后,在615nm以分光光度方式测量颜色的强度。原始数据从读数仪(gen5 2.0软件)输出成excel格式并且在excel中进一步分析。使用graphpad prism 6软件和对数4pl回归模型,生成标准曲线。
[0666]
表14:来自用未缀合寡核苷酸和galnac缀合的寡核苷酸处理的聚(i:c)小鼠(n=3)的总肝脏悬液、肝细胞和非实质细胞中的pd-l1表达和寡聚物含量。
[0667][0668][0669]
结果显示,裸寡核苷酸(cmp id no:748_1)和缀合的寡核苷酸(cmp id no:759_2)在总肝脏细胞中同等良好地减少pd-l1 mrna。在分离的肝细胞中,缀合的寡核苷酸的作用几乎5倍强于裸寡核苷酸的作用,而在非实质细胞中,裸寡核苷酸显示强于galnac缀合的寡核苷酸的作用二倍。在肝细胞和非实质细胞中,pd-l1 mrna表达减少某个程度上与这些细胞类型中的寡核苷酸含量相关。
[0670]
实施例5
–
使用裸pd-l1反义寡核苷酸和galnac缀合的pd-l1反义寡核苷酸时aav/hbv小鼠中的体内pd-l1敲低作用
[0671]
在本研究中,用裸pd-l1反义寡核苷酸或galnac缀合的pd-l1反义寡核苷酸处理aav/hbv小鼠,并且评价肝脏中的pd-l1 mrna表达和hbv基因表达。
[0672]
将5-8周龄雌性hla-a2/dr1小鼠(每组5只动物)在第-1周用溶媒(盐水)、裸pd-l1反义寡核苷酸(cmp id no:752_1,皮下5mg/kg)和galnac pd-l1反义寡核苷酸(cmp id no:763_2,皮下7mg/kg)预处理,这些剂量对应于等摩尔浓度的寡核苷酸。在第0周用5x10
10
vg aav-hbv转导小鼠(更多细节,参见材料和方法章节中对aav/hbv小鼠模型的描述)。从aav-hbv转导后w1至w4,小鼠接受4次额外的pd-l1寡核苷酸或溶媒(盐水溶液)皮下注射,以一周分开给予。
[0673]
在转导之前一周和每次注射后一周取得血液样品。
[0674]
在最后注射后两周,处死小鼠,并且在pbs灌注后取出其肝脏。将肝脏切成较小的小片并直接冷冻。
[0675]
为了测量hbv基因表达,使用qiaamp one-for-all核酸试剂盒,目录号965672,在pbs中按1:20稀释度稀释血清,在200ul缓冲液al中裂解总计100μl,用qiagen biorobot从血清提取dna。以100μl从试剂盒洗脱dna。
[0676]
对于实时qpcr,taqman基因表达主混合物(目录号4369016,applied biosystems)与通过添加1:1:0.5以下引物f3_core、r3_core、p3_core(integrated dna technologies,均各自按100um复溶)配制的引物混合物一起使用。
[0677]
正向(f3_core):ctg tgc ctt ggg tgg ctt t(seq id no:784)
[0678]
反向(r3_core):aag gaa aga agt cag aag gca aaa(seq id no:785)
[0679]
探针(p3_core):56-fam-agc tcc aaa/zen/ttc ttt ata agg gtc gat gtc cat g-3iabkfq(seq id no:786)
[0680]
使用始于1x109个拷贝/μl降至1个拷贝/μl的10倍稀释物并且按照每个反应5μl使用,利用hbv质粒(基因型d,gtd),准备标准曲线。
[0681]
对于每个反应,添加10μl基因表达主混合物、4.5μl水、0.5μl引物混合物和5μl样品或标准品,并进行qpcr。
[0682]
为了分析,使用标准曲线,计算拷贝数/ml/孔。表15中显示结果。
[0683]
使用qpcr,测量pd-l1 mrna表达。
[0684]
从冷冻的肝小片提取mrna,其中添加所述肝小片至含有陶瓷珠(lysing matrix d管,116913500、mpbio)和1ml trizol的2ml管。
[0685]
使用precellys组织破坏器,均化肝小片。将200μl氯仿添加至匀浆物、涡旋混合并在4℃以10000转/分钟离心20分钟。将含有rna的清澈相(约500ul)转入新管并添加相同体积的70%etoh。在充分混合后,将溶液转移到rneasy离心柱上,并且遵循rneasy试剂盒手册,用rneasy微量试剂盒,目录号74104,qiagen(包含无rna消化rna酶的dna酶套装,目录号79254)进一步提取rna。在50μl h2o中洗脱。测量最后的rna浓度并对全部样品调节至100ng/ul。
[0686]
根据生产商的说明,使用taqman rna-to-ct一步法试剂盒,目录号4392938,thermo fisher,对7.5μl rna实施qpcr。所用的引物混合物含有pd-l1_1-3(引物编号mm00452054_m1、mm03048247_m1和mm03048248_m1)和内源对照(atcb mm00607939_s1、canx mm00500330_m1、ywhaz mm03950126_s1和gusb mm01197698_m1)。
[0687]
使用2^-ddct方法,分析数据。全部四个内源对照的均值用来计算dct值。相对于内源对照的均值并以盐水的%计的pd-l1表达。
[0688]
表15:经未缀合的寡核苷酸和galnac缀合的寡核苷酸处理的aav/hbv小鼠(n=5)中的pd-l1 mrna表达和hbv dna。
[0689][0690]
从这些结果,可以见到裸寡核苷酸和galnac缀合的寡核苷酸均能够减少aav/hbv小鼠肝脏中的pd-l1 mrna表达,其中galnac缀合的寡核苷酸或多或少地较好。两种寡核苷酸还导致血清中hbv dna某种程度减少。
[0691]
实施例6
–
对aav/hbv小鼠中t细胞应答的体内影响
[0692]
在本研究中,用靶向pd-l1的抗体或反义寡核苷酸处理来自巴斯德的aav/hbv小鼠。反义寡核苷酸是裸露的或与galnac缀合。在处理期间,动物用针对hbs抗原和hbc抗原的dna疫苗免疫接种(参见材料和方法章节),以确保抗原呈递细胞有效引发t细胞。评价了该处理如何影响肝脏和脾中的细胞群体,以及这些群体上的pd-l1表达及是否可以鉴定hbv特异性t细胞应答。
[0693]
处理方案:
[0694]
根据以下方案处理雌性hla-a2/dr1小鼠。该研究在二个独立的子研究中实施,如下表16和表17中所示,施用方案有轻微差异。
[0695]
dna疫苗和抗pd-l1抗体如材料和方法章节中描述那样施用。所用的反义寡核苷酸是5mg/kg的cmp id no:748_1(裸)和7mg/kg的cmp id no:759_2(galnac缀合的),其中二者均作为皮下(s.c.)注射剂施用。
[0696]
表16:采用dna疫苗和dna疫苗 抗pd-l1抗体的aav/hbv小鼠处理方案,每个组6只小鼠
[0697][0698]
同种型=小鼠igg对照ab,catx=心脏毒素,dna=dna疫苗,ab=抗pd-l1 ab,并且*=血清收集物
[0699]
表17:采用dna疫苗和dna疫苗 裸pd-l1寡核苷酸或缀合的pd-l1寡核苷酸(aso)的aav/hbv小鼠处理方案,每个组7只小鼠
[0700][0701][0702]
dna=dna疫苗,catx=心脏毒素,ab=抗pd-l1 ab,aso=裸pdl-1寡核苷酸,gn-aso=galnac-pdl-1寡核苷酸,以及*=血清收集物
[0703]
处死时,从每个组收集每只小鼠的血液、脾和肝脏单个核细胞并耗尽红血细胞(裂解缓冲液,bd biosciences,555899)。肝脏单个核细胞要求如材料和方法章节中描述的特定制备。
[0704]
细胞群体:
[0705]
在肝脏中,使用细胞计数法,通过肝脏单个核细胞上的表面标记,分析细胞群体(参见材料和方法)。
[0706]
与对照组(即溶媒组和dna免疫接种的组)相比,注意到已处理小鼠的脾和肝脏中nk细胞频率无显著变化。表18显示在肝脏中,与也在图10a中展示的任一对照组(即溶媒组和dna免疫接种组)相比,用裸pd-l1寡核苷酸(cmp id no:748_1)处理和用galnac缀合的pd-l1寡核苷酸(cmp id no:759_2)处理的各组具有明显增加的t细胞数目。这种增加归因于cd4 t细胞群体和cd8 t细胞群体均增加(分别见表18和图10b和图10c)。
[0707]
表18:处理后肝脏中以百万个细胞计的t细胞
[0708][0709]
pd-l1表达:
[0710]
在处死时评价脾和肝脏的巨噬细胞、b细胞和t细胞上pd-l1蛋白的表达。表面标记用抗体混合物中pd-l1抗体的存在(参见材料和方法)允许通过细胞计数法定量表达pd-l1的细胞。
[0711]
在脾中,未观察到各处理之间表达pd-l1的巨噬细胞、b细胞和cd4 t细胞的%有显著差异。与其他处理相比时,经裸pd-l1寡核苷酸(cmp id no:748_1)处理和galnac缀合的pd-l1寡核苷酸(cmp id no:759_2)处理的小鼠中表达pd-l1的cd8 t细胞的%较低(数据未显示)。
[0712]
在肝脏中,pd-l1主要表达在cd8 t细胞上,对照组中的平均频率为32%和41%(溶媒组和dna接种组二者合并,分别见图11a)。用裸pd-l1寡核苷酸或galnac pd-l1寡核苷酸
处理导致表达pd-l1的cd8 t细胞的频率下降(参见表19、图11a)。还注意到aso处理后b细胞和cd4 t细胞中表达pd-l1的细胞%有显著差异,虽然这些细胞类型表达比cd8 t细胞显著更少的pd-l1(参见表19和图11b和图11c)。用抗pd-l1 ab处理还导致在全部细胞类型中pd-l1表达明显减少。然而,这种减少可能部分地归因于pd-l1表位被用于处理的抗pd-l1抗体封闭,从而阻碍表面标记用抗体混合物中的pd-l1检测抗体与pd-l1结合。因此情况似乎是,用于处理的抗pd-l1抗体下调pd-l1可能是处理抗体和检测抗体之间表位竞争的结果。
[0713]
表19:具有pd-l1表达的肝脏细胞群体%
[0714][0715]
hbv特异性t细胞应答:.
[0716]
使用检测ifnγ和tnfα产生的胞内细胞因子染色测定法(参见材料和方法章节),检测产生促炎细胞因子的nk细胞和cd4 t细胞和cd8 t细胞。
[0717]
在脾中,处死时不可检出分泌ifnγ-和tnfα的nk细胞并且检出少数分泌ifnγ-和tnfα的cd4 t细胞(频率《0.1%)。在经裸pd-l1寡核苷酸或galnac pd-l1寡核苷酸处理的小鼠中以及来自这项研究的仅接受dna疫苗的小鼠中检出靶向二种hbv抗原的产生ifnγ的cd8 t细胞(数据未显示)。
[0718]
在dna免疫接种的hbv携带小鼠的肝脏中,处死时未检出产生ifnγ的nk细胞,而在dna免疫接种的一些小鼠的肝脏中,对核心抗原或s2 s抗原特异的分泌ifnγ的cd4 t细胞以低频率(《0.4%,数据未显示)检出。在dna免疫接种的大部分小鼠中检出产生ifnγ的hbv s2 s抗原特异性cd8 t细胞。经dna疫苗和裸pd-l1寡核苷酸或galnac pd-l1寡核苷酸组合处理的小鼠中,分泌ifnγ的cd8 t细胞的频率增加,而用抗pd-l1抗体处理未向dna免疫接种增加任何明显的附加作用(图12)。在dna免疫接种的大部分组(抗pd-l1抗体组例外)中检出靶向包膜抗原和核心抗原的产生ifnγ的cd8 t细胞(图12b)。大部分s2-s抗原特异性t细胞产生ifnγ和tnfα(图12c)。表20中也显示了结果。
[0719]
表20:来自总ifnγ或ifnγ tnfα细胞群体的hbv抗原(s2-s或核心抗原)特异性cd8 t细胞%
[0720][0721]
实施例7
–
对aav/hbv小鼠血清中hbv抗原和hbv dna的体内影响
[0722]
在本研究中,用galnac缀合的pd-l1反义寡核苷酸cmp id no:759_2处理来自上海的aav/hbv小鼠(参见材料和方法章节)。
[0723]
与溶媒处理的动物相比,评价该处理如何影响血清中的hbe抗原和hbs抗原和hbv dna水平。
[0724]
处理方案:
[0725]
这项研究中使用如材料和方法章节中上海模型下所述的经携带hbv基因组的重组腺相关病毒(aav)(aav/hbv)感染的雄性c57bl/6小鼠。用5mg/kg反义寡核苷酸cmp id no:759_2或溶媒(盐水)一周一次注射小鼠(每组6只小鼠)8周,其中二者均以皮下(s.c.)注射施用。在处理期间每周以及处理后6周收集血液样品。如下文所述测量血清样品中的hbv dna水平、hbsag水平和hbeag水平。在表21中和图13中显示前10周的结果。该研究在提交申请时仍持续进行,因此,尚未获得剩余4周的数据。
[0726]
hbsag和hbeag检测
[0727]
根据生产商的操作方案,使用hbsag化学发光免疫测定法(clia)和hbeag clia试剂盒(autobio diagnostics co.ltd.,郑州,中国,目录号分别是cl0310-2和cl0312-2)测定感染的aav-hbv小鼠的血清中的血清hbsag水平和hbeag水平。简而言之,将50μl血清转移至抗体包被的相应微量滴定板并添加50μl酶缀合物试剂。在室温在摇床上温育平板60分钟,之后使用自动清洗机,用洗涤缓冲液洗涤全部孔六次。向每个孔添加25μl底物a及随后添加25μl底物b。将平板在室温温育10分钟,之后使用envision发光读数仪测量发光。hbsag按单位iu/ml给出;其中1ng hbsag=1.14iu。hbeag按单位ncu/ml血清给出。
[0728]
hbv dna提取和qpcr
个细胞/孔的密度接种在胶原蛋白包被的24孔板(becton dickinson ag,allschwil,瑞士)中。用终浓度100μm的寡核苷酸处理启动之前,将细胞预培养4小时以允许贴附于细胞培养平板。表21和表8中显示所用的寡核苷酸,溶媒是pbs。将接种的培养基替换为315μl无血清wme(补充有青霉素(100u/ml)、链霉素(0.1mg/ml)、l-谷氨酰胺(0.292mg/ml))并且将35μl在pbs中的1mm寡核苷酸母液添加至细胞培养物并留在细胞上24小时或66小时。
[0742]
文库制备
[0743]
在illumina测序平台上使用illumina stranded mrna化学,采用以下测序策略进行转录物表达概况分析:2x51bp配对末端读段和最小读段深度为每份样本30m(q squared ea)。在孔中通过添加350μl qiagen rlt缓冲液裂解细胞,并且使其以随机化方案可访问。
[0744]
使用qiagen rneasy微量试剂盒纯化mrna。定量mrna并使用agilent bioanalyzer评估完整性。对分离的rna进行初步质量评估时,观察到全部样品符合输入质量标准:100ng具有rin评分》7.0。
[0745]
始于100ng总rna,使用illumina truseq stranded mrna文库制备法对全部样品生成测序文库。使用agilent bioanalyzer(dna 1000试剂盒)分析最终cdna文库的大小分布,通过qpcr(kapa library quant试剂盒)定量并且对2nm归一化,为测序作准备。standard cluster generation试剂盒v5用来将cdna文库与流动池表面和cbot等温结合以扩增连接的cdna构建体直至克隆簇各自为约1000个拷贝。使用truseq sbs试剂盒,通过合成测序技术测定dna序列。
[0746]
数据处理
[0747]
使用gsnap短读段比对程序,将长度2x51 bp的illumina配对末端测序读段映射到人类参比基因组hg19上。使用samtools程序,将sam格式的比对结果转换成分选的比对bam格式文件。依据hg19的相应gtf文件规定,基于来自ncbi参考序列的外显子注释,对pd-l1估计基因读段计数。使用deseq2 r软件包,对每份样品的不同文库大小应用归一化步骤记录。
[0748]
表22中显示与galnac缀合的pd-l1反义寡核苷酸化合物温育后pd-l1转录物减少。
[0749]
表22:用galnac缀合的寡核苷酸处理后人原代肝细胞中pd-l1转录物减少,n=4
[0750][0751]
全部五种galnac缀合的反义化合物均显示与溶媒处理的样品相比时,温育24和66小时后,pd-l1转录物明显减少。
[0752]
实施例9-hbv感染的asgpr-heparg细胞中缀合的pd-l1反义寡核苷酸和裸pd-l1反义寡核苷酸的ec
50
[0753]
在hbv感染的asgpr-heparg细胞中比较2种裸pd-l1反义寡核苷酸和等同galnac缀合的pd-l1反义寡核苷酸的效能。
[0754]
细胞系
[0755]
在williams e培养基(补充有10%heparg生长补充物(biopredic)中培养heparg细胞(biopredic international,saint-gregoire,法国)。从这个细胞系中,使用慢病毒方法生成稳定过量表达人asgpr1和asgpr2的heparg细胞系。以moi 300用sirion biotech按需产生的慢病毒(clv-cmv-asgpr1-t2a_asgpr2-ires-puro)转导正在增殖的heparg细胞,所述慢病毒编码受cmv启动子控制的人asgpr1和2和嘌呤霉素耐药基因。将转导的细胞用1μg/ml嘌呤霉素选择11天并且随后在相同浓度的抗生素中维持以确保转基因稳定表达。通过rt-qpcr在mrna水平(asgpr1:相对于未转导为8560倍;asgpr2:相对于未转导为2389倍)并通过流式细胞分析在蛋白质水平证实asgpr1/2过量表达。
[0756]
在感染之前至少2周,使用1.8%dmso,使细胞分化。hbv基因型d衍生自hepg2.2.15细胞培养上清液并使用peg沉淀法浓缩。为了评价受试化合物对hbv的活性,将分化的asgpr-heparg细胞在96孔平板中用hbv以moi 20至30感染20小时,之后将细胞用pbs洗涤4次以移除hbv接种物。
[0757]
寡核苷酸效能
[0758]
以下寡核苷酸
[0759]
裸pd-l1 aso等同的galnac缀合的pd-l1 asocpm id no:640_1cpm id no:768_2cpm id no:466_1cpm id no:769_2
[0760]
在感染后第7日和第10日使用25μm至0.4nm的连续稀释物(pbs中1:4稀释),添加至hbv感染的asgpr-heparg细胞。在感染后第13日收获细胞。
[0761]
根据生产商的说明,使用magna pure 96细胞rna大体积试剂盒在magna pure 96系统(roche diagnostics)上提取总mrna。对于基因表达分析,如实施例5中所述那样进行rt-qpcr。
[0762]
使用2^-ddct方法,分析数据。使用肌动蛋白b作为计算dct值的内源对照。pd-l1表达是相对于内源对照和相对于盐水溶媒的。
[0763]
在graphpad prism6中执行ec
50
计算并且在表23中显示。
[0764]
表23:hbv感染的asgpr-heparg细胞中的ec
50
,n=4。
[0765]
cmp id noec50(μm)640_12.25768_20.10466_15.82769_20.13
[0766]
这些数据明确显示,pd-l1反义寡核苷酸的galnac缀合显著地改善ec
50
值。
[0767]
实施例10
–
在衍生自慢性hbv患者的pbmc中刺激t细胞功能
[0768]
研究了裸pd-l1反义化合物是否可以在离体hbv抗原刺激外周血单个核细胞(pbmc)后提高hbv慢性感染(chb)患者的t细胞功能。
[0769]
将三位慢性hbv感染患者的冷冻pbmc解冻并且以200,000个细胞/孔的密度接种在100μl培养基(rpmi1640 glutamax 8%人血清 25mm hepes 1%penstrep)中。次日,在含有100pg/ml il-12和5ng/ml il-7的100μl培养基中,用1μm pepmix hbv大包膜蛋白或1μm pepmix hbv核心蛋白(参见表9)在伴有或未伴有5μm cmp id no:466_1或cmp id no:640_1时刺激细胞(仅在第8日施加伴刀豆球蛋白刺激)。四天后,用含有50iu il-2的培养基更新pd-l1反义寡核苷酸处理。在首次刺激后第8日,用pepmix或5μg/ml伴刀豆球蛋白a加pd-l1反义寡核苷酸再刺激细胞24小时。对于最后5小时刺激,添加0.1μl布雷菲德菌素a、0.1μl莫能菌素和3μl抗人cd-107(apc)。
[0770]
24小时后,将细胞用染液缓冲液(pbs 1%bsa 0.09%叠氮钠 edta)洗涤并且在4℃进行表面染色30分钟[抗人cd3(bv 605)、抗人cd4(fitc)、抗人cd8(bv711)、抗人pdl1(bv421)、抗人pd1(percp-cy5.5)和活-死染液(bv510)(bd biosciences)]。将细胞在4℃于bd固定缓冲液中固定15分钟。次日清晨,将细胞在4℃用bd perm/wash缓冲液透化15分钟并且在4℃进行胞内染色30分钟[抗人infγ(pe)]。在perm/wash缓冲液中洗涤后,将细胞溶解于250μl染色缓冲液中。
[0771]
在bd fortessa(bd biosciences)上进行facs测量。为了分析,完整细胞群体首先对活细胞(活-死染液,bv510)设门,并且随后对cd3 (bv605)细胞设门。随后将cd3 细胞作为cd107a (apc)相对于ifnγ (pe)作图。
[0772]
表24中显示结果。
[0773]
表24:pd-l1 aso处理对分离自三位hbv慢性感染患者的pbmc中cd3 t细胞的影响。
[0774][0775]
从这些数据,可以见到,抗原刺激本身能够诱导chb患者(n=3)的pbmc中t细胞活化(升高表达infγ和/或cd107a的cd3 细胞%)。添加pd-l1反义寡核苷酸cmp466_1或640_1导致cd3 t细胞应答额外升高。主要在hbv包膜刺激组中观察到这种升高。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。