1.本发明属于生物制品技术领域,具体涉及一种病毒样颗粒疫苗冻干保护剂、制备方法及应用。
背景技术:
2.传统的疫苗主要是减毒疫苗和灭活疫苗,这些疫苗可以很好地激发机体的免疫反应,抵御疾病的传播,但是这些传统疫苗也有一些明显的缺陷,比如其安全性以及制作的困难性制约了疫苗在某些疾病上的使用。病毒样颗粒(virus-like particles vlps)是由病毒的一个或多个结构蛋白在体内或体外自组装而成的空心颗粒,因其不含病毒的遗传物质,无法复制和扩增,而不具备感染致病的能力。vlps是一种多蛋白分子,大部分由几个相同的蛋白质组成二十面体或螺旋结构,在与活病毒结构相似的同时缺失病毒的基因组,因此十分安全。同时vlps在形态结构上与天然病毒颗粒相似,很好地模拟天然病毒的抗原表位,数十纳米的尺度和高度有序的表位结构也有利于树突状细胞的吞噬和抗原加工,从而有效地诱导集体产生对病毒的免疫保护反应。此外在生产vlps疫苗时,可使用大肠杆菌等原核表达系统或者其他真核表达系统进行疫苗的生产,生产过程中可避免使用活的病毒,这也减少了疫苗生产过程中涉及到的生物安全风险。与传统疫苗相比,vlps具有更好的安全性,同时还具有用途传统疫苗相当的免疫原性,因此越来越多的病原疫苗的制备都采用了vlps技术。
3.vlps疫苗的生产制备过程包括4个主要步骤,分别是裂解、粗提、纯化和组装,因此在vlps的制备过程中均保持为溶液状态,但是采用液体形式对vlps进行保存时,即使采用低温条件进行保存,仍容易出现病毒样颗粒的聚集、变性、析出等现象,而这些现象将导致vlps疫苗的免疫效果大打折扣,因此在制备vlps疫苗时,完成纯化组装后的vlps样品要在很短的时间内制备成液体状态的疫苗,这就限制了疫苗的批次生产效率,增加疫苗的产品,同时也增加了疫苗成本的质量不稳定性因素,同时液体状态的疫苗对运输条件和要求更为苛刻。
4.冷冻干燥技术是生物制品生产中最为常用的技术。它既可以保持产品的生物学特性,又能延长生物成品保存的有效期。冷冻干燥是将溶液或悬液冷冻成固态,然后在低温和高真空度下使冰升华,留下干物。因为冷冻干燥是在低温高真空度下进行的,所以样品不起泡,不暴沸,干物不粘壁,易取出,而且成为疏松的粉块,极易溶于水。由于冷冻干燥的上述优点,适于对热敏感,易吸湿,易氧化及溶剂蒸发时易产生泡沫而引起变性的制品(如蛋白质,酶,核酸,抗生素,激素等)。冷冻干燥能使蛋白质脱水,使破坏蛋白质的化学反应难以进行,并使它们的有效期大大延长,但冷冻过程会对生物活性造成损伤,导致溶解度下降和效价降低。由于vlps疫苗的安全性和免疫效力取决于其中vlps的构型、形态、比例等多种因素,因此在进行病毒样颗粒的冻干时,研制出适合的冻干保护剂是生物制品冻干过程中至关重要的,只有适合的冻干保护剂才能保证vlps的构型、形态、比例等特征与冻干前基本相当,不影响最终疫苗产品的安全性和免疫效力。
技术实现要素:
5.针对现有技术中的上述不足,本发明提供一种病毒样颗粒疫苗冻干保护剂及其制备方法,以降低vlps保存过程中对环境的特殊要求,提高生产效率,降低生产成本和运输成本。
6.为实现上述目的,本发明解决其技术问题所采用的技术方案是:
7.一种病毒样颗粒疫苗冻干保护剂,包括以体积比为1:1~3:1混合的a液和b液;
8.其中,a液中包括具有以下终浓度的组分:
9.0.01~0.5mol/l基础液ⅰ、0.5~2mmol/l基础液ⅱ、0.01~0.1%聚山梨醇80、5~20%的蔗糖,以及1~5%胰蛋白胨;
10.b液中包括具有以下终浓度的组分:
11.0.1~5%海藻糖、0.1~5%低聚半乳糖,以及0.1~2%peg6000。
12.进一步地,a液和b液的体积比为2:1。
13.进一步地,a液中包括具有以下终浓度的组分:
14.0.01mol/l基础液ⅰ、1mmol/l基础液ⅱ、0.05%聚山梨醇80、10%的蔗糖,以及2.5%胰蛋白胨。
15.进一步地,基础液ⅰ为ph值8.0的tris溶液;基础液ⅱ为ph值8.0的edta溶液。
16.进一步地,b液中包括具有以下终浓度的组分:
17.2%海藻糖、2%低聚半乳糖,以及1%peg6000。
18.上述病毒样颗粒疫苗冻干保护剂的制备方法,包括以下步骤:
19.(1)制备基础液ⅰ和基础液ⅱ;
20.(2)按配方将a液各组分混合溶解,于100~150℃,80~100kpa条件下灭菌;
21.(3)按配方将b液各组分混合溶解后,过滤灭菌;
22.(4)待a液冷却至室温后,将a液和b液以体积比为1:1~3:1的比例混合均匀即可。
23.进一步地,a液的灭菌温度为116℃,压强为100kpa。
24.进一步地,冻干保护剂与病毒样颗粒溶液按1:1~1:2的比例混合后进行冻干。
25.本发明的有益效果:
26.1、本发明中的冻干保护剂分为a液和b液,a液主要是为缓冲液、赋形剂、蛋白质等物质,可使病毒样颗粒在冻干过程中保持固定ph值并始终保持其固有形态。b液含有海藻糖、低聚半乳糖和peg6000。
27.其中,海藻糖与蔗糖均为还原性二糖,可以相互补充,两者复合使用,可充当低温保护剂,且能在干燥脱水过程中起到脱水保护剂的作用;低聚半乳糖除具有保护剂的作用外,还兼有免疫增强剂的效果,对后期vlps疫苗具有提高免疫效果的作用。此外,b液的海藻糖等物质可进一步提升a液蔗糖等对病毒样颗粒形态的保持作用,而a液中的蔗糖等物质对病毒样颗粒的免疫原性保持起到保护作用,从而有助于b液中低聚半乳糖的免疫增强作用。
28.2、病毒样颗粒半成品和成品以液体状态进行保存时,会出现占用空间大且质量随着保存时间降低的缺点,使用本发明的冻干保护剂对病毒样颗粒进行冻干后,可以在保存病毒样颗粒的特性和免疫原性的前提下,大大延长病毒样颗粒的保存时间,从而降低生产成品,提高产品的质量和稳定。
29.3、病毒样颗粒半成品和成品为液体状态时,要想制备多联多价病毒样颗粒疫苗,
会受到病毒样颗粒含量等多种因素的影响,对半成品的生产技术和生产质量要求更高,同时还会大幅提高疫苗的生产成本。使用本发明的冻干保护剂可在已有生产技术和条件下,可更加方便快捷地实现多联多价病毒样颗粒疫苗的制备。
30.图说明
31.图1为冻干前猪口蹄疫o型病毒样颗粒电镜图;
32.图2为冻干后猪口蹄疫o型病毒样颗粒电镜图;
33.图3为-15℃保存24个月的猪口蹄疫o型病毒样颗粒电镜图;
34.图4为冻干前后以及保存24个月后猪口蹄疫o型病毒样颗粒粒径检测结果;
35.图5为冻干前后以及保存24个月后的组装率检测结果。
具体实施方式
36.下面对本发明的具体实施方式进行描述,以便于本技术领域的技术人员理解本发明,但应该清楚,本发明不限于具体实施方式的范围,对本技术领域的普通技术人员来讲,只要各种变化在所附的权利要求限定和确定的本发明的精神和范围内,这些变化是显而易见的,一切利用本发明构思的发明创造均在保护之列。
37.实施例1
38.一种病毒样颗粒疫苗冻干保护剂,其制备方法如下:
39.1、基础溶液的配制
40.(1)0.1mol/l tris溶液(ph8.0)的配制:将12.1g tris碱溶解于800ml水中,用盐酸调节溶液ph值至8.0,加水定容至1000ml。
41.(2)50mmol/l edta溶液(ph8.0)的配制:将18.6g edta二钠溶解于800ml水中,用氢氧化钠溶液调节ph值至8.0,加水定容至1000ml。
42.2、a液的配制
43.每升a液中含100ml的0.1mol/l tris溶液(ph8.0)、20ml的50mmol/l edta溶液(ph8.0)、0.05%w/v的聚山梨醇80、10%w/v的蔗糖、2.5%w/v的胰蛋白胨,所有物质加入适量的水中溶解,定容至1000ml,在116℃温度、100千帕压强条件下进行灭菌备用。
44.3、b液的配制
45.每升b液中含2%w/v的海藻糖、2%w/v的低聚半乳糖、1%w/v的peg6000,所有物质混合后加入适量的水溶解,定量至1000ml,过滤除菌备用。
46.4、冻干保护剂的配制
47.待a液冷却至室温后,将a液与b液按1:1~3:1的比列混合均匀,即可作为病毒样颗粒的冻干保护剂。
48.实施例2
49.一种病毒样颗粒疫苗冻干保护剂,其制备方法如下:
50.1、基础溶液的配制
51.(1)0.1mol/l tris溶液(ph8.0)的配制:将12.1g tris碱溶解于800ml水中,用盐酸调节溶液ph值至8.0,加水定容至1000ml。
52.(2)50mmol/l edta溶液(ph8.0)的配制:将18.6g edta二钠溶解于800ml水中,用氢氧化钠溶液调节ph值至8.0,加水定容至1000ml。
53.2、a液的配制
54.每升a液中含100ml的0.1mol/l tris溶液(ph8.0)、20ml的50mmol/l edta溶液(ph8.0)、0.01%w/v的聚山梨醇80、5%w/v的蔗糖、1%w/v的胰蛋白胨,所有物质加入适量的水中溶解,定容至1000ml,在110℃温度、100千帕压强条件下进行灭菌备用。
55.3、b液的配制
56.每升b液中含0.1%w/v的海藻糖、0.1%w/v的低聚半乳糖、0.1%w/v的peg6000,所有物质混合后加入适量的水溶解,定量至1000ml,过滤除菌备用。
57.4、冻干保护剂的配制
58.待a液冷却至室温后,将a液与b液按3:1的比列混合均匀,即可作为病毒样颗粒的冻干保护剂。
59.实施例3
60.一种病毒样颗粒疫苗冻干保护剂,其制备方法如下:
61.1、基础溶液的配制
62.(1)0.1mol/l tris溶液(ph8.0)的配制:将12.1g tris碱溶解于800ml水中,用盐酸调节溶液ph值至8.0,加水定容至1000ml。
63.(2)50mmol/l edta溶液(ph8.0)的配制:将18.6g edta二钠溶解于800ml水中,用氢氧化钠溶液调节ph值至8.0,加水定容至1000ml。
64.2、a液的配制
65.每升a液中含100ml的0.1mol/l tris溶液(ph8.0)、20ml的50mmol/l edta溶液(ph8.0)、0.1%w/v的聚山梨醇80、20%w/v的蔗糖、5%w/v的胰蛋白胨,所有物质加入适量的水中溶解,定容至1000ml,在116℃温度、100千帕压强条件下进行灭菌备用。
66.3、b液的配制
67.每升b液中含5%w/v的海藻糖、5%w/v的低聚半乳糖、2%w/v的peg6000,所有物质混合后加入适量的水溶解,定量至1000ml,过滤除菌备用。
68.4、冻干保护剂的配制
69.待a液冷却至室温后,将a液与b液按1:1~3:1的比列混合均匀,即可作为病毒样颗粒的冻干保护剂。
70.实施例4(对照组)
71.普通疫苗冻干保护剂的配制,具体如下:
72.参照发明专利:一种疫苗耐热保护剂、疫苗以及疫苗的制备方法(专利申请号:2016111534800)配制普通疫苗冻干保护剂。
73.实验例
74.1、冷冻干燥
75.(1)病毒样颗粒冻干保护剂冷冻干燥:将本发明实施例1制备得到的冻干保护剂与口蹄疫o型病毒样颗粒溶液按1:1的比例进行混合,混合均匀后按2ml/瓶的剂量分装于西林瓶中,通过预冻、升华和干燥等步骤完成病毒样颗粒的冷冻干燥。采用此冻干保护剂冻干后的口蹄疫o型病毒样颗粒为白色海绵状疏松团块,易与瓶壁脱离,加稀释液后迅速溶解。
76.(2)普通疫苗冻干保护剂冷冻干燥:参照发明专利2016111534800,将普通疫苗冻干保护剂与口蹄疫o型病毒样颗粒溶液按1:1的比例进行混合,混合均匀后按2ml/瓶的剂量
分装于西林瓶中,通过预冻、升华和干燥等步骤完成病毒样颗粒的冷冻干燥。采用此冻干保护剂冻干后的口蹄疫o型病毒样颗粒呈颜色黄色、萎缩状贴敷与瓶底,加稀释液后部分不溶解。
77.采用病毒样颗粒冻干保护剂冷冻干燥后的口蹄疫o型病毒样颗粒性状符合相关规定,而普通疫苗冻干保护剂(对照组)冷冻干燥的形态特征不满足冻干制品的基本要求。
78.2、病毒样颗粒冻干保护剂冻干效果的评价
79.(1)水分测定
80.抽取4瓶冻干后的口蹄疫o型病毒样颗粒,按现行中国兽药典附录进行水分测定,结果4瓶的水分含量分别为2.4%、2.3%、2.5%和2.3%。
81.(2)无菌检验
82.抽取5瓶冻干后的口蹄疫o型病毒样颗粒,按现行中国兽药典附录进行无菌检验,结果为5/5无菌生长。
83.(3)电镜观察
84.将冻干后的口蹄疫o型病毒样颗粒进行复溶,并将冻干前后的口蹄疫o型病毒样颗粒分别进行电镜观察,结果冻干前后的口蹄疫o型病毒样颗粒形态基本一致。
85.结果表明病口蹄疫o型毒样颗粒的形态在冻干未发生明显变化,冻干后的病毒样颗粒的形态保持与冻干前基本一致。(结果见图1及图2)
86.(4)粒径分析
87.将冻干后的口蹄疫o型病毒样颗粒复溶后,与冻干前后的口蹄疫o型病毒样颗粒分别使用动态光散射仪进行粒径分析,结果冻干前后的,口蹄疫o型病毒样颗粒的粒径均为20~30nm。结果表明口蹄疫o型病毒样颗粒的粒径在冻干过程中未发生发生变化,冻干后的病毒样颗粒的粒径与冻干前基本保持一致。
88.(结果见图4)
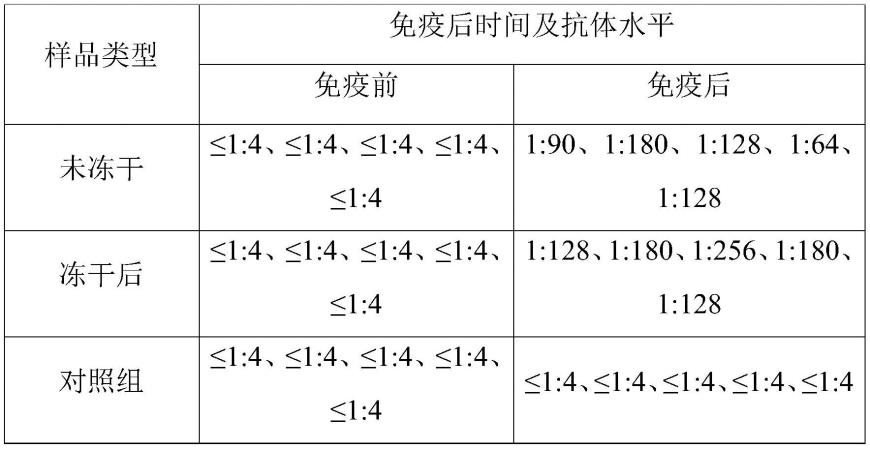
89.(5)病毒样颗粒组装率分析
90.冻干后的口蹄疫o型病毒样颗粒复溶后,与冻干前后的口蹄疫o型病毒样颗粒分别采用蔗糖梯度离心进行病毒样颗粒组装率分析,结果冻干前后的口蹄疫o型病毒样颗粒的组装率(病毒样颗粒占总体积的比例)基本保存一致。结果表明口蹄疫o型病毒样颗粒的组装率在冻干过程中未发生明显变化,冻干后的病毒样颗粒的组装率与冻干前基本保持一致。(结果见图5)
91.(6)免疫效果评价
92.将冻干后的口蹄疫o型病毒样颗粒复溶后制备成病毒样颗粒疫苗,与同批次未进行冻干处理的口蹄疫o型病毒样颗粒疫苗分别稀释相同的浓度,按口蹄疫o型病毒样颗粒疫苗制备工艺制备成疫苗,分别免疫健康架子猪,在免疫后28日采血分离血清,采用液相阻断elisa方法测定抗体效价。
93.如表1所示,冻干后的口蹄疫o型病毒样颗粒制成疫苗后免疫仔猪,免疫后产生的抗体水平高于冻干前。结果表明,由于冻干保护剂中含有的低聚半乳糖具有免疫增强剂的作用,冻干后的猪口蹄疫o型病毒样颗粒免疫效果优于冻干前。
94.表1冻干前后口蹄疫o型病毒样颗粒疫苗免疫效果评价结果
[0095][0096]
3、冻干后的病毒样颗粒保存期试验
[0097]
将冻干后的病毒样颗粒疫苗在-15℃条件下保存24个月,抽样后分别进行水分测定、无菌检验、电镜观察、粒径分析、组装率分析及免疫效果评价,以确定冻干后的病毒样颗粒保存期限。
[0098]
(1)水分测定
[0099]
抽取4瓶保存24个月后的口蹄疫o型病毒样颗粒冻干品,按现行中国兽药典附录进行水分测定,结果4瓶的水分含量分别为2.5%、2.4%、2.5%和2.5%。结果冻干后的口蹄疫o型病毒样颗粒在-15℃保存24个月,其水分测定结果与保存前无显著差异。
[0100]
(2)无菌检验
[0101]
抽取5瓶保存24个月后的口蹄疫o型病毒样颗粒冻干品,按现行中国兽药典附录进行无菌检验,结果为5/5无菌生长。结果冻干后的口蹄疫o型病毒样颗粒在-15℃保存24个月,其无菌检验结果与保存前无显著差异。
[0102]
(3)电镜观察
[0103]
将保存24个月后的口蹄疫o型病毒样颗粒冻干品复溶后进行电镜观察,结果冻干后的口蹄疫o型病毒样颗粒在-15℃保存24个月,其电镜观察结果与保存前无显著差异。(结果见图3)
[0104]
(4)粒径分析
[0105]
将保存24个月后的口蹄疫o型病毒样颗粒冻干品复溶后进行粒径分析,结果冻干后的口蹄疫o型病毒样颗粒在-15℃保存24个月,其粒径分析结果与保存前无显著差异。(结果见图4)
[0106]
(5)病毒样颗粒组装率分析
[0107]
将保存24个月后的口蹄疫o型病毒样颗粒冻干品复溶后进行组装率分析,结果冻干后的口蹄疫o型病毒样颗粒在-15℃保存24个月,其组装率略有想,但与保存前差异不显著。(结果见图5)
[0108]
(6)免疫效果评价
[0109]
将保存24个月后的口蹄疫o型病毒样颗粒冻干品复溶后,按口蹄疫o型病毒样颗粒疫苗制备工艺制备成疫苗,免疫健康架子猪评价免疫效果。结果冻干后的口蹄疫o型病毒样
颗粒在-15℃保存24个月,其免疫后动物后产生的抗体水平略有下降,但是与保存前差异不显著。
[0110]
表2冻干口蹄疫o型病毒样颗粒保存24个月后疫苗免疫效果
[0111][0112]
冻干后的口蹄疫o型病毒样颗粒在-15℃保存24个月,其特性及免疫效果均未发生显著变化。以上保存期试验结果表明,冻干后的口蹄疫o型病毒样颗粒在-15℃条件下的保存期至少为21个月及以上。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
