il4、il21、il27至少两种细胞因子处理获得的间充质干细胞及其外泌体和应用
技术领域
1.本发明涉及生物医学领域技术,尤其是指一种il4、il21、il27至少两种细胞因子处理获得的间充质干细胞及其外泌体和应用。
背景技术:
2.难治性系统性红斑狼疮(sle)是一种多因素引起的自身免疫性疾病,好发于20至40周龄女性,发病缓慢,临床表现多样。其中,由于患者自身细胞、体液免疫功能存在障碍所产生的自身抗体,会累及全身多处脏器,如:皮肤、关节、肾脏、神经系统等;常见症状包括关节炎、发烧、胸痛、脱发、淋巴肿大及脸部红疹等等。造成sle的病因尚不明确,目前认为可能与遗传因素、环境因素、内分泌因素等共同相互作用下导致的。在我国,sle人群的平均发病率在30-70人/每10万人,其中男女患病比例为1:11.9,平均患病年龄在30.7岁,患者发病后致死率和致残率较高,一旦发病对患者本人、家庭都会造成一定的经济和心理负担。而难治性系统性红斑狼疮在临床治疗上,常规疗法没有完全治愈的案例出现,现有传统疗法也会随疾病进程逐渐失去应有的疗效,身体机能在长期慢性炎症反应下逐渐崩解,对患者的生活质量有极大的影响。
3.间充质干细胞,是一类具有多能性干细胞,广泛存在于机体内的各种组织脏器中,起到组织修复及免疫调节作用。在体外,间充质干细胞具有多向分化潜能、能自我更新、增殖速度快的特点。而其被广泛关注的生物学特性主要是具备较低的免疫原性、较强的免疫调节能力,因此,在众多临床试验中被大量使用,得到领域内众多专家学者的青睐。在间充质干细胞应用的临床试验中,有一大部分涉及治疗自身免疫性疾病,如:系统性红斑狼疮、类风湿性关节炎、银屑病、克罗恩病等,说明间充质干细胞在治疗自身免疫性疾病上具有较好的应用场景,并且也已取得一定的治疗效果。但,并不是所有参与使用间充质干细胞治疗的临床试验患者都能得到较好的治疗效果,普通间充质干细胞在治疗自身免疫性疾病上存在一定的个体差异性,往往并非所有的受试者都能得到较好的预期疗效,这主要是因为普通间充质干细胞本身的异质性所导致的。用于常规临床治疗所制备的普通间充质干细胞虽然经过了数次传代扩增,但其细胞群内仍存在各种功能性状不一的细胞亚群,而间充质干细胞在针对自身免疫性疾病上主要是通过旁分泌途径发挥免疫调节功能,临床治疗时使用的普通间充质干细胞由于细胞异质性,在注射至体内后,需要经过体内微环境的刺激后,才会逐渐形成功能统一、性状相似的细胞亚群,之后才会发挥治疗效果。而细胞在注射至体内后其代谢周期相对固定,且有一大部分细胞会被截留在肺部并不会游走全身,而细胞需要接收体内刺激后才能发挥功能占用了大部分代谢周期内的时间后,能发挥治疗效果的时间就会大大减少,从而导致不同患者间的治疗效果参差不齐。
4.外泌体是一类包含了复杂rna、蛋白质或糖类的小膜泡,通常直径范围在40-100nm之间。外泌体在多种细胞状态下均会被分泌至细胞外,作为一种特异性分泌的膜泡,在参与细胞通讯、细胞间相互作用上发挥着重要功能,且由于外泌体仅有膜结构,没有核结构,不
容易产生安全性问题的特点,受到临床研究及学术研究的广泛关注。而外泌体作为间充质干细胞发挥旁分泌功能,在调节机体免疫功能上具有重要意义,但因为普通间充质干细胞难以在进入机体后第一时间进行反应,能分泌具有调节免疫功能的外泌体是十分有限的。因此,更需要一种技术方式使得间充质干细胞接受相应炎症环境信号刺激,迅速、大量产生相应的具有对应炎症环境调节功能的外泌体。
5.综上,解决间充质干细胞活化问题,是提高/增强间充质干细胞治疗效果的关键问题,已有研究证明,间充质干细胞在体外接受相应细胞因子刺激后会出现相应的生物学特性的改变,且会随细胞因子类型、浓度、刺激程度产生不同的效果,因此,提供一种用于治疗sle的间充质干细胞及其外泌体具有重要的研究意义。
技术实现要素:
6.有鉴于此,本发明针对现有技术存在之缺失,其主要目的是提供一种il4、il21、il27至少两种细胞因子处理获得的间充质干细胞及其外泌体和应用,其通过使用本发明提供的细胞因子组合物预处理后得到的间充质干细胞及其外泌体可发挥更强的免疫调节功能,更好的用于免疫性疾病的治疗。
7.为实现上述目的,本发明采用如下之技术方案:
8.一种il4、il21、il27至少两种细胞因子处理获得的间充质干细胞及其外泌体,其由细胞因子组合物对间充质干细胞进行预处理后获得该间充质干细胞及其外泌体,所述细胞因子组合物包括il4、il21、il27中的至少两种细胞因子;所述预处理获得该间充质干细胞的方式为:采用大规模生物反应器,对间充质干细胞使用含有细胞因子组合物的完全培养基进行分阶段处理刺激,获得赋能后的间充质干细胞;所述预处理获得该外泌体的方式为:采用大规模生物反应器,对间充质干细胞使用含有细胞因子组合物的完全培养基进行分阶段处理刺激,然后更换为基础培养基饥饿处理,收集培养上清,梯度超速离心获得外泌体。
9.作为一种优选方案:所述分阶段处理刺激的方法为:分阶段添加含有对应浓度之不同细胞因子组合物的完全培养基至大规模生物反应器中,对间充质干细胞进行赋能刺激;所述完全培养基为培养哺乳动物细胞的任一基础培养基混合血清替代物。
10.作为一种优选方案:所述il4、il21、il27三种细胞因子的浓度范围分别为:il4:25-150ng/ml、il21:100-300ng/ml、il27:50-250ng/ml。
11.作为一种优选方案:所述细胞因子组合物包括il4、il21,或者,该细胞因子组合物包括il21、il27,或者,该细胞因子组合物包括il4、il27。
12.作为一种优选方案:所述细胞因子组合物包括浓度为30ng/ml的il4和浓度为200ng/ml的il21;或者,该细胞因子组合物包括浓度为150ng/ml的il21和浓度为200ng/ml的il27;或者,该细胞因子组合物包括浓度为25ng/ml的il4和浓度为75ng/ml的il27。
13.作为一种优选方案:所述细胞因子组合物对间充质干细胞进行预处理过程中需接触培养16-36小时;所述细胞因子组合物包括il4、il21,其中il4预处理时间为10小时,il21预处理时间为12小时;该细胞因子组合物包括il21、il27,其中il21预处理时间为10小时,il27预处理时间为12小时;该细胞因子组合物包括il4、il27,其中;il4预处理时间为6小时,il27预处理时间为10小时。
14.作为一种优选方案:所述使用基础培养基饥饿处理时间为24小时。
15.作为一种优选方案:未经预处理的间充质干细胞来源于人体组织中骨髓、脂肪、胎盘、脐带和牙髓中的至少一种;该外泌体来源于间充质干细胞所分泌。
16.作为一种优选方案:所述il4、il21、il27至少两种细胞因子处理获得的间充质干细胞及其外泌体,具有抗sle治疗活性增强的作用。
17.所述的il4、il21、il27至少两种细胞因子处理获得的间充质干细胞及其外泌体的应用,用于制备治疗sle引起的全身性、免疫性炎症药物。
18.本发明与现有技术相比具有明显的优点和有益效果,具体而言,由上述技术方案可知,本发明提供的细胞因子组合物是根据sle患者发病进程中机体内炎症微环境细胞因子的表达特点筛选出来的,可刺激人间充质干细胞在针对sle上具有更好的抗炎症活性;相比常规培养方法获得的人间充质干细胞或其外泌体,经本发明提供的间充质干细胞及其外泌体可以有更好的抗炎症环境活性,以用于治疗sle引起的免疫炎症反应,降低炎症反应对全身组织的破坏,缓解疾病进展速度;具体表现在:降低t/b淋巴细胞增殖比例、降低t辅助淋巴细胞增殖比例、上调t调节淋巴细胞增殖比例;经本发明培养方法获得的人间充质干细胞及其外泌体对疾病模型的保护程度要优于常规方法获得的人间充质干细胞及其外泌体对疾病模型的保护程度。
19.为更清楚地阐述本发明的结构特征和功效,下面结合附图与具体实施例来对其进行详细说明。
附图说明
20.图1为本发明之sle模型小鼠疾病发展期间体内血清中il4、il21及il27的变化图;
21.图2为本发明之预处理前后人脐带间充质干细胞及其外泌体的治疗效果在sle小鼠的血清dsdna及ana的表现图;
22.图3为本发明之预处理前后人脐带间充质干细胞及其外泌体生物学特性的影响(a为不同组别ido的表达情况、b为不同组别pge2的表达情况、c为不同组别vegf的表达情况);
23.图4为本发明之不同细胞因子浓度对人脐带间充质干细胞及其外泌体表达的细胞因子的影响(a为不同组别ido的表达情况、b为不同组别pge2的表达情况);
24.图5为本发明之不同细胞因子组合物预处理后人脐带间充质干细胞及其外泌体的体外免疫抑制功能的影响图;
25.图6为本发明之在不同处理时间下因子组合对人脐带间充质干细胞及其外泌体的体外免疫抑制功能的影响图;
26.图7为本发明之在不同浓度下细胞因子组合对人脐带间充质干细胞及其外泌体的体外免疫抑制功能的影响图;
27.图8为本发明之sle模型下不同细胞因子组合物预处理后对人脐带间充质干细胞及其外泌体的疗效图。
具体实施方式
28.本发明如图1至图8所示,一种il4、il21、il27至少两种细胞因子处理获得的间充质干细胞及其外泌体,其由细胞因子组合物对间充质干细胞进行预处理后获得该间充质干
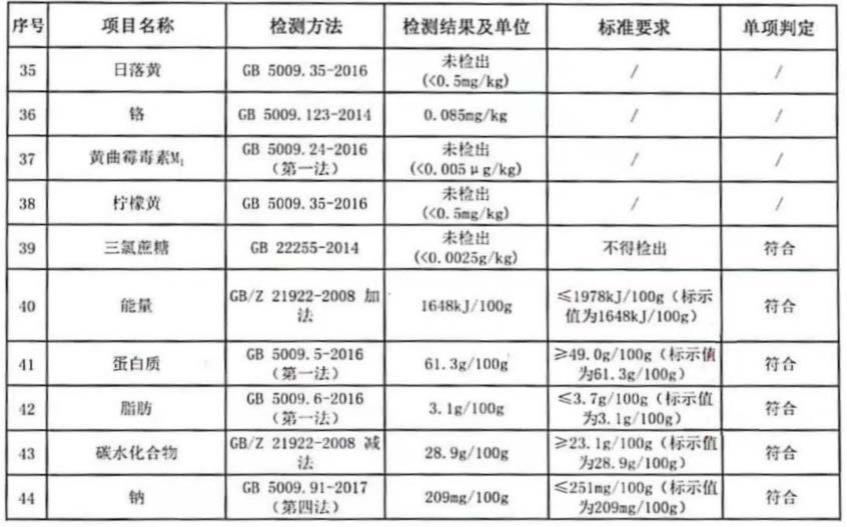
细胞及其外泌体,该细胞因子组合物包括il4、il21、il27中的至少两种细胞因子;该预处理获得该间充质干细胞的方式为:采用大规模生物反应器,对间充质干细胞使用含有细胞因子组合物的完全培养基进行分阶段处理刺激,获得赋能后的间充质干细胞;该预处理获得该外泌体的方式为:采用大规模生物反应器,对间充质干细胞使用含有细胞因子组合物的完全培养基进行分阶段处理刺激,然后更换为基础培养基饥饿处理,收集培养上清,梯度超速离心获得外泌体。
29.该分阶段处理刺激的方法为:分阶段添加含有对应浓度之不同细胞因子组合物的完全培养基至大规模生物反应器中,对间充质干细胞进行赋能刺激;该完全培养基为培养哺乳动物细胞的任一基础培养基混合血清替代物。
30.基础培养基可使用达尔伯克氏改良伊格尔氏培养基(dmem)、达尔伯克氏改良伊格尔氏培养基和f12的混合物(dmem/f12)、rpmi 1640。
31.该il4、il21、il27三种细胞因子的浓度范围分别为:il4:25-150ng/ml、il21:100-300ng/ml、il27:50-250ng/ml。
32.该细胞因子组合物包括il4、il21,或者,该细胞因子组合物包括il21、il27,或者,该细胞因子组合物包括il4、il27。
33.该细胞因子组合物包括浓度为30ng/ml的il4和浓度为200ng/ml的il21;或者,该细胞因子组合物包括浓度为150ng/ml的il21和浓度为200ng/ml的il27;或者,该细胞因子组合物包括浓度为25ng/ml的il4和浓度为75ng/ml的il27。
34.该细胞因子组合物对间充质干细胞进行预处理过程中需接触培养16-36小时;该细胞因子组合物包括il4、il21,其中il4预处理时间为10小时,il21预处理时间为12小时;该细胞因子组合物包括il21、il27,其中il21预处理时间为10小时,il27预处理时间为12小时;该细胞因子组合物包括il4、il27,其中;il4预处理时间为6小时,il27预处理时间为10小时。
35.该使用基础培养基饥饿处理时间为24小时。
36.该未经预处理的间充质干细胞来源于人体组织中骨髓、脂肪、胎盘、脐带和牙髓中的至少一种;该外泌体来源于间充质干细胞所分泌。
37.该il4、il21、il27至少两种细胞因子处理获得的间充质干细胞及其外泌体,具有抗sle治疗活性增强的作用。
38.该的il4、il21、il27至少两种细胞因子处理获得的间充质干细胞及其外泌体的应用,用于制备治疗sle引起的全身性、免疫性炎症药物。
39.本发明中,所用试剂和试验材料均可从市售渠道获取,其中生物材料来源如下:
40.il4、il21、il27细胞因子均购自r&d systems公司。
41.实施例一:
42.细胞因子组合物预处理的人脐带间充质干细胞及其外泌体的制备方法:
43.第一:人脐带间充质干细胞制备方法:
44.人脐带间充质干细胞的分离及培养:
45.在医学伦理委员会的监督下,从健康供体获取新鲜脐带进行华通氏胶的分离,对华通氏胶进行剪碎,采用贴壁法培养,在无血清培养系统下进行原代细胞的获取和扩增,该无血清培养系统为:mscxf medium(bi,以色列) 2%血小板裂解物 msc
xf supplement mix(bi,以色列)。
46.对原代细胞进行扩增并于“p2代”进行冻存做为种子细胞:
[0047]“p2代”指:原代细胞在细胞工厂中,按3000-5000cells/m2进行扩增培养,积累一定数量后,转入圆柱形细胞扩增生物反应器中,将细胞与微载体混合培养,以10000-12000cells/ml为培养浓度进行细胞扩增,并通过灌流系统及时补充培养液;在培养24后,进入使用细胞因子组合物处理阶段。
[0048]
第二:细胞因子组合物预处理人脐带间充质干细胞:
[0049]
将不同细胞因子按组合方式,分阶段、以对应浓度添加入细胞培养基中,并随灌流系统,逐步替换原有培养基,组合内每种因子的使用按相应顺序刺激人脐带间充质干细胞相应时间后,即更换下一种细胞因子或更换基础培养基进行饥饿处理。
[0050]“预处理”是指如下过程,在培养人脐带来源的间充质干细胞的过程中,将添加有il4、il21、il27中至少2种细胞因子的细胞因子组合物的细胞培养基与人脐带来源的间充质干细胞接触培养。
[0051]
该“基础培养基”可以使用市售任意哺乳动物适用的细胞培养基,如:dmem、mem、dmem/f12;本实施例中使用mscxf medium(bi,以色列)。
[0052]
在本说明书中,为针对sle疾病病理特点,该细胞因子组合物包括il4、il21,称为细胞因子组合物1;该细胞因子组合物包括il21、il27,称为细胞因子组合物2;该细胞因子组合物包括il4、il27,称为细胞因子组合物3;细胞因子浓度范围如下il4:25-150ng/ml、il21:100-300ng/ml、il27:50-250ng/ml。
[0053]
在本说明书中,含有细胞因子组合物的预处理培养基与细胞接触培养时间:
[0054]
细胞因子组合物1为il4预处理时间为10小时,il21预处理时间为12小时;细胞因子组合物2为il21预处理时间为10小时,il27预处理时间为12小时;细胞因子组合物3为il4预处理时间为6小时,il27预处理时间为10小时。
[0055]
在本说明书中,经细胞因子组合物的预处理培养基处理后的间充质干细胞,仍需进行24小时的饥饿处理后,方可进行消化,制备为细胞制剂,存储运输至患者处使用。
[0056]
第三:外泌体制备方法:
[0057]
收集饥饿处理后的培养上清液,在200g的离心力下,离心10min去除大部分细胞碎片;之后,使用中空纤维柱为过滤载体进行切向流浓缩,调整压力在40-100psi之间,去除大于250kd的杂质并将液体浓缩50至100倍,本实施例中,浓缩倍数为50倍。
[0058]
将浓缩液进行超速梯度离心,具体方法如下:
[0059]
4℃下,10,000g离心30min,保留上清;将上清于4℃下,10,0000g离心90min,保留沉淀;将沉淀加入20ml d-pbs在4℃下,100,000g,离心90min,保留离心沉淀,即获得分离后的外泌体;使用1ml d-pbs溶解并混匀离心沉淀后,于-80℃下保存备用。
[0060]
效果实施例一:
[0061]
预处理前后人脐带间充质干细胞及其外泌体的生物学特性对比
[0062]
在本说明书中,为进一步阐明细胞因子组合物对人脐带间充质干细胞的生物学特性影响,进行了体外细胞因子分泌检测。其中,体外细胞因子分泌检测主要考察在体外培养的条件下,相同培养时间内,普通人脐带间充质干细胞、不同细胞因子浓度预处理的人脐带间充质干细胞和不同细胞因子组合物预处理的人脐带间充质干细胞(组合类型包括:细胞
因子组合物1、细胞因子组合物2、细胞因子组合物3)的培养上清中的细胞因子浓度,考察不同细胞因子浓度或不同细胞因子组合物对人脐带间充质干细胞表达细胞因子的影响。
[0063]
具体的是,在细胞融合度达到80%以上是,添加对应浓度或不同组合的含有细胞因子的完全培养基刺激间充质干细胞10h-24h,然后收集培养上清检测间充质干细胞细胞因子表达情况,同时更换为基础培养基再饥饿处理24h检测外泌体中细胞因子表达情况。
[0064]
预处理前后的人脐带间充质干细胞外泌体的获取方式为,经过预处理后的间质干细胞在更换基础培养基后对其饥饿处理,然后收集培养上清进行梯度离心,获得浓缩后的抗sle活性增强的间质干细胞的外泌体,并通过纳米粒径分析仪以及western blot检测鉴定;“预处理时间”是指接触培养时间。
[0065]
图3和图4结果表明,使用elisa法检测ido、pge2、vegf蛋白表达量发现,预处理后人脐带间充质干细胞的培养上清及外泌体中,ido、pge2、vegf的浓度明显上升。
[0066]
图4表明,采用单独组分的不同细胞因子浓度对人脐带间充质干细胞及其外泌体的表达时,il4优选浓度为45ng/ml、il21优选浓度为200ng/ml、il27优选浓度为75ng/ml。
[0067]
效果实施例二:
[0068]
预处理前后人脐带间充质干细胞及其外泌体的体外免疫抑制试验
[0069]
间充质干细胞在体外与人外周血单个核细胞共培养,是检测间充质干细胞在体外免疫抑制能力的重要实验检测方法。本发明中,将人外周血单个核细胞标记cfse且经过cd3、cd28单抗激活后,分别与普通人脐带间充质干细胞或其外泌体、预处理后的人脐带间充质干细胞或其外泌体(组合类型包括:细胞因子组合物1、细胞因子组合物2、细胞因子组合物3)进行共培养72-80小时,流式检测pbmc的增殖情况。
[0070]
图5、图6和图7结果表明:经过80小时的共培养后,经过细胞因子组合物预处理后的人脐带间充质干细胞或其外泌体的免疫抑制效果明显优于普通人脐带间充质干细胞或其外泌体的免疫抑制效果。从流式检测结果上看,细胞因子组合物1、细胞因子组合物2、细胞因子组合物3预处理后的人脐带间充质干细胞或其外泌体共培养的cd3 总t细胞的增殖比例明显下降,增殖下降比例明显高于与普通人脐带间充质干细胞或其外泌体共培养的cd3 总t细胞。从抑制百分比统计,与因子组合预处理后的人脐带间充质干细胞或其外泌体共培养的cd3 总t细胞的抑制效果好,抑制比例明显高于与普通人脐带间充质干细胞或其外泌体共培养的cd3 总t细胞的抑制比例。
[0071]
图6结果表明,所述预处理中,细胞因子组合物1为il4预处理时间为10小时,il21预处理时间为12小时;细胞因子组合物2为il21预处理时间为10小时,il27预处理时间为12小时;细胞因子组合物3为il4预处理时间为6小时,il27预处理时间为10小时。
[0072]
图7和图8结果表明,通过体外免疫抑制实验及sle模型治疗实验,得出细胞因子组合物1的优选浓度为30ng/ml的il4、200ng/ml的il21;细胞因子组合物2的优选浓度为150ng/ml的il21、200ng/ml的il27;细胞因子组合物3的优选浓度为25ng/ml il4、75ng/ml il27。
[0073]
效果实施例三:
[0074]
不同细胞因子组合物预处理的人脐带间充质干细胞或其外泌体治疗sle小鼠模型
[0075]
利用mrl/lpr小鼠作为sle小鼠模型,mrl/lpr小鼠在实验室饲养到12周龄后,小鼠会开始自然发病,从第10周开始检测sle小鼠血清细胞因子(il4、il-18、il27)变化,检测小
鼠血清抗核抗体(ana)、抗dsdna抗体(dsdna)浓度。在本发明中,利用普通人脐带间充质干细胞或其外泌体、预处理后的人脐带间充质干细胞或其外泌体(组合类型包括:细胞因子组合物1、细胞因子组合物2、细胞因子组合物3)的免疫抑制功能特性,应用于治疗sle上。
[0076]“sle模型治疗实验”为在mrl/lpr基因鼠(该基因鼠在12周龄时,会出现与临床上系统性红斑狼疮相似的疾病特点,是一种sle良好的疾病研究模型)达到12周龄时尾静脉注射1
×
106个预处理前后的人脐带间充质干细胞进行治疗,或尾静脉注射总蛋白含量为200μg的预处理前后的人脐带间充质干细胞外泌体进行治疗,并于造模后第14天处死小鼠取其内脏组织进行病理切片,与对照组一同进行h&e染色,判断治疗效果。
[0077]
由图2、图5至图8表明,结果发现,普通人脐带间充质干细胞或其外泌体在对sle有一定的治疗效果,说明普通人脐带间充质干细胞或其外泌体能够接受到体内炎性因子的刺激后发挥相应的免疫抑制作用,但由于普通人脐带间充质干细胞未经过特定细胞因子预处理,并不能在进入体内后立刻发挥作用,因此治疗作用效果有限,而未处理的人脐带间充质干细胞所释放的外泌体也表现出同样的生物学特性,说明未经过预处理的间充质干细胞能发挥的免疫调节功能有限;然而在sle疾病模型中细胞因子组合物1、细胞因子组合物2、细胞因子组合物3预处理后的人脐带间充质干细胞或其外泌体表现出了优于普通人脐带间充质干细胞或其外泌体的免疫抑制能力。
[0078]
因此,这一结果与本说明书中在体外实验中得出的结论相符,本发明提供的细胞因子组合物对人脐带间充质干细胞或其外泌体用于治疗sle具有增强作用。
[0079]
由图2、图5至图8表明,本发明提供了含有细胞因子组合物培养得到的间充质干细胞及其外泌体,其针对sle具有良好的抗炎活性。经实验验证,相比于普通现有的间充质干细胞及其外泌体,经过含有il4、il21、il27中的至少2种细胞因子的细胞因子组合物处理后的间充质干细胞及其外泌体,在针对sle上有明显改善的治疗效果,可以有效降低dsdna及ana在动物模型上的分泌水平。
[0080]
其中:“抗sle活性”是指经过含有il4、il21、il27中至少2种细胞因子的细胞因子组合物处理后间充质干细胞及其外泌体对t/b淋巴细胞具有更好地免疫抑制功能。
[0081]
在本发明中,所述“抗sle活性”的主要实现机制为:通过在体外提前使用相应的细胞因子组合物对间充质干细胞进行预处理,提前接触疾病微环境下主要发挥功能地细胞因子,使之在体外培养下便开始活化,缩短进入机体内的活化时间,同时增强其针对特殊微环境的功能性,从而提高了对应疾病的对抗活性及治疗效果。
[0082]
图8结果表明,使用本说明书中的预处理后的间充质干细胞或外泌体进行治疗后,出现明显的治疗效果。
[0083]
本发明的设计重点在于,通过使用本发明提供的细胞因子组合物预处理后得到的间充质干细胞及其外泌体可发挥更强的免疫调节功能,更好的用于免疫性疾病的治疗,同时为针对疾病的不同状态提供个性化的细胞治疗方案打下基础;本发明为精准治疗提供了一套切实可行的临床干细胞治疗方案,可以更好的对不同sle病人的疾病严重不同程度进行针对性的精准治疗,有效提高治疗效果,降低疾病临床症状。
[0084]
以上所述,仅是本发明的较佳实施例而已,并非对本发明的技术范围作任何限制,故凡是依据本发明的技术实质对以上实施例所做的任何细微修改、等同变化与修饰,均仍属于本发明技术方案的范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。