1.本发明涉及原花色素的制备与应用技术领域,具体涉及一种从杨梅果实中提取并纯化原花色素的方法及其降血糖应用。
背景技术:
2.杨梅是原产于我国的常绿乔木,属于木兰纲、杨梅科、杨梅属,代表性品种有荸荠种、晚稻种和东魁种等,现种植面积达500余万亩,果实年产量达100余万吨。研究表明,杨梅果实具有极强的降血糖功效。但杨梅果实保鲜难度大,季节性极强,难以满足消费者对其降血糖功能的长期需求;而且杨梅产业以低附加值的传统加工模式为主,亟需实现精深加工转型。
3.杨梅果实富含多种酚类物质,其中原花色素可能是其发挥生理功效的关键性成分之一,但未得到证实。原花色素是一类以黄烷-3-醇为结构单元的聚合型多酚,因黄烷-3-醇的种类不同,原花色素结构差异巨大,生理功效也不同。杨震峰等研究发现,杨梅果实原花色素是以表没食子儿茶素没食子酸酯为主要结构单元,并含有表没食子儿茶素没食子酸酯、表没食子儿茶素和儿茶素等结构单元的复杂原花色素。由于结构特殊,尚未有研究报道其其他来源,也无报道证实其降血糖功效。
4.原花色素制备多采用水或有机溶剂水溶液提取分离,结合大孔吸附树脂、葡聚糖凝胶进行纯化,但在杨梅果实中,原花色素和花色苷溶解性相近,难以实现高效分离。谢建华等采用响应面法优化了乙醇水溶液提取杨梅果实原花色素的工艺,但未去除花色苷等酚类纯化原花色素。相关杨梅果实原花色素的纯化研究尚未见报道。卢棉等采用乙醇超声提取,结合h-103大孔吸附树脂制备杨梅叶原花色素。专利cn201310181254.3公开了一种丙酮水溶液浸提,结合葡聚糖凝胶lh-20制备杨梅叶原花色素的方法。专利cn202010440691.2公开了一种含抗坏血酸的丙酮水溶液浸提,结合三氯甲烷萃取及盐析制备杨梅叶原花色素多聚体的方法。上述制备杨梅叶原花色素的技术可应用于杨梅果实,但花色苷等其它酚类物质未被去除,所得原花色素的纯度低。加之,上述技术需要大量消耗丙酮、甲醇和三氯甲烷等有机溶剂,污染环境、安全性难以保证,且纯化效率低、成本高,只适用于实验室研究,不适用于规模化批量生产,难以应用于食品原料生产。此外,杨梅果实降血糖功效研究仅集中于矢车菊素-3-o-葡萄糖苷等花色苷,而关键功效成分原花色素尚未被研究。因此,亟需开发新的技术从杨梅果实中高效分离制备高纯度原花色素,并探究其降血糖活性。
技术实现要素:
5.本发明要解决的技术问题是提供一种从杨梅果实中提取并纯化原花色素的方法。
6.为了解决上述技术问题,本发明提供一种杨梅果实原花色素的制备方法(从杨梅果实中提取并纯化原花色素的方法),包括如下步骤:
7.(1)将去核杨梅先榨汁,榨汁所得浆液加水浸提,得水提取液;所述水提取液中含有原花色素、花色苷、糖类、蛋白质和杨梅素、槲皮素等小分子黄酮类物质;
8.(2)将步骤(1)得到的水提取液旋转蒸发至固形物含量48~52%(重量%),得浓缩液;
9.(3)取步骤(2)所得的浓缩液吸附于大孔吸附树脂层析柱(8
×
100cm),以3
±
0.5倍柱体积的去离子水洗脱弃去洗脱液,再用3
±
0.5倍柱体积的体积浓度80%的乙醇水溶液洗脱并收集全部的洗脱液,旋转蒸发去除乙醇后,喷雾干燥,获得喷干粉(杨梅果实多酚类物质);
10.(4)按照1.0~3.0mg/ml的料液比,将步骤(3)所得的喷干粉溶解于ph=3的水中,过滤后吸附于阳离子交换树脂层析柱(25
×
300mm);用3
±
0.5倍柱体积的4~6%的酸化甲醇溶液(v/v)洗脱并弃去洗脱液,以去除花色苷,再用3
±
0.5倍柱体积的去离子水洗脱并收集全部的洗脱液,从而获得含有杨梅果实原花色素粗提物的洗脱液;
11.说明:可采用1mol/l盐酸实现对水的ph的调节;
12.(5)向步骤(4)所得的含有杨梅果实原花色素粗提物的洗脱液中加入1~3倍体积的乙酸乙酯,充分混合均匀后于室温下静置30~60分钟,取静置所得水相(位于下层)喷雾干燥,获得杨梅果实原花色素(纯度≥98%,最高可达99.5%)。
13.作为本发明的杨梅果实原花色素的制备方法的改进:
14.步骤(1)中的浸提:榨汁所得浆液中加入为去核杨梅果实1~1.5重量倍的水,于90~95℃下避光浸提1小时,500目滤网过滤浸提液,所得残渣再重复浸提1~3次;并合并所有的水提取液。
15.作为本发明的杨梅果实原花色素的制备方法的进一步改进:所述步骤(2)(3)中的旋转蒸发过程的真空度低于0.08mpa,温度为40~60℃。
16.作为本发明的杨梅果实原花色素的制备方法的进一步改进:所述步骤(3)(5)中的喷雾干燥过程的进风温度为160~180℃,进料流量为3~5ml/min,进风压力为0.2mpa。
17.作为本发明的杨梅果实原花色素的制备方法的进一步改进:
18.所述步骤(4)中的酸化甲醇溶液为乙酸甲醇溶液、甲酸甲醇溶液或盐酸甲醇溶液;
19.乙酸、甲酸、盐酸在酸化甲醇溶液中的体积浓度为4~6%。
20.作为本发明的杨梅果实原花色素的制备方法的进一步改进:
21.所述步骤(3)中的大孔吸附树脂为hpd500型、ab-8型或x-5型。
22.作为本发明的杨梅果实原花色素的制备方法的进一步改进:
23.所述步骤(4)中的阳离子交换树脂为d001型、d113型或d152型。
24.本发明还同时提供了利用上述方法制备而得的杨梅果实原花色素在制备降血糖药物中的应用。
25.本发明实际使用时的用法和用量可参照目前现有的原花色素的用法和用量。
26.本发明采用水溶液浸提杨梅果实原花色素,利用大孔吸附树脂去除糖类和蛋白质,再联合阳离子交换树脂纯化(去除花色苷)和乙酸乙酯萃取(去除小分子黄酮类物质),获得高纯度的原花色素。制备所得杨梅果实原花色素为棕褐色粉末,优选案例(实施例1)时,含量为221.73
±
0.60mg当量表儿茶素/g样品(干重),纯度=99.5%。
27.相对于现有技术,本发明的有益效果主要体现在:
28.1、本发明制备方法采用水溶液浸提杨梅果实原花色素,并联合大孔吸附树脂和阳离子交换树脂纯化及乙酸乙酯萃取,有效分离得到高纯度的原花色素;
29.而现有技术大多采用有机溶剂并联合大孔吸附树脂或葡聚糖凝胶提取、纯化原花色素,效果不佳、污染环境且成本较高;
30.因此,本发明降低了提取成本,有效分离去除极性相近的花色苷、糖类和小分子黄酮类物质等,提高了原花色素的纯度。
31.2、本发明制备所得杨梅果实原花色素具有降血糖活性。
32.综上,本发明的方法针对从杨梅果实中难以高效分离原花色素和花色苷的问题,利用hpd500大孔吸附树脂去除糖和蛋白质等杂质,进一步联合阳离子交换树脂分离纯化及乙酸乙酯萃取,获得高纯度的原花色素(以峰面积计算,纯度≥98%,最高可达99.5%),并以体内、外实验证实了其降血糖活性。
附图说明
33.下面结合附图对本发明的具体实施方式作进一步详细说明。
34.图1是荸荠种杨梅果实原花色素hplc图谱;
35.图2是荸荠种杨梅果实原花色素对α-葡萄糖苷酶活性的影响;
36.图3是荸荠种杨梅果实原花色素对正常icr小鼠和高脂膳食诱导ⅱ型糖尿病小鼠血糖水平的影响:(a)正常icr小鼠灌胃阿卡波糖或原花色素(400mg/kg)和蔗糖(2g/kg)后血糖浓度;(b)正常icr小鼠灌胃阿卡波糖或原花色素(400mg/kg)和蔗糖后auc值;(c)ⅱ型糖尿病小鼠灌胃原花色素(400mg/kg)和葡萄糖(2g/kg)后血糖浓度;(d)ⅱ型糖尿病小鼠灌胃原花色素(400mg/kg)和葡萄糖(2g/kg)后auc值。
37.其中,bqps表示实施例1所制得的荸荠种杨梅果实原花色素(纯度=99.5%)。
具体实施方式
38.为使本发明的技术方案更加清楚,下面对本发明的具体实施方式作进一步详细说明,但并不以此来限制本发明。
39.原料来源:荸荠种杨梅果实——购自浙江省台州市仙居县。
40.hpd500型、ab-8型、x-5型大孔吸附树脂和d001型、d113型、d152型阳离子交换树脂购自北京索莱宝科技有限公司。
41.乙酸、乙腈(色谱级)和α-葡萄糖苷酶(来源于酿酒酵母)购自美国sigma-aldrich公司。
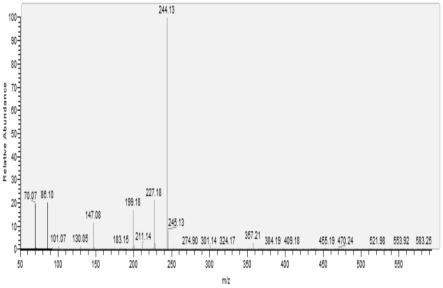
42.甲醇、乙酸、甲酸、盐酸、乙醇、乙酸乙酯(分析纯)购自国药集团化学试剂有限公司。
43.阿卡波糖购自上海阿拉丁生化科技股份有限公司。
44.4-硝基苯-α-吡喃葡萄糖苷(pnpg)购自上海皓鸿生物医药科技有限公司。
45.icr小鼠(雄性,6周龄)和c57bl/6j小鼠(雄性,4周龄)购自浙江省医学科学院。
46.实施例1
47.一种从杨梅果实中提取并纯化原花色素的方法,包括以下步骤:
48.(1)取1.0kg去核杨梅先榨汁,榨汁所得浆液中加入1000ml水,92℃下避光浸提1小时,500目滤网过滤得浸提液,过滤所得残渣再浸提2次,合并3次所得的浸提液,作为水提取液。
49.此水提取液中含有原花色素、花色苷、糖类、蛋白质和杨梅素、槲皮素等小分子黄酮类物质。
50.(2)在0.05mpa真空度和50℃下旋转蒸发步骤(1)所得水提取液,浓缩至固形物含量约50%;得浓缩液。
51.说明:可采用常规的折光法检测固形物含量。
52.(3)将步骤(2)所得的浓缩液吸附于hpd500大孔吸附树脂层析柱(8
×
100cm),以3倍柱体积的去离子水洗脱并弃去洗脱液,再用3倍柱体积的体积浓度80%的乙醇水溶液(即,乙醇与水按照4:1的体积比混合)洗脱并收集全部的洗脱液,旋转蒸发(真空度0.05mpa,温度50℃)去除乙醇后,在170℃进风温度、4ml/min进料流量、0.2mpa进风压力下喷雾干燥,获得喷干粉(杨梅果实多酚类物质),约50.32g。
53.(4)将步骤(3)所得的全部的喷干粉按2.0mg/ml溶解于ph=3的水中,过滤(500目滤网过滤)后的滤液吸附于d001阳离子交换树脂层析柱(25
×
300mm),用3倍柱体积的5%的乙酸甲醇溶液(v/v)洗脱以去除花色苷(洗脱液作废弃处理),再用3倍柱体积的去离子水洗脱并收集全部的洗脱液,从而获得含有杨梅果实原花色素粗提物的洗脱液。
54.说明:5%的乙酸甲醇溶液,是指乙酸:甲醇=5:95的体积比。
55.(5)向步骤(4)所得的含有原花色素粗提物洗脱液中加入2倍体积的乙酸乙酯,充分混合均匀后于室温下静置60分钟,取静置所得水相(位于下层)喷雾干燥(在170℃进风温度、4ml/min进料流量、0.2mpa进风压力下喷雾干燥),获得杨梅果实原花色素24.80g(纯度=99.5%)。
56.得率为2.48%。
57.采用香草醛-硫酸法测得:杨梅果实中原花色素的含量为221.73
±
0.60mg当量表儿茶素/g样品(干重)。具体测定方法如下:
58.配制1.0ml 1%(v/v)杨梅果实原花色素喷干粉溶液置于10ml离心管,加入2.5ml 1%(v/v)香草醛甲醇溶液和2.5ml 20%(v/v)硫酸甲醇溶液后混匀,30℃水浴加热15min,测定500nm下吸光度值。以甲醇作为空白对照。
59.准确称取1.0mg制得的杨梅果实原花色素,溶于1ml甲醇溶液,过0.22μm滤膜后,利用高效液相色谱(hplc)检测纯度为98.8%,hplc色谱图如图1。
60.hplc检测方法如下(常规技术):waters 2695高效液相色谱;waters 2489紫外-可见光检测器;色谱柱型号为hilic色谱柱(250
×
4.6mm,5μm;phenomenex technologies co.,ltd);检测波长为280nm;流动相为0.5%乙酸乙腈溶液(v/v)(a)和纯水(b);梯度洗脱:0-30min,10-27%b,30-40min,27-80%b,40-42min,80-10%b,42-50min,10%b;流速:1ml/min;进样量:10μl;柱温:30℃。利用峰面积计算杨梅果实原花色素的纯度。
61.实施例2、一种从杨梅果实中提取并纯化原花色素的方法
62.将实施例1步骤(3)中hpd500大孔吸附树脂替换为ab-8或x-5大孔吸附树脂,其余操作等同于实施例1。
63.上述案例得率和纯度与实施例1的对比如下表1所述。
64.表1不同型号大孔吸附树脂纯化对原花色素得率和纯度的影响
[0065][0066]
实施例3、一种从杨梅果实中提取并纯化原花色素的方法,
[0067]
将实施例1步骤(4)中d001阳离子交换树脂替换为d113或d152阳离子交换树脂,其余操作等同于实施例1。
[0068]
上述案例得率和纯度与实施例1的对比如下表2所述。
[0069]
表2不同型号阳离子交换树脂纯化对原花色素得率和纯度的影响
[0070][0071]
对比例1,将实施例1步骤(1)的“1000ml水”改成“体积浓度70%丙酮水溶液1000”,其余操作等同于实施例1。
[0072]
所得杨梅果实原花色素的得率为2.32%,纯度为99.1%。这与本发明结果无显著差异,但本发明采用水作为浸提液,成本较低、安全性高且环境友好。
[0073]
对比例2、取消实施例1的步骤(3)~步骤(5),改成:
[0074]
将步骤(2)所得的浓缩液利用葡聚糖凝胶lh-20层析柱纯化,具体为取原花色素大孔树脂粗提物,以1.0g/ml溶解在3ml 90%甲醇中,上样于葡聚糖凝胶lh-20层析柱(300
×
25mm),用5倍柱体积的90%甲醇洗脱并弃去洗脱液,再用3倍柱体积的70%丙酮洗脱并收集全部的洗脱液,旋转蒸发后喷雾干燥得原花色素精提物,其余操作等同于实施例1。
[0075]
所得杨梅果实原花色素的得率为2.01%,纯度为87.6%。该纯度远低于本发明所得原花色素的纯度,这主要是由于花色苷等杂质的干扰。
[0076]
实验1、体外抑制α-葡萄糖苷酶活性试验
[0077]
将实施例1所得的杨梅果实原花色素加水配制成原花色素溶液(0.04~1mg/ml)。
[0078]
将20μlα-葡萄糖苷酶溶液(14.5units/ml)、20μl原花色素溶液(0.04
–
1mg/ml)与90μl磷酸盐缓冲液(0.2m,ph6.9)加入96孔板中混匀,37℃下孵育5min,立即加入20μlpnpg(1mm)启动反应,37℃下孵育30min,加入50μl na2co3水溶液(0.2m)终止反应,冷却至室温后测定405nm处吸光度值。分别以阿卡波糖溶液和磷酸盐缓冲液作为阳性和阴性对照。酶活抑制率的计算按照下述公式:式中:a4代表样品组的吸光度值,a2代表以等体积磷酸盐缓冲液替换样品溶液后的吸光度值,a3和a1分别代表将上述两个体系中的酶溶液替换为等体积磷酸盐缓冲液后的吸光度值。结果如图2所示,杨梅果实原花色素对α-葡萄糖苷酶活性的抑制呈现浓度依赖性,最大抑制率和半抑制浓度(ic
50
)分别为86.88%和11.91μg/ml,其中,ic
50
值远低于阿卡波糖(ic
50
=3.20mg/ml);因此,杨梅果实
原花色素对α-葡萄糖苷酶活性的体外抑制作用强于阿卡波糖,是潜在的α-葡萄糖苷酶抑制剂。
[0079]
实验2、体内调控餐后血糖试验:
[0080]
将实施例1所得的杨梅果实原花色素加水配制成400mg/kg原花色素水溶液。
[0081]
icr小鼠(雄性,6周龄)饲养于浙江省医学科学院动物中心,于22
±
1℃下进行12h的昼夜循环,并提供标准颗粒饮食和自由饮水;小鼠经7天适应后,禁食16h,将icr小鼠随机分为3组(8只/组),按0.1ml/10g分别灌胃无菌水、200mg/kg阿卡波糖水溶液和400mg/kg原花色素水溶液,15min后灌胃2g/kg蔗糖水溶液,灌糖后0、15、30、60、90和120min断尾取血并测定血糖;绘制血糖浓度
–
时间曲线并计算曲线下面积(auc),采用单因素方差分析和turkey检验进行多重比较,p《0.05表示差异显著。结果如图3a-b所示,正常icr小鼠灌胃蔗糖溶液15min、30min后血糖分别上升了50.81%和53.90%,而400mg/kg原花色素处理组小鼠的血糖仅上升了29.16%和48.93%,120min后血糖值恢复正常并处于稳定;相同剂量的阿卡波糖效果好于原花色素,但大量的碳水化合物在小肠内难以被消化吸收,导致胃肠胀气等副作用(按照参考文献的告知),而原花色素可延缓碳水化合物的吸收,所以抑制餐后血糖的急剧升高且无副作用。
[0082]
实验3、改善ⅱ型糖尿病小鼠葡萄糖耐量试验:
[0083]
将实施例1所得的杨梅果实原花色素加水配制成400mg/kg原花色素水溶液。
[0084]
c57bl/6j小鼠(雄性,4周龄)饲养于浙江省医学科学院动物中心,于22
±
1℃下进行12h的昼夜循环,并提供标准颗粒饮食和自由饮水;经7天适应后,提供高脂饲料(60%脂肪供能,江苏省协同医药生物工程有限责任公司)供小鼠自由饮食,12周后,急性血糖浓度位于11.0
–
20.0mm被认为是ⅱ型糖尿病小鼠;所有小鼠随机分为2组(6只/组):模型组小鼠按0.1ml/10g灌胃无菌水,处理组小鼠按0.1ml/10g灌胃400mg/kg原花色素水溶液,每天灌胃并持续4周;禁食12h后进行口服葡萄糖耐量试验,灌胃2g/kg葡萄糖水溶液,灌糖后0、15、30、60、90和120min断尾取血并测定血糖;绘制血糖浓度
–
时间曲线并计算曲线下面积(auc),采用单因素方差分析和turkey检验进行多重比较,p《0.05表示差异显著。结果如图3c-d所示,与模型组小鼠相比,处理组小鼠葡萄糖耐量得到显著改善,auc值显著降低29.37%;因此,杨梅果实原花色素是一种潜在的ⅱ型糖尿病治疗药物。
[0085]
最后,还需要注意的是,以上列举的仅是本发明的若干个具体实施例。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。