1.本发明属于生物医药技术领域,具体涉及水溶性正离子型环蕃在制备清除光动力治疗残留物的药物制剂中应用。
背景技术:
2.癌症是21世纪危害人类健康安全最严重的疾病之一,癌症的治疗成为公共卫生问题中亟待攻克的难题。由于肿瘤的复杂性与多样性,癌症的治疗手段也在不断发展。从1903年tappenier和jesionek发现伊红可在特定波长光的激发下治疗肿瘤,到卟吩姆钠经fda批准上市用于治疗肺癌、食管癌和膀胱癌等疾病,光动力治疗(pdt)逐渐发展成为一种可靠的癌症治疗手段。相比于传统的化学疗法,pdt具有高效低毒、时空可控、微创等优点。光动力治疗一般是指利用光敏剂在特定波长光的激发下,将氧分子转化为大量活性氧(ros)来造成病变细胞坏死或凋亡的一种治疗方式。目前,临床获批的光敏剂绝大部分是卟啉及其衍生物,如卟吩姆钠(photofrin)、血卟啉(hiporfin)、替莫泊芬(temoporfin)、帕多泊芬(padoporfin)和他拉泊芬(talaporfin)等,其中最具代表性的是卟吩姆钠。卟吩姆钠具有较高的系间穿越效率及较低的暗毒性,是一种应用较为广泛的光敏剂。然而,这类光敏剂的疏水结构特征让它们极易在皮肤组织上富集并长期残留,使得患者皮肤在光动力治疗完成后的较长一段时间内仍具有光敏性,甚至需要长达数星期的严格避光,给日常生活带来了极大不便。药代动力学研究表明,卟吩姆钠在网状内皮细胞中会残留较长时间,公开测试报告显示,按照推荐剂量2mg/kg的卟吩姆钠治疗后,患者在1-3个月的时间内若暴露在约1倍太阳光或与其相当的强光环境下会出现明显的皮肤光反应,如荨麻疹样红斑等。
技术实现要素:
3.本发明的目的在于提供一种正离子型环蕃及其在制备清除光动力治疗残留物的药物制剂中应用。
4.本发明提供的正离子型环蕃,为含有萘单元的水溶性正离子型盒状大环分子,记为npbox,具体包括三个结构式,根据吡啶在萘单元上的取代位置分别记为2,6-npbox、1,4-npbox和1,5-npbox,三个结构式分别为:
[0005][0006]
本发明提供的npbox,为正离子型环蕃,具有水溶性、高稳定性和低毒性等优点。
[0007]
由于光动力治疗中使用的光敏剂结构中含有羧酸负离子以及卟啉疏水平面,利用静电作用、π-π堆积和疏水作用等多种相互作用。本发明提供的npbox可以与光敏剂高效结合,从而将其清除。因此,本发明还提供所述npbox在制备清除光动力治疗中残留物的药物的药物制剂中的应用,具体是利用水溶性npbox的疏水空腔和高度正电性,通过静电作用、π-π堆积和疏水作用等结合光敏剂,降低光敏剂在皮肤组织的浓度,削弱其单线态氧的产生能力,从而实现降低和消除光敏剂光毒性的目的。而正离子型环蕃的使用不会影响光动力治疗的效果。
[0008]
本发明中,所述清除光动力治疗残留物的药物制剂,还包含药学上可接受的添加剂。
[0009]
本发明中,所述npbox在制备清除光动力治疗残留物药物制剂中的应用,具体操作如下:把npbox溶于5%葡萄糖水溶液中,构成注射剂,npbox水溶液浓度为0.1mg/ml-1.5mg/ml;将200μl光敏剂尾静脉注射到小鼠体内,在光动力治疗结束后的一段时间内(例如一小时内)注射配制的npbox溶液。
[0010]
本发明中,所述光动力治疗所用药物为广谱癌症光动力治疗药物。
[0011]
本发明中,所述光动力治疗药物的模型为卟吩姆钠、二氢卟吩e6或血卟啉。
[0012]
本发明提供的正离子型环蕃,可以显著降低药物在动物皮肤表面的累积量,并且不会影响光动力治疗的效果。
[0013]
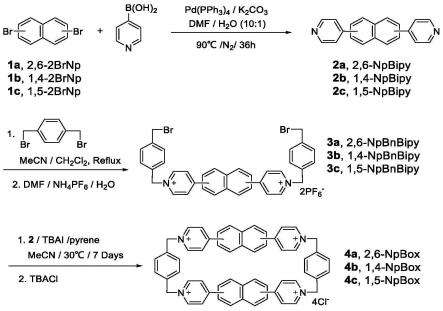
本发明还提供所述正离子型环蕃的制备方法,由不同位置取代的二溴代萘经过铃木偶联反应,再经过两步亲核取代反应得到正离子型环蕃,具体步骤为:
[0014]
(1)二溴代萘与4-硼酸吡啶进行铃木偶联反应,制备二吡啶取代萘,记为npbipy;
[0015]
(2)将npbipy与1,4-二(溴甲基)苯进行亲核取代反应,制备对应的两端对溴甲基苄基取代的化合物npbnbipy;
[0016]
(3)将npbipy与npbnbipy再次进行亲核取代反应制得相应环蕃。
[0017]
本发明对npbox和光敏剂体系进行了体外动态光散射实验、核磁滴定实验、荧光实验、单线态氧产生实验、纳秒瞬态吸收实验、细胞毒性实验、溶血实验、小鼠光敏作用抑制实验等。体外结合实验表明,本发明npbox与不同种类的光敏剂均具有明显的结合效果并能够调节光敏剂的光物理化学性质。细胞毒性实验和溶血实验表明,npbox具有较高的生物安全性;相关动物实验表明,npbox可以显著降低卟吩姆钠等光敏剂在动物皮肤的累积量并抑制其光敏作用。其中,2,6-npbox的效果最为显著。
[0018]
以上实验结果说明,npbox具有良好生物相容性,可以在生物体内实现疏水性负离子型卟啉类光动力治疗药物的结合并抑制其光敏性,在光动力治疗和解决临床问题方面具有广泛的应用前景。
附图说明
[0019]
图1为环蕃npbox合成路线。
[0020]
图2为线性对照化合物npmebipy合成路线。
[0021]
图3为npbox的晶体结构。(a)2,6-npbox;(b)1,4-npbox;(c)1,5-npbox。
[0022]
图4为环蕃与光敏剂包结络合物最低能量模型(dft)。其中,(a)(b)
[0023]
图5为相关化合物在水中的动态光散射粒径dh(nm),其中光敏剂和npbox的浓度为0.1mm,npmebipy的浓度为0.2mm。
[0024]
图6为卟吩姆钠(photofrin)和不同正离子型化合物的混合物在水中的动态光散射粒径dh(nm),其中光敏剂和npbox的浓度比为1:1(均为0.1mm),与npmebipy的比例为1:2(npmebipy为0.2mm)。
[0025]
图7为二氢卟吩e6(chlorin e6)和不同正离子型化合物的混合物在水中的动态光散射粒径dh(nm),其中光敏剂和npbox的浓度比为1:1(均为0.1mm),与npmebipy的比例为1:2(npmebipy为0.2mm)。
[0026]
图8为血卟啉(hiporfin)和不同正离子型化合物的混合物在水中的动态光散射粒径dh(nm),其中光敏剂和npbox的浓度比为1:1(均为0.1mm),与npmebipy的比例为1:2(npmebipy为0.2mm)。
[0027]
图9为2,6-npbox及其与不同光敏剂在20%dmso水溶液中的动态光散射粒径dh(nm),其中光敏剂和npbox的浓度比为1:1(均为0.1mm)。
[0028]
图10为二氢卟吩e6(chlorin e6)与不同比例的2,6-npbox在d2o中的1hnmr谱图(400mhz,25℃,[chlorin e6]=0.2mm)。其中,(a)chlorin e6,(b)2,6-npbox(0.2mm),(c)[2,6-npbox]/[chlorin e6]=0.5,(d)[2,6-npbox]/[chlorin e6]=1。
[0029]
图11为二氢卟吩e6(chlorin e6)与不同比例的2,6-npbox在cd3od中的1hnmr谱图(400mhz,25℃,[chlorin e6]=0.2mm)。其中,(a)2,6-npbox(0.2mm),(b)chlorin e6,(c)[2,6-npbox]/[chlorin e6]=0.05,(d)[2,6-npbox]/[chlorin e6]=0.1,(e)[2,6-npbox]/[chlorin e6]=0.2,(f)[2,6-npbox]/[chlorin e6]=0.3,(g)[2,6-npbox]/[chlorin e6]=0.4,(h)[2,6-npbox]/[chlorin e6]=0.6,(i)[2,6-npbox]/[chlorin e6]=0.8,(j)[2,6-npbox]/[chlorin e6]=1,(k)[2,6-npbox]/[chlorin e6]=1.2,(l)[2,6-npbox]/[chlorin e6]=1.4。
[0030]
图12为二氢卟吩e6(chlorin e6)与1,4-npbox在d2o中的1hnmr谱图(400mhz,25℃,[chlorin e6]=0.2mm)。其中,(a)chlorin e6,(b)1,4-npbox(0.2mm),(c)[1,4-npbox]/[chlorin e6]=1
[0031]
图13为二氢卟吩e6(chlorin e6)与1,5-npbox在d2o中的1hnmr谱图(400mhz,25℃,[chlorin e6]=0.2mm)。(a)chlorin e6,(b)1,5-npbox(0.2mm),(c)[1,5-npbox]/[chlorin e6]=1)。
[0032]
图14为二氢卟吩e6(chlorin e6)与不同比例的1,4-npbox在cd3od中的1hnmr谱图(400mhz,25℃,[chlorin e6]=0.2mm)。其中,(a)chlorin e6,(b)[1,4-npbox]/[chlorin e6]=0.4,(c)[1,4-npbox]/[chlorin e6]=0.8,(d)[1,4-npbox]/[chlorin e6]=1.2(e)[1,4-npbox]/[chlorin e6]=1.6,(f)[1,4-npbox]/[chlorin e6]=2,(g)[1,4-npbox]/[chlorin e6]=2.4。
[0033]
图15为二氢卟吩e6(chlorin e6)与不同比例的1,5-npbox在cd3od中的1hnmr谱图(400mhz,25℃,[chlorin e6]=0.2mm)。其中,(a)chlorin e6,(b)[1,5-npbox]/[chlorin e6]=0.4,(c)[1,5-npbox]/[chlorin e6]=0.8,(d)[1,5-npbox]/[chlorin e6]=1.2(e)[1,5-npbox]/[chlorin e6]=1.6,(f)[1,5-npbox]/[chlorin e6]=2,(g)[1,5-npbox]/[chlorin e6]=2.4。
[0034]
图16为二氢卟吩e6(chlorin e6)与不同比例的2,6-npmebipy在cd3od中的1hnmr谱图(400mhz,25℃,[chlorin e6]=0.2mm)。其中,(a)chlorin e6,(b)[2,6-npmebipy]/[chlorin e6]=1,(c)[2,6-npmebipy]/[chlorin e6]=2,(d)[2,6-npmebipy]/[chlorin e6]=4。
[0035]
图17为二氢卟吩e6(chlorin e6)与不同比例的1,4-npmebipy在cd3od中的1hnmr谱图(400mhz,25℃,[chlorin e6]=0.2mm)。其中,(a)chlorin e6,(b)[1,4-npmebipy]/[chlorin e6]=1,(c)[1,4-npmebipy]/[chlorin e6]=2,(d)[1,4-npmebipy]/[chlorin e6]=4。
[0036]
图18为二氢卟吩e6(chlorin e6)与不同比例的1,5-npmebipy在cd3od中的1hnmr谱图(400mhz,25℃,[chlorin e6]=0.2mm)。其中,(a)chlorin e6,(b)[1,5-npmebipy]/[chlorin e6]=1,(c)[1,5-npmebipy]/[chlorin e6]=2,(d)[1,5-npmebipy]/[chlorin e6]=4。
[0037]
图19为血卟啉(hiporfin)与不同比例的2,6-npbox在d2o中的1hnmr谱图(400mhz,25℃,[hiporfin]=0.2mm)。其中,(a)hiporfin,(b)2,6-npbox(0.2mm),
[0038]
(c)[2,6-npbox]/[hiporfin]=0.5,(d)[2,6-npbox]/[hiporfin]=1。
[0039]
图20为血卟啉(hiporfin)与1,4-npbox在d2o中的1hnmr谱图(400mhz,25℃,[hiporfin]=0.2mm)。其中,(a)hiporfin,(b)1,4-npbox(0.2mm),(c)[1,4-npbox]/[hiporfin]=1。
[0040]
图21为血卟啉(hiporfin)与1,5-npbox在d2o中的1hnmr谱图(400mhz,25℃,[hiporfin]=0.2mm)。(a)hiporfin,(b)1,5-npbox(0.2mm),(c)[1,5-npbox]/[hiporfin]=1。
[0041]
图22为血卟啉(hiporfin)与不同比例的2,6-npbox在20%cd3od/d2o溶液中的1hnmr谱图(400mhz,25℃,[hiporfin]=0.2mm)。其中,(a)2,6-npbox(0.2mm),(b)hiporfin,(c)[2,6-npbox]/[hiporfin]=0.05,(d)[2,6-npbox]/[hiporfin]=0.1,(e)[2,6-npbox]/[hiporfin]=0.2,(f)[2,6-npbox]/[hiporfin]=0.3,(g)[2,6-npbox]/[hiporfin]=0.4,(h)[2,6-npbox]/[hiporfin]=0.6,(i)[2,6-npbox]/[hiporfin]=0.8,(j)[2,6-npbox]/[hiporfin]=1,(k)[2,6-npbox]/[hiporfin]=1.2,(l)[2,6-npbox]/[hiporfin]=1.4。
[0042]
图23为血卟啉(hiporfin)与不同比例的1,4-npbox在20%cd3od/d2o溶液中的1hnmr谱图(400mhz,25℃,[hiporfin]=0.2mm)。其中,(a)hiporfin,(b)[1,4-npbox]/[hiporfin]=0.4,(c)[1,4-npbox]/[hiporfin]=0.8,(d)[1,4-npbox]/[hiporfin]=1.2(e)[1,4-npbox]/[hiporfin]=1.6,(f)[1,4-npbox]/[hiporfin]=2,(g)[1,4-npbox]/[hiporfin]=2.4。
[0043]
图24为血卟啉(hiporfin)与不同比例的1,5-npbox在20%cd3od/d2o溶液中的1hnmr谱图(400mhz,25℃,[hiporfin]=0.2mm)。其中,(a)hiporfin,(b)[1,5-npbox]/[hiporfin]=0.4,(c)[1,5-npbox]/[hiporfin]=0.8,(d)[1,5-npbox]/[hiporfin]=1.2(e)[1,5-npbox]/[hiporfin]=1.6,(f)[1,5-npbox]/[hiporfin]=2,(g)[1,5-npbox]/[hiporfin]=2.4。
[0044]
图25为血卟啉(hiporfin)与不同比例的2,6-npmebipy在20%cd3od/d2o溶液中的1hnmr谱图(400mhz,25℃,[hiporfin]=0.2mm)。(a)hiporfin,(b)[2,6-npmebipy]/[hiporfin]=1,(c)[2,6-npmebipy]/[hiporfin]=2,(d)[2,6-npmebipy]/[hiporfin]=4。
[0045]
图26为血卟啉(hiporfin)与不同比例的1,4-npmebipy在20%cd3od/d2o溶液中的1hnmr谱图(400mhz,25℃,[hiporfin]=0.2mm)。(a)hiporfin,(b)[1,4-npmebipy]/[hiporfin]=1,(c)[1,4-npmebipy]/[hiporfin]=2,(d)[1,4-npmebipy]/[hiporfin]=4。
[0046]
图27为血卟啉(hiporfin)与不同比例的1,5-npmebipy在20%cd3od/d2o溶液中的1hnmr谱图(400mhz,25℃,[hiporfin]=0.2mm)。(a)hiporfin,(b)[1,5-npmebipy]/[hiporfin]=1,(c)[1,5-npmebipy]/[hiporfin]=2,(d)[1,5-npmebipy]/[hiporfin]=4。
[0047]
图28为卟吩姆钠(photofrin)与不同正离子型环蕃在20%dmso-d6/d2o溶液中的1hnmr谱图(400mhz,25℃,photofrin单体浓度为0.2mm)。其中,(a)photofrin,(b)[2,6-npbox](0.2mm),(c)[2,6-npbox]/[photofrin]=1,(d)[1,4-npbox](0.2mm),(e)[1,4-npbox]/[photofrin]=1,(f)[1,5-npbox](0.2mm),(g)[1,5-npbox]/[photofrin]=1。
[0048]
图29为卟吩姆钠(photofrin)与不同正离子型线性化合物在20%dmso-d6/d2o溶液中的1hnmr谱图(400mhz,25℃,photofrin单体浓度为0.2mm)。其中,(a)photofrin,(b)[2,6-npmebipy](0.4mm),(c)[2,6-npmebipy]/[photofrin]=2,(d)[1,4-npmebipy](0.4mm),(e)[1,4-npmebipy]/[photofrin]=2,(f)[1,5-npmebipy](0.4mm),(g)[1,5-npmebipy]/[photofrin]=2。
[0049]
图30为卟吩姆钠(photofrin,10μm)与不同比例2,6-npbox混合后在磷酸缓冲溶液(20mm,ph 7.4)中的荧光光谱(激发波长410nm)。其中,(a)样品在570~750nm的发射光谱;(b)样品在670nm处的荧光强度变化曲线。
[0050]
图31为二氢卟吩e6(chlorin e6,5μm)与不同比例的2,6-npbox混合后在磷酸缓冲溶液(20mm,ph 7.4)中的荧光光谱(激发波长420nm)。其中,(a)样品在570~750nm的发射光谱;(b)样品在660nm处的荧光强度变化曲线。
[0051]
图32为血卟啉(hiporfin,5μm)与不同比例的2,6-npbox混合后在磷酸缓冲溶液(20mm,ph 7.4)中的荧光光谱(激发波长430nm)。其中,(a)样品在570~750nm的发射光谱;(b)样品在670nm处的荧光强度变化曲线。
[0052]
图33为卟吩姆钠(photofrin,10μm)与不同比例的1,4-npbox混合后在磷酸缓冲溶液(20mm,ph 7.4)中的荧光光谱(激发波长410nm)。其中,(a)样品在570~750nm的发射光谱;(b)样品在670nm处的荧光强度变化曲线。
[0053]
图34为二氢卟吩e6(chlorin e6,5μm)与不同比例的1,4-npbox混合后在磷酸缓冲溶液(20mm,ph 7.4)中的荧光光谱(激发波长420nm)。其中,(a)样品在570~750nm的发射光谱;(b)样品在660nm处的荧光强度变化曲线。
[0054]
图35为血卟啉(hiporfin,5μm)与不同比例的1,4-npbox混合后在磷酸缓冲溶液(20mm,ph 7.4)中的荧光光谱(激发波长430nm)。其中,(a)样品在570~750nm的发射光谱;(b)样品在670nm处的荧光强度变化曲线。
[0055]
图36为卟吩姆钠(photofrin,10μm)与不同比例的1,5-npbox混合后在磷酸缓冲溶
液(20mm,ph 7.4)中的荧光光谱(激发波长410nm)。其中,(a)样品在570~750nm的发射光谱;(b)样品在670nm处的荧光强度变化曲线。
[0056]
图37为二氢卟吩e6(chlorin e6,5μm)与不同比例的1,5-npbox混合后在磷酸缓冲溶液(20mm,ph 7.4)中的荧光光谱(激发波长420nm)。其中,(a)样品在570~750nm的发射光谱;(b)样品在660nm处的荧光强度变化曲线
[0057]
图38为血卟啉(hiporfin,5μm)与不同比例的1,5-npbox混合后在磷酸缓冲溶液(20mm,ph 7.4)中的荧光光谱(激发波长430nm)。其中,(a)样品在570~750nm的发射光谱;(b)样品在670nm处的荧光强度变化曲线。
[0058]
图39为卟吩姆钠(photofrin,10μm)与不同比例的2,6-npmebipy混合后在磷酸缓冲溶液(20mm,ph 7.4)中的荧光光谱(激发波长410nm)。其中,(a)样品在570~750nm的发射光谱;(b)样品在670nm处的荧光强度变化曲线。
[0059]
图40为二氢卟吩e6(chlorin e6,5μm)与不同比例的2,6-npmebipy混合后在磷酸缓冲溶液(20mm,ph 7.4)中的荧光光谱(激发波长420nm)。其中,(a)样品在570~750nm的发射光谱;(b)样品在660nm处的荧光强度变化曲线。
[0060]
图41为血卟啉(hiporfin,5μm)与不同比例的2,6-npmebipy混合后在磷酸缓冲溶液(20mm,ph 7.4)中的荧光光谱(激发波长430nm)。其中,(a)样品在570~750nm的发射光谱;(b)样品在670nm处的荧光强度变化曲线。
[0061]
图42为卟吩姆钠(photofrin,10μm)与不同比例的1,4-npmebipy混合后在磷酸缓冲溶液(20mm,ph 7.4)中的荧光光谱(激发波长410nm)。其中,(a)样品在570~750nm的发射光谱;(b)样品在670nm处的荧光强度变化曲线。
[0062]
图43为二氢卟吩e6(chlorin e6,5μm)与不同比例的1,4-npmebipy混合后在磷酸缓冲溶液(20mm,ph 7.4)中的荧光光谱(激发波长420nm)。其中,(a)样品在570~750nm的发射光谱;(b)样品在660nm处的荧光强度变化曲线。
[0063]
图44为血卟啉(hiporfin,5μm)与不同比例的1,4-npmebipy混合后在磷酸缓冲溶液(20mm,ph 7.4)中的荧光光谱(激发波长430nm)。其中,(a)样品在570~750nm的发射光谱;(b)样品在670nm处的荧光强度变化曲线。
[0064]
图45为卟吩姆钠(photofrin,10μm)与不同比例的1,5-npmebipy混合后在磷酸缓冲溶液(20mm,ph 7.4)中的荧光光谱(激发波长410nm)。其中,(a)样品在570~750nm的发射光谱;(b)样品在670nm处的荧光强度变化曲线。
[0065]
图46为二氢卟吩e6(chlorin e6,5μm)与不同比例的1,5-npmebipy混合后在磷酸缓冲溶液(20mm,ph 7.4)中的荧光光谱(激发波长420nm)。其中,(a)样品在570~750nm的发射光谱;(b)样品在660nm处的荧光强度变化曲线。
[0066]
图47为血卟啉(hiporfin,5μm)与不同比例的1,5-npmebipy混合后在磷酸缓冲溶液(20mm,ph 7.4)中的荧光光谱(激发波长430nm)。其中,(a)样品在570~750nm的发射光谱;(b)样品在670nm处的荧光强度变化曲线。
[0067]
图48为光敏剂与一定比例的npbox(1:1)或npmebipy(1:2)混合后在磷酸缓冲溶液(20mm,ph 7.4)中指定波长的荧光强度(photofrin,10μm;chlorin e6,5μm;hiporfin,5μm)。
[0068]
图49为二氢卟吩e6(chlorin e6,5μm)与不同比例的2,6-npbox混合后在甲醇中
666nm处的荧光强度差值δemission的变化曲线(δemission为2,6-npbox浓度为零时的荧光强度与对应荧光强度的差值)及通过非线性拟合获得的1:1结合模式下的络合常数ka。
[0069]
图50为血卟啉(hiporfin,5μm)与不同比例的2,6-npbox混合后在甲醇中670nm处的荧光强度差值δemission的变化曲线(δemission为2,6-npbox浓度为零时的荧光强度与对应荧光强度的差值)及通过非线性拟合获得的1:1结合模式下的络合常数ka。
[0070]
图51为卟吩姆钠(photofrin,2μm)与不同npbox在pbs溶液中1:1混合前后的单线态氧生成曲线(dpbf检测法,[dpbf]=25μm)。
[0071]
图52为二氢卟吩e6(chlorin e6,2μm)与不同npbox在pbs溶液中1:1混合前后的单线态氧生成曲线(dpbf检测法,[dpbf]=25μm)。
[0072]
图53为血卟啉(hiporfin,2μm)与不同npbox在pbs溶液中1:1混合前后的单线态氧生成曲线(dpbf检测法,[dpbf]=25μm)。
[0073]
图54为卟吩姆钠(photofrin,30μm)在20mm nah2po4缓冲液(ph 7.4)中的纳秒瞬态吸收光谱(λ
ex
=420nm)。并对5
×
10-7
~2
×
10-3
s范围内430nm处的吸收差值(δabs)做单指数拟合得三重态寿命τ
t
。
[0074]
图55为二氢卟吩e6(chlorin e6,7.5μm)在20mmnah2po4缓冲液(ph 7.4)中的纳秒瞬态吸收光谱(λ
ex
=420nm)。并对5
×
10-7
~2
×
10-3
s范围内430nm处的吸收差值(δabs)做单指数拟合得三重态寿命τ
t
。
[0075]
图56为血卟啉(hiporfin,30μm)在20mm nah2po4缓冲液(ph 7.4)中的纳秒瞬态吸收光谱(λ
ex
=420nm)。并对5
×
10-7
~2
×
10-3
s范围内430nm处的吸收差值(δabs)做单指数拟合得三重态寿命τ
t
。
[0076]
图57为卟吩姆钠(photofrin,30μm)与npbox混合前后在20mm nah2po4缓冲液(ph 7.4)中的纳秒瞬态吸收光谱(λ
ex
=420nm,λ
obs
=430nm)。其中,(a)线性横坐标;(b)对数横坐标。
[0077]
图58为二氢卟吩e6(chlorin e6,7.5μm)与npbox混合前后在20mmnah2po4缓冲液(ph7.4)中的纳秒瞬态吸收光谱(λ
ex
=420nm,λ
obs
=430nm)。其中,(a)线性横坐标;(b)对数横坐标。
[0078]
图59为血卟啉(hiporfin,30μm)与npbox混合前后在20mm nah2po4缓冲液(ph 7.4)中的纳秒瞬态吸收光谱(λ
ex
=420nm,λ
obs
=430nm)。其中,(a)线性横坐标;(b)对数横坐标。
[0079]
图60为不同浓度2,6-npbox处理后h9c2(a)与l02(b)的细胞活性(mtt法,孵育24h,n=6)。
[0080]
图61为不同浓度1,4-npbox处理后h9c2(a)与l02(b)的细胞活性(mtt法,孵育24h,n=6)。
[0081]
图62为不同浓度1,5-npbox处理后h9c2(a)与l02(b)的细胞活性(mtt法,孵育24h,n=6)。
[0082]
图63为不同浓度2,6-npbox处理后人红细胞与大鼠红细胞的溶血活性(545nm)。
[0083]
图64为不同浓度的2,6-npbox葡萄糖溶液(5%)经尾静脉注射后balb/c小鼠的体重随时间变化曲线(每组6只,雌雄各3只)。
[0084]
图65为动物模型实验结果。其中,(a)动物实验简化流程;(b)空白对照组(pbs)、阴性对照组(photofrin)和实验组(photofrin 2,6-npbox)在不同时间段的照片;(c)阴性对
calcd for c
36h30
br2n2pf6[m-pf6]
:795.0400;found:795.0400;1,5-npbnbipy(3c,1.2g,90%):1h nmr(400mhz,dmso-d6)δ9.34(d,j=6.4hz,4h),8.39(d,j=6.8hz,4h),8.07(dd,j=7.6,1.9hz,2h),7.85
–
7.74(m,4h),7.65(d,j=8.1hz,4h),7.58(d,j=8.2hz,4h),5.91(s,4h),4.75(s,4h);
13
cnmr(101mhz,dmso-d6)δ155.45,144.87,139.42,134.70,134.35,130.18,129.84,129.47,129.39,129.19,127.38,127.28,62.46,33.71;ms calcd for c
36h30
br2n2pf6[m-pf6]
:795.0406;found:795.0406。
[0093]
将2,6-npbnbipy(200mg,0.21mmol),2,6-npbipy(57.2mg,0.20mmol),tbai(15mg,0.041mmol)和芘(212mg,1.05mmol)溶于200ml干燥的乙腈中,在30℃下反应7天。反应结束后,加入(t-bu)4ncl的饱和乙腈溶液2-3ml淬灭反应。粗产物经柱层析分离(洗脱剂ch3oh:h2o:sat.nh4cl=6:3:1)得到黄色固体。2,6-npbox(4a,51.1mg,26%):1h nmr(400mhz,d2o)δ8.96(d,j=6.4hz,8h),8.37(s,4h),8.27(d,j=9.5hz,8h),8.06(d,j=9.3hz,4h),7.87(d,j=7.7hz,4h),7.71(s,8h),5.83(s,8h);
13
c nmr(101mhz,dmso-d6)δ154.13,144.39,136.49,133.84,132.41,130.36,129.99,129.13,125.44,125.30,61.20;ms calcd for c
56h44
n4[m]
4
:193.0886;found:193.0904;1,4-npbox(4b,53.5mg,27%):1h nmr(400mhz,d2o)δ9.09(d,j=6.0hz,8h),8.17(d,j=6.1hz,8h),7.91
–
7.82(m,4h),7.75(s,8h),7.62(d,j=5.6hz,4h),7.41(s,4h),5.93(s,8h);
13
c nmr(101mhz,dmso-d6)δ155.61,144.48,136.31,136.02,130.21,129.96,129.22,129.17,128.88,125.48,61.93;ms calcd for c
56h44
n4p2f
12
[m-2pf6]
2
:531.1419;found:531.1419;1,5-npbox(4c,63.2mg,32%):1h nmr(400mhz,d2o)δ9.08(d,j=6.3hz,8h),8.12(d,j=4.6hz,8h),7.83(s,8h),7.80(d,j=8.9hz,4h),7.48
–
7.42(m,8h),5.94(s,8h);
13
c nmr(101mhz,dmso-d6)δ156.16,144.25,136.63,134.42,130.27,129.55,129.40,129.21,127.23,126.83,62.21;ms calcd for c
56h44
n4p2f
12
[m-2pf6]
2
:531.1419;found:531.1419。
[0094]
作为对照化合物,如图2所示,本发明还合成了吡啶端甲基取代的正离子型线性化合物npmebipy(5)。以2,6-npbipy(2a)为原料合成2,6-npmebipy(5a)为例,具体操作为:将化合物2,6-npbipy(100mg,0.35mmol)和mei(0.5g,3.5mmol)溶于dmf(10ml)中,50℃下反应12h。反应结束后,冷却至室温,加入50ml et2o,过滤收集固体,通过离子交换获得甲基化氯盐。2,6-npmebipy(5a,98.0mg,72%):1h nmr(400mhz,dmso-d6)δ9.10(d,j=6.6hz,4h),8.89(s,2h),8.68(d,j=6.8hz,4h),8.35(d,j=8.7hz,2h),8.29(d,j=10.4hz,2h),4.38(s,6h);
13
c nmr(101mhz,d2o)δ155.65,145.05,133.41,131.06,130.24,128.65,125.37,125.18,45.32;ms calcd for c
22h20
n2[m]
2
:156.0808;found:156.0806;1,4-npmebipy(5b,84.4mg,62%):1h nmr(400mhz,d2o)δ8.95(d,j=6.6hz,4h),8.29(d,j=6.6hz,4h),8.00(dd,j=6.5,3.3hz,2h),7.82(s,2h),7.74(dd,j=6.5,3.2hz,2h),4.52(s,6h);
13
c nmr(101mhz,d2o)δ156.70,145.03,136.35,130.10,128.93,128.36,127.49,125.16,47.51;ms calcd for c
22h20
n2[m]
2
:156.0808;found:156.0808;1,5-npmebipy(5c,89.9mg,66%):1h nmr(400mhz,d2o)δ8.93(d,j=6.5hz,4h),8.28(d,j=6.3hz,4h),8.08(dd,j=6.3,3.2hz,2h),7.81
–
7.75(m,4h),4.51(s,6h);
13
c nmr(101mhz,d2o)δ157.10,144.93,134.56,130.00,128.97,127.13,127.05,47.30;ms calcd for c
22h20
n2[m]
2
:156.0808;found:156.0818。
[0095]
三种环蕃的固相结构得到其晶体结构(图3)确证。三种环蕃均呈四方盒状,内部形
成疏水空腔,从两个相对苯基的距离看空腔尺寸2,6-npbox》1,5-npbox≈1,4-npbox,可能结合尺寸匹配的化合物。理论计算模拟显示(图4),chlorin e6,hiporfin等可以进入环蕃2,6-npbox的空腔,与之形成包结络合物。
[0096]
实施例2:正离子型环蕃及其线性对照化合物与光动力治疗药物的动态光散射实验。
[0097]
动态光散射实验提供了溶液中粒径分布情况,图5~图9分别表征了一定浓度的光敏剂水溶液、环蕃npbox水溶液、线性化合物npmebipy水溶液及特定比例的光敏剂与环蕃npbox(1:1)或线性化合物npmebipy(1:2)在水溶液中的粒径。如图5所示,水溶液中2,6-npbox和photofrin在测试浓度下的dh分别为10nm和30nm左右,其余样品的粒径都在1nm左右。如图6~图8所示,三种光敏剂分别与环蕃1,4-或1,5-npbox的1:1混合物在水溶液中都形成粒径大于1000nm的粒子,说明其通过多种弱相互作用发生堆积形成大颗粒;水溶液中光敏剂与环蕃2,6-npbox的1:1混合物粒径则较小,约为20-30nm。光敏剂与线性化合物的组装行为也不尽相同,在测试条件下三种光敏剂分别与2,6-npmebipy的1:2混合物水合粒径也大于1000nm,与1,4-或1,5-npmebipy的1:2混合物水合粒径则在100nm以下,hiporfin和1,4-或1,5-npmebipy的1:2混合物水合粒径小于10nm,说明堆积方式不同。2,6-npbox及其分别与三种光敏剂的复合物在20%dmso水溶液中的水合粒径都在1nm左右(图9),与相应化合物水溶液中的动态光散射粒径相比较,水溶液中的水合粒径均较大,说明这些化合物在水溶液中都有一定堆积作用。
[0098]
实施例3:正离子型环蕃及其对照化合物与光动力治疗药物的核磁滴定实验。
[0099]
通过核磁滴定实验进一步确定光敏剂与本发明所述的正离子型环蕃或线性化合物在溶液中的组装形式。以2,6-npbox环蕃与chlorin e6在重水中的核磁滴定实验为例说明。具体操作为:分别配制chlorin e6(0.2mm)和2,6-npbox(2mm)的重水溶液,向chlorin e6溶液中按比例逐渐滴入2,6-npbox溶液,并测定每一次滴加后溶液体系的核磁共振氢谱(图10)。核磁滴定实验研究表明,本发明所述的正离子型环蕃2,6-npbox与光敏剂chlorin e6在重水中滴定时分辨率急剧下降,在1:1比例时,出现较宽的信号峰并有明显的化学位移变化。在cd3od中的核磁滴定实验(图11)观察到随着环蕃2,6-npbox的逐渐增加,chlorin e6信号峰变宽,2,6-npbox的信号峰也有峰型及化学位移的逐渐变化。chlorine6与环蕃1,4-npbox(图12)或1,5-npbox(图13)在重水中以1:1的比例结合后,chlorine6芳香区几乎无信号,无法有效分辨,而环蕃的信号变化不明显,在cd3od中,随着环蕃1,4-npbox(图14)或1,5-npbox(图15)比例的逐渐增加,光敏剂和环蕃的信号均无明显变化。在cd3od中分别使用三种线性化合物对chlorin e6进行核磁滴定实验时,随着线性化合物比例增加,没有观察到chlorin e6信号峰的明显变化,同时,三种线性化合物信号峰的峰型及化学位移也没有明显变化(图16~图18)。以上实验结果说明,在水溶液中,本发明所述的正离子型环蕃与光敏剂有较强的相互作用,1,4-npbox或1,5-npbox与chlorin e6的结合模式相似,2,6-npbox与chlorin e6的结合模式和1,4-npbox或1,5-npbox与chlorin e6的结合模式有所不同。结合理论计算实验结果(图4a),chlorin e6可能进入2,6-npbox的空腔形成包结,而与1,4-npbox或1,5-npbox则可能在环外发生堆积作用。在重水(图19~图21)或20%cd3od/d2o(图22~图24)中,环蕃对hiporfin的核磁滴定实验结果均与chlorin e6相似。在20%cd3od/d2o中三种线性化合物对hiporfin的核磁滴定实验结果也与chlorin e6相似(图25~
图27)。核磁滴定实验结果说明hiporfin和三种环蕃的相互作用与chlorin e6有类似的作用模式。photofrin在核磁共振氢谱中表现为宽峰,特别在低场区信号很弱,当分别加入与photofrin单体等摩尔量的三种环蕃时(图28),表现出与chlorin e6,hiporfin相似的实验结果,说明在溶液相,photofrin与环蕃都有较强的相互作用。当分别加入与photofrin单体等摩尔量的三种线性化合物时(图29),核磁氢谱信号仍表现为分辨率很低的宽峰。
[0100]
实施例4:正离子型环蕃与光动力治疗药物在水溶液中的荧光实验。
[0101]
通过荧光实验表征光敏剂与本发明所述的正离子型环蕃或线性化合物在溶液相的结合作用。具体操作为:配制一定浓度的光敏剂溶液,逐滴滴加npbox或npmebipy溶液,进行荧光测试。随着后者的加入,光敏剂荧光强度不断下降,直至平衡,说明光敏剂与npbox及npmebipy之间存在一定程度的电荷转移或能量转移。如图30~图47所示,通过荧光测试可以确定正离子型环蕃npbox及线性化合物npmebipy与光敏剂都有一定的相互作用。从图48可以直观地比较npbox和npmebipy对光敏剂荧光的猝灭效果,并获得以下结论:(1)2,6-npbox可以最显著地猝灭光敏剂的荧光;(2)npbox比相应npmebipy的光敏剂荧光猝灭效果更为明显。荧光实验表明,2,6-npbox与chlorine6(图49)和hiporfin(图50)在1:1模式下于甲醇溶液中的结合常数分别为(1.89
±
0.31)
×
106和(2.86
±
0.57)
×
106。
[0102]
实施例5:正离子型环蕃对光动力治疗药物单线态氧产率的影响。
[0103]
配制一定浓度的光敏剂溶液,加入一定比例的npbox(1:1),再加入一定浓度的1,3-二苯基异苯并呋喃(dpbf)作为单线态氧指示剂。在进行激光照射前先测定溶液在300~500nm波长范围内的吸光度,经过一定时间的激光照射后再测定相同波长范围内的吸光度。通过427nm处dpbf特征吸收随时间的衰减速率计算单线态氧产率。如图51~图53所示,实验结果表明正离子型环蕃的加入可以降低光敏剂的单线态氧产率。在三种环蕃中,2,6-npbox可以最为显著地降低光敏剂的单线态氧产率,说明2,6-npbox与光敏剂发生了能量或电荷转移,阻碍了光敏剂产生单线态氧。在抑制能力上与荧光实验一致。
[0104]
实施例6:正离子型环蕃对光动力治疗药物三线态寿命的影响。
[0105]
单线态氧的产生依赖于光敏剂的三重态,通常光敏剂的三重态寿命越长越有利于将氧气敏化成单线态氧。从图54~图56可以看出,三种光敏剂的三重态寿命数量级在10-5
~10-4
s。配制一定浓度的光敏剂溶液,加入一定比例的npbox(1:1),通过纳秒瞬态吸收光谱测定420nm激发波长下光敏剂在430nm处的吸收变化值,实验结果表明(图57~图59),在加入一定比例的npbox(1:1)后,光敏剂的三重态吸收都发生了显著的变化,其中2,6-npbox能够在仪器的分辨尺度上(10-9
s)完全猝灭光敏剂的三重态,说明加入2,6-npbox后,三种光敏剂的三重态寿命均小于10-9
s。1,4-npbox和1,5-npbox与光敏剂结合后也明显降低了体系中游离三重态光敏剂的浓度。
[0106]
实施例7:正离子型环蕃的细胞毒性实验。
[0107]
通过细胞计数试剂盒cell counting kit-8(cck-8),我们利用正常肝细胞(l-02)和大鼠心肌细胞(h9c2)作为模型研究2,6-npbox、1,4-npbox和1,5-npbox三种正离子型环蕃的体外细胞毒性。结果显示,当环蕃样品含量在0~100μg/ml时,两种细胞的存活率均在85%以上(图60~图62),说明2,6-npbox、1,4-npbox和1,5-npbox三种环蕃的细胞毒性均较低。
[0108]
实施例8:2,6-npbox的动物急性毒性实验及溶血实验。
[0109]
遵循实验动物伦理原则,以2,6-npbox为例进行动物实验。首先通过溶血实验验证生物相容性。如图63所示,实验表明2,6-npbox在0~100μg/ml的浓度下未发生明显的溶血现象,说明2,6-npbox具有良好的生物相容性。急性毒性实验具体操作过程为:选择体重为18至24克的icr小鼠作为生物模型对2,6-npbox的生物毒性进行测试(每组实验分别选用三只雄鼠和三只雌鼠);称量并记录小鼠初始体重;通过尾静脉向小鼠一次性注射2,6-npbox注射液,剂量分别为0mg/kg、5mg/kg、10mg/kg、15mg/kg,注射体积控制在0.2ml,注射时间为60秒;随后每24小时称量并记录小鼠体重,持续记录14天(图64)。这一研究表明2,6-npbox在使用浓度(4mg/kg)下对动物有较低的急性毒性,在高达15mg/kg剂量下(3.75倍于有效剂量)未出现动物死亡,证明其生物安全性较高。
[0110]
实施例9:2,6-npbox对光敏剂光动力治疗及治疗后光毒性影响的研究。
[0111]
在动物层面上,我们研究了2,6-npbox对光敏剂肿瘤治疗效果及治疗后光敏作用的影响(图65)。以卟吩姆钠(phorofrin)为例,首先尾静脉注射光敏剂,一段时间后尾静脉注射2,6-npbox,分别在暗室饲养不同时间后对动物背部皮肤进行光照、拍照观察、取样切片等操作。如图65b所示,皮肤光敏作用实验结果表明,仅注射phorofrin的实验动物出现了严重的光敏反应,皮肤出现了明显的红肿与红斑,注射了2,6-npbox的动物皮肤光敏反应被明显抑制,抑制效果与2,6-npbox的剂量和注射后到光照的时间间隔有关(图66)。与光敏剂组相比,注射了2,6-npbox的动物皮肤及主要器官的光敏剂荧光强度明显减弱(图65c)。皮肤切片染色图可以观察到光敏剂组出现了毛细血管破裂和红细胞渗出,毛囊减少;而2,6-npbox组与空白对照组基本保持一致,无明显异常(图65d)。与此同时,抗肿瘤效果不受影响(图65e~图65g)。整个实验过程中,三组动物的体重没有明显改变(图67)。对光敏剂二氢卟吩e6(图68)或血卟啉(图69)的动物模型实验得到了相似的结果。以上实验结果说明2,6-npbox对光动力治疗后光毒性有明显抑制作用且不会影响光动力治疗效果。
[0112]
以上所述为本发明的优化实施例而已,并不用于限制发明,凡在本发明的精神和原则之内所做的修改、等同替换和改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
