1.本发明是关于一种促纤溶活性物质及其制备方法与应用,属于保健食品及生物医药加工技术领域。
背景技术:
2.随着人们的生活水平日益提高,同时伴随着饮食结构的巨大改变,因日常摄入高糖、高脂、高蛋白的食物,这些使得血栓栓塞性疾病成为人们健康的严重威胁。纤维蛋白是血栓中最为顽固的组成部分,高度不溶,而纤溶则指其被分解液化的现象。纤溶活性物质指能分解纤维蛋白的物质,主要是一些纤溶酶,包括尿激酶、阿替普酶(rt-pa)、链激酶、蚓激酶、纳豆激酶、胰蛋白酶等。纤溶酶根据其各自不同特点有着不同的应用,在临床上用于溶栓治疗的有尿激酶、阿替普酶、链激酶、蚓激酶等;用于保健食品的有纳豆激酶;而胰蛋白酶虽能直接溶解血栓但却由于其缺乏特异性而并不用于溶栓治疗,临床上作为注射用酶制剂主要用于抗炎消肿,其主要作为蛋白水解酶用于动物源纤溶活性物质的提取或蛋白质组成分析。
3.各种纤溶酶均存在着热不稳定、难保存、且在临床应用中如果大剂量使用可能会出现出血等并发症的问题,如何寻找更加安全可靠的溶栓治疗和预防手段和方法成为非常迫切的需求。
4.须见洋行在文献“纳豆中所含线溶激活物质及其特性”(《日本农艺化学会期刊》第74卷第11号,2000年11月)中指出纳豆中除了纳豆激酶外,另含有一种可以激活纤溶酶的活性物质(fas),并指出该活性物质耐热性、耐酸性较好,且提供了一种酸沉醇提法。
技术实现要素:
5.为解决上述技术问题,本发明的目的在于提供一种以纳豆为原料制备促纤溶活性物质的方法。
6.为达到上述目的,本发明提供一种促纤溶活性物质的制备方法,其中,该制备方法包括以下步骤:
7.对含纳豆促纤溶活性物质的纳豆水浸提液进行加热、超滤处理,得到未透过膜的部分,即所述促纤溶活性物质,其中,所述超滤处理采用截留分子量为8000-15000dal的超滤离心管或者超滤膜进行。
8.根据本发明的具体实施方案,其中,当采用超滤离心管进行超滤处理时,所述超滤是以2000-8000rpm的转速超滤离心处理10min-60min。
9.根据本发明的具体实施方案,其中,该制备方法包括以下步骤:
10.对含纳豆促纤溶活性物质的纳豆水浸提液进行第一次离心获取第一上清液;
11.对第一上清液进行加热、超滤处理,得到未透过膜的部分,即所述促纤溶活性物质,其中,所述超滤处理采用截留分子量为8000-15000dal的超滤离心管或者超滤膜进行。
12.根据本发明的具体实施方案,其中,该制备方法包括以下步骤:
13.将上述含纳豆促纤溶活性物质的纳豆水浸提液,或上述第一上清液置于高压蒸汽灭菌锅中,115-126℃加热20min-30min或90-100℃水浴加热30min-60min;
14.对经过加热的液体进行第二次离心获取第二上清液,然后进行超滤处理。
15.根据本发明的具体实施方案,其中,该制备方法包括以下步骤:
16.将含纳豆促纤溶活性物质的纳豆水浸提液,或所述第一上清液置于高压蒸汽灭菌锅中,121℃加热20min-30min或100℃水浴加热30min-60min;
17.对经过加热的液体进行二次离心获取第二上清液,然后进行超滤处理。
18.根据本发明的具体实施方案,其中,所述第二次离心并超滤的过程包括:
19.将加热处理后的溶液经3000-8000rpm第二次离心10-30min,弃去沉淀物;
20.第二次离心后,对第二上清液超滤纯化:取第二上清液使用截留分子量为8000-15000dal的超滤离心管于2000-8000rpm超滤离心10min-60min,或采用截留分子量为8000-15000dal的超滤膜过滤,取未透过膜的部分保存。
21.根据本发明的具体实施方案,其中,该制备方法还包括将所得到的促纤溶活性物质制成粉末的过程;具体可以采用烘干、真空干燥和冷冻干燥等方法。
22.根据本发明的具体实施方案,其中,该制备方法包括:
23.取纳豆50g加入100ml蒸馏水,于室温下缓慢搅拌60min,300目过滤网滤过,过滤除去豆渣后,以3000rpm离心30min获取第一上清液;
24.向第一上清液中加入0.8-5g纳豆激酶分子印迹聚合物,4℃静置吸附20h,离心得到第三上清液;
25.将离心得到的第三上清液于115-126℃加热20min-30min或90-100℃水浴加热30min-60min,离心得第四上清液;
26.将第四上清液用8000-15000dal的超滤膜进行超滤,得到未透过膜的部分,得到促纤溶活性物质。
27.本发明另提供采用所述制备方法制备得到的纳豆促纤溶活性物质。
28.根据本发明的具体实施方案,其中,所述纳豆促纤溶活性物质的分子量为15-80kd。
29.根据本发明的具体实施方案,优选地,所述纳豆促纤溶活性物质的分子量为20-70kd。
30.根据本发明的具体实施方案,其中,所述纳豆促纤溶活性物质的等电点为ph4.0-4.8。
31.根据本发明的具体实施方案,其中,所述纳豆促纤溶活性物质的等电点为ph4.0-4.5。
32.本发明还提供所述纳豆促纤溶活性物质在制备纤溶酶促进制剂中的应用;优选地,所述纤溶酶包括胰蛋白酶try、尿激酶uk、纳豆激酶nk中的一种或多种。
33.本发明从纳豆中提取分离到一类促纤溶活性物质,其本身无纤溶活性,不能溶解血栓,但却能增加纤溶活性物质的溶栓作用,具有耐热性能,因其具有促纤溶活性和热稳定性,易保存,服用方便,将为促进相关纤溶酶的溶栓活性起到积极作用,可与纤溶酶联合使用,增加其活性,或通过减少纤溶酶用量来减少其副作用。本发明涉及其制备方法,具有较强创新性、先进性和较高的实际应用价值。
34.本发明所提供的纳豆促纤溶活性物质的制备方法既可直接从纳豆浸提液中提取,也可与分子印迹聚合物提取纳豆激酶的方法联用,同时从纳豆中提取纳豆激酶和纳豆促纤溶活性物质,减少了纳豆促纤溶活性物质的提取中纳豆激酶的浪费,大大提高了纳豆促纤溶活性物质的制备效率。
35.与酸沉醇提法相比,本发明所提供的制备方法所制得的纳豆促纤溶活性物质的活性更高,具有较强的实际应用价值。
附图说明
36.图1为直接加热法促纤溶物质fas对各纤溶酶促进作用点样方式。
37.图2为直接加热法促纤溶物质fas对纤溶酶活性的影响结果。
38.图3为纳豆激酶及纳豆黏液加热前后溶液的电泳图。
39.图4为分光光度法测直接加热法促纤溶物质fas等电点结果图。
具体实施方式
40.为了对本发明的技术特征、目的和有益效果有更加清楚的理解,现对本发明的技术方案进行以下详细说明,但不能理解为对本发明的可实施范围的限定。
41.以下实施例中所采取的试剂原料若无特殊说明均为市售获得。
42.实施例1
43.本实施例提供一种直接加热法从纳豆中提取分离耐热促纤溶活性物质的方法,其包括以下步骤:
44.步骤1)制备含纳豆促纤溶活性物质的纳豆浸提过滤液:取新鲜纳豆50g加入100ml蒸馏水,于室温下缓慢搅拌20min,80目过滤网滤过,过滤除去豆渣后,得到含纳豆促纤溶活性物质的纳豆浸提过滤液;
45.步骤2)第一次离心:将上述含纳豆促纤溶活性物质的纳豆浸提过滤液离心,5000rpm离心10min后获取第一上清液;
46.步骤3)对第一上清液直接加热:将步骤2)中离心后得到的第一上清液于高压蒸汽灭菌锅中,121℃条件下加热20min;
47.步骤4)第二次离心:将步骤3)中加热后的液体离心,5000rpm离心10min后获取第二上清液;
48.步骤5)超滤处理得到纳豆促纤溶活性物质:取步骤4)中第二次离心后得到的第二上清液,使用截留分子量为10000dal的超滤离心管于3500rpm下超滤离心30min,取未透过膜的部分保存,即得到纳豆促纤溶活性物质。
49.实施例2
50.本实施例提供一种直接加热法从纳豆中提取分离耐热促纤溶活性物质的方法,其包括以下步骤:
51.步骤1)制备含纳豆促纤溶活性物质的纳豆浸提过滤液:取新鲜纳豆50g加入200ml蒸馏水,于室温下缓慢搅拌40min,100目过滤网滤过,过滤除去豆渣后,得到含纳豆促纤溶活性物质的纳豆浸提过滤液;
52.步骤2)第一次离心:将上述纳豆浸提过滤液离心,8000rpm离心5min后获取第一上
清液;
53.步骤3)对第一上清液直接加热:将步骤2)中离心后得到的第一上清液于100℃沸水浴加热40min;
54.步骤4)第二次离心:将步骤3)中加热后的液体离心,8000rpm离心5min后获取第二上清液;
55.步骤5)超滤得到纳豆促纤溶活性物质:取步骤4)中第二次离心后得到的第二上清液,用截留分子量为8000dal的超滤膜过滤,取未透过膜的部分,即得到纳豆促纤溶活性物质。
56.步骤6)干燥:将步骤5)得到的纳豆促纤溶活性物质冷冻干燥成粉末保存。
57.实施例3
58.本实施例提供一种直接加热法从纳豆中提取分离耐热促纤溶活性物质的方法,其包括以下步骤:
59.步骤1)制备含纳豆促纤溶活性物质的纳豆浸提过滤液:取新鲜纳豆50g加入500ml蒸馏水,于室温下缓慢搅拌60min,300目过滤网滤过,过滤除去豆渣后,得到纳豆浸提过滤液;
60.步骤2)第一次离心:将上述纳豆浸提过滤液离心,3000rpm离心30min后获取第一上清液;
61.步骤3)对第一上清液直接加热:将步骤2)中离心后得到的第一上清液100℃沸水浴加热60min;
62.步骤4)第二次离心:将步骤3)中加热后的液体离心,3000rpm离心30min后获取第二上清液;
63.步骤5)超滤得到纳豆促纤溶活性物质:取步骤4)中第二次离心后得到的第二上清液,用截留分子量为15000dal的超滤膜过滤,取未透过膜的部分,即得到纳豆促纤溶活性物质。
64.步骤6)干燥:将步骤5)得到的纳豆促纤溶活性物质真空干燥后制成粉末保存。
65.实施例4
66.本实施例提供一种分子印迹法结合直接加热法从纳豆中提取分离耐热促纤溶活性物质的方法,其包括以下步骤:
67.步骤1)制备含纳豆促纤溶活性物质的纳豆浸提过滤液:取新鲜纳豆50g加入100ml蒸馏水,于室温下缓慢搅拌60min,300目过滤网滤过,过滤除去豆渣后,得到含纳豆促纤溶活性物质的纳豆浸提过滤液。
68.步骤2)第一次离心:将上述纳豆浸提过滤液离心,3000rpm离心30min后获取第一上清液。
69.步骤3)分子印迹法吸附纳豆激酶:加入2g纳豆激酶分子印迹聚合物(nk-mips,按照cn110437491a的实施例1制备),4℃静置吸附20h,离心,离心后得到沉淀与第三上清液,分别依照步骤4)、步骤5)的方法对沉淀和第三上清液进行处理。
70.步骤4)离心后的沉淀进行洗脱分离,得到纳豆激酶:沉淀印迹聚合物经充分洗脱后收集获得纳豆激酶的方法参照cn110437491a。
71.步骤5)离心后的第三上清液经直接加热法得到纳豆促纤溶活性物质:将离心得到
的第三上清液于121℃条件下加热20min,离心,获取第四上清,将第四上清液用8000-15000dal的超滤膜进行超滤,得到未透过膜的部分,得到纳豆促纤溶活性物质。
72.步骤6)干燥:将步骤5)得到的纳豆促纤溶活性物质冻干后制成粉末保存。
73.对比例1
74.本对比例提供一种采用酸沉醇提法从纳豆中提取促纤溶物质fas的方法。
75.酸沉醇提法从纳豆中提取促纤溶物质的步骤如下:
76.步骤1)制备含纳豆促纤溶活性物质的纳豆浸提过滤液:取新鲜纳豆50g加入500ml蒸馏水,于室温下缓慢搅拌60min,300目过滤网滤过,过滤除去豆渣后,得到含纳豆促纤溶活性物质的纳豆浸提过滤液;
77.步骤2)第一次离心:将上述纳豆浸提过滤液离心,3000rpm离心30min后获取第一上清液;
78.步骤3)调节ph得到白色沉淀:用盐酸或硫酸调节第一上清液的ph=2.0,离心获得白色沉淀;
79.步骤4)溶解:加入200ml95%乙醇溶解步骤3)中的白色沉淀,再滤去不溶物,得纳豆促纤溶活性物质的醇溶液;
80.步骤5)将步骤4)中的溶液在60℃下减压蒸馏后干燥即得促纤溶活性物质。
81.实验例1
82.本实验例提供对直接加热法得到的促纤溶物质fas的促纤溶活性的研究方法。
83.本方法从两个方面研究直接加热法得到的促纤溶活性物质fas的促纤溶活性:
84.1)制备纳豆提取液,比较其加热处理前后的溶液自身的溶栓作用;
85.2)分别测定直接加热法提取分离得到的促纤溶物质fas对不同纤溶酶的溶栓作用的促进效果。
86.实验例所用样品的具体制备方法如下:
87.步骤1)制备含纳豆促纤溶活性物质的纳豆浸提过滤液:取新鲜纳豆50g加入100ml蒸馏水,于室温下缓慢搅拌20min,80目过滤网滤过,过滤除去豆渣后,得到含纳豆促纤溶活性物质的纳豆浸提过滤液;
88.步骤2)第一次离心:将上述纳豆浸提过滤液离心,5000rpm离心10min后获取第一上清液,记为加热前提取液备用;
89.步骤3)对第一上清液直接加热:取部分步骤2)中离心后得到的第一上清液于高压蒸汽灭菌锅中,121℃条件下加热20min;
90.步骤4)第二次离心:将步骤3)中加热后的液体离心,5000rpm离心10min后获取第二上清液,记为fas提取液备用。
91.测定纳豆加热前提取液及fas提取液的促纤溶活性的过程如下:
92.本实验例采用琼脂糖-纤维蛋白平板法,测定纳豆加热前提取液及fas提取液对四种纤溶酶的体外溶栓性能的促进作用,所述四种纤溶酶具体包括:纳豆激酶nk1(日本纳百恩食品有限公司,批号kab1507),纳豆激酶nk2(广东双骏生物科技有限公司,20000fu/g,批号yn20171125a01)、胰蛋白酶(amresco公司)、尿激酶(食品药品检定研究院,批号140604-201224)。
93.(1)制备用于检测实验的琼脂糖-纤维蛋白平板:
94.配制0.05mol/l硼砂缓冲溶液(ph=7.8,含0.15mol/l氯化钠)、1bp/ml牛凝血酶溶液,1.5mg/ml的牛纤维蛋白原溶液,质量分数为1.5%的琼脂糖凝胶溶液。
95.制备琼脂糖-纤维蛋白平板:先取40ml琼脂糖凝胶溶液,再依次加入1bp/ml牛凝血酶溶液4ml、1.5mg/ml的牛纤维蛋白原溶液40ml,整个操作过程于55℃水浴锅中保温进行,同时用玻璃棒搅拌,充分混匀,除去气泡后迅速倒入培养皿中,于4℃下冷却待用,并预先做好标记用于后续点样。
96.(2)配制各种待测溶液:
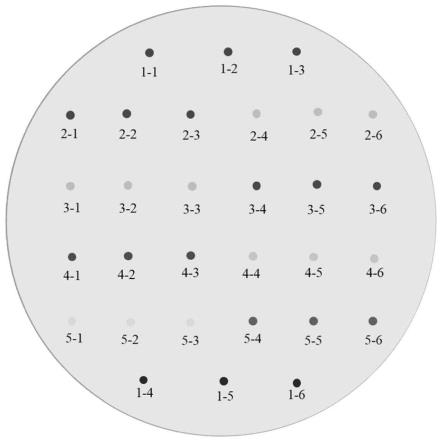
97.各纤溶酶溶液的配制:分别配制0.2mg/ml的胰蛋白酶try溶液,20mg/ml的纳豆激酶nk1溶液,1mg/ml的纳豆激酶nk2溶液和99.2iu/ml的尿激酶uk溶液。
98.fas提取液的配制:待测促纤溶物质fas提取液冻干后再用生理盐水配制成40mg/ml的fas提取液备用。
99.加热前提取液的配制:待测的加热前提取液冻干后再用生理盐水配制成40mg/ml的加热前提取液备用。
100.点样样品的配制:将四种纤溶酶与fas提取液按1:1等体积(各50μl)混匀,用于点样;将四种纤溶酶溶液与生理盐水以1:1等体积(各50μl)混匀,用于点样。
101.(3)平板点样:
102.在制备好的琼脂糖-纤维蛋白平板上,对(2)中配制的加热前提取液、促纤溶物质fas提取液,以及各纤溶酶 fas,以及各纤溶酶 生理盐水样品进行点样。每个样品溶液平行3次点样,测量透明圈面积,结果取平均值。具体点样方式如图1所示,其中,各编号的含义为:
103.1-1,1-2,1-3:加热前提取液;
104.1-4,1-5,1-6:fas提取液;
105.2-1,2-2,2-3:nk1 fas提取液;
106.2-4,2-5,2-6:nk1 生理盐水;
107.3-1,3-2,3-3:uk 生理盐水;
108.3-4,3-5,3-6:uk fas提取液;
109.4-1,4-2,4-3:try fas提取液;
110.4-4,4-5,4-6:try 生理盐水;
111.5-1,5-2,5-3:nk2 生理盐水;
112.5-4,5-5,5-6:nk2 fas提取液。
113.(4)测定纳豆加热前提取液及纳豆fas提取液的促纤溶活性:
114.采用琼脂糖-纤维蛋白平板法,测定纳豆加热前提取液及fas提取液对四种纤溶酶的体外溶栓性能的促进作用。点样方式如(3)所示,孵育后,溶栓结果如图2所示。图2体现了点样后孵育18h时各样品的溶栓透明圈。
115.(5)测定纳豆加热前提取液及纳豆fas提取液的促纤溶效率:
116.促纤溶效率的计算方法:通过琼脂糖-纤维蛋白平板法,以形成的透明圈面积s1(mm2)代表酶的表观溶栓活力,即s1代表酶 fas提取液的溶栓透明圈面积,而s2(mm2)代表空白对照品,即s2代表酶 生理盐水的溶栓透明圈面积,并取点样结果的平均值计算出s1/s2的值,作为促进效率。
117.首先,对于加热前纳豆提取液和加热处理后fas提取液的溶栓活性进行考察,测定加热前后提取液作用所得透明圈面积s(mm2)结果见表1:
118.表1加热前后提取液作用所得透明圈面积s(mm2)(18h)
[0119][0120]
结果表明,加热前提取液里因含有纳豆激酶nk,具有一定的溶栓活性,而于121℃加热20min后,各培养时间段内均无溶栓透明圈的出现,说明直接加热法破坏了纳豆激酶nk的活性,最终获取的fas提取液中完全不含有纳豆激酶nk,排除了溶液中纳豆激酶nk自身溶栓对后续实验的影响。
[0121]
同时,如图2所示直接加热法制备的fas提取液对各纤溶酶的影响,根据具体测量对纤溶酶溶栓透明圈面积s(mm2)的影响结果,计算fas提取液对各酶的纤溶促进效率,见表2:
[0122]
表2直接加热法促纤溶物质fas提取液对各纤溶酶的促进效率
[0123]
酶溶液促进效率(18h)纳豆激酶nk11.09纳豆激酶nk21.26胰蛋白酶try1.19尿激酶uk1.37
[0124]
由表2可以看出,虽然所采用的三种酶的溶栓机制不同,但直接加热法所得产物fas提取液对不同纤溶酶均表现出了不同程度的促进作用。
[0125]
实验例2
[0126]
本实验例提供对分子印迹法与直接加热法联用制备促纤溶物质的活性研究方法。
[0127]
按实施例4中分子印迹法结合直接加热法从纳豆中提取分离的促纤溶活性物质,制备得到40mg/ml溶液。按上述实施例1中琼脂糖-纤维蛋白平板法测定对不同纤溶酶的溶栓作用的促进效果。所得结果见表3。可以看到,分子印迹法与直接加热法联用制备促纤溶物质fas对各纤溶酶均具有促进作用。
[0128]
表3分子印迹法与直接加热法联用促纤溶物质fas的促进效率
[0129]
酶溶液促进效率(18h)纳豆激酶nk11.02
纳豆激酶nk21.19胰蛋白酶try1.43尿激酶uk1.20
[0130]
实验例3
[0131]
本实验例提供按对比例1酸沉醇提法制得的促纤溶物质fas提取液促纤溶活性的情况。
[0132]
测定方法同实验例1。测定结果如表4所示。
[0133]
表4酸沉醇提法fas溶液对各纤溶酶的促进效率
[0134]
酶溶液促进效率(18h)纳豆激酶nk10纳豆激酶nk20胰蛋白酶try1.10尿激酶uk1.06
[0135]
由表4可知,酸沉醇提法制备的fas提取液对胰蛋白酶和尿激酶具有一定的促进作用,但对两种纳豆激酶均未能显示促进作用。
[0136]
结果提示,与酸沉醇提法制备fas方法相比,本发明所述直接加热方法以及分子印迹与直接加热联用法制备的fas产品活性更高。
[0137]
实验例4
[0138]
本实验例提供研究直接加热法促纤溶物质fas成分的方法。
[0139]
1.直接加热法所得fas提取物溶液中不同组分的促纤溶作用
[0140]
盐析法提取蛋白组分:取实施例1中所得fas提取物,制备成100mg/ml溶液40ml,用硫酸铵盐析,使饱和度达到70%,于4℃下盐析4h,10000rpm离心10min,沉淀用10ml生理盐水溶解。
[0141]
醇沉法提取多糖组分:取实例1中所得fas提取物,制备成100mg/ml溶液40ml,用sewage法除去蛋白,然后加入160ml95%乙醇,使得乙醇终浓度为80%,醇沉12h。过滤,沉淀烘干得多糖,加入10ml生理盐水溶解。
[0142]
采用纤维蛋白平板法测蛋白组分和和多糖组分促纤溶作用活性,并与热提取fas溶液进行比较。
[0143]
通过结果计算纳豆热提取物多糖和蛋白质组分的纤溶促进效率,见表5。由表中可得,fas对try、nk和uk的促进效率分别为1.16、1.14和1.14,纳豆热热提取物成分里的多糖对try、nk和uk的促进效率分别为1.02、1.01和1.03,纳豆热热提取物成分里的蛋白质对try、nk和uk的促进效率分别为1.10、1.13和1.11,所以多糖组分对三种纤溶酶活性并没有明显的促进作用,蛋白质组分对三种纤溶酶活性有明显的促进作用,且与fas的促进效率基本一致,这说明多糖组分并没有促纤溶活性作用,蛋白质组分具有促纤溶活性作用,所以fas成分为蛋白质组分。后续将对纳豆热热提取物里的蛋白质成分进行研究。
[0144]
表5热提取物多糖和蛋白质组分对纤溶酶的促进作用
[0145][0146]
2.电泳法fas成分研究:
[0147]
本实验例采用sds-page电泳对直接加热法促纤溶物质fas中蛋白组分进行研究,通过电泳条带判断组分的性质。实验选择纳豆激酶nk2、纳豆激酶nk2热解产物、纳豆黏液、直接加热法促纤溶物质fas四种样品溶液进行电泳,并对结果进行比较。
[0148]
(1)待测溶液的配制:
[0149]
制备0.1g/ml的纳豆激酶nk2溶液:取纳豆激酶nk2用生理盐水配而成。
[0150]
制备纳豆粘液:取新鲜纳豆50g加入100ml蒸馏水,于室温下缓慢搅拌20min,搅拌浸提10min,80目过滤网滤过,过滤除去豆渣后,以5000rpm离心10min获取上清。
[0151]
制备纳豆激酶nk2热解产物、直接加热法促纤溶物质fas:上述两溶液各取少量(100μl)备用后,再将此两溶液均加热处理(121℃、20min),以5000rpm离心20min分别获取上清,即得纳豆激酶nk2热解产物、直接加热法促纤溶物质fas。
[0152]
(2)样品电泳:
[0153]
将(1)中各样品溶液用0.45μm滤膜过滤,取20μl后再加入5μl上样缓冲液,混匀后于沸水中煮5min,待上样。第一条泳道上样蛋白质分子质量标准液15μl。
[0154]
电泳实验基本操作:
[0155]
①
安装装置。
[0156]
②
配制分离胶,混匀后注入装置两玻璃板间的空隙层,再用水液封,凝固40min左右。
[0157]
③
配制浓缩胶,混匀,倒掉液封的水后缓慢注入分离胶的上层,加满后插入样品梳。
[0158]
④
待浓缩胶凝固30min左右,将整个装置放入电泳槽,加入电泳缓冲液后将样品梳拔掉。
[0159]
⑤
上样15μl后120v稳压跑胶,待溴酚蓝即将跑出胶体时停止电泳。
[0160]
⑥
回收电泳缓冲液后卸胶,加入染色液摇床染色60min。
[0161]
⑦
采用热水脱色的方式,将胶体于90℃左右的水浴中脱色,不断换水至看到清晰条带。实验分离胶及浓缩胶的配制如表6所示:
[0162]
表6电泳凝胶配方
[0163]
12vol.%分离胶10ml5vol.%浓缩胶5mlh2o3.2h2o3.430%分离胶贮液430%分离胶贮液0.831.5m tris-hcl ph 8.82.61.0m tris-hcl ph 6.80.6310%sds0.1010%sds0.0510%过硫酸铵0.1010%过硫酸铵0.05
四乙基乙二胺(temed)0.004四乙基乙二胺(temed)0.005
[0164]
纳豆促纤溶活性物质电泳实验结果如图3所示。图3显示纳豆激酶及纳豆黏液加热前后溶液的电泳图,其中,由左至右,各泳道样品分别为:
[0165]
1:蛋白质分子量标准品:mark;
[0166]
2:纳豆激酶nk2未加热:nk2;
[0167]
3:纳豆激酶nk2热解产物:f;
[0168]
4:纳豆黏液未加热:纳豆黏液;
[0169]
5:纳豆黏液加热后:fas。
[0170]
从图3可以看出,泳道2显示纳豆激酶nk2分子量在28kd左右,具有很明显的电泳条带,为纳豆激酶(分子量27728dal),但该泳道并不仅有单一条带,只是其余均比较浅,表明该产品不仅只含纳豆激酶nk;
[0171]
泳道3表明纳豆激酶nk2加热后无条带,在14.4-116kd分子量范围内,该物质加热后未生成其他蛋白质,表明纳豆激酶nk不耐热,121℃加热能完全除去或破坏纳豆激酶nk;
[0172]
泳道4表明纳豆黏液除含纳豆激酶nk外,还含有许多分子量大大小小的蛋白质物质,其中20kd左右的蛋白质条带较粗且明显,表明该分子量位置含有较多的蛋白质物质;
[0173]
泳道5表明纳豆黏液加热后,即促纤溶物质fas在20kd处显示单一条带,表明加热除去了纳豆黏液中的多数蛋白质,fas发挥促纤溶作用的主要为该条带处的物质。
[0174]
3.紫外分光光度法测fas等电点
[0175]
用醋酸钠和醋酸溶液配制ph值分别为3.0、3.2、3.4、3.6、3.8、4.0、4.3、4.5、4.8、5.0、5.3、5.6、5.9和6.0的系列缓冲液,在试管中分别加入6ml的缓冲液和2ml的fas溶液,摇匀,滴加等体积的无水乙醇后,混匀280nm测吸光度。每组测3个平行。结果见图4。fas的等电点分布范围为ph=4.0-4.8。
[0176]
结论:通过直接加热法并结合超滤技术,可获得一类耐热的具有促纤溶活性的物质。
[0177]
本发明创新性强,且制备方法简单易行,具有广阔的应用前景。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。