2-氨基吡啶类schiff碱及其制备方法与应用
技术领域
1.本发明涉及有机合成领域,具体涉及一种2-氨基吡啶类schiff碱及其制备方法与应用。
背景技术:
2.在有机反应中,醛和一级胺缩合形成一类重要的有机化合物,即席夫碱(schiff碱),schiff碱类化合物可以灵活地选择反应物制备,即通过改变取代基种类以及取代基位置设计、合成出结构和性质丰富的schiff碱衍生物。schiff碱化合物作为配体分子,可以跟很多金属离子形成稳定的配位物。这些配合物在分析化学、医药领域、分子自组装、超分子化学、生物仿生科学、催化、材料等学科方面具有重要的意义。
3.2-氨基吡啶类化合物作为一种重要的医药中间体,可经缩合、水解得到磺胺类抗菌药——吡啶磺胺。磺胺吡啶重氮化后与水杨酸偶合、酸化即制得柳氮磺胺吡啶。柳氮磺胺吡啶属不易口服吸收的磺胺药,经过在肠微生物吸收作用下水解成5-氨基水杨酸和磺胺吡啶。此外,2-氨基吡啶还用于合成镇痛消炎药——吡罗昔康、氯诺昔康等,用于骨关节炎、类风湿关节炎和强直性脊柱炎的症状缓解。苯甲醛类化合物是医药、染料、香料和树脂工业的重要原料,还可用作溶剂、增塑剂和低温润滑剂等。针对上述现有技术,本发明利用2-氨基吡啶类化合物和苯甲醛类化合物,合成了一类新的2-氨基吡啶类schiff碱,并测试了其相关应用。
技术实现要素:
4.本发明提供了式i所示的化合物或其药学上可接受的盐,
[0005][0006]
其中,r1为甲基;r2为氢或羟基;r3选自氯、硝基、羟基或甲氧基。
[0007]
在一些实施方案中,前述式i化合物具有如式ii所示的结构,
[0008][0009]
其中,r1为甲基;
[0010]
r2为羟基;
[0011]
r3选自氯、硝基、羟基或甲氧基,优选地,r3选自氯。
[0012]
在一些实施方案中,前述式i化合物具有如式iii所示的结构,
[0013][0014]
其中,r1为甲基;
[0015]
r2为h或羟基;
[0016]
r3选自氯、硝基、羟基或甲氧基;优选地,r3选自羟基或甲氧基。
[0017]
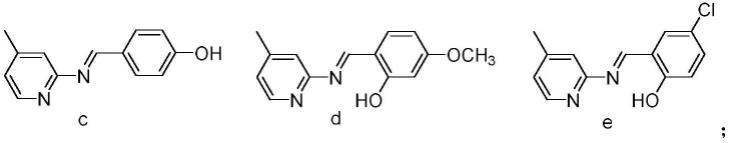
在一些特定的实施方案中,本发明提供了以下化合物或其药学上可接受的盐,
[0018][0019]
本发明所述式i化合物按下述路线进行合成:
[0020][0021]
其中r1、r2、r3如式i中所述。
[0022]
在一些实施方案中,所述式i化合物的合成步骤如下:式a化合物和式b化合物溶于有机溶剂c,于40-90℃温度范围内,搅拌反应2-8h,冷却过滤,滤液置于烧杯中,静置1-5天后,得到固体,过滤,用有机溶剂c洗涤或重结晶,得到式i化合物。
[0023]
在一些实施方案中,所述的有机溶剂c或有机溶剂d独立地选自为甲醇、乙醇、乙酸乙酯、氯仿、二氯甲烷、n,n-二甲基甲酰胺中的一种或二种以上的组合;优选为氯仿或乙醇;进一步优选地,所述的有机溶剂c与有机溶剂c相同,选自氯仿或者乙醇;
[0024]
在一些实施方案中,所述的式a化合物为3-甲基-2-氨基吡啶或4-甲基-2-氨基吡啶;所述的式b化合物选自5-氯水杨醛、5-硝基水杨醛、对羟基苯甲醛、4-甲氧基水杨醛中的一种。
[0025]
在一些实施方案中,所述的有机溶剂用量与式b化合物投料量的比例(体积:摩尔数)为10~3:1;式a化合物与式b化合物的投料摩尔比为1:0.8~1.2。
[0026]
本发明提供的化合物a晶体为正交晶系,p212121空间群,空间群,本发明提供的化合物b晶体为单斜晶系,p21/c空间群,
[0027]
本发明提供的化合物的单晶培养方法:将所述化合物用氯仿溶解置于50ml烧杯,
用保鲜膜密封,对称扎孔,静置安静处,2-3天可得到淡黄色块状晶体,过滤,用甲醇洗涤3次,得到该化合物的单晶。
[0028]
另一方面,本发明还提供了一种药物组合物,其包含治疗有效量的式i、ii或iii化合物或其药学上可接受的盐以及一种或多种药学上可接受的载体。
[0029]
另一方面,本发明还提供了式i、ii或iii化合物在制备用于抗菌或杀菌药物中的用途。
[0030]
另一方面,本发明还提供了式i、ii或iii化合物在制备抑制dpph自由基抗氧化剂中的应用。
[0031]
本发明的有益效果:本发明提供的化合物兼具吡啶环、亚胺基、苯酚骨架,使其具有良好抗菌、清除dpph自由基活性,可用于制备抗菌或杀菌药物,或用作抗氧化剂。
附图说明
[0032]
图1是化合物a的晶体结构图
[0033]
图2是化合物b的晶体结构图
[0034]
图3是化合物a沿a轴的晶胞堆积图
[0035]
图4是化合物b沿c轴的晶胞堆积图
具体实施方案
[0036]
下面结合具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好的理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
[0037]
实施例1化合物a的合成
[0038]
在100ml圆底烧瓶中加入0.4697g(3mmol)5-氯水杨醛和5ml乙醇,搅拌使其溶解。再加入0.348g(3mmol)3-甲基-2-氨基吡啶乙醇溶液10ml,80℃反应4h,冷却至室温,过滤,滤渣用氯仿重结晶,干燥;滤液合并,置于50ml烧杯中,用保鲜膜封口,用针将保鲜膜对称扎孔,放置在阴凉、安静处,2-3天,过滤,用甲醇洗涤,得到针状晶体化合物a。
[0039]
化合物a为黄色针状晶体,熔点103~105℃,收率为62%。1h nmr(500mhz,chloroform-d)δ13.79(s,1h),9.41(s,1h),8.37(d,j=4.4hz,1h),7.63(d,j=7.5hz,1h),7.50(d,j=2.6hz,1h),7.36(dd,j=8.8,2.2hz,1h),7.19(dd,j=7.3,4.9hz,1h),7.01(d,j=8.8hz,1h),2.49(s,3h)。
13
c nmr(126mhz,chloroform-d)δ162.68,160.66,155.33,146.47,139.64,133.55,132.17,128.72,123.73,123.06,119.93,118.84,17.62。
[0040]
实施例2化合物b的合成
[0041]
化合物b的合成方法与实施例1相同,将原料5-氯水杨醛换成5-硝基水杨醛,将溶剂换成1ml n,n-二甲基甲酰胺和4ml乙醇即可。化合物b为橘黄色针状晶体,熔点182~183℃,收率为86%。1h nmr(500mhz,chloroform-d)δ15.06(s,1h),9.56(s,1h),8.51(d,j=2.7hz,1h),8.40(d,j=4.5hz,1h),8.30(dd,j=9.2,2.7hz,1h),7.67(d,j=7.5hz,1h),7.24(dd,j=7.5,4.7hz,1h),7.11(d,j=9.2hz,1h),2.51(s,3h)。
13
c nmr(126mhz,chloroform-d)δ168.32,161.99,153.90,146.69,139.88(d,j=7.0hz),129.55,128.91,128.55,123.68,118.65,117.84,17.46。
[0042]
实施例3化合物c的合成
[0043]
化合物c的合成方法与实施例1相同,将原料3-甲基-2-氨基吡啶换成4-甲基-2-氨基吡啶,将原料5-氯水杨醛换成对羟基苯甲醛即可。化合物c为黄色固体,熔点201~202℃,收率为64%。1h nmr(500mhz,dmso-d6)δ10.27(s,1h),9.02(s,1h),8.30(d,j=5.0hz,1h),7.85(d,j=8.6hz,2h),7.11(s,2h),6.91(d,j=8.5hz,2h),2.35(s,3h);
13
c nmr(126mhz,dmso-d6)δ162.12,161.68,161.51,149.63,148.79,131.82,127.51,122.95,120.14,116.26,20.87;hrms(esi)m/z calcd for(m h
)(c
13h12
n2o)213.1029,found 213.1020。
[0044]
实施例4化合物d的合成
[0045]
化合物c的合成方法与实施例1相同,将原料3-甲基-2-氨基吡啶换成4-甲基-2-氨基吡啶,将原料5-氯水杨醛换成4-甲氧基水杨醛即可。化合物d为黄色固体,熔点101~103℃,收率为78%。1h nmr(500mhz,chloroform-d)δ14.14(s,1h),9.31(s,1h),8.34(d,j=5.0hz,1h),7.35(d,j=9.3hz,1h),7.09(s,1h),7.00(s,1h),6.48(d,j=4.7hz,2h),3.86(s,3h),2.40(s,3h)。
13
c nmr(126mhz,chloroform-d)δ166.17,164.88,162.39,157.21,149.80,148.49,134.74,122.99,120.19,112.89,107.70,101.11,55.47,20.97。
[0046]
实施例5化合物e的合成
[0047]
化合物c的合成方法与实施例1相同,将原料3-甲基-2-氨基吡啶换成4-甲基-2-氨基吡啶,将原料5-氯水杨醛换成4-氯水杨醛即可。化合物e为黄色固体,熔点154~156℃,收率为81%。1h nmr(500mhz,chloroform-d)δ13.53(s,1h),9.39(s,1h),8.38(d,j=4.9hz,1h),7.47(d,j=2.2hz,1h),7.35(dd,j=8.8,2.0hz,1h),7.18(s,1h),7.09(d,j=4.6hz,1h),7.00(d,j=8.8hz,1h),2.43(s,3h)。
13
c nmr(126mhz,chloroform-d)δ163.37,160.46,157.12,150.03,148.69,133.48,132.17,124.02,123.71,121.35,119.78,118.85,20.97。
[0048]
实施例6化合物a和化合物b的晶体结构
[0049]
分别选择一块尺寸约0.20mm
×
0.13mm
×
0.12mm和0.12mm
×
0.08mm
×
0.05mm的前述所得的a和b单晶置于bruker smart 1000ccd衍射仪上,用石墨单色化的mo-k
α
(λ=0.71073nm)射线以ω-2θ扫描方式,于298(2)k下测定。全部强度数据还原在bruker saint程序上进行。以l
p
因子修正数据,晶体结构采用shelexs 97软件由直接法解出,理论加氢,全部非氢原子的坐标和各向异性热参数经全矩阵最小二乘法修正收敛。详细晶体学数据见表1。部分键长和键角数据见表2。
[0050]
化合物a晶体为正交晶系,p212121空间群,空间群,化合物b晶体为单斜晶系,p21/c空间群,化合物b晶体为单斜晶系,p21/c空间群,其ortep图和原子编号见图1~2,其晶胞堆积图见图3~4。
[0051]
表1化合物a、b的晶体学数据
[0052][0053]
表2化合物a、b结构中部分键长(nm)和键角(
°
)
[0054][0055]
测试例1
[0056]
化合物b抑菌实验
[0057]
参考文献(xu r.b.,j.chem.crystallogr.2012,42(9):928-932)的抑菌实验步骤和方法,测定了化合物b对三种受试细菌大肠杆菌、金黄色葡萄球菌、枯草杆菌的抑制作用。取34g营养琼脂,加1l蒸馏水,溶解后置于高压灭菌锅内,120℃灭菌30min。冷却至50~60℃制成平板。取0.1ml活化菌液,在平板上涂抹均匀,以等距离均匀、垂直放置5个牛津杯。在牛津杯中加入0.1ml化合物b溶液,盖好平皿,置于37℃生化培养箱中培养24h。取出后,测量每
个牛津杯周围所产生的透明抑菌圈直径(mm)。结果列于表4。
[0058]
表4化合物b抑菌实验结果
[0059][0060]
从表4可以看出,化合物b对三种受试菌株均表现出抑制作用,其中:对金黄色葡萄球菌和枯草芽孢杆菌活性非常优异,而对大肠杆菌的抑制作用一般;随着化合物浓度的增加,对三种细菌的抑制活性也增强。
[0061]
化合物a、c、e抑菌活性评价
[0062]
参照文献(schug a.,veterinary microbiology,2020,248:108791)的微量肉汤稀释法测定化合物a、c、e的最低抑菌浓度(mic)。采用微量二倍稀释法,在一次性聚乙烯96孔板中分别按顺序加入100μl液体培养基、100μl样品待测液,充分混匀,最后,再加入100μl受试菌株的菌液,把96孔板置于37℃恒温培养箱中培养24h。培养结束后,比较检验组与空白对照组浑浊度差异,液体澄清且无沉淀的孔内所含药物浓度即为最低抑菌浓度。受试菌株为大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌、溶藻性弧菌和副溶血性弧菌,结果列于表5。
[0063]
表5化合物a、c和e最小抑菌浓度
[0064][0065]
从表5中可以看出,以上化合物对五种受试菌株均表现出抑制作用,对溶藻性弧菌和副溶血性弧菌的抑菌作用均大于对大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌的作用。化合物a、e的抑菌活性比c强。
[0066]
测试例2化合物a~e对dpph自由基的清除效率
[0067]
取6支10ml具塞棕色比色管,分别加入2ml 0.1mm dpph
·
甲醇溶液和2ml不同浓度(0.05、0.1、0.5、1和5mg/ml)的化合物a、c、d或e其中一种的甲醇溶液,再用1ml甲醇定容至5ml。摇匀,置于37℃水浴锅中,避光反应120min。取样,以甲醇为参比,用紫外分光光度计测516nm处吸光度a值。
[0068]
化合物b清除dpph自由基的实验方法与上相同,仅个别参数不同:dpph
·
甲醇溶液为0.3mm;样品浓度为0.1、0.5、1、2和5mg/ml;反应时间为4h。
[0069]
样品对dpph
·
的清除率按照下面公式进行计算:
[0070]
dpph
·
清除率/%=[1-(ai-aj)]
×
100%/a0[0071]
其中:a0是空白对照的吸光度;ai是加样品液后吸光度;aj是样品液本底吸收。
[0072]
在实验测试浓度范围内,化合物对dpph自由基的清除率与浓度之间关系的回归方程列于表6。从表中可以看出,清除率与化合物a~c、e浓度或化合物b浓度的ln值之间存在良好线性关系,都表现出良好清除dpph自由基能力,其中化合物d效果最好,半抑制浓度ic
50
为0.81mg/ml。
[0073]
表6化合物a~e的对dpph
·
自由基的清除作用
[0074]
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
