兼具d2受体激动和nmda受体拮抗作用的化合物及其应用
技术领域
1.本发明属于制药领域,涉及一类兼具d2受体激动作用和nmda受体部分拮抗作用的新型帕金森病治疗药物。
背景技术:
2.帕金森病(parkinson's disease,pd)是世界上第二大神经进行性退行疾病,年龄65岁以上的人口中,有2%的生命健康和生活质量受到其威胁。pd的病理特征主要是中脑黑质致密部多巴胺神经元损伤,伴随着静止性震颤、僵直、行动迟缓等运动症状及睡眠障碍、认知障碍等非运动症状。
3.目前,临床上帕金森病治疗策略主要分为保护多巴胺能神经元及补充多巴胺。其中,拟多巴胺类药物左旋多巴,随着病情的进展和使用剂量的增加,会伴随异动症等运动障碍产生,影响治疗疗效。多巴胺受体激动剂(多为多巴胺ⅱ型(d2)受体激动剂)由于可以改善患者帕金森样症状且不良反应较少,为越来越多的患者所接受。普拉克索(化学名称:(s)-2-氨基-4,5,6,7-四氢-6-丙胺-苯并噻唑)是一种临床上常用的治疗pd的d2受体激动剂,可以激动d2受体,抑制d2神经元介导的间接通路的no-go效应,从而发挥缓解运动障碍的作用。
4.临床数据显示,多达40%的pd患者可能会发生认知功能障碍和痴呆,且随着pd病情的进展,痴呆和认知功能障碍发生的概率会增加,金刚烷胺、美金刚等nmda受体拮抗剂可以改善伴有痴呆的pd患者的认知障碍,可以阻断pd患者纹状体内异常的谷氨酸信号,降低神经毒性,从而起到神经保护作用,一定程度上延缓疾病的进展。
5.帕金森病的发生过程中,存在很多发病机制,包括环境因素、氧化应激、兴奋性毒性等。因此,仅针对其中的一个靶点很难取得令人满意的治疗效果。
技术实现要素:
6.本发明的目的在于提供一类多功能的帕金森治疗药物。
7.本发明的目的是通过以下技术方案实现的:
8.结构如式ⅰ所示的化合物或其药学上可接受的盐:
[0009][0010]
其中,x选自ch2、o;n为选自1~6的整数,m为选自1~6的整数。
[0011]
优选的,x选自o;n为选自1~6的整数,m为选自1~6的整数。
[0012]
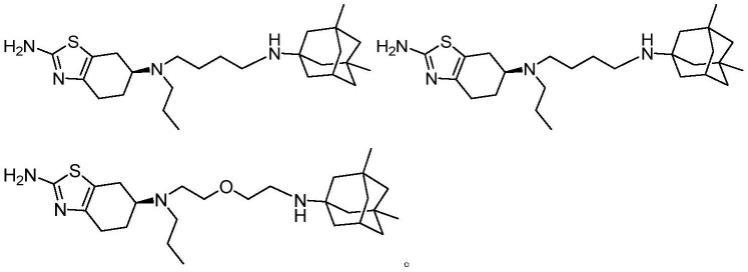
具体的,选自以下化合物:
[0013][0014]
药学上可接受的盐为盐酸盐、氢溴酸盐、硝酸盐、高氯酸盐、磷酸盐、硫酸盐、甲酸盐、乙酸盐、阿康酸盐、抗坏血酸盐、苯磺酸盐、苯甲酸盐、肉桂酸盐、柠檬酸盐、庚酸盐、富马酸盐、谷氨酸盐、乙醇酸盐、乳酸盐、马来酸盐、丙二酸盐、扁桃酸盐、甲磺酸盐、萘-2-磺酸盐、邻苯二甲酸盐、水杨酸盐、山梨酸盐、硬脂酸盐、琥珀酸盐、酒石酸盐或对甲苯磺酸盐。
[0015]
本发明所述的化合物至少具有nmda受体拮抗作用;尤其是当x选自o时,化合物同时具有d2受体激动作用与nmda受体拮抗作用,且该nmda受体拮抗作用不影响正常功能,在改善帕金森病模型(mptp模型)小鼠运动症状的同时也改善了mptp模型小鼠所出现的运动和认知障碍,缓解了mptp模型小鼠黑质致密部多巴胺神经元的损伤,其机制可能与化合物可以改善纹状体中nmdar受体及胆碱能神经元的异常兴奋性,改善纹状体整体输出功能有关。可见,本发明化合物具有更好的帕金森病治疗效果。
[0016]
因此,本发明的另一个目的在于提供式ⅰ所示的化合物或其药学上可接受的盐在制备d2受体激动剂和/或nmda受体拮抗剂的应用。
[0017]
本发明的另一个目的是提供式ⅰ所示的化合物或其药学上可接受的盐在制备预防和治疗帕金森病药物中的应用。
[0018]
本发明的另一个目的是提供通式ⅰ所示的化合物的制备方法,合成路线如下:
[0019][0020][0021]
本发明的有益效果:
[0022]
本发明化合物是多药理学机制的新型帕金森病治疗药物,兼具d2受体激动作用和nmda受体拮抗作用,可以改善pd模型小鼠的运动及认知障碍,具有比单靶点药物更好的治疗效果。
附图说明
[0023]
图1:普拉克索、化合物ml-a、ml-b、ml-c在不同浓度下对d2受体的激动作用结果;其中,a:上图为chat-egfp小鼠脑片中纹状体部位荧光图,下图为玻璃电极记录胆碱能神经元示意图;b:50μm、100μm、200μm化合物ml-b、200μm普拉克索灌流脑片前后胆碱能神经元的动作电位代表图;c:50μm、100μm、200μm化合物ml-b灌流脑片前后胆碱能神经元的动作电位统计结果图;d:200μm普拉克索灌流脑片前后胆碱能神经元的动作电位统计结果图;e:比较相同基线条件下,200μm化合物ml-b与200μm普拉克索减少胆碱能神经元的动作电位的百分比;f:200μm化合物ml-a、200μm化合物ml-c灌流脑片前后胆碱能神经元的动作电位代表图;g:200μm化合物ml-a灌流脑片前后胆碱能神经元的动作电位统计结果图;h:200μm化合物ml-c灌流脑片前后胆碱能神经元的动作电位统计结果图;
[0024]
图2:普拉克索、化合物ml-a、ml-c、化合物ml-b在不同浓度下对nmda受体的拮抗作用结果;其中,a:记录纹状体msns的nmdar介导的epsc的示意图;b:上部分别为50μm、100μm、200μm化合物ml-b灌流脑片前后msns中nmdar介导的epsc代表图,下部分别为统计结果图;c:上部为200μm普拉克索灌流脑片前后msns中nmdar介导的epsc代表图,下部图为统计结果图;d:上部为200μm化合物ml-a灌流脑片前后msns中nmdar介导的epsc代表图,下部图为统计结果图;e:上部为200μm普拉克索200μm化合物ml-c灌流脑片前后msns中nmdar介导的epsc代表图,下部图为统计结果图;
[0025]
图3:化合物ml-b的药时曲线图;其中,a:化合物ml-b在脑内浓度随时间变化的药时曲线图;b:药物在血浆内浓度随时间变化的药时曲线图。
[0026]
图4:小鼠连续给药(化合物ml-b)一个月后的器官石蜡切片he染色图;其中,a:对照组小鼠各器官图,b:给药组小鼠各器官图,图4a和图4b中,从左至右依次为心、肝、脾、肺、肾。
[0027]
图5:转棒实验结果图;其中,a:转棒实验示意图,b:转棒实验结果图。
[0028]
图6:旷场实验结果图;其中,a:各组小鼠转棒实验轨迹图;b:各组小鼠旷场实验中运动总距离;c:各组小鼠旷场实验中运动速度;d:各组小鼠旷场实验中不动时间百分比。
[0029]
图7:黑质致密部th染色图;其中,a:各组小鼠黑质致密部多巴胺神经元酪氨酸羟化酶染色免疫荧光图;b:各组小鼠黑质致密部多巴胺神经元th染色统计结果图。
[0030]
图8:新物体识别实验结果图;其中,a:新物体识别实验示意图,b:不同组别小鼠对于两个完全相同的物体的探索行为统计结果图,c:不同组别小鼠对于两个颜色与形状均不同的物体的探索行为统计结果图。
[0031]
图9:高架十字迷宫实验结果图;其中,a:高架十字迷宫示意图,b:不同组别小鼠统计结果图。
[0032]
图10:化合物ml-b对纹状体胆碱能神经元放电的影响;a:记录纹状体胆碱能神经元动作电位模式图,b:各组别小鼠不同注入电流强度下所产生的动作电位代表图,c:各组别小鼠不同注入电流强度下所产生的动作电位统计结果图。
[0033]
图11:化合物ml-b对纹状体msn中nmda受体活性的影响;a:在给予五个不同刺激强度下,各组别小鼠nmdar介导的epsc的代表图,b:统计结果图。
[0034]
图12:化合物ml-b对纹状体突触可塑性影响;a:记录纹状体场电位模式图;b:正常组场电位基线及给予高频刺激后fepsp记录统计结果图,c:模型组场电位基线及给予高频
刺激后fepsp记录统计结果图,d:给药组场电位基线及给予高频刺激后fepsp记录统计结果图。
具体实施方式
[0035]
下面的实施例可使本专业技术人员更全面地理解本发明,但不以任何方式限制本发明。
[0036]
实施例1
[0037]
1.1、6-羟基己基对甲苯磺酸酯的合成
[0038][0039]
将1,6-己二醇(30mmol,3.54g)、et3n(30mmol)与催化量dmap(4-二甲氨基吡啶)溶于干燥的ch2cl2(150ml)中,在0℃、搅拌下慢慢加入tscl(4-甲基磺酰氯,33mmol),室温搅拌反应4h;反应结束后,用饱和nh4cl溶液50ml激烈搅拌下淬灭反应,反应液用乙酸乙酯(3
×
50ml)萃取,乙酸乙酯萃取液用饱和食盐水洗涤后、再用无水na2so4干燥,浓缩,用乙酸乙酯:石油醚=1:1v/v稀释,析出大部分双对甲苯磺酸酯产物,过滤,滤液浓缩,进行硅胶柱层析,用pe:ea=2:1v/v作为洗脱剂,纯化得到产物(3.12g,产率38.2%),经鉴定为6-羟基己基对甲苯磺酸酯。1h nmr(400mhz,cdcl3)d:7.79(d,2h,j=8.36hz),7.35(d,2h,j=8.0),4.03(t,2h,j=6.44hz),3.60(t,2h,j=6.56hz),2.45(s,3h),1.70-1.61(m,2h),1.55-1.48(m,2h),1.38-1.27(m,4h).
[0040]
1.2、6-(3,5-二甲基金刚烷-1-基)氨基-1-己醇
[0041][0042]
将6-羟基己基对甲苯磺酸酯(11.5mmmol)、美金刚盐酸盐(9.55mmmol)与k2co3(23.8mmol)溶于dmf(50ml)中,在氮气保护下,于温度80℃下搅拌反应48h;然后蒸干溶剂,用ch2cl2(3
×
10ml)萃取,取有机层并浓缩,通过硅胶柱层析,用ch2cl2:ch3oh:33%氨水=9:1:0.15v/v/v作为洗脱剂,得到产物(1.63g,产率61.1%),经鉴定为6-(3,5-二甲基金刚烷-1-基)氨基-1-己醇。1h nmr(400mhz,cdcl3)d:3.64(t,2h,j=6.50hz),2.59(t,2h,j=7.16hz),1.60-1.46(m,6h),1.39-1.25(m,12h),1.15-1.06(m,2h),0.84(s,6h).
[0043]
1.3、6-(n-boc-n-(3,5-二甲基金刚烷-1-基))氨基-1-己醇
[0044][0045]
将6-(3,5-二甲基金刚烷-1-基)氨基-1-己醇(5.73mmol)溶于30ml thf/h2o(2/1,v/v)的溶液中,加入na2co3(14.25mmol)和(boc)2o(二碳酸二叔丁酯,8.59mmol),室温搅拌过夜;将溶剂蒸干,用水溶解并用乙酸乙酯萃取,收集乙酸乙酯萃取液,饱和食盐水洗涤后、再用无水na2so4干燥,浓缩,进行硅胶柱层析,用pe:ea=6:4v/v作为洗脱剂,得到产物(0.95g,产率43.7%),经鉴定为6-(n-boc-n-(3,5-二甲基金刚烷-1-基))氨基-1-己醇。1h nmr(400mhz,cdcl3)d:3.64(t,2h,j=6.48hz),3.22(t,2h,j=7.88hz),2.17-2.11(m,1h),1.78-1.68(m,4h),1.62-1.51(m,4h),1.50-1.43(m,11h),1.41-1.32(m,4h),1.30-1.21(m,
4h),1.17-1.07(m,2h),0.84(s,6h).
[0046]
1.4、6-(n-boc-n-(3,5-二甲基金刚烷-1-基)氨基)己基对甲苯磺酸酯
[0047][0048]
将6-(n-boc-n-(3,5-二甲基金刚烷-1-基))氨基-1-己醇0.93g(2.45mmmol)、et3n 0.68ml(4.90mmol)与催化量dmap溶于干燥的50ml ch2cl2中,在0℃、搅拌下加入tscl,室温搅拌反应3.5h;反应结束后,用饱和nh4cl水溶液淬灭反应,用乙酸乙酯(3
×
50ml)萃取,乙酸乙酯萃取液用饱和食盐水洗涤后、再用无水na2so4干燥,蒸干溶剂,进行硅胶柱层析,用pe:ea=9:1v/v作为洗脱剂,得到产物(0.717g,产率54.8%),经鉴定为6-(n-boc-n-(3,5-二甲基金刚烷-1-基)氨基)己基对甲苯磺酸酯。1h nmr(400mhz,cdcl3)d:7.78(d,2h,j=8.4hz),7.34(d,2h,j=7.84hz),4.02(t,2h,j=6.52hz),3.17(t,2h,j=8.08hz),2.45(s,3h),2.16-2.11(m,1h),1.92-1.88(m,2h),1.74-1.67(m,4h),1.67-1.60(m,2h),1.47-1.37(m,11h),1.37-1.30(m,4h),1.28-1.21(m,2h),1.21-1.15(m,2h),1.14-1.07(m,2h),0.84(s,6h).
[0049]
1.5、(6-(((s)-2-氨基-4,5,6,7-四氢苯并[d]噻唑-6-基)(丙基)氨基)己基)(3,5-二甲基金刚烷-1-基)氨基甲酸叔丁酯(pu-c6-me(boc))
[0050][0051]
在一耐压管中,将6-(n-boc-n-(3,5-二甲基金刚烷-1-基)氨基)己基对甲苯磺酸酯0.715g(1.34mmol)、普拉克索0.232g(1.12mmol)、et3n 0.31ml(2.24mmol)溶于12mlmecn(乙腈)中,氮气置换后,80℃下搅拌反应48h;蒸干溶剂,残余物进行硅胶柱层析,用ea:meoh=20:1v/v作为洗脱剂,得到产物(0.20g,产率31.3%),经鉴定为(6-(((s)-2-氨基-4,5,6,7-四氢苯并[d]噻唑-6-基)(丙基)氨基)己基)(3,5-二甲基金刚烷-1-基)氨基甲酸叔丁酯(记为pu-c6-me(boc))。1h nmr(400mhz,cdcl3)d:4.92(br,s,1h),3.25-3.17(m,2h),3.03(br,s,1h),2.73-2.38(m,7h),2.17-2.10(m,2h),2.01-1.95(m,1h),1.95-1.89(m,2h),1.78-1.67(m,5h),1.52-1.40(m,14h),1.40-1.19(m,10h),1.18-1.07(m,2h),0.88(t,3h,j=7.32hz),0.84(s,6h).
[0052]
1.6、(6s)-n
6-(6-((3,5-二甲基金刚烷-1-基)氨基)己基)-n
6-丙基-4,5,6,7-四氢苯并[d]噻唑-2,6-二胺(pu-c6-me,化合物ml-c)
[0053][0054]
在0℃下,将2.6ml浓度为4m的hcl二氧六环溶液滴入0.2g(0.35mmol)pu-6c-me(boc)中,室温搅拌2h,蒸干溶剂,用高效液相色谱进行纯化,冻干,再转化成盐酸盐,得产物0.14g,收率84.8%。1h nmr(400mhz,dmso-d6)d:10.94(s,1h),9.45(s,2h),9.04(s,2h),
3.25-2.95(m,6h),2.92-2.75(m,3h),2.74-2.56(m,2h),2.43-2.33(m,1h),2.21-2.13(m,1h),2.03-1.88(m,1h),1.84-1.63(m,8h),1.61-1.50(m,4h),1.42-1.22(m,8h),1.19-1.07(m,2h),0.92(t,3h,j=7.24hz),0.86(s,6h).mass[m h]found:473.7.
[0055]
实施例2
[0056]
2.1、4-羟基丁基对甲苯磺酸酯
[0057][0058]
从1,4-丁二醇出发,用等摩尔量的1,4-丁二醇替换1,6-己二醇,按实施例1.1的方法进行制备,用硅胶柱层析(洗脱剂为乙酸乙酯:石油醚=1:1v/v)纯化得到产物(收率26.9%),经鉴定为4-羟基丁基对甲苯磺酸酯。1h nmr(400mhz,cdcl3)d:7.79(d,2h,j=8.32hz),7.35(d,2h,j=8.08),4.06(t,2h,j=6.32hz),3.620(t,2h,j=6.24hz),2.44(s,3h),1.80-1.72(m,2h),1.64-1.56(m,2h).
[0059]
2.2、4-(3,5-二甲基金刚烷-1-基)氨基-1-丁醇
[0060][0061]
从4-羟基丁基对甲苯磺酸酯出发,用等摩尔量的4-羟基丁基对甲苯磺酸酯替换6-(3,5-二甲基金刚烷-1-基)氨基-1-己醇,按实施例1.2的方法,制备得到4-(3,5-二甲基金刚烷-1-基)氨基-1-丁醇,产率25.2%。1h nmr(400mhz,cdcl3)d:3.60(t,2h,j=5.08hz),2.72(t,2h,j=5.86hz),2.19-2.14(m,1h),1.79-1.71(m,2h),1.70-1.65(m,2h),1.65-1.61(m,2h),1.46-1.24(m,8h),1.14(s,2h),0.85(s,6h).
[0062]
2.3、4-(n-boc-n-(3,5-二甲基金刚烷-1-基))氨基-1-丁醇
[0063][0064]
从4-(3,5-二甲基金刚烷-1-基)氨基-1-丁醇出发,用等摩尔量的4-(3,5-二甲基金刚烷-1-基)氨基-1-丁醇替换6-(3,5-二甲基金刚烷-1-基)氨基-1-己醇,按实施例1.3的方法,制备得到4-(n-boc-n-(3,5-二甲基金刚烷-1-基))氨基-1-丁醇,产率35%。1h nmr(400mhz,cdcl3)d:3.71-3.63(m,2h),3.30-3.24(m,2h),2.18-2.11(m,1h),1.95-1.91(m,2h),1.76-1.71(m,4h),1.58-1.48(m,4h),1.46(s,9h),1.39-1.32(m,2h),1.29-1.23(m,2h),1.17-1.08(m,2h),0.85(s,6h).
[0065]
2.4、4-(n-boc-n-(3,5-二甲基金刚烷-1-基)氨基)丁基对甲苯磺酸酯
[0066][0067]
从实施例2.3的产物出发,用等摩尔量的4-(n-boc-n-(3,5-二甲基金刚烷-1-基))氨基-1-丁醇替换6-(n-boc-n-(3,5-二甲基金刚烷-1-基))氨基-1-己醇,按实施例1.4的方法,制备得到4-(n-boc-n-(3,5-二甲基金刚烷-1-基)氨基)丁基对甲苯磺酸酯,产率43%。1h nmr(400mhz,cdcl3)d:7.79(d,2h,j=8.28hz),7.34(d,2h,j=7.84hz),4.03(t,2h,j=6.4hz),3.23-3.17(m,2h),2.45(s,3h),2.16-2.10(m,1h),1.90-1.86(m,2h),1.74-1.65
(m,4h),1.52-1.47(m,4h),1.42(s,9h),1.37-1.29(m,4h),1.14-1.09(m,2h),0.84(s,6h).
[0068]
2.5、(4-(((s)-2-氨基-4,5,6,7-四氢苯并[d]噻唑-6-基)(丙基)氨基)丁基)(3,5-二甲基金刚烷-1-基)氨基甲酸叔丁酯(pu-c4-me(boc))
[0069][0070]
从实施例2.4的产物出发,用等摩尔量的4-(n-boc-n-(3,5-二甲基金刚烷-1-基)氨基)丁基对甲苯磺酸酯替换6-(n-boc-n-(3,5-二甲基金刚烷-1-基)氨基)己基对甲苯磺酸酯,按实施例1.5的方法,制备得到(4-(((s)-2-氨基-4,5,6,7-四氢苯并[d]噻唑-6-基)(丙基)氨基)丁基)(3,5-二甲基金刚烷-1-基)氨基甲酸叔丁酯(记为pu-c4-me(boc)),产率68.3%。1h nmr(400mhz,cdcl3)d:4.70(s,1h),3.28-3.19(m,2h),3.01(br,s,1h),2.75-2.37(m,7h),2.18-2.10(m,1h),2.01-1.87(m,3h),1.75-1.65(m,5h),1.50-1.40(m,14h),1.39-1.31(m,3h),1.28-1.22(m,4h),1.18-1.07(m,2h),0.88(t,3h,j=7.08hz),0.85(s,6h).
[0071]
2.6、(6s)-n
6-(6-((3,5-二甲基金刚烷-1-基)氨基)丁基)-n
6-丙基-4,5,6,7-四氢苯并[d]噻唑-2,6-二胺(pu-c4-me,化合物ml-a)
[0072][0073]
从实施例2.5的产物出发,用等摩尔量的pu-c4-me(boc)替换pu-c6-me(boc),按实施例1.6的方法进行制备,得到(6s)-n6-(6-((3,5-二甲基金刚烷-1-基)氨基)丁基)-n6-丙基-4,5,6,7-四氢苯并[d]噻唑-2,6-二胺(pu-c4-me,化合物ml-a),收率88%。1h nmr(400mhz,dmso-d6)d:10.96(s,1h),9.46(s,2h),9.13(s,2h),3.16-2.93(m,5h),2.89-2.77(m,3h),2.69-2.53(m,2h),2.39-2.30(m,1h),2.16-2.09(m,1h),1.97-1.79(m,3h),1.79-1.64(m,6h),1.58-1.46(m,4h),1.28-1.16(m,5h),1.15-1.02(m,2h),0.87(t,3h,j=7.12hz),0.81(s,6h).mass[m h]found:445.7.
[0074]
实施例3
[0075]
3.1、(2-羟基乙氧基)乙基对甲苯磺酸酯
[0076][0077]
从二缩乙二醇出发,用等摩尔量的二缩乙二醇替换1,6-己二醇,按实施例1.1的方法进行制备,进行硅胶柱层析(洗脱剂为乙酸乙酯:石油醚=1:1v/v)纯化得到产物,收率35%,经鉴定为(2-羟基乙氧基)乙基对甲苯磺酸酯。1h nmr(400mhz,cdcl3)d:7.81(d,2h,j=8.12hz),7.36(d,2h,j=8.24),4.22-4.18(m,2h),3.72-3.65(m,4h),3.56-3.52(m,2h).
[0078]
3.2、2-(2-(3,5-二甲基金刚烷-1-基)氨基)-乙氧基乙醇
[0079][0080]
从(2-羟基乙氧基)乙基对甲苯磺酸酯出发,用等摩尔量的(2-羟基乙氧基)乙基对甲苯磺酸酯替换6-(3,5-二甲基金刚烷-1-基)氨基-1-己醇,按实施例1.2的方法进行制备,得到2-(2-(3,5-二甲基金刚烷-1-基)氨基)-乙氧基乙醇,产率61.0%。1h nmr(400mhz,cdcl3)d:4.8(br,m,2h),3.85-3.80(m,2h),3.77-3.73(m,2h),3.71-3.66(m,2h),2.99-2.95(m,2h),2.21-2.16(m,1h),1.68-1.63(m,2h),1.49-1.37(m,4h),1.33-1.29(m,4h),1.18-1.06(m,2h),0.85(s,6h).
[0081]
3.3、2-(2-(n-boc-n-(3,5-二甲基金刚烷-1-基))氨基)乙氧基)乙醇
[0082][0083]
从实施例3.2的产物出发,用等摩尔量的2-(2-(3,5-二甲基金刚烷-1-基)氨基)-乙氧基乙醇替换6-(3,5-二甲基金刚烷-1-基)氨基-1-己醇,按实施例1.3的方法进行制备,得到2-(2-(n-boc-n-(3,5-二甲基金刚烷-1-基))氨基)乙氧基)乙醇,产率43%。1h nmr(400mhz,cdcl3)d:3.73(t,2h,j=4.48hz),3.57(t,2h,j=4.36hz),3.51-3.48(m,4h),2.18-2.11(m,1h),1.95-1.91(m,2h),1.73(s,4h),1.46(s,9h),1.38-1.31(m,2h),1.28-1.22(m,2h),1.14-1.10(m,2h),0.85(s,6h).
[0084]
3.4、2-(2-(n-boc-n-(3,5-二甲基金刚烷-1-基))氨基)乙氧基)乙基对甲苯磺酸酯
[0085][0086]
从实施例3.3的产物出发,用等摩尔量的2-(2-(n-boc-n-(3,5-二甲基金刚烷-1-基))氨基)乙氧基)乙醇替换6-(n-boc-n-(3,5-二甲基金刚烷-1-基))氨基-1-己醇,按实施例1.4的方法进行制备,得到2-(2-(n-boc-n-(3,5-二甲基金刚烷-1-基))氨基)乙氧基)乙基对甲苯磺酸酯,产率68.3%。1h nmr(400mhz,cdcl3)d:7.80(2h,d,j=8.70hz),7.53(d,2h,j=7.84hz),4.17-4.13(m,2h),3.65-3.61(m,2h),3.42-3.38(m,4h),2.45(s,3h),2.15-2.10(m,1h),1.90-1.87(m,2h),1.74-1.67(m,4h),1.44(s,9h),1.35-1.22(m,4h),1.14-1.06(m,2h),0.83(m,6h).
[0087]
3.5、(2-(2-(((s)-2-氨基-4,5,6,7-四氢苯并[d]噻唑-6-基)(丙级)氨基)乙氧基)乙基)(3,5-二甲基金刚烷-1-基)氨基甲酸叔丁酯(pu-3o-me(boc))
[0088][0089]
从实施例3.4的产物出发,用等摩尔量的2-(2-(n-boc-n-(3,5-二甲基金刚烷-1-基))氨基)乙氧基)乙基对甲苯磺酸酯替换6-(n-boc-n-(3,5-二甲基金刚烷-1-基)氨基)己基对甲苯磺酸酯,按实施例1.5的方法进行制备,得到(2-(2-(((s)-2-氨基-4,5,6,7-四氢
苯并[d]噻唑-6-基)(丙级)氨基)乙氧基)乙基)(3,5-二甲基金刚烷-1-基)氨基甲酸叔丁酯(记为pu-3o-me(boc)),产率31.6%。1h nmr(400mhz,cdcl3)d:4.80(s,2h),3.50-3.40(m,6h),3.08-2.97(m,1h),2.75-2.62(m,4h),2.60-2.45(m,4h),2.16-2.10(m,1h),2.02-1.95(m,1h),1.95-1.90(m,2h),1.77-1.68(m,5h),1.49-1.40(m,11h),1.37-1.31(m,2h),1.28-1.21(m,2h),1.16-1.06(m,2h),0.88(t,3h,j=7.28hz),0.83(s,6h).
[0090]
3.6、(6s)-n
6-(2-(2-((3,5-二甲基金刚烷-1-基)氨基)乙氧基)乙基)-n
6-丙基-4,5,6,7-四氢苯并[d]噻唑-2,6-二胺(pu-3o-me,化合物ml-b)
[0091][0092]
从实施例3.5的产物出发,用等摩尔量的pu-3o-me(boc)替换pu-c6-me(boc),按实施例1.6的方法进行制备,得到(6s)-n6-(2-(2-((3,5-二甲基金刚烷-1-基)氨基)乙氧基)乙基)-n6-丙基-4,5,6,7-四氢苯并[d]噻唑-2,6-二胺(pu-3o-me,化合物ml-b),收率90%。1h nmr(400mhz,dmso-d6)d:10.06-10.43(br,1h),9.48-9.14(m,4h),3.84-3.71(m,5h),3.57-3.27(m,6h),3.20-3.04(m,5h),2.75-2.65(m,1h),2.21-2.14(m,1h),1.92-1.76(m,4h),1.72-1.58(m,4h),1.33-1.26(m,4h),1.19-1.06(m,2h),0.92(t,3h,j=7.12hz),0.85(s,6h).mass[m h]found:461.6
[0093]
实施例4 d2受体激动作用实验
[0094]
1.试剂配制
[0095]
1.1富含蔗糖的切片液:40mmol/l nacl,4.5mmol/l kcl,1.25mmol/l nah2po4,25mmol/l nahco3,10mmol/l葡萄糖,148.5mmol/l蔗糖,1mmol/l抗坏血酸盐,3mmol/l丙酮酸钠,3mmol/l肌醇,0.5mmol/l cacl2,7mmol/l mgcl2。
[0096]
1.2人工脑脊液:125mmol/l nacl,4.5mmol/l kcl,1.25mmol/l nah2po4,2.5mmol/l cacl2,1.3mmol/l mgso4,25mmol/l nahco3,15mmol/l葡萄糖,15mmol/l蔗糖。
[0097]
1.3记录动作电位的电极内液:123mmol/l甲磺酸钾,8mmol/l nacl,15mmol/l hepes,0.2mmol/l egta,1mmol/l mgcl2·
h2o,2mmol/l mgatp,0.3mmol/l na3gtp,7mmol/l na2crpi。渗透压为290mosm,用koh调ph至7.2。
[0098]
切片液与人工脑脊液分别用于鼠脑切片与脑片孵育,电极内液用于记录细胞反应。
[0099]
2.胆碱能神经元电流诱发的动作电位的纪录
[0100]
选用chat-egfp小鼠,如图1a,采用膜片钳电流钳全细胞模式,开始记录之前,至少观察5min,保证细胞处于较为稳定状态。灌流液中加入gaba电流阻断剂(bic,10μm),钳制胆碱能神经元在-70mv,注入电流,记录300ms内电流诱发的动作电位个数。分别灌流由生理盐水(0.9%的nacl溶液)配制的不同浓度的化合物ml-b、普拉克索、化合物ml-a、化合物ml-c观察其对于动作电位个数的影响。
[0101]
3.实验结果
[0102]
结果见图1,表明,化合物ml-b浓度为50μm时,不具有d2受体激动作用,当浓度达到100μm时,化合物ml-b具有d2受体激动作用,化合物ml-b浓度在200μm时同样具有d2受体激
动作用,化合物ml-b体现出较好的剂量相关性。普拉克索(prami)浓度达到200μm时,具有d2受体激动作用;而化合物ml-a、化合物ml-c的浓度即使达到200μm,也不具有d2受体激动作用。
[0103]
实施例5 nmda受体拮抗作用实验
[0104]
1.试剂配制
[0105]
1.1富含蔗糖的切片液:40mmol/l nacl,4.5mmol/l kcl,1.25mmol/l nah2po4,25mmol/l nahco3,10mmol/l葡萄糖,148.5mmol/l蔗糖,1mmol/l抗坏血酸盐,3mmol/l丙酮酸钠,3mmol/l肌醇,0.5mmol/l cacl2,7mmol/l mgcl2。
[0106]
1.2无镁的人工脑脊液:125mmol/l nacl,4.5mmol/l kcl,1.25mmol/l nah2po4,2.5mmol/l cacl2,25mmol/l nahco3,15mmol/l葡萄糖,15mmol/l蔗糖。
[0107]
1.3记录兴奋性突触后电流的电极内液:119mmol/l csmeso4,8mmol/l teacl,15mmol/l hepes,0.6mmol/l egta,0.3mmol/l na3gtp,4mmol/l mgatp,5mmol/l qx-314.cl,7mmol/l na2crpo4。渗透压为290mosm,用csoh调ph至7.2。
[0108]
2.nmda受体介导的兴奋性突触后电流的记录
[0109]
采用膜片钳电压钳全细胞记录模式,开始记录之前,至少观察5min,保证细胞处于较为稳定状态。灌流液中加入gaba电流阻断剂(bic,10μm)、ampa受体阻断剂(cnqx,10μm),放置刺激电极,在刺激电极附近,钳制细胞在-70mv,记录nmda介导的的兴奋性突触后电流,分别灌流分别灌流由生理盐水配制的不同浓度的化合物ml-b、普拉克索、化合物ml-a、化合物ml-c,观察其对于nmda介导的兴奋性突触后电流幅度的影响。
[0110]
3实验结果
[0111]
结果见图2,表明,化合物ml-b为50μm时,不具有nmda受体拮抗作用,当浓度达到100μm时,化合物ml-b具有nmda受体的拮抗作用,化合物ml-b浓度为200μm时,同样表现出nmda受体拮抗作用,化合物ml-b体现出较好的剂量相关性。普拉克索、ml-a的浓度为200μm时,未显示明显的nmda受体拮抗作用,而浓度为200μm的化合物ml-c显示出了完全的nmda受体拮抗作用。
[0112]
结合实施例4d2受体激动作用实验结果可知,化合物ml-b同时具有nmda受体拮抗作用和d2受体激动作用。
[0113]
实施例6化合物ml-b在血浆内和脑匀浆内浓度测量实验
[0114]
1.溶液配制
[0115]
1.1化合物标准溶液的配制:精确称取化合物ml-b2.0 mg于10ml容量瓶中,用甲醇溶解定容,配制成浓度0.2mg/ml的标准溶液,4℃保存。
[0116]
1.2内标的配制:精确称取4.15mg氟西汀于10ml容量瓶中,用甲醇溶解定容,配制成浓度415g/ml的标准溶液。取0.1ml标准溶液于10ml容量瓶,用甲醇定容,配制成浓度4.15g/ml的标准溶液作为内标。
[0117]
1.3给药溶液的配制:精确称取化合物ml-b4.8 mg,加19.2ml生理盐水溶解。
[0118]
2.检测条件:
[0119]
安捷伦1200系列液相系统,使用sunfire预处理c
18
柱(4.6mm
×
250mm),流动相为0.1%甲酸水(流动相a):甲醇(流动相b)=80:20,v/v),流速为0.25ml/min。
[0120]
3.血浆预处理
[0121]
取空白血浆100μl置于1.5ml离心管中,加入内标10μl,再加入甲醇:乙腈=1:1v/v混合溶剂300μl沉淀蛋白,于涡旋仪上混旋1min,于离心机中12000r/min离心10min,取上清液10μl进样。
[0122]
4.标准曲线的绘制
[0123]
取空白血浆,用化合物标准溶液配制成相当于化合物ml-b血浆浓度为0.05、0.1、0.2、1、2.5、5μg/ml的标准空白血浆系列标本,按“血浆预处理”项下进行处理,按“检测条件”项进行测定。记录血浆样品和内标的色谱峰面积,以化合物ml-b浓度为横坐标,以峰面积比值(化合物和内标峰面积之比)为纵坐标,进行线性回归运算,求得线性回归方程为y=1.2182x-0.1107,r2值为0.9943,结果表明化合物ml-b在血浆中0.05~5μg/ml范围内与峰面积比值有良好的线性关系。
[0124]
5.脑组织预处理
[0125]
将小鼠迅速处死,解剖取出脑组织,用生理盐水将组织表面的血渍漂洗干净,用滤纸将组织表面水分吸干,称重,加入定量生理盐水(1g组织加入3ml生理盐水)用电动匀浆器将组织制成匀浆液,超声10min排气泡。
[0126]
取空白脑组织100μl置于1.5ml离心管中,加入内标10μl,再加入甲醇:乙腈=1:1v/v混合溶剂300μl沉淀蛋白,于涡旋仪上涡旋1min,于离心机中12000r/min离心10min,取上清10μl进样。
[0127]
6.脑匀浆标准曲线的绘制
[0128]
取空白脑组织,用化合物标准溶液配制成相当于浓度为10、50、100、200、400、600ng/g的空白样本,按照“脑组织预处理”项下进行处理,按“检测条件”项进行测定,记录脑匀浆样品和内标的色谱峰面积,以化合物浓度为横坐标,以峰面积比值为纵坐标,进行线性回归运算,求得线性回归方程为y=0.0035x 0.0191,r2值为0.9931,结果表明化合物ml-b在脑匀浆中10~600ng/g范围内与峰面积比值有良好的线性关系。
[0129]
7.小鼠腹腔给药实验
[0130]
取小鼠8-10周龄,体重20-30g,随机分到各个时间点,每个时间点2只,腹腔注射化合物ml-b(由生理盐水配制),剂量为2.5mg/kg。小鼠禁食不禁水12h,试验期间自由饮水,给药后分别于5min、10min、30min、60min、90min、180min、240min从眼眶静脉丛取血,血浆样品置于预先用肝素处理过的离心管中,随后处死小鼠,解剖取出脑组织;血浆样品于离心机中12000r/min离心10min,按照“血浆预处理”项下处理血浆样品,脑组织按“脑组织预处理”项下处理,并按照“检测条件”项下分析条件对处理后样品进行分析,用化合物ml-b和内标峰面积比值,代入相应的标准曲线,求得化合物ml-b各时间点的血浆内药物浓度和脑组织药物浓度,并绘制折线图,计算相应药代动力学参数。
[0131]
表1.化合物ml-b在血浆中药代动力学参数
[0132]
t
1/2
(min)521.78tmax(min)5cmax(ng/ml)3268.57
[0133]
结果见表1和图3,表明,化合物ml-b可通过血脑屏障发挥治疗作用。
[0134]
实施例7he染色实验
[0135]
实验步骤:取c57/b6小鼠(8~10周龄,20~30g),随机分为对照组和给药组;给药
组连续腹腔注射化合物ml-b(采用生理盐水配制成浓度0.025%的溶液)一个月,剂量为2.5mg/kg,按0.1ml/10g换算给药量;对照组连续腹腔注射生理盐水一个月,按照小鼠体重换算生理盐水量。一个月后,小鼠心脏灌注后取心、肝、脾、肺、肾,分别置于10%中性福尔马林溶液中浸泡,进行石蜡切片、he染色后,拍片。
[0136]
对照组和药物组he染色结果图见图4,对照组(图4a)和药物组(图4b)的心、肝、脾、肺、肾无明显差异,药物对于小鼠重要器官无明显毒性反应。
[0137]
实施例8
[0138]
小鼠mptp模型的建立
[0139]
1.动物:c57/b6小鼠(8-10周龄,20~30g)。维持室内温度22
±
2℃和光照(12h明暗周期),随意获取食物和水。
[0140]
2.配制1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,mptp)溶液:以生理盐水为溶剂,配制浓度为0.6%的mptp溶液,给药体积为0.05ml/10g,即给药剂量为30mg/kg。
[0141]
3.评估结果:mptp注射后,小鼠会出现流涎、弓背、四肢震颤等症状。
[0142]
4.给药方式:小鼠随机分为模型组(mptp)、给药组、阳性药组(prami)和正常组(ctrl);模型组小鼠腹腔注射浓度为0.6%的mptp溶液,给药体积为0.05ml/10g,即给药剂量30mg/kg,一小时后腹腔注射生理盐水,给药体积为0.05ml/10g,连续五天相同操作;给药组小鼠腹腔注射浓度为0.6%的mptp溶液,给药体积为0.05ml/10g,即给药剂量30mg/kg,一小时后腹腔注射等体积不同浓度的ml-b溶液(采用生理盐水配制;化合物ml-b浓度0.05%,给药剂量2.5mg/kg;化合物ml-b浓度0.02%,给药剂量1.0mg/kg;化合物ml-b浓度0.008%,给药剂量0.4mg/kg),连续五天相同操作;阳性药组小鼠腹腔注射浓度为0.6%的mptp溶液,给药体积为0.05ml/10g,即给药剂量30mg/kg,一小时后腹腔注射等体积普拉克索溶液(采用生理盐水配制,普拉克索浓度0.02%,给药剂量1mg/kg),连续五天相同操作;正常组小鼠每天注射两次生理盐水,两次给药时间相差一小时,每次给药体积为0.05ml/10g,连续五天相同操作。
[0143]
转棒实验
[0144]
实验步骤:取造模及给药结束后小鼠,如图5a,将小鼠置于转棒仪上。转棒仪设置5min内转速由5rpm/min匀速增加至40rpm/min,记录小鼠在棒时间,比较各组小鼠的在棒停留时间。
[0145]
实验结果见图5b,表明:化合物ml-b可以延长mptp模型小鼠的在棒停留时间,且化合物ml-b体现出较好的剂量相关性;与阳性药普拉克索相比,化合物ml-b改善模型组小鼠作用与其无明显差异。
[0146]
旷场实验
[0147]
实验步骤:取造模及给药结束后小鼠,置于旷场箱(40cm
×
40cm
×
40cm)中,运用行为学实验软件记录各组小鼠5min内的运动总距离、运动速度和不动时间(速度<0.2cm/s)百分比及运动轨迹。
[0148]
实验结果见图6,图6a、6b、6c、6d分别为各组小鼠转棒实验轨迹图、运动总距离、运动速度、不动时间百分比,表明:化合物ml-b可以增加mptp模型小鼠的运动总距离、运动速度,减少小鼠的不动时间百分比;与阳性药普拉克索相比,化合物ml-b改善模型组小鼠作用
与其无明显差异。
[0149]
黑质致密部多巴胺神经元免疫荧光染色实验
[0150]
实验步骤:行为学考察结束后,小鼠心脏灌注pbs溶液20ml、4%多聚甲醛溶液40ml后断头取脑,将鼠脑置于4%多聚甲醛溶液中固定过夜,次日换成30%蔗糖溶液沉糖两天,包埋剂包埋后进行厚度为20μm的黑质致密部冰冻切片,贴片,后续进行酪氨酸羟化酶(th)免疫荧光染色,采用含dapi的抗荧光淬灭的甘油封片剂封片后,10倍荧光显微镜下拍片,记录th染色阳性细胞个数。
[0151]
实验结果见图7,荧光图中暗处为背景,亮的圆点为th阳性细胞,即为多巴胺神经元,虚线框出的区域为小鼠黑质致密部。荧光图框出区域内亮的圆点越多,即多巴胺神经元数目越多。结果表明:化合物ml-b给药剂量为2.5mg/kg时,可以缓解mptp模型小鼠黑质致密度多巴胺神经元损伤,减少多巴胺神经元数目下降速度,起到神经保护作用;与普拉克索相比,化合物ml-b与其无统计学差异。
[0152]
实施例9
[0153]
新物体识别实验
[0154]
实验步骤:小鼠随机分为模型组(mptp)、给药组、阳性药组(prami)和正常组(ctrl)。模型组小鼠腹腔注射浓度为0.6%的mptp溶液,给药体积为0.05ml/10g,即给药剂量30mg/kg,一小时后腹腔注射生理盐水,给药体积为0.05ml/10g,连续五天相同操作;给药组小鼠腹腔注射浓度为0.6%的mptp溶液,给药体积为0.05ml/10g,即给药剂量30mg/kg,一小时后腹腔注射等体积的ml-b溶液(采用生理盐水配制,化合物ml-b浓度0.05%,给药剂量2.5mg/kg),连续五天相同操作;阳性药组小鼠腹腔注射浓度为0.6%的mptp溶液,给药体积为0.05ml/10g,即给药剂量30mg/kg,一小时后腹腔注射等体积阳性药普拉克索溶液(采用生理盐水配制,普拉克索浓度0.02%,给药剂量1mg/kg),连续五天相同操作;正常组小鼠每天注射两次生理盐水,两次给药时间相差一小时,每次给药体积为0.05ml/10g,连续五天相同操作。
[0155]
新物体识别实验一般分为适应期、熟悉期和测试期。在适应期时,将小鼠放置于实验箱中(40
×
40
×
40cm),让小鼠熟悉环境。适应期第二天,对小鼠进行熟悉期与测试期实验。如图8a,在熟悉期时,在实验箱内放入两个完全相同的物体,记录10min内小鼠对于两物体的探索行为;60min后,进入测试期实验,将两个完全相同的物体中的一个物体,更换为颜色与形状均不同的物体,位置不变,记录5min内小鼠对于熟悉物体(familiar)和新颖物体(novel)的探索时间进行记录,小鼠的学习记忆能力用辨别指数(discrimination index,di)来进行评价。
[0156]
实验结果见图8b、8c,表明:与模型组小鼠相比,化合物ml-b组小鼠探究新物体所用时间显著增加,表明化合物ml-b改善了mptp模型小鼠的认知功能障碍,而阳性药普拉克索对mptp模型小鼠认知功能障碍无明显改善作用。
[0157]
高架十字迷宫实验
[0158]
实验步骤:如图9a,高架十字迷宫一般包括两个相对开放臂(open arm)和两个相对闭合臂(closed arm),迷宫距离地面50cm高。在迷宫正上方安装摄像头,将小鼠放置在开放臂远离中心区的末端,面朝远离中心区,记录小鼠从开放臂到第一次进入闭合臂的时间,连续测量两次,每次间隔时间为24h。评价小鼠学习记忆的指标为两次从开放臂进入闭合臂
时间的比值(transfer latency,tl)。
[0159]
实验结果见图9b,表明:与模型组小鼠相比,化合物ml-b组小鼠第二次由开放臂进入闭合臂所用时间显著减少,表明化合物ml-b改善了mptp模型小鼠的认知功能障碍,而阳性药普拉克索对mptp模型小鼠认知功能障碍无明显改善作用。
[0160]
实施例10
[0161]
纹状体胆碱能神经元自发放电及电流诱发动作电位记录实验
[0162]
1.试剂配制
[0163]
1.1富含蔗糖的切片液:40mmol/l nacl,4.5mmol/l kcl,1.25mmol/l nah2po4,25mmol/l nahco3,10mmol/l葡萄糖,148.5mmol/l蔗糖,1mmol/l抗坏血酸盐,3mmol/l丙酮酸钠,3mmol/l肌醇,0.5mmol/l cacl2,7mmol/l mgcl2。
[0164]
1.2人工脑脊液:125mmol/l nacl,4.5mmol/l kcl,1.25mmol/l nah2po4,2.5mmol/l cacl2,1.3mmol/l mgso4,25mmol/l nahco3,15mmol/l葡萄糖,15mmol/l蔗糖。
[0165]
1.3记录动作电位及自发放电的电极内液:123mmol/l甲磺酸钾,8mmol/l nacl,15mmol/l hepes,0.2mmol/l egta,1mmol/l mgcl2·
h2o,2mmol/l mgatp,0.3mmol/l na3gtp,7mmol/l na2crpi。渗透压为290mosm,用koh调ph至7.2。
[0166]
2.胆碱能神经元自发放电及电流诱发的动作电位的纪录
[0167]
使用转棒实验与旷场实验结束后小鼠,小鼠分为:对照组(两次腹腔注射生理盐水),模型组(一次腹腔注射mptp,之后一小时腹腔注射等体积生理盐水),给药组(一次腹腔注射mptp,一小时后腹腔注射2.5mg/kg化合物ml-b)。
[0168]
如图10a,先在膜片钳电压钳细胞贴附式模式下,开始记录前,至少观察5min,保证细胞处于较为稳定状态。灌流液中加入gaba受体阻断剂(bic,10μm),钳制细胞在-65mv,在电流钳模式下,逐步注入电流,记录不同注入电流下,电流诱发动作电位的个数。
[0169]
3.实验结果
[0170]
结果见图10b、10c,表明:化合物ml-b可以降低pd模型小鼠纹状体胆碱能神经元电流诱发的动作电位个数,降低胆碱能神经元兴奋性。
[0171]
实施例11
[0172]
纹状体中棘神经元nmda受体活性检测实验
[0173]
1.试剂配制
[0174]
1.1富含蔗糖的切片液:40mmol/l nacl,4.5mmol/l kcl,1.25mmol/l nah2po4,25mmol/l nahco3,10mmol/l葡萄糖,148.5mmol/l蔗糖,1mmol/l抗坏血酸盐,3mmol/l丙酮酸钠,3mmol/l肌醇,0.5mmol/l cacl2,7mmol/l mgcl2。
[0175]
1.2无镁的人工脑脊液:125mmol/l nacl,4.5mmol/l kcl,1.25mmol/l nah2po4,2.5mmol/l cacl2,25mmol/l nahco3,15mmol/l葡萄糖,15mmol/l蔗糖。
[0176]
1.3记录兴奋性突触后电流的电极内液:119mmol/l csmeso4,8mmol/l teacl,15mmol/l hepes,0.6mmol/l egta,0.3mmol/l na3gtp,4mmol/l mgatp,5mmol/l qx-314.cl,7mmol/l na2crpo4。渗透压为290mosm,用csoh调ph至7.2。
[0177]
2.nmda受体介导的兴奋性突触后电流及nmda诱发电流的记录
[0178]
小鼠随机分为模型组(mptp)、给药组、阳性药组(prami)和正常组(ctrl),模型组小鼠腹腔注射浓度为0.6%的mptp溶液,给药体积为0.05ml/10g,即给药剂量30mg/kg,一小
时后腹腔注射生理盐水,给药体积为0.05ml/10g,连续五天相同操作;给药组小鼠腹腔注射浓度为0.6%的mptp溶液,给药体积为0.05ml/10g,即给药剂量30mg/kg,一小时后腹腔注射等体积的ml-b溶液(采用生理盐水配制,化合物ml-b浓度0.05%,给药剂量2.5mg/kg),连续五天相同操作;阳性药组小鼠腹腔注射浓度为0.6%的mptp溶液,给药体积为0.05ml/10g,即给药剂量30mg/kg,一小时后腹腔注射等体积普拉克索溶液(采用生理盐水配制,普拉克索浓度0.02%,给药剂量1mg/kg),连续五天相同操作;正常组小鼠每天注射两次生理盐水,两次给药时间相差一小时,每次给药体积为0.05ml/10g,连续五天相同操作。在转棒实验与旷场实验结束之后,分别取各组小鼠鼠脑切片,切片液与人工脑脊液用于鼠脑切片与脑片孵育,电极内液用于记录细胞反应。采用膜片钳电压钳全细胞记录模式,开始记录之前,至少观察5min,保证细胞处于较为稳定状态。灌流液中加入gaba电流阻断剂(bic,10μm),ampa受体阻断剂(cnqx,10μm),放置刺激电极,在刺激电极附近,钳制细胞在-70mv,依次给予1v、2v、3v、4v、5v五个刺激强度,记录对照组、模型组、给药组、阳性药组中nmdar介导的的兴奋性突触后电流。
[0179]
3.实验结果
[0180]
结果见图11,表明:在给予同等刺激强度下,化合物ml-b中记录的nmdar介导的的兴奋性突触后电流变化幅度,小于pd模型鼠在给予同等刺激强度下记录的nmdar介导的的兴奋性突触后电流,降低了pd模型鼠中异常的nmdar兴奋性突触传递。
[0181]
实施例12
[0182]
纹状体场电位记录实验
[0183]
1.试剂配制
[0184]
1.1富含蔗糖的切片液:40mmol/l nacl,4.5mmol/l kcl,1.25mmol/l nah2po4,25mmol/l nahco3,10mmol/l葡萄糖,148.5mmol/l蔗糖,1mmol/l抗坏血酸盐,3mmol/l丙酮酸钠,3mmol/l肌醇,0.5mmol/l cacl2,7mmol/l mgcl2。
[0185]
1.2人工脑脊液:125mmol/l nacl,4.5mmol/l kcl,1.25mmol/l nah2po4,2.5mmol/l cacl2,1.3mmol/l mgso4,25mmol/l nahco3,15mmol/l葡萄糖,15mmol/l蔗糖。
[0186]
1.3记录纹状体场电位的电极内液:1mol/l nacl。
[0187]
2.纹状体兴奋性突触后电位的记录
[0188]
小鼠随机分为模型组(mptp)、给药组和正常组(ctrl);模型组小鼠腹腔注射浓度为0.6%的mptp溶液(采用生理盐水配制),给药体积为0.05ml/10g,即给药剂量30mg/kg,一小时后腹腔注射生理盐水,给药体积为0.05ml/10g,连续五天相同操作;给药组小鼠腹腔注射浓度为0.6%的mptp溶液,给药体积为0.05ml/10g,即给药剂量30mg/kg,一小时后腹腔注射等体积的ml-b溶液(采用生理盐水配制,化合物ml-b浓度0.05%,给药剂量2.5mg/kg),连续五天相同操作;正常组小鼠每天注射两次生理盐水,两次给药时间相差一小时,每次给药体积为0.05ml/10g,连续五天相同操作。在转棒实验与旷场实验结束之后,分别取各组小鼠鼠脑切片,切片液与人工脑脊液用于鼠脑切片与脑片孵育,电极内液用于记录细胞反应。进行脑片膜片钳实验,在灌流液中加入gaba受体拮抗剂(bic,10μm),在膜片钳电流钳模式下记录,将刺激电极置于皮层,玻璃记录电极置于纹状体,记录皮层-纹状体通路的场兴奋性突触后电位(field excitatory postsynaptic potential,fepsp)。先调节刺激强度大小,使fepsp在合适的范围内。稳定记录10min基线后,给予高频刺激诱导fepsp的长时程抑制
(ltd),诱导刺激结束后持续记录45min。比较高频刺激后fepsp的幅度与基线幅度。
[0189]
3.实验结果
[0190]
结果见图12,表明:mptp模型小鼠中,给予高频刺激,皮层-纹状体通路的fepsp的幅度无明显变化,无法诱导出长时程抑制(ltd)。化合物ml-b可以恢复mptp模型小鼠中突触可塑性受损情况,改善纹状体整体输出功能。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。