1.本发明属于化学合成领域,涉及一种手性苯并环丁烯醇、其合成方法及用途。
背景技术:
2.具有手性中心的苯并环丁烯醇是一类重要的手性化合物。toshio honda在1993年首次利用不对称还原策略将环丁烯酮还原成手性环丁烯醇中间体并应用在具有手性环丁烷骨架的单萜grandisol的合成(tetrahedron:asymmetry 1993,4,1537.)。e.peter k
ü
ndig在1996年首次实现苯并环丁烯酮的不对称还原并用于扩环反应上(tetrahedron,1996,52.)。但是,基于苯并环丁酮底物的不对称还原反应未有报道。
3.手性环丁烯骨架结构是一类重要的合成砌块,可以转化为多种多样的分子结构。而且,手性环丁烯骨架结构广泛存在于天然产物与药物分子中,如用于治疗心脏疾病的市售药物盐酸伊伐布雷定以及具有潜在药物活性的麻醉药物(j.med.chem.2017,60,3618)。
4.因此,进一步发展高效的方法合成手性苯并环丁烯酮中间体具有重要的理论与现实意义。
技术实现要素:
5.本发明的目的在于提供一类手性苯并环丁烯醇及其合成方法,首先通过转移氢化方法将苯并环丁烯酮还原成手性苯并环丁烯醇,然后在铱催化下利用醇导向策略实现醇γ位碳氢键选择性硅化反应,直接构建含有季碳手性中心的环丁烯醇化合物。
6.为了达到上述目的,本发明提供了一种手性苯并环丁烯醇的合成方法,该方法是以带有取代基的苯并环丁烯酮1为原料,在钌催化剂、氢供体的共同作用下,进行不对称还原,制备具有手性中心的苯并环丁烯醇化合物,反应方程式如下:
[0007][0008]
其中,r1选自取代或未取代的c1-c20的烃基、取代或未取代的苯基、取代或未取代的芳基、取代或未取代的杂环基中的任意一种或两种以上,取代基选自碳-碳双键、碳-碳三键、酯基、羟基、酰基、酰氧基、酰胺基、卤素、羧基、氰基中的任意一种或任意两种以上;所述芳基包含邻、间、对位带有吸电子或给电子取代的苯基,所述吸电子取代基包括卤素、硝基、酯基、羧基、酰基、酰胺基、氰基中的任意一种或任意两种以上,所述给电子取代基包括烷基、烯基、苯基、烃氧基、羟基、氨基中的任意一种或任意两种以上。
[0009]
可选地,r1为取代或未取代的c1-c10的烃基,优选地,r1选自甲基,乙基,正丙基,异丙基,正丁基,正戊基,正己基,正庚基,正辛基,苯乙基,4-氯丁基,3-甲基丁基,3-氰基丙基,烯丙基中的任意一种或任意两种以上。
[0010]
可选地,所述的氢供体包含甲酸三乙胺共沸物,其用量为以带有取代基的苯并环
μ-甲氧基二铱(i),(1,5-环辛二烯)氯化铱(i)二聚体,二(环辛烯)氯化铱(i)二聚体中的任意一种或多种;所述的第一铱催化剂、第二铱催化剂的用量为以手性苯并环丁烯醇的摩尔数比例计为0.01-10%,优选为0.05-1%;所述的有机金属试剂包含有机金属锂试剂、有机金属镁试剂中的任意一种或多种;所述的有机金属试剂的用量以手性苯并环丁烯醇的摩尔数为基准为(1~5):1。
[0022]
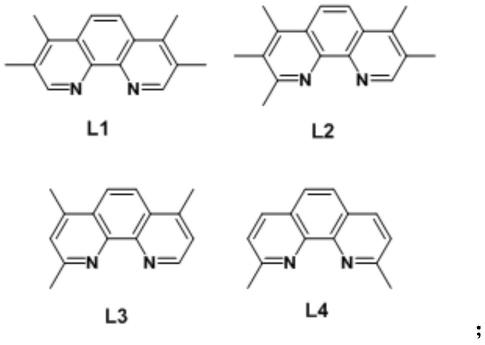
可选地,所述的菲啰啉配体包含l1,l2,l3,l4中的任意一种或多种,
[0023]
所述的氢受体为降冰片烯,环辛二烯,双环[2.2.1]-5-庚烯-2-甲酸叔丁酯(包括甲酯、乙酯、苄酯、叔丁基酯等等)中的任意一种或多种。所述的硅氢试剂包含二乙基硅烷、二甲基硅氢、二苯基硅氢、二乙氧基硅氢、二甲氧基硅氢中的任意一种或任意两种以上。
[0024]
可选地,所述的有机金属锂试剂的结构通式为r
2-li,所述的有机金属镁试剂的结构通式为r
2-mgx,x代表卤素,r2为c1~c6的烃基、苯基或芳基,所述芳基是邻、间、对位有c1~c6烃基取代的苯基。
[0025]
本发明还提供了一种手性苯并环丁烯醇产物3,其结构通式为:
[0026][0027]
其中,r1为取代或未取代的c1-c20的烃基、苯基、芳基或杂环基,取代基选自碳-碳双键、碳-碳三键、酯基、羟基、酰基、酰氧基、酰胺基、卤素、羧基、氰基;所述芳基包含邻、间、对位带有吸电子或给电子取代的苯基,所述吸电子取代基包括卤素、硝基、酯基、羧基、酰基、酰胺基、氰基,所述给电子取代基包括烷基、烯基、苯基、烃氧基、羟基、氨基;r2选自c1-c10直链烷基,c1-c10环烷基,末端带有官能团的c1-c10烷基,苯基,芳基或者杂环基。
[0028]
本发明的创新点在于,以简单易得的官能化苯并环丁烯酮为起始原料,在钌催化剂,氢供体的作用下,首次实现了一步合成具有高光学活性的苯并环丁烯醇化合物(手性醇)。并且,还可通过手性醇在铱催化下实现碳氢键活化,进而合成季碳手性苯并环丁烯醇。
[0029]
本发明的有益效果还包括:原料和试剂简单易得,制备方便;反应条件温和,操作简单;底物普适性广;官能团兼容性好;产物具有高对映选择性(85%ee~》99%ee);产物易分离纯化等。
具体实施方式
[0030]
下面将结合以下具体实施例,对本发明作进一步的详细说明。显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0031]
本发明的具体步骤主要包含:
[0032]
1)向干燥的反应管中加入钌催化剂,将反应管用橡皮塞塞好后,连接真空泵,在氩气氛围下置换氩气,依次加入一定体积的甲酸/三乙胺共沸物5:2,和反应底物苯并环丁烯酮,将反应管置于25℃或者60℃油浴中反应12-72小时;
[0033]
其中,所述有机溶剂(甲酸/三乙胺共沸物5:2)的用量为1.0-5.0ml/mmol。优选地,为1.0ml/mmol。以式(1)所示的官能化苯并环丁烯醇的用量为基准。
[0034]
2)待步骤1)反应完全后,所得混合液用硅胶短柱过滤,并用一定量体积比1:1的石油醚和乙酸乙酯洗涤后,浓缩,快速柱层析得具有手性的苯并环丁烯醇化合物;
[0035]
其中,所述一定体积的乙酸乙酯是指以式(1)所示的官能化苯并环丁烯酮的用量为基准,所述乙酸乙酯的用量为1.0-100ml/mmol。优选地,为30ml/mmol。
[0036]
3)待步骤2)得到手性苯并环丁烯醇后,向一个干燥的反应管中加入铱催化剂,连接真空泵,在氩气氛围下置换氩气,依次加入一定体积的手性苯并环丁烯醇的四氢呋喃溶液,和硅氢试剂,然后室温反应12小时,真空1小时抽干多余的四氢呋喃和硅氢试剂得到苯并环丁烯醇硅醚衍生物。
[0037]
4)待步骤3)真空除去低沸点物质后,在另一个干燥的反应管中加入铱催化剂,菲啰啉配体,连接真空泵,在氩气氛围下置换氩气,依次加入苯并环丁烯醇硅醚衍生物,四氢呋喃,氢受体。将反应管置于室温下搅拌2小时,再放入100℃油浴下反应24小时。
[0038]
5)待步骤4)反应完成后,将反应管置于-78℃下冷却并加入一定量有机金属试剂,在-78℃下反应3小时。其中,所述一定量的有机溶剂是指以步骤3)中手性苯并环丁烯醇的用量为基准,所述一定量有机金属试剂用量为1.0-5.0mmol/mmol;
[0039]
其中,所述一定量有机金属试剂用量为1.0-5.0mmol/mmol;优选地,为3mmol/mmol。
[0040]
6)待步骤5)反应完全后,向反应管中加入一定量的饱和氯化铵溶液,恢复室温,所得混合液用二氯甲烷萃取,干燥,浓缩,快速柱层析得到具有季碳手性中心的苯并环丁烯醇衍生物。
[0041]
实施本发明的过程、条件、实验方法等,除以下专门提及的内容之外,均为本领域的普遍知识和公知常识,本发明没有特别限制内容。所有实施例中所涉及的钌金属催化剂,氢受体,菲啰啉配体的具体结构式和对应编号如下所示:
[0042][0043]
实施例1
[0044][0045]
其中,mol表示摩尔,hooh表示甲酸,et3n表示三乙胺,ee表示对映异构体过量百分数。
[0046]
向一个干燥的封管中依次加入(s,s)-n-(对甲苯磺酰)-1,2-二苯乙烷二胺(对异丙基苯)氯化钌(ii)(6.2mg,10.0μmol)。将封管用橡皮塞塞好后,连接真空泵,在氩气氛围下置换氩气三次,在氩气保护氛围下,加入苯并环丁烯醇1a(0.146g,1.00mmol),甲酸三乙胺共沸物5:2(1ml)。联通氩气,搅拌24小时。将反应液通过硅胶短柱,用30ml体积比1:1石油醚乙酸乙酯冲洗,浓缩,快速柱层析(淋洗剂:石油醚(60~90℃)/乙酸乙酯=10/1)得到手性苯并环丁烯醇产物(s)-2a(0.139g,94%)固体;ee:97%(oj-h;3%i-proh in hexanes;flow rate=1.0ml/min;detection at 210nm;t1=8.2min(major);t2=20.9min(minor)23.34(c 1.3,chcl3).1h nmr(400mhz,cdcl3)δ(ppm):7.31
–
7.19(m,3h),7.13
–
7.06(m,1h),4.81(d,j=9.0hz,1h),2.18(d,j=9.1hz,1h),1.39(s,3h),1.33(s,3h).
13
c nmr(101mhz,cdcl3)δ(ppm):152.55,144.21,129.43,127.66,123.32,120.91,79.40,51.07,25.13,22.17.hrms-dart(m/z):[m nh4]
calcd.for c
10h16
on,166.1225;found,166.1226。
[0047][0048]
向一个干燥的封管中依次加入手性苯并环丁烯醇(s)-2a(81.0mg,0.500mmol)。将封管用橡皮塞塞好后,连接真空泵,在氩气氛围下置换氩气三次,在氩气保护氛围下,加入新鲜制备的二(1,5-环辛二烯)二-μ-甲氧基二铱(i)(0.166mg,0.250μmol)的四氢呋喃溶
液(0.1ml),二乙基硅烷(52.9mg,0.500mmol),四氢呋喃溶液(0.4ml)。将封管密闭好置于室温反应12小时。将封管连接真空系统,真空下将多余的四氢呋喃与二乙基硅烷抽去得到硅醚中间体(苯并环丁烯醇硅醚衍生物)。在另一个封管中加入二(环辛烯)氯化铱(i)二聚体(8.4mg,12.5μmol),l1(7.1mg,30.0μmol),将封管用橡皮塞塞好后,连接真空泵,在氩气氛围下置换氩气三次,在氩气保护氛围下,分别加入上述硅醚中间体,a(92.1mg,0.500mmol),四氢呋喃(2.0ml)。将封管密闭好置于室温反应2小时,再放入100℃油浴下反应24小时。恢复室温,置于-78℃下并加入phli(1.2m的乙醚溶液,1.25ml,1.50mmol),在-78℃下反应3小时,加入饱和氯化铵溶液(1.0ml)淬灭反应,恢复室温加入水(5.0ml),分别用二氯甲烷(10ml),二氯甲烷(10ml),二氯甲烷(5.0ml)萃取,干燥,浓缩,快速柱层析(淋洗剂:石油醚(60~90℃)/乙酸乙酯=50/1)得到手性苯并环丁烯醇产物3a(86.4mg,56%)无色液体;ee:95%(ad-h;3%i-proh in hexanes;flow rate=1.0ml/min;detection at 210nm;t1=8.1min(minor);t2=8.7min(major).(c 1.2,chcl3).1h nmr(400mhz,cdcl3)δ(ppm):7.55
–
7.45(m,2h),7.42
–
7.33(m,3h),7.21
–
7.09(m,3h),6.56(dt,j=7.0,1.2hz,1h),4.62(d,j=7.2hz,1h),2.04(d,j=8.6hz,1h),1.35(d,j=14.7hz,1h),1.37(s,3h),1.23(d,j=14.7hz,1h),1.05
–
0.91(m,10h).
13
c nmr(101mhz,cdcl3)δ(ppm):152.64,143.98,137.29,134.45,129.13,129.03,127.89,127.43,123.32,122.12,80.36,53.60,26.26,19.82,7.47,4.69,4.56.hrms-ei(m/z):[m]
calcd.for c
20h26
osi,310.1744;found,310.1747。
[0049]
实施例2
[0050][0051]
操作同实施例1。(s,s)-n-(对甲苯磺酰)-1,2-二苯乙烷二胺(对异丙基苯)氯化钌(ii)(6.2mg,10.0μmol),甲酸三乙胺共沸物5:2(1ml),1b(0.160g,1.0mmol),在室温下,反应48小时。快速柱层析(淋洗剂:石油醚(60~90℃)/乙酸乙酯=10/1)得到手性苯并环丁烯醇产物(s)-2b(0.136g,84%)白色固体;ee:95%(ic;3%i-proh in hexanes;flow rate=1.0ml/min;detection at 210nm;t1=6.3min(minor);t2=7.2min(major).(c 1.2,chcl3).1h nmr(400mhz,cdcl3)δ(ppm):7.10(d,j=7.0hz,2h),7.04
–
6.97(m,1h),4.79(d,j=9.4hz,1h),2.35(s,3h),2.01(d,j=9.4hz,1h),1.38(s,3h),1.31(s,3h).
13
c nmr(101mhz,cdcl3)δ(ppm):149.44,144.24,137.41,130.24,123.77,120.68,79.19,50.44,25.27,22.28,21.97.hrms-ei(m/z):[m]
calcd.for c
10h14
o,162.1034;found,162.1039。
[0052]
[0053]
操作同实施例1。硅醚中间体的制备使用(s)-2b(81.1mg,0.500mmol),新鲜制备的二(1,5-环辛二烯)二-μ-甲氧基二铱(i)(0.166mg,0.250μmol)的四氢呋喃溶液(0.1ml),二乙基硅烷(52.9mg,0.500mmol),四氢呋喃溶液(0.4ml),室温反应12小时后抽干。向封管中分别加入(环辛烯)氯化铱(i)二聚体(8.4mg,12.5μmol),l1(7.1mg,30.0μmol),将封管用橡皮塞塞好后,连接真空泵,在氩气氛围下置换氩气三次,在氩气保护氛围下,分别加入硅醚中间体,a(92.1mg,0.500mmol),四氢呋喃(2.0ml);与硅醚中间体100℃油浴下反应24小时。再加入phli(1.2m的乙醚溶液,1.25ml,1.50mmol)在-78℃下反应3小时。柱层析得3b(0.110g,68%)无色液体;ee:95%(ic;2%i-proh in hexanes;flow rate=0.5ml/min;detection at 210nm;t1=11.2min(major);t2=11.9min(minor).(c 1.2,chcl3).1hnmr(400mhz,cdcl3)δ(ppm):7.56
–
7.47(m,2h),7.44
–
7.32(m,3h),7.02(s,1h),6.97(d,j=7.6hz,1h),6.45(dd,j=7.6,0.9hz,1h),4.59(d,j=8.9hz,1h),2.32(s,3h),2.04(d,j=9.2hz,1h),1.35(s,3h),1.34(d,j=14.7hz,1h),1.21(d,j=14.7hz,1h),1.07
–
0.91(m,10h).
13
c nmr(101mhz,cdcl3)δ(ppm):149.58,144.01,137.36,137.14,134.46,129.96,128.97,127.85,123.74,121.91,80.14,52.93,26.34,21.88,19.90,7.48,4.68,4.60.hrms-ei(m/z):[m]
calcd.for c
21h28
osi,324.1910;found,324.1904。
[0054]
实施例3
[0055][0056]
操作同实施例1。(s,s)-n-(对甲苯磺酰)-1,2-二苯乙烷二胺(对异丙基苯)氯化钌(ii)(6.2mg,10.0μmol),甲酸三乙胺共沸物5:2(1ml),1c(0.181g,1.0mmol),在室温下,反应48小时。快速柱层析(淋洗剂:石油醚(60~90℃)/乙酸乙酯=10/1)得到手性苯并环丁烯醇产物(s)-2c(0.170g,93%)白色固体;ee:88%(ad-h;2%i-proh in hexanes;flow rate=1.0ml/min;detection at210nm;t1=14.5min(major);t2=15.4min(minor).33.03(c 1.2,chcl3).1hnmr(400mhz,cdcl3)δ(ppm):7.26
–
7.17(m,2h),7.05
–
6.97(m,1h),4.73(d,j=6.7hz,1h),3.03(d,j=7.2hz,1h),1.35(s,3h),1.29(s,3h).
13
c nmr(101mhz,cdcl3)δ(ppm):150.46,145.31,133.06,129.79,123.83,122.46,78.66,50.55,25.01,21.94.hrms-ei(m/z):[m]
calcd.for c
10h11
ocl,182.0490;found,182.0493。
[0057][0058]
操作同实施例1。硅醚中间体的制备使用(s)-2c(91.3mg,0.500mmol),新鲜制备的二(1,5-环辛二烯)二-μ-甲氧基二铱(i)(0.166mg,0.250μmol)的四氢呋喃溶液(0.1ml),二乙基硅烷(52.9mg,0.500mmol),四氢呋喃溶液(0.4ml),室温反应12小时后抽干。(环辛
烯)氯化铱(i)二聚体(8.4mg,12.5μmol),l1(7.1mg,30.0μmol),将封管用橡皮塞塞好后,连接真空泵,在氩气氛围下置换氩气三次,在氩气保护氛围下,再加入硅醚中间体、a(92.1mg,0.500mmol),四氢呋喃(2.0ml);与硅醚中间体100℃油浴下反应24小时。加入phli(1.2m的乙醚溶液,1.25ml,1.50mmol)在-78℃下反应3小时。柱层析得3c(0.106g,62%)无色液体;ee:88%(ad-h;2%i-proh in hexanes;flow rate=1.0ml/min;detection at 210nm;t1=14.5min(major);t2=15.4min(minor).33.03(c 1.2,chcl3).1h nmr(400mhz,cdcl3)δ(ppm):7.26
–
7.17(m,2h),7.05
–
6.97(m,1h),4.73(d,j=6.7hz,1h),3.03(d,j=7.2hz,1h),1.35(s,3h),1.29(s,3h).
13
c nmr(101mhz,cdcl3)δ(ppm):150.46,145.31,133.06,129.79,123.83,122.46,78.66,50.55,25.01,21.94.hrms-ei(m/z):[m]
calcd.for c
10h11
ocl,182.0490;found,182.0493。
[0059]
实施例4
[0060][0061]
操作同实施例1。(s,s)-n-(对甲苯磺酰)-1,2-二苯乙烷二胺(对异丙基苯)氯化钌(ii)(6.2mg,10.0μmol),甲酸三乙胺共沸物5:2(1ml),1d(0.164g,1.0mmol),在室温下,反应48小时。快速柱层析(淋洗剂:石油醚(60~90℃)/乙酸乙酯=10/1)得到手性苯并环丁烯醇产物(s)-2d(0.133g,93%)白色固体;ee:89%(oj-h;3%i-proh in hexanes;flow rate=1.0ml/min;detection at 210nm;t1=7.9min(major);t2=18.5min(minor)12.13(c 1.2,chcl3).1h nmr(400mhz,cdcl3)δ(ppm):7.09
–
7.01(m,1h),7.01
–
6.91(m,2h),4.77(s,1h),2.15(brs,1h),1.37(s,3h),1.31(s,3h).
13
c nmr(101mhz,cdcl3)δ(ppm):162.66(d,j=244.7hz),147.52(d,j=2.8hz),145.19(d,j=6.6hz),122.62(d,j=8.7hz),116.89(d,j=23.6hz),110.86(d,j=21.9hz),78.49(d,j=2.8hz),50.19,25.18,22.16.
19
f nmr(376mhz,cdcl3)δ(ppm):
–
112.70.hrms-ei(m/z):[m]
calcd.for c
10h11
of,166.0792;found,166.0788。
[0062][0063]
操作同实施例1。硅醚中间体的制备使用(s)-2d(83.1mg,0.500mmol),新鲜制备的二(1,5-环辛二烯)二-μ-甲氧基二铱(i)(0.166mg,0.250μmol)的四氢呋喃溶液(0.1ml),二乙基硅烷(52.9mg,0.500mmol),四氢呋喃溶液(0.4ml),室温反应12小时后抽干。将(环辛烯)氯化铱(i)二聚体(8.4mg,12.5μmol),l1(7.1mg,30.0μmol)加入到封管中,用橡皮塞塞好后,连接真空泵,在氩气氛围下置换氩气三次,在氩气保护氛围下,加入硅醚中间体,a(92.1mg,0.500mmol),四氢呋喃(2.0ml);与硅醚中间体100℃油浴下反应24小时。加入phli(1.2m的乙醚溶液,1.25ml,1.50mmol)在-78℃下反应3小时。柱层析得3d(65.0mg,40%)无
色液体;ee:85%(odh;2%i-proh in hexanes;flow rate=0.5ml/min;detection at 210nm;t1=14.7min(minor);t2=16.2min(major).(c 2.0,chcl3).1h nmr(400mhz,cdcl3)δ(ppm):δ7.52
–
7.45(m,2h),7.44
–
7.31(m,3h),6.88(dd,j=7.6,2.3hz,1h),6.79(ddd,j=10.6,8.1,2.3hz,1h),6.38(dd,j=8.1,4.5hz,1h),4.55(d,j=8.7hz,1h),2.00(d,j=9.0hz,1h),1.34(s,3h),1.31(d,j=14.7hz,1h),1.18(d,j=14.7hz,1h),1.05
–
0.88(m,10h).
13
c nmr(101mhz,cdcl3)δ(ppm):162.52(d,j=244.8hz),147.61(d,j=2.8hz),145.07(d,j=6.5hz),137.09,134.45,129.16,127.98,123.97(d,j=8.7hz),116.59(d,j=23.5hz),110.70(d,j=21.6hz),79.46(d,j=2.6hz),52.74,26.36,19.85,7.43,4.68,4.48.
19
fnmr(376mhz,cdcl3)δ(ppm):
–
112.98.hrms-dart(m/z):[m nh4]
calcd.for c
20h29
onfsi,346.1994;found,346.1997。
[0064]
实施例5
[0065][0066]
操作同实施例1。(s,s)-n-(对甲苯磺酰)-1,2-二苯乙烷二胺(对异丙基苯)氯化钌(ii)(6.2mg,10.0μmol),甲酸三乙胺共沸物5:2(1ml),1e(88.1mg,0.5mmol),在室温下,反应100小时。快速柱层析(淋洗剂:石油醚(60~90℃)/乙酸乙酯=10/1)得到手性苯并环丁烯醇产物(s)-2e(49.7mg,56%)白色固体;ee:94%oj-h;3%i-proh in hexanes;flow rate=1.0ml/min;detection at 210nm;t1=14.1min(major);t2=23.8min(minor).15.85(c 1.2,chcl3).1h nmr(400mhz,cdcl3)δ(ppm):7.17(d,j=8.0hz,1h),6.77(dd,j=8.1,2.2hz,1h),6.66(d,j=2.2hz,1h),4.73(s,1h),3.78(s,3h),2.02(brs,1h),1.37(s,3h),1.31(s,3h).
13
c nmr(101mhz,cdcl3)δ(ppm):161.06,153.74,135.83,124.76,114.59,105.93,78.58,55.38,50.37,24.99,22.09.hrms-ei(m/z):[m]
calcd.for c
11h14
o2,178.0984;found,178.0988。
[0067][0068]
操作同实施例1。硅醚中间体的制备使用(s)-2e(89.1mg,0.500mmol),新鲜制备的二(1,5-环辛二烯)二-μ-甲氧基二铱(i)(0.166mg,0.250μmol)的四氢呋喃溶液(0.1ml),二乙基硅烷(52.9mg,0.500mmol),四氢呋喃溶液(0.4ml),室温反应12小时后抽干。将(环辛烯)氯化铱(i)二聚体(8.4mg,12.5μmol),l1(7.1mg,30.0μmol)加入封管,用橡皮塞塞好后,连接真空泵,在氩气氛围下置换氩气三次,在氩气保护氛围下,分别加入硅醚中间体,a(92.1mg,0.500mmol),四氢呋喃(2.0ml),与硅醚中间体100℃油浴下反应24小时。再加入phli(1.2m的乙醚溶液,1.25ml,1.50mmol)在-78℃下反应3小时。柱层析得3e(87.7mg,52%)无色液体;ee:93%(ad-h;3%i-proh in hexanes;flow rate=1.0ml/
min;detection at 210nm;t1=10.7min(minor);t2=16.1min(major).(c 1.2,chcl3).1h nmr(400mhz,cdcl3)δ(ppm):7.57
–
7.50(m,2h),7.41
–
7.33(m,3h),7.09(d,j=8.1hz,1h),6.71(dd,j=8.1,2.2hz,1h),6.01(d,j=2.1hz,1h),4.53(d,j=9.0hz,1h),3.62(s,3h),1.96(d,j=9.2hz,1h),1.35(s,3h),1.34(d,j=14.5hz,1h),1.20(d,j=14.7hz,1h),1.10
–
0.83(m,10h).
13
c nmr(101mhz,cdcl3)δ(ppm):160.77,153.92,137.36,135.54,134.56,129.07,127.90,124.73,114.97,106.80,79.55,55.37,52.86,26.08,19.75,7.48,7.46,4.76,4.60.hrms-dart(m/z):[m h]
calcd.for c
21h29
o2si,341.1928;found,341.1931。
[0069]
实施例6
[0070][0071]
操作同实施例1。n-[(1r,2r)-1,2-二苯基-2-(2-(4-甲基苄氧基)乙基氨基)乙基]-4-甲基苯磺酰胺(氯)钌(ii)(6.5mg,10.0μmol),甲酸三乙胺共沸物5:2(1ml),1f(0.160g,0.5mmol),在室温下,反应48小时。快速柱层析(淋洗剂:石油醚(60~90℃)/乙酸乙酯=10/1)得到手性苯并环丁烯醇产物(r)-2f(0.125g,77%)白色固体;ee:98%(od-h;2%i-proh in hexanes;flow rate=0.5ml/min;detection at 210nm;t1=17.0min(minor);t2=19.4min(major).(c 1.2,chcl3).1h nmr(400mhz,cdcl3)δ(ppm):7.16(d,j=7.5hz,1h),7.06(d,j=7.5hz,1h),6.93(s,1h),4.77(d,j=9.4hz,1h),2.35(s,3h),1.99(d,j=9.5hz,1h),1.38(s,3h),1.31(s,3h).
13
c nmr(101mhz,cdcl3)δ(ppm):152.62,141.12,139.41,128.52,123.13,121.39,79.02,50.67,25.14,22.19.hrms-ei(m/z):[m]
calcd.for c
11h14
o,162.1039;found,162.1037。
[0072][0073]
操作同实施例1。硅醚中间体的制备使用(r)-2f(80.1mg,0.500mmol),新鲜制备的二(1,5-环辛二烯)二-μ-甲氧基二铱(i)(0.166mg,0.250μmol)的四氢呋喃溶液(0.1ml),二乙基硅烷(52.9mg,0.500mmol),四氢呋喃溶液(0.4ml),室温反应12小时后抽干。将(环辛烯)氯化铱(i)二聚体(8.4mg,12.5μmol),l1(7.1mg,30.0μmol)加入封管,用橡皮塞塞好后,连接真空泵,在氩气氛围下置换氩气三次,在氩气保护氛围下,分别加入硅醚中间体,a(92.1mg,0.500mmol),四氢呋喃(2.0ml);与硅醚中间体100℃油浴下反应24小时。再加入phli(1.2m的乙醚溶液,1.25ml,1.50mmol)在-78℃下反应3小时。柱层析得3f(95.1mg,59%)无色液体;ee:98%(oj-h;3%i-proh in hexanes;flow rate=1.0ml/min;detection at 210nm;t1=8.8min(major);t2=16.9min(minor).13.97(c 1.2,
chcl3).1h nmr(400mhz,cdcl3)δ(ppm):7.56
–
7.47(m,2h),7.44
–
7.31(m,3h),7.06(d,j=7.5hz,1h),6.97(d,j=7.5hz,1h),4.56(d,j=8.0hz,1h),2.19(s,3h),1.92(d,j=9.1hz,1h),1.35(s,3h),1.33(d,j=14.6hz,1h),1.17(d,j=14.6hz,1h),1.06
–
0.90(m,10h).
13
c nmr(101mhz,cdcl3)δ(ppm):152.65,140.81,138.93,137.32,134.59,129.02,128.22,127.87,123.03,122.76,80.04,53.15,26.09,22.02,19.89,7.48,7.45,4.75,4.50.hrms-dart(m/z):[m nh4]
calcd.for c
21h32
onsi,342.2244;found,342.2248。
[0074]
实施例7
[0075][0076]
操作同实施例1。n-[(1r,2r)-1,2-二苯基-2-(2-(4-甲基苄氧基)乙基氨基)乙基]-4-甲基苯磺酰胺(氯)钌(ii)(6.5mg,10.0μmol),甲酸三乙胺共沸物5:2(1ml),1g(0.252g,1.0mmol),在60℃下,反应48小时。快速柱层析(淋洗剂:石油醚(60~90℃)/乙酸乙酯=10/1)得到手性苯并环丁烯醇产物(r)-2g(0.236g,99%)白色固体;ee:99%(od-h;3%i-proh in hexanes;flow rate=1.0ml/min;detection at 210nm;t1=11.7min(major);t2=14.3min(minor).(c 1.3,chcl3).1h nmr(400mhz,cdcl3)δ(ppm):7.48
–
7.41(m,2h),7.43
–
7.34(m,2h),7.36
–
7.28(m,1h),7.23(t,j=7.8hz,1h),6.81(d,j=8.4hz,1h),6.70(d,j=7.1hz,1h),5.37(d,j=12.0hz,1h),5.26(d,j=12.0hz,1h),4.79(d,j=9.8hz,1h),2.21(d,j=9.9hz,1h),1.36(s,3h),1.34(s,3h).
13
c nmr(101mhz,cdcl3)δ(ppm):154.71,154.59,137.45,131.41,128.50,127.84,127.34,127.31,115.21,112.96,78.97,71.19,50.41,25.07,22.13.hrms-ei(m/z):[m]
calcd.for c
17h18
o2,254.1301;found,254.1302。
[0077][0078]
操作同实施例1。硅醚中间体的制备使用(r)-2g(0.127g,0.500mmol),新鲜制备的二(1,5-环辛二烯)二-μ-甲氧基二铱(i)(0.166mg,0.250μmol)的四氢呋喃溶液(0.1ml),二乙基硅烷(52.9mg,0.500mmol),四氢呋喃溶液(0.4ml),室温反应12小时后抽干。将(环辛烯)氯化铱(i)二聚体(8.4mg,12.5μmol),l1(7.1mg,30.0μmol)加入封管,用橡皮塞塞好后,连接真空泵,在氩气氛围下置换氩气三次,在氩气保护氛围下,分别加入硅醚中间体,a(92.1mg,0.500mmol),四氢呋喃(2.0ml);与硅醚中间体100℃油浴下反应24小时。phli(1.2m的乙醚溶液,1.25ml,1.50mmol)在-78℃下反应3小时。柱层析得3g(0.162g,78%)无色液体;ee:99%(od-h;3%i-proh in hexanes;flow rate=1.0ml/min;detection at 210nm;t1=9.5min(minor);t2=11.8min(major).(c 1.2,
chcl3).1h nmr(400mhz,cdcl3)δ(ppm):7.50
–
7.42(m,2h),7.45
–
7.27(m,8h),7.11(dd,j=8.3,7.2hz,1h),6.75(d,j=8.3hz,1h),6.28(d,j=7.2hz,1h),5.20(d,j=11.9hz,1h),5.14(d,j=11.9hz,1h),4.57(d,j=9.9hz,1h),2.03(d,j=9.9hz,1h),1.34(d,j=14.7hz,1h),1.34(s,3h),1.26(d,j=14.7hz,1h),1.05
–
0.88(m,10h).
13
cnmr(101mhz,cdcl3)δ(ppm):154.74,154.63,137.45,137.16,134.48,131.08,129.12,128.42,127.99,127.77,127.40,127.22,114.98,114.08,79.74,71.14,52.87,26.47,20.02,7.47,7.45,4.64,4.43.hrms-dart(m/z):[m h]
calcd.for c
27h33
o2si,417.2246;found,417.2244。
[0079]
实施例8
[0080][0081]
操作同实施例1。n-[(1r,2r)-1,2-二苯基-2-(2-(4-甲基苄氧基)乙基氨基)乙基]-4-甲基苯磺酰胺(氯)钌(ii)(6.5mg,10.0μmol),甲酸三乙胺共沸物5:2(1ml),1h(0.190g,1.0mmol),在60℃下,反应48小时。快速柱层析(淋洗剂:石油醚(60~90℃)/乙酸乙酯=10/1)得到手性苯并环丁烯醇产物(r)-2h(0.175g,91%)白色固体;ee:99%(od-h;3%i-proh in hexanes;flow rate=1.0ml/min;detection at 210nm;t1=7.2min(minor);t2=7.9min(major).(c 1.0,chcl3).1h nmr(400mhz,cdcl3)δ(ppm):6.52(s,2h),4.84(d,j=10.1hz,1h),3.96(s,3h),2.30(d,j=0.7hz,3h),2.08(d,j=10.1hz,1h),1.36(s,3h),1.32(s,3h).
13
c nmr(101mhz,cdcl3)δ(ppm):155.12,154.58,141.70,124.03,114.79,113.40,78.35,56.75,50.19,25.02,21.95,21.91.hrms-ei(m/z):[m]
calcd.for c
12h16
o2,192.1145;found,192.1139。
[0082][0083]
操作同实施例1。硅醚中间体的制备使用(r)-2h(96.1mg,0.500mmol),新鲜制备的二(1,5-环辛二烯)二-μ-甲氧基二铱(i)(0.166mg,0.250μmol)的四氢呋喃溶液(0.1ml),二乙基硅烷(52.9mg,0.500mmol),四氢呋喃溶液(0.4ml),室温反应12小时后抽干。将(环辛烯)氯化铱(i)二聚体(8.4mg,12.5μmol),l1(7.1mg,30.0μmol)加入封管,用橡皮塞塞好后,连接真空泵,在氩气氛围下置换氩气三次,在氩气保护氛围下,分别加入硅醚中间体,a(92.1mg,0.500mmol),四氢呋喃(2.0ml);与硅醚中间体100℃油浴下反应24小时。再加入phli(1.2m的乙醚溶液,1.25ml,1.50mmol)在-78℃下反应3小时。柱层析得3h(0.136g,77%)无色液体;(c 1.2,chcl3).1h nmr(400mhz,cdcl3)δ(ppm):7.55
–
7.42(m,2h),7.44
–
7.31(m,3h),6.45(s,1h),5.84(s,1h),4.62(d,j=10.0hz,1h),3.86(s,3h),2.17(s,3h),2.00(d,j=10.0hz,1h),1.34(s,3h),1.33(d,j=14.7hz,1h),1.19(d,j=14.7hz,1h),1.13
–
0.82(m,10h).
13
c nmr(101mhz,cdcl3)δ(ppm):155.27,154.63,141.43,
137.21,134.57,129.07,127.92,123.97,114.75,114.44,79.35,56.84,52.72,26.19,21.91,20.01,7.46,4.70,4.42.hrms-dart(m/z):[m h]
calcd.for c
22h31
o2si,355.2088;found,355.2088。
[0084]
实施例9
[0085][0086]
操作同实施例1。n-[(1r,2r)-1,2-二苯基-2-(2-(4-甲基苄氧基)乙基氨基)乙基]-4-甲基苯磺酰胺(氯)钌(ii)(6.5mg,10.0μmol),甲酸三乙胺共沸物5:2(1ml),1i(0.206g,1.0mmol),在60℃下,反应48小时。快速柱层析(淋洗剂:石油醚(60~90℃)/乙酸乙酯=10/1)得到手性苯并环丁烯醇产物(r)-2i(0.175g,91%)白色固体;ee:99%(ad-h;5%i-proh in hexanes;flow rate=1.0ml/min;detection at 210nm;t1=12.7min(major);t2=17.6min(minor).(c 1.2,chcl3).1h nmr(400mhz,cdcl3)δ(ppm):6.27(d,j=1.8hz,1h),6.23(d,j=1.9hz,1h),4.78(d,j=9.8hz,1h),3.94(s,3h),3.75(s,3h),2.33(d,j=9.9hz,1h),1.34(s,3h),1.30(s,3h).
13
cnmr(101mhz,cdcl3)δ(ppm):162.84,156.76,155.30,119.23,100.46,98.73,78.16,57.00,55.41,50.13,24.91,21.97.hrms-ei(m/z):[m]
calcd.for c
12h16
o3,208.1094;found,208.1088。
[0087][0088]
操作同实施例1。硅醚中间体的制备使用(r)-2i(0.104g,0.500mmol),新鲜制备的二(1,5-环辛二烯)二-μ-甲氧基二铱(i)(0.166mg,0.250μmol)的四氢呋喃溶液(0.1ml),二乙基硅烷(52.9mg,0.500mmol),四氢呋喃溶液(0.4ml),室温反应12小时后抽干。将(环辛烯)氯化铱(i)二聚体(8.4mg,12.5μmol),l1(7.1mg,30.0μmol)加入封管,用橡皮塞塞好后,连接真空泵,在氩气氛围下置换氩气三次,在氩气保护氛围下,加入硅醚中间体,a(92.1mg,0.500mmol),四氢呋喃(2.0ml);与硅醚中间体100℃油浴下反应24小时。再加入phli(1.2m的乙醚溶液,1.25ml,1.50mmol),在-78℃下反应3小时。柱层析得3i(0.153g,82%):无色液体;ee:99%(od-h;3%i-proh in hexanes;flow rate=0.5ml/min;detection at 210nm;t1=15.1min(major);t2=16.4min(minor).(c 1.25,chcl3).1h nmr(400mhz,cdcl3)δ(ppm):7.53
–
7.48(m,2h),7.41
–
7.33(m,3h),6.19(d,j=1.8hz,1h),5.74(d,j=1.9hz,1h),4.58(d,j=9.7hz,1h),3.85(s,3h),3.62(s,3h),2.02(d,j=9.9hz,1h),1.33(d,j=14.7hz,1h)1.33(s,3h),1.22(d,j=14.7hz,1h),1.06
–
0.89(m,10h).
13
c nmr(101mhz,cdcl3)δ(ppm):162.59,156.76,155.46,137.25,134.54,129.11,127.93,119.24,100.60,99.53,78.96,56.92,55.45,52.61,26.15,19.86,7.46,4.71,
4.50.hrms-dart(m/z):[m h]
calcd.for c
22h31
o3si,371.2037;found,371.2037。
[0089]
实施例10
[0090][0091]
操作同实施例1。n-[(1r,2r)-1,2-二苯基-2-(2-(4-甲基苄氧基)乙基氨基)乙基]-4-甲基苯磺酰胺(氯)钌(ii)(26.0mg,40.0μmol),甲酸三乙胺共沸物5:2(3ml),1j(0.380g,2.0mmol),在60℃下,反应48小时。快速柱层析(淋洗剂:石油醚(60~90℃)/乙酸乙酯=10/1)得到手性苯并环丁烯醇产物(r)-2j(0.379g,99%)白色固体;ee:99%(ad-h;3%i-proh in hexanes;flow rate=1.0ml/min;detection at 210nm;t1=7.3min(major);t2=9.0min(minor).(c 1.2,chcl3).1h nmr(400mhz,cdcl3)δ(ppm):7.07(d,j=7.1hz,2h),6.58(d,j=7.1hz,2h),4.88(d,j=10.5hz,1h),4.07(s,3h),2.19(d,j=10.5hz,1h),2.17(s,3h),1.37(s,3h),1.32(s,3h).
13
cnmr(101mhz,cdcl3)δ(ppm):153.84,151.95,132.48,126.03,124.79,112.23,79.18,57.57,49.89,25.29,22.23,16.75.hrms-dart(m/z):[m h]
calcd.for c
12h17
o2,193.1226;found,193.1223。
[0092][0093]
操作同实施例1。硅醚中间体的制备使用(r)-2j(96.2mg,0.500mmol),新鲜制备的二(1,5-环辛二烯)二-μ-甲氧基二铱(i)(0.166mg,0.250μmol)的四氢呋喃溶液(0.1ml),二乙基硅烷(52.9mg,0.500mmol),四氢呋喃溶液(0.4ml),室温反应12小时后抽干。将(环辛烯)氯化铱(i)二聚体(8.4mg,12.5μmol),l1(7.1mg,30.0μmol)加入封管,用橡皮塞塞好后,连接真空泵,在氩气氛围下置换氩气三次,在氩气保护氛围下,分别加入硅醚中间体,a(92.1mg,0.500mmol),四氢呋喃(2.0ml);与硅醚中间体100℃油浴下反应24小时。再加入phli(1.2m的乙醚溶液,1.25ml,1.50mmol),在-78℃下反应3小时。柱层析得3j(0.138g,78%)无色液体;ee:99%(ad-h;3%i-proh in hexanes;flow rate=1.0ml/min;detection at 210nm;t1=6.4min(major);t2=7.1min(minor).(c 1.30,chcl3).1h nmr(400mhz,cdcl3)δ(ppm):7.49
–
7.42(m,2h),7.41
–
7.30(m,3h),6.96(d,j=7.2hz,1h),6.14(d,j=7.2hz,1h),4.66(d,j=10.5hz,1h),3.94(s,3h),2.15(s,3h),1.99(d,j=10.5hz,1h),1.34(s,3h),1.32(d,j=14.6hz,1h),1.21(d,j=14.6hz,1h),1.08
–
0.84(m,10h).
13
c nmr(101mhz,cdcl3)δ(ppm):153.81,152.08,137.19,134.49,132.21,129.09,127.94,125.93,124.53,113.37,79.94,57.53,52.30,26.66,20.19,16.74,7.50,7.48,4.63,4.49.hrms-dart(m/z):[m nh4]
calcd.for c
22h34
o2nsi,372.2350;found,
372.2353。
[0094]
实施例11
[0095][0096]
操作同实施例1。n-[(1r,2r)-1,2-二苯基-2-(2-(4-甲基苄氧基)乙基氨基)乙基]-4-甲基苯磺酰胺(氯)钌(ii)(6.5mg,10.0μmol),甲酸三乙胺共沸物5:2(1ml),1k(0.206g,1.0mmol),在60℃下,反应48小时。快速柱层析(淋洗剂:石油醚(60~90℃)/乙酸乙酯=5/1)得到手性苯并环丁烯醇产物(r)-2k(0.201g,97%)白色固体;ee:99%(od-h;5%i-proh in hexanes;flow rate=1.0ml/min;detection at 210nm;t1=12.6min(major);t2=14.3min(minor)(c 1.2,chcl3).1h nmr(400mhz,cdcl3)δ(ppm):6.83(d,j=7.6hz,1h),6.61(d,j=7.6hz,1h),4.88(d,j=10.3hz,1h),4.11(s,3h),3.82(s,3h),2.20(d,j=10.5hz,1h),1.37(s,3h),1.31(s,3h).
13
cnmr(101mhz,cdcl3)δ(ppm):147.81,145.61,145.54,126.94,114.20,112.48,78.75,58.12,56.48,49.50,25.43,22.28.hrms-ei(m/z):[m]
calcd.for c
12h16
o3,208.1094;found,208.1095。
[0097][0098]
操作同实施例1。硅醚中间体的制备使用(r)-2k(0.104g,0.500mmol),新鲜制备的二(1,5-环辛二烯)二-μ-甲氧基二铱(i)(0.166mg,0.250μmol)的四氢呋喃溶液(0.1ml),二乙基硅烷(52.9mg,0.500mmol),四氢呋喃溶液(0.4ml),室温反应12小时后抽干。将(环辛烯)氯化铱(i)二聚体(8.4mg,12.5μmol),l1(7.1mg,30.0μmol)加入封管,用橡皮塞塞好后,连接真空泵,在氩气氛围下置换氩气三次,在氩气保护氛围下,分别加入硅醚中间体,a(92.1mg,0.500mmol),四氢呋喃(2.0ml);与硅醚中间体100℃油浴下反应24小时。再加入phli(1.2m的乙醚溶液,1.25ml,1.50mmol),在-78℃下反应3小时。柱层析得3k(0.154g,83%)无色液体;ee:99%(ad-h;5%i-proh in hexanes;flow rate=1.0ml/min;detection at 210nm;t1=10.3min(major);t2=7.9min(minor).(c 1.3,chcl3).1h nmr(400mhz,cdcl3)δ(ppm):7.50
–
7.42(m,2h),7.43
–
7.30(m,3h),6.71(d,j=7.8hz,1h),6.13(d,j=7.8hz,1h),4.64(d,j=10.4hz,1h),3.98(s,3h),3.80(s,3h),2.10(d,j=10.5hz,1h),1.33(s,3h),1.31(d,j=14.6hz,1h),1.21(d,j=14.6hz,1h),1.06
–
0.88(m,10h).
13
c nmr(101mhz,cdcl3)δ(ppm):147.60,145.62,145.48,137.10,134.45,129.10,127.94,126.89,113.90,113.67,79.44,58.03,56.39,51.90,26.83,20.16,7.44,4.60,4.41.hrms-dart(m/z):[m h]
calcd.for c
22h31
o3si,371.2037;found,371.2037。
[0099]
实施例12
[0100][0101]
操作同实施例1。(s,s)-n-(对甲苯磺酰)-1,2-二苯乙烷二胺(对异丙基苯)氯化钌(ii)(6.2mg,10.0μmol),甲酸三乙胺共沸物5:2(1ml),1l(0.196g,1.0mmol),在室温下,反应48小时。快速柱层析(淋洗剂:石油醚(60~90℃)/乙酸乙酯=10/1)得到手性苯并环丁烯醇产物(s)-2l(0.182g,92%)白色固体;ee:99%(ad-h;3%i-proh in hexanes;flow rate=1.0ml/min;detection at 210nm;t1=15.5min(major);t2=19.0min(minor).111.08(c 1.2,chcl3).1h nmr(400mhz,cdcl3)δ(ppm):7.90(d,j=8.7hz,1h),7.85(d,j=8.2hz,1h),7.80(d,j=8.1hz,1h),7.51(ddd,j=8.2,6.9,1.3hz,1h),7.43(ddd,j=8.2,6.8,1.3hz,1h),5.07(d,j=5.3hz,1h),2.22(d,j=6.4hz,1h),1.44(s,3h),1.40(s,3h).
13
c nmr(101mhz,cdcl3)δ(ppm):150.41,139.36,133.52,130.48,129.60,129.55,126.80,125.12,122.54,119.38,78.91,51.01,24.95,22.39.hrms-dart(m/z):[m nh4]
calcd.for c
14h18
on,216.1382;found,216.1383。
[0102][0103]
操作同实施例1。硅醚中间体的制备使用(s)-2l(99.2mg,0.500mmol),新鲜制备的二(1,5-环辛二烯)二-μ-甲氧基二铱(i)(0.166mg,0.250μmol)的四氢呋喃溶液(0.1ml),二乙基硅烷(52.9mg,0.500mmol),四氢呋喃溶液(0.4ml),室温反应12小时后抽干。将(环辛烯)氯化铱(i)二聚体(8.4mg,12.5μmol),l1(7.1mg,30.0μmol)加入封管,用橡皮塞塞好后,连接真空泵,在氩气氛围下置换氩气三次,在氩气保护氛围下,分别加入硅醚中间体,a(92.1mg,0.500mmol),四氢呋喃(2.0ml);与硅醚中间体100℃油浴下反应24小时。再加入phli(1.2m的乙醚溶液,1.25ml,1.50mmol),在-78℃下反应3小时。柱层析得3l(87.6mg,49%)无色液体;ee:93%(ad-h;3%i-proh in hexanes;flow rate=1.0ml/min;detection at 210nm;t1=13.1min(major);t2=16.2min(minor).99.88(c 1.2,chcl3).1h nmr(400mhz,cdcl3)δ(ppm):7.83(ddd,j=7.7,4.2,1.2hz,2h),7.66(d,j=8.2hz,1h),7.51
–
7.35(m,5h),7.36
–
7.27(m,2h),6.69(d,j=8.2hz,1h),4.87(d,j=9.7hz,1h),2.14(d,j=9.8hz,1h),1.44(d,j=14.7hz,1h),1.42(s,3h),1.29(d,j=14.7hz,1h),1.08
–
0.90(m,10h).
13
c nmr(101mhz,cdcl3)δ(ppm):150.45,139.29,137.24,134.46,133.29,129.97,129.67,129.33,129.05,127.92,126.59,125.10,122.64,120.59,79.77,53.58,26.09,20.26,7.49,4.70,4.54.hrms-dart(m/z):[m nh4]
calcd.for c
24h32
onsi,378.2242;found,378.2248。
[0104]
尽管本发明的内容已经通过上述优选实施例作了详细介绍,但应当认识到上述的
描述不应被认为是对本发明的限制。在本领域技术人员阅读了上述内容后,对于本发明的多种修改和替代都将是显而易见的。因此,本发明的保护范围应由所附的权利要求来限定。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。