dna甲基转移酶dnmt2在肝脏损伤修复中的作用
技术领域
1.本发明涉及dna甲基转移酶dnmt2的作用,尤其是在调控肝脏损伤修复中的作用。
背景技术:
2.1.dnmt2简介
3.生物体的遗传特征除了由基因序列决定,甲基化、磷酸化、乙酰化等也是能够改变基因遗传功能的方式。其中,甲基化是指在不改变基因序列的基础上,利用甲基转移酶将甲基从活性甲基化合物(如s-腺苷甲硫氨,sam)转移至蛋白质或核酸进行修饰,从而调节基因的表达和沉默,与癌症、衰老、老年痴呆等许多疾病密切相关,是表观遗传学的重要研究内容。
4.甲基化的的对象主要包括dna、rna、蛋白质,需要的酶也是三种不同的酶,分别是dna甲基转移酶dnmt,rna甲基转移酶(如mettl)与组蛋白甲基转移酶。其中,哺乳动物dna甲基转移酶家族主要包括dnmt1、dnmt2、dnmt3a、dnmt3b和dnmt3l,dnmt1的功能是维持dna甲基化,dnmt3的功能是参与dna的从头甲基化,dnmt2是其中最特殊的一个成员,它的dna甲基化功能一直以来都存在争议,是否能够甲基化dna还未得到确定的答案,但越来越多的研究都证明了dnmt2具有甲基化rna的功能,包括trna、micrna,最近还证明了其能够甲基化mrna。dnmt2之所以被归类为dna甲基转移酶,是由于其序列与细菌的dna甲基化转移酶具有同源性,同时还因为人类的dnmt2蛋白以及酵母的pmt1甲基转移酶结构域与细菌dna甲基转移酶结构域具有相似性。
5.1998年,okano m等人发现在小鼠和人的细胞存在一个拥有甲基转移酶功能域的基因,并且和酵母的pmt1基因具有很高的同源性,因此被命名为dnmt2。在结构上,dnmt2与dna甲基转移酶家族其它成员有所不同:dnmt基因由n末端结构域、c端催化功能域和靶结合域三个部分组成,n端结构域能够将酶靶向定位到细胞核和复制灶,但是dnmt2缺少n端结构域,保留了催化功能域和靶结合域。同时dnmt2还包含10个在原核生物和真核生物的dna甲基转移酶中保守的序列,包括一致的s-腺苷-l-蛋氨酸结合基序和活性位点pro-cys二肽,也正是因为如此,dnmt2被归入了dna甲基转移酶家族。与此同时,dnmt2也是该家族基因中最保守的成员,在几乎所有物种中都可以找到dnmt2的同源物,不过值得注意的是dnmt2缺乏确定的核酸结合位点,同时催化基序iv和其他部分催化中心的环也是无序的。
6.dnmt2存在于原核生物和真核生物中,包括植物、真菌、寄生虫、昆虫和哺乳动物的基因组中,是在长期进化筛选压力下保留下来的基因之一,主要存在于肌肉、发育中的胚胎内脏、卵巢囊肿以及增殖中的睾丸细胞中。但是,正常情况下,dnmt2蛋白的表达水平很低。在斑马鱼中,dnmt2定位于细胞质,而在果蝇中则存在于胞浆和核内,定位显示大量的dnmt2结合于核基质处。在小鼠细胞中观察dnmt2的定位,发现内源性dnmt2定位于细胞核,将gfp-dnmt2转染鼠源或人源细胞后,发现其定位在细胞质,并且分布不均匀,在许多细胞中,gfp-dnmt2会浓缩成胞质灶,且胞质灶随转染时间的延长而增加,表明了dnmt2会发生核质穿梭。值得注意的是,dnmt2的过表达会使细胞致死,在转染12h后,荧光信号会随转染时间增加而
急剧减少。还有研究显示,egfp-dnmt2在细胞分裂s期弥散分布,但在有丝分裂开始后迅速定位于细胞核,在中期和后期,egfp-dnmt2形成纺锤状结构,并在核运动期间重新定位至中心体,在随后的s期中,egfp-dnmt2会分布至整个合胞体细胞质中,直到下一个有丝分裂期开始。
7.2.dnmt2的功能
8.(1)甲基化功能
9.dnmt2蛋白是dna甲基转移酶家族中最保守的成员,但是它的作用底物的特异性以及生物功能一直以来都存在争议,目前确定的是dnmt2对rna的甲基化,但是对dna是否存在甲基化作用大家各执一词。
10.(1.1)dna甲基化作用
11.如前所述,dnmt2蛋白最初被认为是一种dna甲基化酶,尽管dnmt2与典型的dna甲基转移酶有很相似的基因序列及蛋白结构,但经多项研究发现,与其他dnmt家族成员相比,dnmt2仅表现出非常弱的体外dna甲基化活性,所以其是否具有dna甲基化功能至今为止都存在较大争议。不过另有研究表明,在果蝇细胞中过表达dnmt2蛋白会导致cpt和cpa核苷酸呈现明显的高甲基化水平,进而证明了果蝇中的dna甲基化是由甲基转移酶dnmt2介导的。同时,有研究人员在s2细胞中转染果蝇及小鼠来源的dnmt2超表达质粒及其他质粒,发现dnmt2能够甲基化共转染质粒的胞嘧啶。还已经发现人b细胞中某些基因启动子若包含cctgg或ccagg序列会被甲基化,并且提出了dnmt2可能是发挥催化作用的酶。同时,最近两项重要的研究为dnmt2具有dna甲基化作用提供了有力支持。首先是有人提出,依赖dnmt2酶的dna甲基化作用可调节胆管细菌性疾病的病原体曼氏葡萄球菌(s.mansoni)的产卵;其次是研究证明黑腹果蝇基因组的稳定性与dnmt2对转座子的甲基化作用有关。
12.有趣的是,经研究发现在一些动物物种体内,dnmt2蛋白是其唯一的dna甲基转移酶,如粟酒裂殖酵母,溶组织内阿米巴,曼氏血吸虫和黑腹果蝇等,而且在这些生物体中,dna甲基化水平非常低。总而言之,dnmt2在生物体中的内源性表达量不高,而且敲除dnmt2基因的果蝇和普通果蝇基因组甲基化水平并没有明显的差别,所以是否有明确的dna甲基化功能还需要更进一步的研究才能确定。
13.(1.2)rna的甲基化作用
14.从上世纪七十年代开始,人们逐渐发现,除dna及蛋白质外,生物体内还存在转录后甲基化修饰——rna甲基化,其作用主要是参与rna稳定性维持、rna的定位和运输、剪切,以及mrna的翻译等。其中n6-甲基腺嘌呤(m6a)修饰是最先发现的也是生物体内最常见的修饰,高达百分之八十,mrna和非编码rna是主要的m6a修饰底物,该修饰影响发育以及干细胞增殖、生理节律等生物学过程。当然,除m6a修饰外,rna甲基化修饰还存在其他方式,即5-甲基胞嘧啶(m5c)rna甲基化修饰,其在trna和rrna中高丰度稳定存在。该修饰可以在调控干细胞应激、细胞毒性应激、mrna出核及基因表达等方面发挥作用。
15.2006年,goll mg等人利用northern blot实验发现在果蝇中敲除dnmt2基因后,trna
asp
由于缺乏甲基化修饰而导致迁移率发生改变,首次验证了dnmt2对trna
asp
的甲基化功能。此外,目前已知的底物还包括trna
gly
、trna
val
、trna
glu
,其中trna
glu
仅在粟酒裂殖酵母中被dnmt2甲基化,在盘基网柄菌(d.discoideum)中,trna
glu
仅在体外被修饰,而在体内未被修饰。
16.现有研究表明,dnmt2是作用于trna反密码子环38位碱基胞嘧啶的第五位碳,即采用m5c的方式对trna进行修饰,从而稳定trna的二级结构,防止其降解。众所周知,trna是用于蛋白质合成的关键分子,trna通过反密码子识别氨基酸密码子,将其转运至多肽链进行翻译。trna甲基化修饰发生在许多碱基处,并可能影响特定的反密码子-密码子相互作用并调节翻译,从已有研究报道中所知,trna修饰改变还与线粒体疾病和癌症进展有关。若trna的c38甲基化水平降低,则其对底物氨基酸密码子正确判别的能力也会相应下降,由于氨基酸的错误掺入,进而会导致产生错误翻译或新生多肽的中止,从而触发赖氨酸泛素化、蛋白酶体活化以及错误翻译的蛋白质降解等结果,最终影响动物体的代谢活动等生命过程。所以trna的c38甲基化修饰在生物体各项生命活动中发挥不可估量的作用。
17.在机体应激条件下,dnmt2甲基化trna,保护其免受核糖核酸酶裂解,维持trna结构的完整性,从而保证机体蛋白质稳定合成。其中,raghuvaran shanmugam等人研究表明,dnmt2主要通过甲基化trna
asp
维持其稳定性,进而对含有poly-asp氨基酸序列的蛋白质翻译发挥调节作用,敲除dnmt2将会导致此类蛋白质合成减少。具有poly-asp的蛋白大多数都具有核定位,并在基因表达和转录调控中起作用的特点,所以,可以得出dnmt2介导的trna
asp
甲基化代表了一种调节含有poly-asp序列的蛋白质组的新机制。而且,除poly-asp外,氨基酸的均聚物链段在人蛋白质组中也很普遍,并且可能具有类似的调节作用,这种翻译调节途径可以参与dnmt2介导的应激反应。此外,有一项研究表明dnmt2基因敲除小鼠的蛋白质表达存在差异性,这是由于某些dnmt2依赖性修饰的trna缺少甲基化导致了特定密码子翻译错误,再次证明了trna的c38甲基化在区分近同源密码子和维持精确的多肽合成中具有十分重要的作用。已有研究表明trna的反密码子环中的几种转录后修饰对于蛋白质翻译的微调以及维持酵母和秀丽隐杆线虫的蛋白质组完整性是很重要的。核糖体谱分析显示,在dnmt2基因敲除小鼠中,dnmt2的所有目标密码子在核糖体a位点的密码子占有率均降低,这是因为缺乏dnmt2蛋白后,trna反密码子环的c38甲基化随之减少,阻碍了对近同源trna
asp-guc和trna
glu-uuc的辨别,从而降低了翻译的保真度。因此,dnmt2介导的trna的c38甲基化修饰可以保证翻译过程中密码子的正确使用,进而调控蛋白质的合成。
18.近年来,dnmt2对mrna的甲基化作用也得到广泛的关注和研究,例如研究显示,ros诱导dna损伤后,dnmt2会被募集到dna损伤位点对刚转录完成的dna-mrna杂合双链的mrna进行m5c修饰,rad52可识别m5c进而招募dna修复蛋白,进行同源重组,修复受损dna。敲除dnmt2基因则会严重损害dna修复;此外还发现dnmt2会结合一些基因mrna的3'utr、5'utr或cds区,进行m5c修饰,导致mrna表达水平的变化,如果mrna 3'utr的m5c甲基化水平降低,会导致这些基因的mrna表达上调,5'utr的m5c甲基化水平降低,则相反,会导致其mrna表达下调,若是cds区的m5c修饰减少,则可能对mrna表达量没有影响。dnmt2的作用底物也许不仅仅局限在目前已经发现的这些,还有更多未知的领域需要继续探索。
19.(1.3)甲基化作用机理
20.从结构上来看,胞嘧啶是一个电子贫乏的杂环芳香环,其c5不能轻易地对sam的甲基进行亲核攻击,所以由rna和dna甲基转移酶催化的反应涉及到了迈克尔加成反应的激活。dnmt2蛋白包含dna-胞嘧啶c5甲基转移酶催化的所有保守残基,为了进一步验证dnmt2酶对rna的作用,jurkowski等人将人源dnmt2基因中常见的rna甲基转移酶中起作用的关键位点突变,发现trna
asp
c38甲基化活性并没有发生变化,但是突变了一个具有dna甲基化作
用的位点后,dnmt2酶的甲基化活性消失,证明了dnmt2仍然是利用dna甲基化的方式发挥作用,只不过底物变成了rna。随着广泛而深入的研究,dnmt2蛋白甲基化rna的功能日益被大家所认可。
21.(2)响应机体应激作用
22.除了具有甲基化修饰作用之外,dnmt2还会和细胞应激的蛋白质相互作用,并且响应细胞应激。如前所述,dnmt2在正常情况下表达量很低,但是当机体发生应激,dnmt2表达量会大大提高,并且发生核质穿梭,即在小鼠中,dnmt2通常定位于细胞核中,但是在应激条件下,会重新定位到细胞质中。thiagarajan d等人的研究中表明,dnmt2是rna处理体或p小体(pbs)和应激颗粒(sg)的组成成分,其中,p小体是细胞质内5’—3’端mrna降解的场所,而应激颗粒会包裹未被翻译的mrna,暂停蛋白质翻译系统,当应激停止后,应激颗粒便会自动解聚,将其中包含的蛋白和rna等物质释放出来,细胞可以通过该反应及时停止多个错误的生命活动,在蛋白翻译、细胞凋亡、免疫、细胞病变等过程中发挥至关重要的作用。sg和pb均含有mrna、翻译起始因子(例如eif4e,eif3等)、mrna衰减因子(例如dcp1a,dcp2)、microrna、argonaute蛋白和维持mrna稳定和翻译的各种调节剂(例如ttp,rck/p54和cpeb),其中有些因子是dnmt2的结合蛋白。有研究显示,热应激及氧化应激条件下,dnmt2会由细胞核移向细胞质,重新定位于应激颗粒,甲基化trna保护其免受切割。此外已知核糖核酸酶在应激诱导的trna裂解中发挥着重要作用,而dnmt2对底物trna的c38处的甲基化可以抑制核糖核酸酶的降解作用,不过dnmt2的甲基化作用及其参与应激颗粒的组装之间是否存在一定的调控关系还需要进一步研究。dnmt2作为sg的组装成分之一,那它的缺失是否会导致sg参与某些应激反应的功能异常也有待探索。同时,dnmt2是催化人类细胞的细胞质和线粒体中trna的m2,2g修饰所必需的,dnmt2缺陷型细胞表现出蛋白整体翻译水平下降、细胞ros(活性氧)水平改变以及对氧化剂的超敏性,并且缺乏响应氧化应激拯救细胞翻译或细胞存活的能力,但是,该活性目前仅在体外重组的dnmt2上表现出来。
23.(3)机体发育中的作用
24.dna甲基转移酶家族在动物机体的发育中有着很重要的作用,比如缺乏dnmt1或dnmt3b的小鼠在早期胚胎发生过程中死亡,缺乏dnmt3a的小鼠在出生4周后死亡,但是大量研究结果显示,敲除dnmt2基因后,小鼠是可活的且可育的,没有明显的异常表型。不过有文章表明,在新生dnmt2基因缺陷小鼠中,软骨内骨化被延迟,同时还伴随着造血干细胞和祖细胞数量的减少以及它们所分化的细胞数量的减少。此外rai k等人还证明敲除斑马鱼胚胎中的dnmt2基因后会导致包括视网膜、肝脏和大脑等器官的分化缺陷,但是dnmt2在脊椎动物中的功能重要性仍然难以捉摸,敲除dnmt2基因的小鼠之所以没有表现出任何缺陷,一种可能的解释是:小鼠具有补偿dnmt2损失的冗余机制。近期发现,将高等真核生物中的dnmt2和第二个已知的m5c-trna-甲基转移酶nsun2双基因敲除后,小鼠会表现出细胞分化受损、蛋白质合成总体减少和早期致死性的表型。rna甲基化分析表明dnmt2和nsun2具有互补的特异性靶位点,并且在双敲除小鼠中trna的m5c修饰完全丧失,从而导致trna稳定性降低,蛋白质合成速率大大降低。不过敲除dnmt2基因后,nsun2是否能弥补dnmt2的作用还需要进一步研究。总而言之,动物机体的正常发育是不需要dnmt2酶的,但是在环境发生变化的时候,dnmt2会发挥其功能,有利于机体更好的应对应激,适应环境。
25.(4)dnmt2在各组织器官中的作用
26.(4.1)dnmt2在心脏中的作用
27.tuorto等人进行了蛋白质组学分析,确定了心血管疾病是dnmt2基因缺陷小鼠中最明显的表现。之后又有研究称,dnmt2基因缺陷小鼠会出现心脏肥大表型,证明了dnmt2是通过调节rna polii的磷酸化来限制心脏的生长和分化的:在dnmt2基因缺陷小鼠中,非编码rna rn7sk甲基化程度降低使其稳定性降低,从而容易从p-tefb复合体上解离下来进而激活该复合体,而p-tefb复合体的激活正是心脏生长的关键步骤,它可以促进心脏中的rna pol ii磷酸化,从而增加mrna和蛋白质表达,介导心脏生长。
28.(4.2)dnmt2在肝脏中的作用
29.dnmt2在脊椎动物中的功能重要性仍然难以捉摸,敲除dnmt2基因的小鼠没有表现出任何缺陷。而在dnmt2被抑制的斑马鱼体中,肝脏晚期分化的两个标志物,肝脂肪酸结合蛋白(l-fabp)和转铁蛋白-α(transferrin-α)大量减少,抑制肝脏的后期分化。之所以小鼠和果蝇的肝脏分化不受dnmt2敲除的影响,可能也是因为小鼠和果蝇具有补偿dnmt2损失的冗余机制。在果蝇中同时敲除dnmt2和nsun2,抑制体内所有的trna甲基化,最终由于分化程序受损而会影响肝脏的发育,并具有明显的发育缺陷和致死性。
30.(4.3)dnmt2在造血组织中的作用
31.如上文所述,dnmt2在小鼠的多种器官组织中表达,其中在造血器官脾脏、胸腺和成人骨髓中表达水平较低。最近有研究表明dnmt2在造血过程中发挥着非常重要的作用,通过对trna的c38位点甲基化来确保准确的多肽合成,促进造血器官中蛋白的保真性。lsk细胞代表异质性细胞群,其中包含最原始的具有自我更新能力的造血祖细胞,这些祖细胞可产生外周血中发现的所有成熟细胞类型。在8日龄的dnmt2基因敲除小鼠的骨髓中检测到lsk细胞的数量显著减少,但值得注意的是,分化的外周血细胞群体的数量却没有任何变化,并且lsk细胞的数量随年龄的增长而有所恢复。作者还验证了dnmt2是造血过程中细胞自主分化以及骨髓间充质干细胞正确分化所必需的,并且dnmt2基因敲除小鼠骨髓中trna
gly-gcc
和trna
asp-guc
片段增多,也就说明dnmt2的缺失导致这两种trna稳定性降低。同时利用dml(dimethyl-labeling analysis)分析鉴定出dnmt2基因敲除小鼠骨髓中有153种蛋白质显著失调,但是观察到相应mrna的表达水平变化却很小,这些发现表明dnmt2可以通过独立于mrna水平的机制来调节蛋白质水平。
32.(5)dnmt2在癌症中的作用
33.有报道指出,在癌症细胞系中dnmt2的表达水平是多变的,其影响癌症发生的过程机制目前还不是很清楚。与正常细胞相比,癌细胞具有更快的生长速度及更强的增殖能力,dnmt2对trna的甲基化作用能够有利于维护trna结构的稳定性以及蛋白质合成的高保真性,从而能够较好的满足癌细胞快速生长繁殖的需要。同时,有研究证明通过改变dnmt2的酶活性能够影响癌症进程,氮胞苷和去甲他滨通过抑制人癌细胞系dnmt2靶点trna
asp
的c38甲基化,会显著降低结肠癌细胞及髓系白血病细胞的代谢活性。有数据表明,在癌细胞中,trna甲基转移酶的表达水平会发生改变,在cosmic数据库中列出的数百个肿瘤样本中发现dnmt2的表达上调,同时在源自各种组织的肿瘤中发现了dnmt2的60多种体细胞突变,这些突变频繁且规则地发生。elhardt w等人比较了所发现的dnmt2基因突变的分布,观察到了某些特定残基的经常性交换,推测发生的突变会产生特定的功能效应,为了进一步研究,选择了13个突变位点,生成突变基因,然后表达并纯化突变的dnmt2蛋白,在体外利用trna asp
及trna guc
测试了蛋白的trna甲基化活性:其中有两种残基交换的突变蛋白导致其活性大大降低(g155s和l257v);另外两个突变蛋白几乎失去甲基化活性(r371h和g155v);一种体细胞癌突变(e63k)导致其活性增加了两倍,由此可知该位点突变会增加蛋白质的稳定性与活性。
34.还有研究显示dnmt2在肝癌和结直肠癌等癌症组织中表达低于正常组织,在肝细胞癌中也发现同样的趋势,有研究证明过表达dnmt2在细胞形态学上能够抑制胃癌细胞的迁移,不过目前还没有dnmt2参与癌症信号通路作用的研究。此外,据相关研究显示,具有抗炎及抗癌活性的天然化合物parthenolide可以降低由dnmt2介导的总体甲基化水平,从而恢复某些抑癌基因的表达;用于癌症光谱化学治疗的药物azacytidine也会降低由dnmt2催化的trna甲基化水平。
技术实现要素:
35.本发明通过研究dna甲基转移酶dnmt2在肝脏损伤修复或再生中所发挥的作用,从而为治疗肝脏损伤的药物研发提供新的靶点或理论基础。
36.为实现上述目的,申请人给野生型小鼠及dnmt2敲除小鼠(以下称为dko小鼠)饲喂ddc饲料,建立肝脏慢性胆汁淤积恢复模型。结果表明:经饲喂ddc饲料,小鼠肝脏均因发生胆汁淤积而呈现棕红色,且肝脏肿大,肝重比上升,而dko小鼠肝脏体积更大,肝重比也更高;血清生化分析及病理学检测均表明敲除dnmt2,导致小鼠肝脏损伤更显著;dko小鼠较野生型小鼠相比,丙氨酸氨基转移酶(alt)、谷草转氨酶(ast)含量更高,纤维化指标α-sma及col1a1表达更高;而且he染色更直观地证明了这一点,dko小鼠会有更明显的胆汁淤积;同时,通过对比普通饲料组与ddc饲料组的野生型小鼠发现,在肝脏发生损伤后,dnmt2蛋白会发生重新定位,由细胞核向细胞质转移,这也与之前证明的dnmt2在应激条件下会进行核质穿梭,重新定位到细胞质的报道相符。
37.敲除dnmt2,一方面抑制了cyclin-d1的表达,导致在肝脏修复和再生过程中细胞无法正常进入细胞周期进行增殖,另一方面阻碍了肝细胞中sox9的激活,可能会抑制肝细胞向胆管细胞的转分化。我们猜测敲除dnmt2是通过抑制肝细胞、胆管细胞的增殖以及肝细胞向胆管细胞转分化而造成更严重的肝脏损伤。
38.综上,dnmt2在动物肝脏损伤修复及再生中发挥十分重要的作用,可作为新的靶点,对肝脏损伤的治疗和药物研发具有重要意义。
39.更详尽的技术方案参见具体实施例。
附图说明
40.图1:pcr及rt-qpcr方法证明dnmt2敲除效率。
41.图2:小鼠肝脏外观及肝重比。
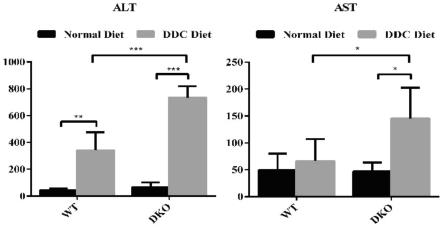
42.图3:小鼠血清alt和ast水平。
43.图4:rt-qpcr检测小鼠肝脏中纤维化指标αsma及col1a1 mrna表达量。
44.图5:小鼠肝脏he染色。
45.图6:if分析小鼠肝脏中dnmt2定位。
46.图7:rna-seq测序结果。
47.图8:rt-qpcr方法检测ki67等细胞周期相关基因表达量。
48.图9:if分析小鼠肝脏中brdu表达量。
49.图10:if分析小鼠肝脏中肝细胞增殖数量。
50.图11:if分析小鼠肝脏中胆管细胞增殖数量。
51.图12:rt-qpcr、wb方法检测sox9表达量。
52.图13:if分析小鼠肝细胞中sox9表达。
53.图中,数据以mean
±
sd进行表示。*p《0.05,**p《0.01,***p《0.001显著性使用t检验。
具体实施方式
54.下面通过具体实施例对本发明进行详细说明。
55.1.实验材料
56.1.1小鼠
57.c57bl/6j spf小鼠购自华中农业大学动物实验中心。实验单位使用许可证编号:syxk(鄂)2014-0080;
58.dnmt2-/-小鼠(c57bl/6j背景)购自赛业生物科技有限公司。
59.1.2主要试剂和试剂盒
60.ddc饲料购自南通特洛菲科技有限公司;
61.trizol及反转录试剂盒购自takara公司;
62.pcr引物由天一辉远有限公司(武汉)合成;
63.pcr master mix购自北京艾德莱生物科技有限公司产品;
64.sybr green realtime pcr master mix购自monad公司;
65.dna marker购自北京艾德莱生物科技有限公司;
66.蛋白酶k(protein k)购自美国纽英伦生物技术有限公司(neb);
67.pcr产物回收试剂盒(d6492)、胶回收试剂盒(d2500)和无内毒素质粒提取试剂盒(endo-free plasmid mini kitⅱd6943)均购自omega生物科技公司;
68.谷草转氨酶(ast/got)检测试剂盒、谷丙转氨酶(alt/gpt)检测试剂盒均购自南京建成生物工程研究所;
69.伊红染色液、苏木素染色液均购自biosharp公司;
70.ripa裂解液、5
×
sds-page蛋白上样缓冲液、bca蛋白浓度测定试剂盒及dapi均购自碧云天公司;
71.甘氨酸、trizma base、过硫酸铵、temed和吐温-20均购自sigma-aldrich公司;
72.pbs缓冲液、tbs缓冲液、显影液、定影液均购自武汉谷歌公司;
73.聚丙烯酰胺、脱脂奶粉和sds均购自biosharp公司;
74.pvdf膜购自millipore公司;
75.化学发光底物clarity enhanced chemiluminescence,ecl为advansta生物公司产品;
76.dapi购自赛默飞世尔科技(中国)有限公司;
77.抗dnmt2抗体(sc-365001)、抗β-actin抗体(sc-47778)、抗gs抗体(sc-74430)、抗
tbx3抗体(sc-166623)均购自santa cruz生物公司;
78.抗sox9抗体(et1611-56,华安生物公司产品);
79.抗hnf4α(ab41898)抗体、抗hnf4α(ab201460)、抗ck19抗体(ab197)均购自艾博抗(上海)贸易有限公司(abcam);
80.抗ki67抗体(pa5-114437,thermo fisher公司产品);
81.抗brdu抗体(gb12051,servicebio公司产品);
82.辣根过氧化物酶(hrp)标记的羊抗兔igg二抗(sa00001-1,proteintech公司产品);
83.辣根过氧化物酶(hrp)标记的羊抗鼠igg二抗(sa00001-2,proteintech公司产品);
84.羊抗兔(h l)二抗af488(a11008)、羊抗鼠(h l)二抗af555(a21424)、羊抗兔(h l)二抗af555(a21428)、羊抗鼠(h l)二抗af488(a11001)购自赛默飞世尔科技(中国)有限公司;
85.甘油、氯化钠(nacl)、乙二胺四乙酸钠(edta)、三羟甲基氨甲烷(tris)、tris平衡酚、氯仿、异戊醇、甲醇和无水乙醇均购自国药集团化学试剂有限公司;
86.20mg/ml蛋白酶k储存液:200mg蛋白酶k溶于10ml ddh2o,1.5ml分装,-20℃保存;
87.depc处理水(浓度0.01%):将0.1ml的depc加入1000ml双蒸水中,在37℃条件下充分搅拌过夜后高压灭菌备用;
88.电泳缓冲液1000ml:称取tris-base 3.02g,甘氨酸19g,sds 1g,加水定容到1000ml;
89.电转缓冲液1000ml:称取甘氨酸14.4g,tris-base 3.03g,甲醇200ml,加水定容到1000ml;
90.封闭液:脱脂奶粉5g,用100ml的1
×
tbst混匀后使用;
91.洗膜溶液tbst 2000ml:将一袋tbs缓冲液粉末溶于ddh2o,加入2ml吐温-20,调ph至7.4,最终定容到2000ml;
92.一抗稀释液:称取1g bsa,0.1g鱼皮胶,0.05gnan3,溶于pbs,定容至100ml,过滤后避光保存。
93.brdu溶液:称取50mgbrdu粉末,溶于50ml无菌pbs中,充分涡旋混匀,注意全程避光配制,-20℃避光保存。
94.组织裂解液1000ml:称取sds 5g,加热溶解,后加入tris 1.21g,nacl 5.84g,edta
·
2na 3.72g,加纯水至800ml左右,调ph至8.0,最终定容至1000ml;
95.1.3主要仪器和设备
96.凝胶成像系统(newbio indusrty产品);
97.近红外成像系统(g:box,syngene产品);
98.雪花制冰机(xueke,武汉科昊佳生物科技有限公司产品);
99.电子天平称(ax124zh/e,奥豪斯仪器有限公司产品);
100.紫外可见光分光光度计(uv-3100pc,上海美谱达仪器有限公司产品);
101.酶标仪(mk3型,赛默飞世尔科技有限公司产品);
102.磁力搅拌器(78-1,金坛市医疗器械厂产品);
103.普通pcr仪(a200,杭州朗基科学仪器有限公司产品);
104.荧光定量pcr仪(abi quantstudio3荧光定量pcr仪,美国应用生物系统公司产品);
105.微波炉(mm823ea6-ps,广东美的厨房电器制造有限公司产品);
106.室温水平摇床(sk-r1807-e,scilogex产品);
107.电泳仪及电泳槽(dyy-6c型,北京市六一仪器厂产品);
108.台式高速冷冻离心机(5404,德国eppendorf公司产品);
109.﹣20℃冰箱(dw-yl270,中科美菱产品);
110.﹣80℃超低温冰箱(dw-86l626,青岛海尔特种电器有限公司产品);
111.超净工作台(hdl apparatus,哈尔滨市东联公司产品);
112.立式自动电热压力蒸汽灭菌器(lx-b50l型,合肥华泰医疗设备有限公司产品);
113.微孔板迷你离心机(mini-p25,杭州奥盛仪器有限公司产品);
114.高通量组织研磨器(scientz-48,宁波新芝生物科技股份有限公司产品);
115.涡旋振荡器(mx-s,scilogex产品);
116.超微量分光光度计(ds-11,denovix产品);
117.载玻片(10127105p,江苏世泰试验器材有限公司产品);
118.盖玻片(10212450c,江苏世泰试验器材有限公司产品);
119.电热鼓风干燥箱(dgx-9143b-1,上海福玛实验设备有限公司产品);
120.电热恒温培养箱(dnp-9162型,上海精宏实验设备有限公司产品);
121.优普系列超纯水器(upt-11-20t,四川优普超纯有限公司产品);
122.数显恒温水浴锅(hh-6,国华电器有限公司产品);
123.移液器(plus,德国eppendorf公司产品);
124.石蜡切片机(cut 5062,德国slee公司产品);
125.倒置荧光显微镜(mf53,广州明美光电技术有限公司);
126.共聚焦显微成像系统(zeiss lsm 800)。
127.1.4应用的分析软件和生物信息学网站
128.分子生物学分析软件包括:primer 5.0、graphpad prism 5、image j等。
129.生物信息学网站:ncbi:https://www.ncbi.nlm.nih.gov
130.2.实验方法
131.2.1实验动物及饲养管理
132.2.1.1 dna抽提
133.(1)将老鼠耳朵剪下,放入破碎管中,每管添加500μl组织裂解液和10μl 20mg/ml的proteinase k,组织匀浆仪破碎;
134.(2)55℃水浴2~4h;
135.(3)每管添加250μl 5mol/l nacl,剧烈摇晃大于20次,常温最大速度离心10min;
136.(4)转移上清液到新的离心管中,加入冰冻的100%乙醇700μl,并轻轻混匀,最大转速离心5min,可见絮状沉淀;
137.(5)尽量弃净上清液,切勿吸取到dna沉淀,ep管中加入1ml 70%乙醇,上下颠倒混匀,最大转速离心5min,弃上清液;
138.(6)鼓风干燥箱烘干5~8min;
139.(7)100μl te buffer重悬,涡旋混匀;
140.(8)超微量分光光度计测定样品浓度并做好标记。
141.2.1.2 dnmt2-/-小鼠基因型鉴定
142.表1用于鉴定dnmt2-/-小鼠基因型的pcr引物
[0143][0144]
表2 pcr扩增反应体系
[0145][0146]
表3 pcr扩增反应程序
[0147][0148]
2.1.3 dna凝胶电泳和成像
[0149]
取5μl pcr扩增产物,于1.5%(含eb)的琼脂糖凝胶中电泳,以4μl dna标准分子量dl 2000 marker作为参照,150v/cm电泳,凝胶成像系统成像,若目的条带单一,则将剩余扩增产物用于pcr产物回收纯化。
[0150]
2.1.4模型构建分组
[0151]
体重相近的8周龄野生型及dnmt2-/-小鼠各10只,自由饮食和饮水,适应性饲喂7天。7天后,将小鼠各分为2组,每组5只,分别饲喂对照饲料及0.1%ddc饲料,每天记录小鼠体重变化,实验动物分组见表4:
[0152]
表4实验动物分组
[0153][0154]
2.2 rna提取、cdna制备及rt-qpcr
[0155]
2.2.1 rna提取
[0156]
(1)从﹣80℃冰箱中取出适宜大小的小鼠肝脏组织置于无酶ep管中,每管加入1mltrizol试剂,机械匀浆器匀浆,加入0.2ml氯仿,用力震荡15sec,静置2min;
[0157]
(2)4℃,12000rpm/min,离心15min,取上清(注意不要取到中间蛋白层);
[0158]
(3)加入0.5ml异丙醇,将管中的液体轻轻混匀,室温静置10min;
[0159]
(4)4℃,12000rpm/min,离心10min,弃上清;
[0160]
(5)加入1ml 75%乙醇(depc水配制),轻轻洗涤沉淀;
[0161]
(6)4℃,7500rpm/min,离心5min,弃上清;
[0162]
(7)沉淀自然晾至将干未干,加入适当的depc水溶解;
[0163]
(8)取少许检测rna纯度(od260/280)及完整性,记录rna浓度,于-80℃保存备用。
[0164]
2.2.2反转录
[0165]
以提取的rna为模板,进行反转录
[0166]
表5反转录反应体系
[0167][0168][0169]
2.2.3荧光定量pcr
[0170]
以获得的cdna为模板进行real-time pcr扩增
[0171]
表6 real-time pcr反应体系
[0172][0173]
表7基因扩增引物
[0174][0175]
每个样品中检测基因的相对mrna表达水平可以用以下公式计算:相对mrna表达=2
‑△
ct
。
[0176]
2.3western blot
[0177]
2.3.1总蛋白提取
[0178]
从﹣80℃冰箱中取出冻存肝脏组织,用电子天平称量100mg,每管加入1ml ripa裂解液,机械匀浆器均浆,12000rpm/min 4℃离心5min,吸取上清,﹣80℃保存备用。
[0179]
2.3.2测量蛋白浓度
[0180]
按照碧云天bca蛋白浓度测定试剂盒说明书进行,具体步骤如下:
[0181]
(1)根据样品数量,按50体积bca试剂a加1体积bca试剂b,配制适量bca工作液,充分混匀。bca工作液室温24h内稳定;
[0182]
(2)完全溶解蛋白标准品,取10μl稀释至100μl,致使终浓度为0.5mg/ml,用ripa蛋白裂解液稀释标准品;
[0183]
(3)将标准品按0μl、1μl、2μl、4μl、8μl、12μl、16μl、20μl,加到96孔板的标准品孔中,用ripa蛋白裂解液补足20μl;
[0184]
(4)加适量样品到96孔板的样品孔中,用ripa蛋白裂解液补足20μl;
[0185]
(5)各孔中加入200μl bca工作液,37℃放置30min;
[0186]
(6)用酶标仪测定a562 nm的波长,根据标准曲线计算出蛋白浓度,配制适宜浓度的蛋白样品。
[0187]
2.3.3 western blot
[0188]
(1)配胶:按照说明书制备8%分离胶和5%浓缩胶;
[0189]
(2)倒胶:夹好灌制聚丙烯酰胺凝胶的玻璃板,将制好的8%的sds丙烯酰胺分离胶约5ml迅速灌入两块玻璃板的间隙中,留出灌注浓缩胶所需空间,在分离胶上缓慢均匀加入一层无水乙醇,置室温聚合30min,分离胶聚合后,倾出覆盖层液体,用吸水纸吸净残留液体,再将制好的5%浓缩胶灌入分离胶上层,立即插入梳子,置37℃聚合30min,待浓缩胶全部聚合后移出梳子,固定于电泳装置;
[0190]
(3)电泳:在电泳装置中加入适量1
×
tris-甘氨酸电泳缓冲液,胶孔中加入等量蛋白样品。接通电源,调至电压200v,5min,将样品压到同一水平线后电压110v进行电泳,待溴酚蓝指示剂跑到分离胶底部(约需2h)时断电,结束电泳;
[0191]
(4)转膜:电泳结束后,取sds-page凝胶,依据目的蛋白分子量与marker蛋白分离条带,切下含目的蛋白的胶,利用bio-rad公司的mini trans-blot electrophoretic cell转印装置,制备转膜夹、海绵、滤纸、胶、pvdf膜“三明治”转膜装置,在转膜槽中加入1l 1
×
转膜液,在冰水混合物的环境下200ma恒流,转膜2h;
[0192]
(3)配制5%脱脂奶粉封闭液,pvdf膜正放浸入封闭液,摇床室温孵育2h;
[0193]
(4)一抗与靶蛋白结合:将pvdf膜用tbst清洗一遍后,加入一抗溶液,放置于摇床上,4℃孵育过夜;
[0194]
(5)1
×
tbst洗膜3次,每次5min;
[0195]
(6)二抗与靶蛋白结合:加入用封闭液稀释的相应属性的二抗溶液,放置于摇床上,室温孵育90min;
[0196]
(7)1
×
tbst洗膜3次,每次5min;
[0197]
(8)显色:将pvdf膜放入化学发光底物ecl(a液和b液等量混合)溶液中进行避光显色,近红外成像系统成像。
[0198]
2.4组织形态学检测
[0199]
2.4.1取材、脱水浸蜡、包埋及切片
[0200]
(1)取材:麻醉小鼠,取血后,立即解剖,小心取出肝脏,切取组织时应使用锋利的刀、剪,从刀的根部开始向后拉动切开组织;
[0201]
(2)固定:将所取组织在10%中性福尔马林中固定1~2d,厚度约0.2cm~0.3cm,大小为1.5cm
×
1.5cm
×
0.3cm为宜;
[0202]
(3)洗涤:自来水冲洗组织块过夜;
[0203]
(4)脱水:次日将冲洗好的组织于50%乙醇、70%乙醇、80%乙醇各2h,90%乙醇、95%乙醇各1h,无水乙醇ⅰ及无水乙醇ⅱ分别30min;
[0204]
(5)透明:将脱水好的组织块置于二甲苯与乙醇混合液(1:1)中30min,二甲苯ⅰ3min,二甲苯ⅱ9min,透明好的组织块应该呈现棕黄色透明态;
[0205]
(6)浸蜡:将透明好的组织块在二甲苯和石蜡混合液(1:1)中浸蜡30min;石蜡ⅰ中
40min,石蜡ⅱ中1h;
[0206]
(7)包埋和蜡块的修整:将包埋盒在温箱中预热,溶解好的蜡倒入包埋盒中,然后将组织块轻轻放入,应避免产生气泡;
[0207]
(8)切片:切片前将包埋好的组织样本置于冰上冷冻数分钟,待组织达适当硬度即可切片,切片厚度最好为3~5μm,
[0208]
(9)展片、烤片:42℃水浴展片,捞片,将切片小心贴附于载玻片上,贴平粘紧,及时烤片。
[0209]
2.4.2 h&e染色
[0210]
(1)石蜡切片常规脱蜡(依次将切片放入二甲苯ⅰ15min、二甲苯ⅱ15min及无水乙醇ⅰ、无水乙醇ⅱ、85%酒精、75%酒精各5min);
[0211]
(2)蒸馏水冲洗5min;
[0212]
(3)抗原修复(ph 9.0tris-edta高压修复),微波炉中中火7min,停8min,中低火8min;
[0213]
(4)苏木素染液染色2min;
[0214]
(5)流水洗去苏木素染液5min;
[0215]
(6)1%盐酸酒精分化1~3s;
[0216]
(7)水洗1~2s;
[0217]
(8)氨水返蓝5~10s;
[0218]
(9)流水冲洗2min;
[0219]
(10)0.5%伊红液染色2~3min;
[0220]
(11)蒸馏水洗1~2s;
[0221]
(12)脱水:80%乙醇3min,95%乙醇3min;无水乙醇5min,二甲苯ⅰ5min,二甲苯ⅱ5min;
[0222]
(13)晾干后中性树胶封片;
[0223]
(14)镜检。
[0224]
2.4.3石蜡切片免疫荧光
[0225]
(1)石蜡切片常规脱蜡(依次将切片放入二甲苯ⅰ15min、二甲苯ⅱ15min及无水乙醇ⅰ、无水乙醇ⅱ、85%酒精、75%酒精各5min);
[0226]
(2)蒸馏水冲洗5min;
[0227]
(3)抗原修复(ph 9.0tris-edta高压修复),微波炉中中火7min,停8min,中低火8min;
[0228]
(4)将切片置于染色缸中用pbs清洗3次,每次5min;
[0229]
(5)甩干后用组化笔在组织周围画圈,在避光条件下用自发荧光淬灭剂孵育5min,流水冲洗5min;
[0230]
(6)切片滴加组织自发荧光淬灭剂b液室温5min,流水冲洗3min;
[0231]
(7)bsa封闭:滴加5%bsa均匀覆盖组织,37℃封闭30min;
[0232]
(8)一抗孵育:轻轻甩掉封闭液,在切片上滴加按一定比例配好的一抗溶液,切片平放于湿盒内4℃孵育过夜(湿盒内加少量水以防止抗体蒸发);
[0233]
(9)切片置于pbs(ph7.4)中,在脱色摇床上晃动洗涤3次,每次5min;
[0234]
(10)切片稍甩干后在圈内滴加与一抗相应种属的足量荧光二抗,避光室温孵育1h;
[0235]
(11)切片置于pbs(ph7.4)中,在脱色摇床上晃动洗涤3次,每次5min;
[0236]
(12)切片稍甩干后在圈内滴加dapi,避光室温孵育5min后封片;
[0237]
(13)镜检。
[0238]
2.5血清alt检测
[0239]
样本前处理:血清(浆)及其他液体样本测定,取样直接检测,若检测指标超出试剂盒的检测范围,可对样本进行适当的稀释;
[0240]
操作流程如表8:
[0241]
表8 alt检测标准流程
[0242][0243]
轻轻水平摇动96孔板混匀,室温放置15min,波长510nm,酶标仪测定各孔od值,(绝对od=测定孔od值-对照孔od值),根据标准曲线,求得相应的alt活力单位,若样品测定前有进行稀释处理,需要根据稀释倍数进行换算。
[0244]
2.6血清ast检测
[0245]
样本前处理:血清(浆)及其他液体样本测定,取样直接检测,若检测指标超出试剂盒的检测范围,可对样本进行适当的稀释;
[0246]
操作流程如表9:
[0247]
表9 ast检测标准流程
[0248][0249][0250]
轻轻水平摇动96孔板混匀,室温放置15min,波长510nm,酶标仪测定各孔od值,(绝对od=测定孔od值-对照孔od值),根据标准曲线,求得相应的ast活力单位,若样品测定前有进行稀释处理,需要根据稀释倍数进行换算。
[0251]
2.7小鼠肝脏样品采集
[0252]
首先将小鼠称重,腹腔注射适量三溴乙醇麻醉小鼠,待小鼠麻醉完全后,采用眼球采血的方法收集其血液,用于后续血清学检测。随后将小鼠四肢固定于手术台,用酒精棉球擦拭小鼠腹部,沿小鼠腹中线将其腹部打开,暴露腹腔。之后找到肝脏,将肝脏上方静脉剪断,沿膈膜分离肝脏,将所有肝叶取下,并分别用于提取rna、蛋白以及4%多聚甲醛固定。
[0253]
3.结果分析
[0254]
已有报道称在斑马鱼体内敲除dnmt2,会在其肝脏发育过程中抑制后期分化,但是在小鼠体内并不存在这种情况,目前还没有发现敲除dnmt2基因会对小鼠肝脏的发育造成影响,同时还知道dnmt2能够在机体应激情况下发挥重要作用,可以提高细胞在不利条件下的生存能力,所以为了了解dnmt2在是否在小鼠肝脏的损伤修复或再生中具有一定作用,我们给野生型小鼠及dnmt2敲除小鼠(以下称为dko小鼠)饲喂ddc(二乙基-1,4-二氢-2,4,-三甲基-3,5-吡啶二羧酸酯)饲料,饲喂两周后恢复正常饮食5天,建立肝脏慢性胆汁淤积恢复模型。我们在小鼠进食ddc饲料14天后进行采样,并在解剖取材前禁食12h,腹腔注射brdu(10mg/ml,10ul/g),采样前每2h一次,注射4次。dko小鼠基因敲除效率通过dna基因型鉴定及敲除序列荧光定量方法检测证明(图1)。经饲喂ddc饲料,小鼠肝脏均因发生胆汁淤积而呈现棕红色,且肝脏肿大,肝重比上升,dko小鼠肝脏体积更大,肝重比也更高(图2)。血清生化分析及病理学检测均表明敲除dnmt2,导致小鼠肝脏损伤更显著,dko小鼠较野生型小鼠相比,丙氨酸氨基转移酶(alt)、谷草转氨酶(ast)含量更高(图3);纤维化指标α-sma及col1a1表达更高(图4);而且he染色更直观地证明了这一点,dko小鼠会有更明显的胆汁淤积(图5)。同时,通过对比普通饲料组与ddc饲料组的野生型小鼠发现,在肝脏发生损伤后,dnmt2蛋白会发生重新定位,由细胞核向细胞质转移(图6),这也与之前证明dnmt2在应激条件下会进行核质穿梭,重新定位到细胞质的报道相符。由此,我们可以得出一个结论,dnmt2在肝脏损伤修复及再生中发挥十分重要的作用。
[0255]
众所周知,肝细胞是一种暂不增殖的细胞群,在稳态环境中,肝细胞是处于g0期静息状态,不进行增殖,而当肝脏受到某种刺激,比如损伤或肝切除后,肝细胞会迅速分裂增殖。其中,肝脏受损后,主要是通过细胞增殖及分化来进行肝脏修复及再生的,比如我们ddc诱导的肝损伤,肝脏修复反应首先表现为肝细胞和胆管细胞增殖增强,如果细胞再生能力受阻,肝祖细胞便会开始活化并进行分化,肝细胞也会转分化为胆管细胞,从而修复受损的胆管。
[0256]
我们也检测到敲除dnmt2,会导致ddc引起的肝损伤修复过程中cyclin-d1表达下调,因此我们合理地推测,敲除dnmt2会由于抑制了细胞增殖进而不利于肝脏修复。所以,我们又进一步分析了测序结果,发现dko小鼠变化最显著的通路就是细胞周期通路(图7),而且dko小鼠中细胞增殖标志物ki67、细胞周期相关的一些基因如ccnb,cdk1,cdc20等表达均下调。用rt-qpcr方法对测序结果进行验证,也证明肝脏经ddc损伤后,诱导细胞大量增殖,而敲除dnmt2,会导致细胞周期相关基因无法上调,细胞周期停滞(图8)。之后我们用immunofluorescence检测了小鼠肝脏中brdu的表达量,以反映小鼠肝脏中增殖的细胞数量,结果显示:在正常情况下,野生型小鼠及dko小鼠肝脏中增殖的细胞都屈指可数,没有表现出差异,不过经ddc损伤后,dko小鼠肝脏中增殖的细胞远不及野生型小鼠多,这也能够印证之前的测序结果(图9)。为了进一步了解敲除dnmt2,影响的是哪些细胞的增殖,我们将ki67与肝细胞标志基因hnf4α及胆管细胞标志基因ck19共染,通过数量统计分析,发现dko小鼠肝脏中肝细胞及胆管细胞的增殖均受到抑制(图10,图11)。
[0257]
除了在ddc模型中,经典wnt信号通路激活肝细胞中β-catenin的转录激活,β-catenin进入细胞核,从而激活sox9表达,诱导肝细胞向胆管细胞的转分化而增强ddc损伤后的肝胆修复。我们检测到无论是mrna水平还是蛋白水平,dko小鼠受损肝脏中sox9的表达显著降低(图12),因为sox9除了在肝细胞中表达,它还是胆管细胞的一种标志基因,所以为了验证dko小鼠是否能够抑制肝细胞中sox9的表达,我们用immunofluorescence方法将hnf4α和sox9进行共染,发现,经ddc损伤后,dko小鼠肝细胞中的sox9较野生型小鼠大大减少(图13)。
[0258]
通过以上结果可以得知,敲除dnmt2,一方面抑制了cyclin-d1的表达,导致在肝脏修复和再生过程中细胞无法正常进入细胞周期进行增殖,另一方面阻碍了肝细胞中sox9的激活,可能会抑制肝细胞向胆管细胞的转分化。我们猜测敲除dnmt2是通过抑制肝细胞、胆管细胞的增殖以及肝细胞向胆管细胞转分化而造成更严重的肝脏损伤。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。