1.本发明涉及荧光探针技术领域,特别涉及用于识别血红素蛋白的荧光探针及其应用。
背景技术:
2.蛋白质是构成生命的基础物质之一,在生命体活动中起着至关重要的作用。血红素蛋白是一种以血红素作为辅因子的金属蛋白,血红素辅基是由铁离子和原卟啉ix或其衍生物构成的复合物。血红素蛋白(heme protein)由于有充当载体、运输、调节和催化等特点,在生物体内发挥重要的功能。肌红蛋白属于血红蛋白的一种,是典型的氧载体蛋白,在生物休系中具有储存氧和运输分子氧的功能,还能直接与活性氧物质(ros)反应,在生理学起到保护作用。细胞色素c参与电子传递、金属离子结合和atp生成等重要生物学功能。细胞色素c从线粒体释放到胞浆是细胞程序性死亡(即凋亡)的标志。检测人血清中细胞色素c的含量可作为肿瘤诊断的重要依据。神经红蛋白是2000年发现的一种在脊椎动物神经系统中高表达的新型血红素蛋白,具有较高的氧亲和力,能保护神经细胞对抗氧化应激并抑制细胞凋亡级联反应。因此,识别血红素蛋白并研究其相关性质具有重大意义。
3.蛋白质与膜的相互作用在细胞生物学中起着基础性的作用,其相互作用决定了膜的结构性质,起着调节膜的运输、信号转导,蛋白质定位的作用,同时还能引起生物功能障碍。与自然存在的蛋白质和膜的复杂结构相比,蛋白质和膜的简化模型对于系统研究结构和结合特征之间的关系有重要意义,如利用模型细胞膜可以探究蛋白质-脂质相互作用调节脂质组成、膜动力学和结构,这对从细胞骨架组装、膜运输到细胞内和细胞间信号转导等众多细胞过程的进一步深入发掘都是至关重要的。当表面活性剂达到临界胶束浓度(cmc浓度)时,表面活性剂的溶质在溶液中形成胶体尺寸的聚集体,该胶束聚集体有类似细胞膜的性质,使得表面活性剂成为模型细胞膜成为了可能。同时,磷脂酰甘油脂类是天然生物膜中最常见的阴离子脂类之一,也是原核细胞膜中唯一的阴离子脂类类型。磷脂酰甘油分子是制备表面带负电荷的模型脂膜最常用的阴离子脂质。磷脂是两亲性分子,在存在过量水的情况下,它们自组装形成具有封闭双层膜的分子聚集体。这种分子聚集体通常称为囊泡或脂质体。由于细胞膜的基本结构由磷脂囊泡的双层膜提供,人工磷脂囊泡长期以来一直被用作模型膜,以更好地了解生物膜的物理化学性质和结构。
4.有机荧光染料因其体积小、良好的光物理和光化学性质以及跨越整个光谱的发射而广泛应用于各种生物研究中,作为荧光探针和标签。目前报道的研究中,对于血红素蛋白的识别较多使用的是纳米材料碳点作为探针。碳点通常采用苛刻的实验条件(如强酸和电弧放电)、繁琐的操作步骤和昂贵的设备,这大大限制了其实际应用。大多数碳点的最大吸收波长位于紫外到蓝色的波长范围内,这也限制了它们在生物成像领域的应用。另外许多生物物理方法被用于表征体外蛋白质-膜相互作用的不同方面。其中包括等温滴定法、圆二色谱、电子自旋共振和许多基于荧光的技术。高分辨率结构方法(x射线、电子显微镜、核磁共振)为蛋白质-膜相互作用提供了最完整的表征。然而,这些方法通常很慢,并且需要非生
理浓度的蛋白质,这限制了它们在表征蛋白质-膜相互作用的动力学和平衡方面的应用。目前已报道的许多用于检测蛋白与细胞膜相互作用的荧光探针,需要对待测的蛋白进行额外的染色处理。
技术实现要素:
5.有鉴于此,本发明提供了用于识别血红素蛋白的荧光探针及其应用,该有机小分子荧光探针合成简便、经济,用于选择性识别阴性表面活性剂sds、识别血红素蛋白以及模拟血红素蛋白与细胞膜模型作用的应用研究。
6.为了实现上述发明目的,本发明提供以下技术方案:
7.本发明提供了荧光探针,具有如式(i)所示结构:
[0008][0009]
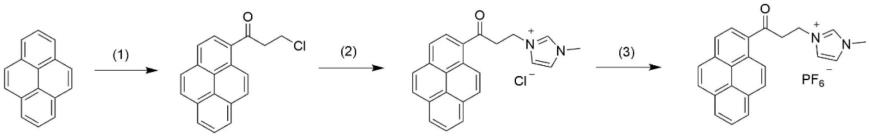
在本发明的一些具体实施方案中,上述荧光探针由甲基咪唑盐和芘荧光团由丙酰基连接而成。
[0010]
本发明还提供了制备方法,包括取3-氯代-1-芘基丙酮和1-甲基咪唑进行反应,获得所述荧光探针。
[0011]
在本发明的一些具体实施方案中,上述制备方法中所述反应的具体步骤为:取3-氯代-1-芘基丙酮和1-甲基咪唑的乙腈溶液在氩下回流24h,冷却至室温(25℃
±
5℃)后,过滤,用乙醚洗涤,获得黄色固体;取所述黄色固体与甲醇混合,再与六氟磷酸钾混合,获得所述荧光探针。
[0012]
在本发明的一些具体实施方案中,上述制备方法中所述3-氯代-1-芘基丙酮和所述1-甲基咪唑的物质的量比值为1:(0.2~0.5)。
[0013]
在本发明的一些具体实施方案中,上述制备方法中所述3-氯代-1-芘基丙酮的制备方法为:取芘和3-氯丙酰溴进行反应,获得所述3-氯代-1-芘基丙酮。
[0014]
在本发明的一些具体实施方案中,上述制备方法中所述取芘和3-氯丙酰溴进行反应的具体步骤为:将芘和3-氯丙酰溴在二氯甲烷中混合,冷却至10℃,20min内与三氯化铝混合,恢复室温后搅拌过夜,冷却,与固体氯化钠混合,再与二氯甲烷混,静置分层后用饱和氯化钠洗涤有机相,用硫酸镁干燥,在真空中过滤,浓缩;用硅胶柱层析进行纯化,获得所述3-氯代-1-芘基丙酮;
[0015]
所述硅胶柱层析中石油醚与二氯甲烷的体积比为7:3。
[0016]
在本发明的一些具体实施方案中,上述制备方法中所述芘、所述3-氯丙酰溴和所述三氯化铝的物质的量比值为1:(0.6~0.8):(1~2)。
[0017]
本发明还提供了试剂和/或试剂盒,包括上述荧光探针,以及可接受的辅料和/或助剂。
[0018]
在本发明的一些具体实施方案中,上述辅料和/或助剂包括但不限于缓冲液、黏合剂、填充剂、崩解剂、润滑剂、等渗调节剂、增溶剂、助溶剂、防腐剂、着色剂、助悬剂、润湿剂、乳化剂和/或表面活性剂。
[0019]
本发明还提供了上述荧光探针或上述试剂和/或试剂盒在识别十二烷基硫酸钠和/或金属蛋白中的应用。
[0020]
在本发明的一些具体实施方案中,上述应用中所述识别十二烷基硫酸钠包括将十二烷基硫酸钠从其他阴性、阳性、中性及两性表面活性剂中区别出。
[0021]
本发明还提供了上述荧光探针或上述试剂和/或试剂盒在表征细胞膜模型与金属蛋白作用中的应用。
[0022]
本发明还提供了十二烷基硫酸钠的检测方法,包括将上述荧光探针与待测表面活性剂混合,检测荧光光谱;根据荧光发射波长的变化,获得检测结果;
[0023]
所述变化为所述荧光发射波长发生蓝移;
[0024]
所述蓝移为所述荧光发射波长从477nm蓝移至455nm。
[0025]
本发明还提供了金属蛋白的检测方法,包括将上述荧光探针与表面活性剂混合,检测荧光光谱,获得第一荧光发射波长;再与待测蛋白混合,检测荧光光谱,获得第二荧光发射波长;根据所述第一荧光发射波长的变化与所述第二荧光发射波长的变化,获得检测结果;
[0026]
所述第一荧光发射波长的变化为所述第一荧光发射波长发生蓝移;
[0027]
所述第二荧光发射波长的变化为所述第二荧光发射波长发生红移;
[0028]
所述蓝移为所述第一荧光发射波长从477nm蓝移至455nm;
[0029]
所述红移为所述第二荧光发射波长从455nm红移至477nm。
[0030]
本发明还提供了模拟金属蛋白与细胞膜的作用的方法,包括将上述荧光探针与处于临界胶束浓度的十二烷基硫酸钠混合,与金属蛋白混合前、后检测荧光光谱;荧光发射强度下降50%以上表征金属蛋白与细胞膜产生作用;
[0031]
所述细胞膜为所述处于临界胶束浓度的十二烷基硫酸钠所模拟。
[0032]
本发明还提供了模拟金属蛋白与细胞膜的作用的方法,包括将上述荧光探针与二肉豆蔻酰磷脂酰胆碱的脂质体混合,与金属蛋白混合前、后检测荧光光谱;荧光发射强度下降50%以上表征金属蛋白与细胞膜产生作用;
[0033]
所述细胞膜为所述二肉豆蔻酰磷脂酰胆碱的脂质体所模拟。
[0034]
在本发明的一些具体实施方案中,上述应用、上述检测方法或上述方法中所述金属蛋白包括血红素蛋白。
[0035]
在本发明的一些具体实施方案中,上述血红素蛋白包括肌红蛋白、细胞色素c和/或神经红蛋白。
[0036]
本发明的探针有如下效果:
[0037]
1、本发明探针溶液的发射波长为477nm,加入阳离子表面活性剂dtab,两性离子表面活性剂bs-12,非离子表面活性剂triton x-100,阴离子表面活性剂sls、sdbs后,溶液的的发射波长没有产生移动,而加入阴离子表面活性剂sds后发射波长蓝移到了455nm处;
[0038]
2、在只有本发明探针存在的pbs缓冲液中,溶液的发射波长为477nm,在加入了sds后,溶液的发射波长蓝移到了455nm处;加入溶菌酶、牛胰蛋白酶和胃蛋白酶,溶液的荧光发
射强度降低,发射波长没有发生变化;加入野生型肌红蛋白、野生型细胞色素c和野生型神经红蛋白,溶液的荧光强度显著下降,同时溶液的发射波长红移,溶液的发射波长红移回到探针本身的发射波长477nm处;
[0039]
3、以sds胶束模型模拟细胞膜,在非血红素蛋白(胃蛋白酶、溶菌酶、牛胰蛋白酶)体系中,溶液的荧光发射强度几乎没有下降;而在血红素蛋白(野生型肌红蛋白、野生型细胞色素c和野生型神经红蛋白)体系中,溶液的荧光发射强度下降明显;
[0040]
4、以dmpc模拟细胞膜,在非血红素蛋白(胃蛋白酶、溶菌酶、牛胰蛋白酶)体系中,溶液的荧光发射强度几乎没有下降;而在血红素蛋白(野生型肌红蛋白、野生型细胞色素c和野生型神经红蛋白)体系中,溶液的荧光发射强度下降明显。
[0041]
本发明使用的有机小分子荧光探针合成简便、经济,有着良好的血红素蛋白识别效果,基于荧光的方法提供了快速的响应,并允许在微摩尔蛋白浓度下研究蛋白质-膜相互作用,这使得它们适合于蛋白质-膜结合平衡和动力学的研究。目前已报道的许多用于检测蛋白与细胞膜相互作用的荧光探针,需要对待测的蛋白进行额外的染色处理。而本发明所使用的探针可以在不染色的情况下对蛋白与细胞膜的相互作用进行表征。
附图说明
[0042]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
[0043]
图1示实施例1中合成的荧光探针的核磁共振氢谱数据图;
[0044]
图2示实施例4中描述的荧光探针(10μm)响应400μm不同表面活性剂的示意图;
[0045]
图3示实施例5中描述的荧光探针(10μm)与400μm sds作用识别血红素蛋白(图中为12μm)与非血红素蛋白(图中为12μm)的荧光表征图;
[0046]
图4示实施例6中描述的荧光探针(10μm)与200μm sds作用识别血红素蛋白(图中为12μm)与非血红素蛋白(图中为12μm)的荧光表征图;
[0047]
图5示实施例7中描述的荧光探针(10μm)与600μm sds作用识别血红素蛋白(图中为12μm)与非血红素蛋白(图中为12μm)的荧光表征图;
[0048]
图6示实施例8中描述的荧光探针(10μm)表征血红素蛋白(图中为12μm)与sds胶束模型细胞膜(cmc浓度)的作用的荧光表征图;
[0049]
图7(a)示实施例9中描述的荧光探针(10μm)表征血红素蛋白(图中为12μm)与dmpc制成的模型细胞膜的作用的荧光表征图;
[0050]
图7(b)示图7(a)的局部放大图;
[0051]
图8示实施例9中制备的dmpc、本发明的探针、以及肌红蛋白三者用细胞共聚焦显微镜成像,其中:(1)为dmpc的细胞共聚焦显微镜成像;(2)为dmpc与探针作用的细胞共聚焦显微镜成像;(3)为dmpc、探针以及肌红蛋白的细胞共聚焦显微镜成像。
具体实施方式
[0052]
本发明公开了用于识别血红素蛋白的荧光探针及其应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过
较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
[0053]
本发明公布了一种基于芘-咪唑结构的探针,结构如式(i)所示,用于选择性识别阴性表面活性剂sds、识别血红素蛋白以及模拟血红素蛋白与细胞膜模型作用的应用研究。本发明中的探针是将芘母体与甲基咪唑用丙酰基连接制得(结构如式(i)所示),能够将sds与其他阴性、阳性、中性及两性表面活性剂区分出来。同时,探针在sds存在的情况下,能够选择性识别血红素蛋白。利用sds形成胶束,探针模拟血红素蛋白与细胞膜的相互作用。且其所表征的结果与dmpc模拟脂质体模型与血红素蛋白作用相同,即:二者均可以使得含不同浓度的三种血红素蛋白溶液的荧光强度有所下降,而同样条件下的三种非血红素蛋白溶液的荧光强度没有发生变化。
[0054]
本发明的目的是提供能够识别血红素蛋白的荧光探针及其在模拟血红素蛋白与细胞膜作用的应用。这一探针通过发射波长的变化作为信号检测不同的表面活性剂,并在表面活性剂十二烷基硫酸钠存在的情况下通过发射波长和荧光强度的变化作为信号,能够识别血红素蛋白,进一步能够通过荧光强度的变化作为由临界胶束浓度的十二烷基硫酸钠(sds)和二肉豆蔻酰磷脂酰胆碱(dmpc)制成的细胞膜模型与血红素蛋白作用的表征。具有制备方法简单,检测灵敏快速的特点,性能优于已有的血红素蛋白的检测探针。
[0055]
本发明所述的一种能够识别血红素蛋白并能表征血红素蛋白与模型细胞膜相互作用的荧光探针,该探针为甲基咪唑盐和芘荧光团由丙酰基连接而成。在365nm处激发,477nm存在荧光发射,其结构如式(i)所示:
[0056][0057]
本发明还提供了一种能用于识别sds表面活性剂及血红素蛋白且能用于模拟细胞膜与血红素蛋白作用的荧光探针,其合成步骤具体如下:
[0058]
(1)将芘和3-氯丙酰溴溶解在40ml无水dcm中,在氮气中冷却至10℃,20min内分次加入alcl3。将反应混合物调成深色,让反应混合物慢慢达到室温,搅拌反应混合物过夜。用碎冰冷却多余的三氯化铝。用固体氯化钠使生成的水相饱和。加入100~200ml新鲜dcm,静置分层。用饱和氯化钠洗涤有机相。硫酸镁干燥混合物。在真空中过滤并浓缩。用硅胶(石油醚-dcm=7:3)柱层析对粗品进行纯化,得到化合物3-氯代-1-芘基丙酮。
[0059]
(2)3-氯代-1-芘基丙酮和1-甲基咪唑在20ml乙腈中的溶液在氩下回流24h。冷却至室温后,过滤沉淀物并用乙醚洗涤,得到黄色固体。
[0060]
(3)将得到的黄色固体溶于甲醇中,缓慢将六氟磷酸钾滴入溶液中得到白色沉淀产物,即响应sds表面活性剂及血红素蛋白且能用于模拟细胞膜与血红素蛋白作用的荧光探针。
[0061]
其合成的路线为:
[0062][0063]
本发明还提供了一种能用于识别sds表面活性剂及血红素蛋白且能用于模拟细胞膜与血红素蛋白作用的荧光探针其合成特征为:(1)第一步反应:按物质的量比,芘:3-氯丙酰溴:三氯化铝=1:(0.6~0.8):(1~2)。反应温度为10℃,分次加入三氯化铝的时间为20分钟以内。(2)第二步反应:按物质的量比,3-氯代-1-芘基丙酮:1-甲基咪唑=1:(0.2~0.5)。
[0064]
本发明还提供了一种能用于识别sds表面活性剂及血红素蛋白且能用于模拟细胞膜与血红素蛋白作用的荧光探针,该荧光探针选择性将sds与其他阴性、阳性、中性及两性表面活性剂区分出来,具体的检测方法是将表面活性剂与荧光探针混合后测荧光光谱;以荧光发射波长的变化作为信号,用于响应不同类型的表面活性剂。
[0065]
本发明还提供了一种能用于识别sds表面活性剂及血红素蛋白且能用于模拟细胞膜与血红素蛋白作用的荧光探针,该荧光探针用于识别血红素蛋白;具体检测方法是将探针和表面活性剂与荧光探针混合后再加入蛋白检测荧光光谱;以荧光的发射波长以及荧光强度的变化作为信号,用于识别血红素蛋白。
[0066]
本发明还提供了一种能用于识别sds表面活性剂及血红素蛋白且能用于模拟细胞膜与血红素蛋白作用的荧光探针,该荧光探针用于模拟血红素蛋白与细胞膜的作用。具体的检测方法如下:将表面活性剂sds制成临界胶束浓度后加入探针以及血红素蛋白,以荧光强度的变化作为信号,用于模拟金属蛋白与细胞膜的作用。
[0067]
本发明还提供了一种能用于识别sds表面活性剂及血红素蛋白且能用于模拟细胞膜与血红素蛋白作用的荧光探针,该荧光探针用于模拟金属蛋白与细胞膜的作用。具体的检测方法如下:将dmpc制成脂质体后加入探针以及血红素蛋白,以荧光强度的变化作为信号,用于模拟金属蛋白与细胞膜的作用。
[0068]
本发明所述室温为25℃
±
5℃。
[0069]
如无特殊说明,本发明所用原料、试剂、耗材以及采用的仪器皆为普通市售品,均可由市场购得。
[0070]
下面结合实施例,进一步阐述本发明:
[0071]
实施例1:用于识别血红素蛋白的荧光探针的合成方法
[0072]
将芘(4g,19.77mmol)和3-氯丙酰溴(2.04g,11.86mmol)溶解在40ml无水dcm中,在氮气中冷却至10℃,20min内分次加入alcl3(2.64g,19.77mmol)。将反应混合物调成深色。让反应混合物慢慢达到室温。搅拌反应混合物过夜。用碎冰冷却多余的三氯化铝。用固体氯化钠使生成的水相饱和。加入100~200ml新鲜dcm,分层。用饱和氯化钠洗涤有机相。硫酸镁干燥混合物。在真空中过滤并浓缩。用硅胶(石油醚-dcm=7:3)柱层析对粗品进行纯化,得到化合物3-氯代-1-芘基丙酮。
[0073]
3-氯代-1-芘基丙酮(0.51g,1.58mmol)和1-甲基咪唑(0.023g,0.32mmol)在20ml乙腈中的溶液在氩下回流24h。冷却至室温后,过滤沉淀物并用乙醚洗涤,得到黄色固体。
[0074]
将得到的黄色固体溶于甲醇中,缓慢将六氟磷酸钾滴入溶液中得到白色沉淀产物,即识别sds表面活性剂及血红素蛋白且能用于模拟细胞膜与血红素蛋白作用的荧光探针。
[0075]
探针的氢谱和碳谱数据(图1)如下:
[0076]
1h nmr(400mhz,dmso-d6)δ9.32(s,1h),8.92(d,j=9.4hz,1h),8.66(d,j=8.1hz,1h),8.55
–
8.35(m,5h),8.29(d,j=9.0hz,1h),8.18(t,j=7.6hz,1h),7.93(d,j=1.5hz,1h),7.75(s,1h),4.69(t,j=6.4hz,2h),4.06(t,j=6.4hz,2h),3.89(s,3h)
[0077]
实施例2:用于识别血红素蛋白的荧光探针合成方法
[0078]
将芘(4g,19.77mmol)和3-氯丙酰溴(2.72g,15.82mmol)溶解在40ml无水dcm中,在氮气中冷却至10℃,20min内分次加入alcl3(5.28g,39.54mmol)。将反应混合物调成深色。让反应混合物慢慢达到室温。搅拌反应混合物过夜。用碎冰冷却多余的三氯化铝。用固体氯化钠使生成的水相饱和。加入100~200ml新鲜dcm,分层。用饱和氯化钠洗涤有机相。硫酸镁干燥混合物。在真空中过滤并浓缩。用硅胶(石油醚-dcm=7:3)柱层析对粗品进行纯化,得到化合物3-氯代-1-芘基丙酮。
[0079]
3-氯代-1-芘基丙酮(0.51g,1.58mmol)和1-甲基咪唑(0.056g,0.79mmol)在20ml乙腈中的溶液在氩下回流24h。冷却至室温后,过滤沉淀物并用乙醚洗涤,得到黄色固体。
[0080]
将得到的黄色固体溶于甲醇中,缓慢将六氟磷酸钾滴入溶液中得到白色沉淀产物,即识别sds表面活性剂及血红素蛋白且能用于模拟细胞膜与血红素蛋白作用的荧光探针。
[0081]
探针的氢谱和碳谱数据如下:
[0082]
1h nmr(400mhz,dmso-d6)δ9.32(s,1h),8.92(d,j=9.4hz,1h),8.66(d,j=8.1hz,1h),8.55
–
8.35(m,5h),8.29(d,j=9.0hz,1h),8.18(t,j=7.6hz,1h),7.93(d,j=1.5hz,1h),7.75(s,1h),4.69(t,j=6.4hz,2h),4.06(t,j=6.4hz,2h),3.89(s,3h)
[0083]
实施例3:用于识别血红素蛋白的荧光探针的合成方法
[0084]
将芘(4g,19.77mmol)和3-氯丙酰溴(2.38g,13.84mmol)溶解在40ml无水dcm中,在氮气中冷却至10℃,20min内分次加入alcl3(3.96g,29.66mmol)。将反应混合物调成深色。让反应混合物慢慢达到室温。搅拌反应混合物过夜。用碎冰冷却多余的三氯化铝。用固体氯化钠使生成的水相饱和。加入100~200ml新鲜dcm,分层。用饱和氯化钠洗涤有机相。硫酸镁干燥混合物。在真空中过滤并浓缩。用硅胶(石油醚-dcm=7:3)柱层析对粗品进行纯化,得到化合物3-氯代-1-芘基丙酮。
[0085]
3-氯代-1-芘基丙酮(0.51g,1.58mmol)和1-甲基咪唑(0.040g,0.55mmol)在20ml乙腈中的溶液在氩下回流24h。冷却至室温后,过滤沉淀物并用乙醚洗涤,得到黄色固体。
[0086]
将得到的黄色固体溶于甲醇中,缓慢将六氟磷酸钾滴入溶液中得到白色沉淀产物,即识别sds表面活性剂及血红素蛋白且能用于模拟细胞膜与血红素蛋白作用的荧光探针。
[0087]
探针的氢谱和碳谱数据如下:
[0088]
1h nmr(400mhz,dmso-d6)δ9.32(s,1h),8.92(d,j=9.4hz,1h),8.66(d,j=8.1hz,1h),8.55
–
8.35(m,5h),8.29(d,j=9.0hz,1h),8.18(t,j=7.6hz,1h),7.93(d,j=1.5hz,1h),7.75(s,1h),4.69(t,j=6.4hz,2h),4.06(t,j=6.4hz,2h),3.89(s,3h)
[0089]
实施例1、实施例2、实施例3所测氢谱和碳谱数据一致,说明其三者制备方法获得了同一种探针,皆为如式(i)所示的荧光探针。
[0090]
实施例4:荧光探针对不同表面活性剂的响应情况
[0091]
将本发明探针溶于dmso溶液中配制成2mm的母液,表面活性剂在水溶液中配成20mm的溶液。在4ml,100mm,ph=7.4的pbs溶液中分别配置10μm探针,探针(10μm)和各种表面活性剂(sds,dtab,triton x-100,bs-12,sls,sdbs,400μm)的混合溶液。用365nm激发波长激发,测定荧光得到图2。
[0092]
图2中,只有探针存在时(10μm)显示溶液的发射波长为477nm,加入阳离子表面活性剂dtab,两性离子表面活性剂bs-12,非离子表面活性剂triton x-100,阴离子表面活性剂sls、sdbs后,溶液的的发射波长没有产生移动,仅荧光强度有所下降,而加入阴离子表面活性剂sds后,不仅光强强度有所下降,而且发射波长蓝移到了455nm处。
[0093]
实施例5:荧光探针对血红素蛋白的识别
[0094]
1.野生型肌红蛋白的制备:
[0095]
1.1表达
[0096]
取15μl含有pmbt7-7质粒的保种菌液于5ml灭菌lb液体培养基中,加入氨苄青霉素0.1mg/l,于37℃恒温水浴箱中震荡培养约12h。再转入500ml rich液体培养基中,并加入氨苄青霉素0.05mg/l,于37℃恒温空气摇床,220r/m,扩大培养至od
600
=0.8(约18h)后,加入诱导剂iptg 500μm诱导表达4h,将菌液冷冻离心留沉淀备用。
[0097]
1.2纯化
[0098]
将沉淀用20mm kpi缓冲液重悬,加入少量dna酶与pmsf(蛋白酶抑制剂)低温超声破菌,使蛋白充分溶出。将破菌后的菌液高速离心,取上清液于超滤杯加压过滤浓缩后离心,取上清液先用deae-52阴离子交换柱初步纯化,初步纯化蛋白溶液中加入少量铁氰化钾将蛋白血红素氧化后再浓缩,于aktapure蛋白纯化仪用s-100凝胶层析柱进一步纯化,得较纯的蛋白溶液(100mm kpi缓冲液,ph=7.0)。浓缩后-80℃冷冻保存备用。
[0099]
2.野生型细胞色素(cyt c)蛋白的制备:
[0100]
将带有pbtr(humancc)载体的大肠杆菌bl21(de3)细胞在含有氨苄西林(100mg/l)的5ml lb培养基中37℃下培养8~10小时。然后将0.5ml细菌溶液转移到500ml富培养基(10g/l色氨酮,8g/l酵母提取物,5g/l nacl)中,并在37℃下培养36小时以扩大蛋白质表达。部分红细胞产物通过离心收集,并在冰水浴中通过超声波裂解。上清液经梯度洗脱后装入cm-52离子交换柱填料洗涤,最终用1m nacl洗脱初步纯化的cyt c。通过超滤浓缩后,将样品装入hipreptm 26/60sephacryl s-100凝胶过滤柱(ge healthcare),该柱带有100mm磷酸盐缓冲液(ph 7.0)。然后将含有被k3fe(cn)6氧化的cyt c的组分装入20mm磷酸盐缓冲液(ph 7.0)中的mono stm 10/100gl柱(ge healthcare)中,并用10%至30%1m nacl的线性梯度洗脱。收集a
soret
/a
280nm
》4.2中测量的蛋白质组分。
[0101]
3.野生型ngb蛋白的制备:
[0102]
神经红蛋白在大肠杆菌bl21(de3)菌株中表达。培养过夜后,将0.5ml培养物转移至500ml富培养基(10g/l蛋白胨,8g/l酵母抽提物,5g/l nacl)。富培养基在37℃下培养约24小时,添加100mg/l 5-氨基乙酰丙酸和100mg/l氨苄西林,12h后添加0.4mm异丙基-β-d-硫代半乳糖苷(iptg)。将细胞颗粒重新悬浮在80ml的裂解缓冲液(1mm edta,0.5mm dtt,
50mm tris-hcl,ph 8.0)中。离心后上清液中的ngb用30%~60%(nh4)2so4沉淀。将溶解在20mm tris-hcl缓冲液(ph 8.0)中并透析的样品装入hipreptm 26/60sephacryl s-100凝胶过滤柱(ge healthcare),该柱与100mm磷酸钾缓冲液平衡。收集ngb组分并用k3[fe(cn)6]氧化,然后装入hipreptm deae ff 16/10柱(ge healthcare)中,该柱用20mm磷酸盐缓冲液(ph 7.0)平衡,并用100mm磷酸盐缓冲液(ph 7.0)洗脱。收集a
soret
/a
280nm
》3.0中测量的蛋白质组分。
[0103]
将本发明的探针溶于dmso溶液中配制成2mm的母液。表面活性剂sds在水溶液中配成20mm的溶液。首先取20μl探针母液加入到4ml pbs缓冲液中,用365nm激发波长激发测定荧光。再取20μl探针母液和80μl sds溶液加入到3.9ml pbs缓冲液中,用365nm激发波长激发测定荧光。然后取20μl探针母液和80μl sds溶液分别加入到3.9ml的含有浓度为12μm的各种蛋白的pbs缓冲溶液中,混匀后,用365nm激发波长激发,测定荧光得到图3。
[0104]
图3中显示,在只有探针存在的pbs缓冲液中,溶液的发射波长为477nm,在加入了400μm sds后,溶液的发射波长蓝移到了455nm处。随着12μm的溶菌酶、牛胰蛋白酶和胃蛋白酶浓度的加入,溶液的荧光发射强度降低,发射波长没有发生变化。然而在加入12μm的野生型肌红蛋白、野生型细胞色素c和野生型神经红蛋白体系中,溶液的荧光强度显著下降,同时溶液的发射波长也不断红移,最终溶液的发射波长红移回到探针本身的发射波长477nm处。
[0105]
实施例6:荧光探针对血红素蛋白的识别
[0106]
1野生型肌红蛋白的制备:
[0107]
1.1表达
[0108]
取15μl含有pmbt7-7质粒的保种菌液于5ml灭菌lb液体培养基中,加入氨苄青霉素0.1mg/l,于37℃恒温水浴箱中震荡培养约12h。再转入500ml rich液体培养基中,并加入氨苄青霉素0.05mg/l,于37℃恒温空气摇床,220r/m,扩大培养至od
600
=0.8(约18h)后,加入诱导剂iptg 500μm诱导表达4h,将菌液冷冻离心留沉淀备用。
[0109]
1.2纯化
[0110]
将沉淀用20mm kpi缓冲液重悬,加入少量dna酶与pmsf(蛋白酶抑制剂)低温超声破菌,使蛋白充分溶出。将破菌后的菌液高速离心,取上清液于超滤杯加压过滤浓缩后离心,取上清液先用deae-52阴离子交换柱初步纯化,初步纯化蛋白溶液中加入少量铁氰化钾将蛋白血红素氧化后再浓缩,于aktapure蛋白纯化仪用s-100凝胶层析柱进一步纯化,得较纯的蛋白溶液(100mm kpi缓冲液,ph=7.0)。浓缩后-80℃冷冻保存备用。
[0111]
2野生型细胞色素(cyt c)蛋白的制备:
[0112]
将带有pbtr(humancc)载体的大肠杆菌bl21(de3)细胞在含有氨苄西林(100mg/l)的5ml lb培养基中37℃下培养8~10小时。然后将0.5ml细菌溶液转移到500ml富培养基(10g/l色氨酮,8g/l酵母提取物,5g/l nacl)中,并在37℃下培养36小时以扩大蛋白质表达。部分红细胞产物通过离心收集,并在冰水浴中通过超声波裂解。上清液经梯度洗脱后装入cm-52离子交换柱填料洗涤,最终用1m nacl洗脱初步纯化的cyt c。通过超滤浓缩后,将样品装入hipreptm 26/60sephacryl s-100凝胶过滤柱(ge healthcare),该柱带有100mm磷酸盐缓冲液(ph 7.0)。然后将含有被k3fe(cn)6氧化的cyt c的组分装入20mm磷酸盐缓冲液(ph 7.0)中的mono stm 10/100gl柱(ge healthcare)中,并用10%至30%1m nacl的线
性梯度洗脱。收集a
soret
/a
280nm
》4.2中测量的蛋白质组分。
[0113]
3野生型ngb蛋白的制备:
[0114]
神经红蛋白在大肠杆菌bl21(de3)菌株中表达。培养过夜后,将0.5ml培养物转移至500ml富培养基(10g/l蛋白胨,8g/l酵母抽提物,5g/l nacl)。富培养基在37℃下培养约24小时,添加100mg/l 5-氨基乙酰丙酸和100mg/l氨苄西林,12h后添加0.4mm异丙基-β-d-硫代半乳糖苷(iptg)。将细胞颗粒重新悬浮在80ml的裂解缓冲液(1mm edta,0.5mm dtt,50mm tris-hcl,ph 8.0)中。离心后上清液中的ngb用30%~60%(nh4)2so4沉淀。将溶解在20mm tris-hcl缓冲液(ph 8.0)中并透析的样品装入hipreptm 26/60sephacryl s-100凝胶过滤柱(ge healthcare),该柱与100mm磷酸钾缓冲液平衡。收集ngb组分并用k3[fe(cn)6]氧化,然后装入hipreptm deae ff 16/10柱(ge healthcare)中,该柱用20mm磷酸盐缓冲液(ph 7.0)平衡,并用100mm磷酸盐缓冲液(ph 7.0)洗脱。收集a
soret
/a
280nm
》3.0中测量的蛋白质组分。
[0115]
将本发明的探针溶于dmso溶液中配制成2mm的母液。表面活性剂sds在水溶液中配成20mm的溶液。首先取20μl探针母液加入到4ml pbs缓冲液中,用365nm激发波长激发测定荧光。再取20μl探针母液和40μl sds溶液加入到3.92ml pbs缓冲液中,用365nm激发波长激发测定荧光。然后取20μl探针母液和40μl sds溶液分别加入到3940μl的含有浓度为12μm的各种蛋白的pbs缓冲溶液中,混匀后,用365nm激发波长激发,测定荧光得到图4。
[0116]
图4中显示,在只有探针存在的pbs缓冲液中,溶液的发射波长为477nm,在加入了200μm sds后,溶液的发射波长蓝移到了455nm处。随着12μm的溶菌酶、牛胰蛋白酶和胃蛋白酶浓度的加入,溶液的荧光发射强度降低,发射波长没有发生变化。然而,在加入12μm的野生型肌红蛋白、野生型细胞色素c和野生型神经红蛋白体系中,溶液的荧光强度显著下降,同时溶液的发射波长也红移,最终溶液的发射波长红移回到探针本身的发射波长477nm处。实施例7:荧光探针对血红素蛋白的识别
[0117]
1.野生型肌红蛋白的制备:
[0118]
1.1表达
[0119]
取15μl含有pmbt7-7质粒的保种菌液于5ml灭菌lb液体培养基中,加入氨苄青霉素0.1mg/l,于37℃恒温水浴箱中震荡培养约12h。再转入500ml rich液体培养基中,并加入氨苄青霉素0.05mg/l,于37℃恒温空气摇床,220r/m,扩大培养至od
600
=0.8(约18h)后,加入诱导剂iptg 500μm诱导表达4h,将菌液冷冻离心留沉淀备用。
[0120]
1.2纯化
[0121]
将沉淀用20mm kpi缓冲液重悬,加入少量dna酶与pmsf(蛋白酶抑制剂)低温超声破菌,使蛋白充分溶出。将破菌后的菌液高速离心,取上清液于超滤杯加压过滤浓缩后离心,取上清液先用deae-52阴离子交换柱初步纯化,初步纯化蛋白溶液中加入少量铁氰化钾将蛋白血红素氧化后再浓缩,于aktapure蛋白纯化仪用s-100凝胶层析柱进一步纯化,得较纯的蛋白溶液(100mm pki缓冲液,ph=7.0)。浓缩后-80℃冷冻保存备用。
[0122]
2.野生型细胞色素(cyt c)蛋白的制备:
[0123]
将带有pbtr(humancc)载体的大肠杆菌bl21(de3)细胞在含有氨苄西林(100mg/l)的5ml lb培养基中37℃下培养8~10小时。然后将0.5ml细菌溶液转移到500ml富培养基(10g/l色氨酮,8g/l酵母提取物,5g/l nacl)中,并在37℃下培养36小时以扩大蛋白质表
达。部分红细胞产物通过离心收集,并在冰水浴中通过超声波裂解。上清液经梯度洗脱后装入cm-52离子交换柱填料洗涤,最终用1m nacl洗脱初步纯化的cyt c。通过超滤浓缩后,将样品装入hipreptm 26/60sephacryl s-100凝胶过滤柱(ge healthcare),该柱带有100mm磷酸盐缓冲液(ph 7.0)。然后将含有被k3fe(cn)6氧化的cyt c的组分装入20mm磷酸盐缓冲液(ph 7.0)中的mono stm 10/100gl柱(ge healthcare)中,并用10%至30%1m nacl的线性梯度洗脱。收集a
soret
/a
280nm
》4.2中测量的蛋白质组分。
[0124]
3.野生型ngb蛋白的制备:
[0125]
神经红蛋白在大肠杆菌bl21(de3)菌株中表达。培养过夜后,将0.5ml培养物转移至500ml富培养基(10g/l蛋白胨,8g/l酵母抽提物,5g/l nacl)。富培养基在37℃下培养约24小时,添加100mg/l 5-氨基乙酰丙酸和100mg/l氨苄西林,12h后添加0.4mm异丙基-β-d-硫代半乳糖苷(iptg)。将细胞颗粒重新悬浮在80ml的裂解缓冲液(1mm edta,0.5mm dtt,50mm tris-hcl,ph 8.0)中。离心后上清液中的ngb用30%-60%(nh4)2so4沉淀。将溶解在20mm tris-hcl缓冲液(ph 8.0)中并透析的样品装入hipreptm 26/60sephacryl s-100凝胶过滤柱(ge healthcare),该柱与100mm磷酸钾缓冲液平衡。收集ngb组分并用k3[fe(cn)6]氧化,然后装入hipreptm deae ff 16/10柱(ge healthcare)中,该柱用20mm磷酸盐缓冲液(ph 7.0)平衡,并用100mm磷酸盐缓冲液(ph 7.0)洗脱。收集a
soret
/a
280nm
》3.0中测量的蛋白质组分。
[0126]
将本发明探针溶于dmso溶液中配制成2mm的母液。表面活性剂sds在水溶液中配成20mm的溶液。首先取20μl探针母液加入到4ml pbs缓冲液中,用365nm激发波长激发测定荧光。再取20μl探针母液和120μl sds溶液加入到3.86ml pbs缓冲液中,用365nm激发波长激发测定荧光。然后取20μl探针母液和120μl sds溶液分别加入到3860μl的含有浓度为12μm的各种蛋白的pbs缓冲溶液中,混匀后,用365nm激发波长激发,进行荧光表征。
[0127]
图5中显示,在只有探针存在的pbs缓冲液中,溶液的发射波长为477nm,在加入了600μm sds后,溶液的发射波长蓝移到了455nm处。随着12μm的溶菌酶、牛胰蛋白酶和胃蛋白酶浓度的加入,溶液的荧光发射强度降低,发射波长没有发生变化。然而,在加入12μm的野生型肌红蛋白、野生型细胞色素c和野生型神经红蛋白体系中,溶液的荧光强度显著下降,同时溶液的发射波长也红移,最终溶液的发射波长红移回到探针本身的发射波长477nm处。
[0128]
实施例8:荧光探针表征血红素蛋白与sds胶束模型细胞膜的作用
[0129]
将本发明的探针溶于dmso溶液中配制成2mm的母液。表面活性剂sds在水溶液中配成20mm的溶液。首先取20μl探针母液加入到4ml pbs缓冲液中,用365nm激发波长激发测定荧光。再取20μl探针母液和1640μl sds溶液加入到2.34ml pbs缓冲液中,用365nm激发波长激发测定荧光。然后取20μl探针母液和1640μl sds溶液分别加入到2.34ml的含有不同浓度为12μm的各种蛋白的pbs缓冲溶液中,混匀后,用365nm激发波长激发,测定荧光得到图6。
[0130]
由图6中可以看出,在非血红素蛋白(胃蛋白酶、溶菌酶、牛胰蛋白酶)体系中,溶液的荧光发射强度几乎没有下降。而在血红素蛋白(野生型肌红蛋白、野生型细胞色素c和野生型神经红蛋白)体系中,溶液的荧光发射强度的下降非常明显。
[0131]
实施例9:所得探针表征血红素蛋白与dmpc制成的模型细胞膜的作用
[0132]
脂质体的制备:
[0133]
1)称取1mg dmpc固体,用适量氯仿溶解dmpc固体。
[0134]
2)将脂质体转移到250ml圆底烧瓶中。
[0135]
3)将容器与旋转蒸发仪连接,将瓶浸入30℃恒温水浴中,转速(60r/min),氮气下将溶剂旋干。
[0136]
4)将圆底烧瓶放入真空管干燥器中干燥至少1小时以上。
[0137]
5)向圆底烧瓶中加入1ml pbs缓冲液,充入氮气,密封瓶口。
[0138]
6)将圆底烧瓶放入超声仪中,超声20~60min。超声的过程中,摇晃几次溶液。形成均匀乳白的、无颗粒沉淀的悬液。
[0139]
将本发明的探针溶于dmso溶液中配制成2mm的母液。首先取20μl探针母液加入到4ml pbs缓冲液中,用365nm激发波长激发测定荧光。再取20μl探针母液加入到3.98ml dmpc溶液中,用365nm激发波长激发测定荧光。然后取20μl探针母液加入到含有浓度为12μm的各种蛋白的3.98ml dmpc溶液中,混匀后,用365nm激发波长激发,测定荧光得到图7(a),图7(b)为其局部放大图。
[0140]
由图中可以看出,实施例9与实施例8的作用效果相吻合。在非血红素蛋白(胃蛋白酶、溶菌酶、牛胰蛋白酶)体系中,随着12μm的蛋白的加入,溶液的荧光发射强度几乎没有变化。而在血红素蛋白(野生型肌红蛋白、野生型细胞色素c和野生型神经红蛋白)体系中,溶液的荧光发射强度的下降非常明显。
[0141]
实施例10
[0142]
实施例9所制备的脂质体dmpc的细胞共聚焦显微镜成像、dmpc与探针作用的细胞共聚焦显微镜成像;dmpc、探针以及肌红蛋白的细胞共聚焦显微镜成像如图8所示。可见,向脂质体溶液中加入探针后,探针分子与脂质体发生作用,使得脂质体的数量有所减少。向脂质体溶液中加入探针,继续加入野生型肌红蛋白后,视野范围的全部脂质体全部破裂,表明血红素蛋白与脂质体发生了强烈作用。在荧光发射光谱的表征即表现为图7中的荧光发射强度下降。
[0143]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。