1.本发明属于生物医药技术领域,具体地,本发明涉及一种帕罗韦德和波普瑞韦中间体的制备方法,更具体地,本发明涉及一种(1r,2s,5s)-6,6二甲基-3-氮杂双环[3.1.0]己烷-2-羧酸甲酯盐酸盐及其制备方法和帕罗韦德或者波普瑞韦的制备方法。
背景技术:
[0002]
帕罗韦德(paxlovid)是一种口服小分子新冠病毒治疗药物,用于治疗成人伴有进展为重症高风险因素的轻至中度新型冠状病毒肺炎(covid-19)患者,例如伴有高龄、慢性肾脏疾病、糖尿病、心血管疾病或慢性肺病等重症高风险因素的患者。有报道称,帕罗韦德在防止高危病人住院和死亡方面有89%的效果。帕罗韦德是pf-07321332和利托那韦(ritonavir)的口服复方制剂。pf-07321332具有阻断sars-cov-2-3cl蛋白酶的活性,其中sars-cov-2-3cl蛋白酶是冠状病毒复制所需的酶;pf-07321332与低剂量抗逆转录病毒药物利托那韦联合使用,有助于减缓pf-07321332的代谢或分解,使其在体内以更高的浓度保持更长时间的活性,以帮助对抗病毒。pf-07321332的结构式如下所示:
[0003][0004]
波普瑞韦(boceprevir)的化学名为(1r,2s,5s)-n-(4-氨基-1-环丁基-3,4-二氧代丁烷-2-基)-3-[(2s)-2-(叔丁基氨基甲酰氨基)-3,3-二甲基丁酰基]-6,6-二甲基-3-氮杂双环[3.1.0]己烷-2-甲酰胺,其与聚乙二醇干扰素α和利巴韦林联合用于治疗chc基因i型慢性病型肝炎。三种药物共同使用能治愈60%以上的患者,是单独使用聚乙二醇干扰素或利巴韦林的治愈率的2到3倍,且boceprevir在提高治愈率的同时还能缩短治疗时间。boceprevir的结构式如下所示:
[0005][0006]
(1r,2s,5s)-6,6二甲基-3-氮杂双环[3.1.0]己烷-2-羧酸甲酯盐酸盐是帕罗韦德和波普瑞韦重要的中间体,其具有巨大的应用市场。
[0007]
因此,亟需开发一种高效制备(1r,2s,5s)-6,6二甲基-3-氮杂双环[3.1.0]己烷-2-羧酸甲酯盐酸盐的方法。
技术实现要素:
[0008]
本发明旨在至少在一定程度上解决现有技术中存在的技术问题至少之一。为此,本发明提供了一种制备(1r,2s,5s)-6,6二甲基-3-氮杂双环[3.1.0]己烷-2-羧酸甲酯盐酸盐的方法,该方法具有合成路线段、产率及手性纯度高等优点。
[0009]
本发明是基于发明人的下列发现而完成的:
[0010]
目前,针对帕罗韦德和波普瑞韦的制备,(1r,2s,5s)-6,6二甲基-3-氮杂双环[3.1.0]己烷-2-羧酸甲酯盐酸盐(inta,即为式(v)所示的化合物)是合成过程中成本最高的关键中间体;
[0011][0012]
而现有合成式(v)所示的化合物的方法存在步骤极其繁琐和反应时间较长等缺点,或者在合成过程中使用了昂贵的催化剂或使用了剧毒氰化钾,增加了生产成本或不能满足环保要求,不利于工业产业化。
[0013]
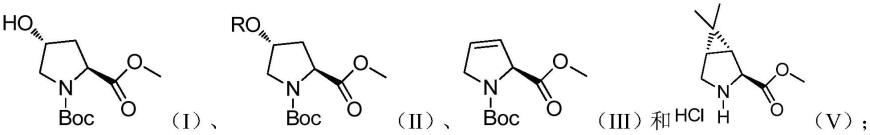
然而,在本发明的一个方面,本发明提出了一种制备式(v)所示的化合物的方法。根据本发明的实施例,所述方法包括:将式(i)所示的化合物进行羟基保护反应,得到式(ii)所示的化合物;将所述式(ii)所示的化合物进行消除反应,得到式(iii)所示的化合物;将所述式(iii)所示的化合物进行环丙烷化反应,得到所述式(v)所示的化合物;
[0014][0015]
其中,r为羟基保护基团。
[0016]
根据本发明实施例的方法中的原料易得且便宜,该方法的合成路线短且反应条件温和,具有操作简单和对设备无特殊的要求等优点,易于实现规模化生产;并且,合成的式(i)所示的化合物具有收率高及手性纯度高等优点,其中,收率可达66%以上,光学纯度ee%可达为95%。
[0017]
在本发明的另一方面,本发明提出了一种式(v)所示的化合物。根据本发明的实施例,所述式(v)所示的化合物是依据前述的方法获得的。本发明式(i)所示的化合物具有收率高及手性纯度高等优点。
[0018]
在本发明的又一方面,本发明提出了一种帕罗韦德或者波普瑞韦的制备方法。根据本发明的实施例,所述制备方法包括:利用前述式(v)所示的化合物制备所述帕罗韦德或者波普瑞韦的步骤。根据本发明实施例的制备方法可制备得到帕罗韦德和波普瑞韦。
[0019]
本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
[0020]
本发明的上述和/或附加的方面和优点从结合下面附图对实施例的描述中将变得明显和容易理解,其中:
[0021]
图1是本发明实施例1合成制得式(v)所示的化合物的核磁共振氢谱图;
[0022]
图2是本发明实施例1合成制得式(v)所示的化合物的液相色谱图。
具体实施方式
[0023]
下面详细描述本发明的实施例。下面描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。
[0024]
需要说明的是,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。进一步地,在本发明的描述中,除非另有说明,“多个”的含义是两个或两个以上。
[0025]
在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
[0026]
在本文中,术语“包含”或“包括”为开放式表达,即包括本发明所指明的内容,但并不排除其他方面的内容。
[0027]
在本文中,术语“任选地”、“任选的”或“任选”通常是指随后所述的事件或状况可以但未必发生,并且该描述包括其中发生该事件或状况的情况,以及其中未发生该事件或状况的情况。
[0028]
本发明提出了一种式(v)所示的化合物及其制备方法和帕罗韦德或者波普瑞韦的制备方法,下面将分别对其进行详细描述。
[0029]
制备式(v)所示的化合物的方法
[0030]
在本发明的一个方面,本发明提出了一种制备式(v)所示的化合物的方法。根据本发明的实施例,所述方法包括:将式(i)所示的化合物进行羟基保护反应,得到式(ii)所示的化合物;将所述式(ii)所示的化合物进行消除反应,得到式(iii)所示的化合物;将所述式(iii)所示的化合物进行环丙烷化反应,得到所述式(v)所示的化合物;
[0031][0032]
其中,r为羟基保护基团。
[0033]
根据本发明实施例的方法中的原料易得且便宜,该方法的合成路线短且反应条件温和,具有操作简单和对设备无特殊的要求等优点,易于实现规模化生产;并且,合成的式(i)所示的化合物具有收率高及手性纯度高等优点。因此,本发明的方法对实现帕罗韦德和波普瑞韦的工业化生产具有重要意义和实用价值。
[0034]
根据本发明的实施例,所述羟基保护反应是通过如下方式实现的:将所述式(i)所
示的化合物与第一碱和羟基保护试剂进行第一混合处理,得到所述式(ii)所示的化合物。由此,通过第一碱和羟基保护试剂可对式(i)所示的化合物的羟基进行保护,有利于后续的消除反应。
[0035]
根据本发明的实施例,所述第一混合处理是在20~30℃条件下进行3~6小时。由此,有利于羟基保护反应的进行,从而保证式(ii)所示的化合物的收率。
[0036]
根据本发明的实施例,所述羟基保护试剂包括选自甲磺酰氯、对氯苯磺酰氯或对甲苯磺酰氯中的至少之一。
[0037]
根据本发明的实施例,r为
[0038]
根据本发明的实施例,所述第一碱包括选自甲醇钠、乙醇钠、叔丁醇钠、甲醇钾、乙醇钾、叔丁醇钾、氢氧化钾、氢氧化钠、碳酸钾、碳酸钠、三乙胺、n,n-二异丙基乙胺、1,8-二氮杂双环[5.4.0]十一碳-7-烯(dbu)和三乙烯二胺(dabco)中的至少之一。
[0039]
根据本发明的实施例,所述式(i)所示的化合物、第一碱和羟基保护试剂的摩尔比为1.0:(1.0~2.0):(1.0~2.0),优选为1.0:(1.0~1.5):(1.0~1.5)。采用上述配比有利于羟基保护反应的进行,从而保证式(ii)所示的化合物的收率。
[0040]
根据本发明的实施例,所述第一混合处理之前,预先将所述式(i)所示的化合物溶于第一溶剂中。
[0041]
根据本发明的实施例,所述第一溶剂包括选自四氢呋喃、甲苯、甲基叔丁基醚和二氯甲烷中的至少之一。
[0042]
根据本发明的实施例,所述消除反应之前,预先将第一混合处理产物和第一酸进行第二混合处理;将第二混合处理产物的有机相依次进行洗涤、干燥和浓缩处理后,得到所述式(ii)所示的化合物。由此,可提高式(ii)所示的化合物的纯度,从而保证终产品(即为式(ii)所示的化合物)的收率。
[0043]
根据本发明的实施例,所述第一酸为柠檬酸溶液,优选为质量百分数为5~30%的柠檬酸溶液。
[0044]
根据本发明的实施例,所述消除反应是通过如下方式实现的:将所述式(ii)所示的化合物与第二碱进行第一加热处理;将第一加热处理产物与甲基化试剂进行第三混合处理,得到所述式(ii)所示的化合物。由此,可在碱性条件下进行消除反应,避免酸性条件影响式(ii)所示的化合物的氨基和羧酸甲酯的稳定性。
[0045]
根据本发明的实施例,所述第一加热处理是在30~50℃条件下进行3~6小时。由此,有利于消除反应的进行,从而保证终产品的收率。
[0046]
根据本发明的实施例,所述第三混合处理是在室温条件下进行的。由此,有利于消除反应的进行,从而保证终产品的收率。
[0047]
根据本发明的实施例,所述第二碱包括选自甲醇钠、乙醇钠、叔丁醇钠、甲醇钾、乙醇钾、叔丁醇钾、氢氧化钾、氢氧化钠、碳酸钾、碳酸钠、三乙胺、n,n-二异丙基乙胺、1,8-二氮杂双环[5.4.0]十一碳-7-烯(dbu)和三乙烯二胺(dabco)中的至少之一。
[0048]
根据本发明的实施例,所述甲基化试剂包括选自碘甲烷、溴甲烷、硫酸二甲酯和碳酸二甲酯中的至少之一。由此,有利于消除反应的进行,从而保证终产品的收率。
[0049]
根据本发明的实施例,所述式(ii)所示的化合物、第二碱和甲基化试剂的摩尔比为1.0:(1.0~4.0):(0.6~2.0),优选为1.0:(2.0~3.0):(0.8~1.5)。采用上述配比有利于消除反应的进行,从而保证终产品的收率。
[0050]
根据本发明的实施例,所述第一加热处理之前,预先将所述式(ii)所示的化合物溶于第二溶剂中。
[0051]
根据本发明的实施例,所述第二溶剂包括选自四氢呋喃、甲苯、甲基叔丁基醚和二氯甲烷中的至少之一。
[0052]
根据本发明的实施例,所述环丙烷化反应之前,预先将第三混合处理产物和第二酸进行第四混合处理;将第四混合处理产物的有机相依次进行洗涤、干燥和浓缩处理后,得到所述式(iii)所示的化合物。由此,可提高式(iii)所示的化合物的纯度,从而保证终产品的收率。
[0053]
根据本发明的实施例,所述第二酸为柠檬酸溶液,优选为质量百分数为5~30%的柠檬酸溶液。
[0054]
根据本发明的实施例,所述环丙烷化反应是通过如下方法实现的:将所述式(iii)所示的化合物与金属催化剂、金属活化剂、金属添加剂和环丙烷化试剂进行第二加热处理,得到所述式(v)所示的化合物。发明人经过实验发现,同时采用金属催化剂、金属活化剂和金属添加剂可有效促进式(v)所示的化合物的双键和环丙烷化试剂发生环丙烷化反应,可提高式(v)所示的化合物的收率及手性纯度。
[0055]
根据本发明的实施例,所述第二加热处理是在30~50℃条件下进行8~12小时。由此,有利于环丙烷化反应的进行,可进一步提高终产品的收率及手性纯度。
[0056]
根据本发明的实施例,所述金属催化剂包括选自钴催化剂、铜催化剂、铁催化剂、镍催化剂和钯催化剂中的至少之一。
[0057]
根据本发明的实施例,所述钴催化剂为[2-t-bu pdi]cobr2。
[0058]
根据本发明的实施例,所述铜催化剂为[2-t-bu pdi]cubr2。
[0059]
根据本发明的实施例,所述铁催化剂为[2-t-bu pdi]febr3。
[0060]
根据本发明的实施例,所述镍催化剂为[2-t-bu pdi]nibr2。
[0061]
根据本发明的实施例,所述钯催化剂为[2-t-bu pdi]pdbr2。
[0062]
根据本发明的实施例,所述金属活化剂包括选自钴粉、铜粉、铁粉、镍粉和钯碳中的至少之一。
[0063]
根据本发明的实施例,所述金属添加剂包括选自溴化钴、氯化钴、氯化铜、溴化铜、氯化铁、溴化铁、溴化镍和氯化镍中的至少之一。
[0064]
根据本发明的实施例,所述环丙烷化试剂包括选自2,2-二氯丙烷、2,2-二溴丙烷和2,2-二碘丙烷中的至少之一。
[0065]
根据本发明的实施例,所述式(iii)所示的化合物、金属催化剂、金属活化剂、金属添加剂和环丙烷化试剂的摩尔比为1.0:(0.001~1.0):(0.6.0~2.0):(1.0~2.5):(0.5~3.0),优选为1.0:(0.001~0.1):(0.8~1.8):(1.0~2.0):(1.0~1.5),更优选为1.0:(0.001~0.01):(0.8~1.8):(1.0~2.0):(1.0~1.5)。采用上述配比有利于环丙烷化反应的进行,可进一步提高终产品的收率及手性纯度。
[0066]
根据本发明的实施例,所述第二加热处理之前,预先将所述式(iii)所示的化合物
溶于第三溶剂中。
[0067]
根据本发明的实施例,所述第三溶剂包括选自四氢呋喃、甲苯、甲基叔丁基醚或二氯甲烷中的至少之一。
[0068]
根据本发明的实施例,所述方法进一步包括:将第二加热处理产物进行抽滤和浓缩,将浓缩产物依次与第三酸、第四碱和有机醚进行第五混合处理;取第五混合处理产物的有机相依次进行洗涤、干燥和浓缩处理后,得到所述式(v)所示的化合物。由此,可提高式(v)所示的化合物的纯度。
[0069]
根据本发明的实施例,所述第三酸为盐酸。
[0070]
根据本发明的实施例,所述第四碱为氢氧化钠。
[0071]
根据本发明的实施例,所述有机醚为甲基叔丁基醚。
[0072]
在本发明的另一方面,本发明提出了一种式(v)所示的化合物。根据本发明的实施例,所述式(v)所示的化合物是依据前述的方法获得的。本发明式(i)所示的化合物具有收率高及手性纯度高等优点。
[0073]
在本发明的又一方面,本发明提出了一种帕罗韦德或者波普瑞韦的制备方法。根据本发明的实施例,所述制备方法包括:利用前述式(v)所示的化合物制备所述帕罗韦德或者波普瑞韦的步骤。根据本发明实施例的制备方法可制备得到帕罗韦德和波普瑞韦。
[0074]
下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
[0075]
制备例1:钴催化剂的制备
[0076]
本发明实施例中的钴催化剂为[2-t-bu pdi]cobr2,具体合成如下所示:
[0077][0078]
1、中间体int1的制备:将二乙酰吡啶sm1(1.50g,9.2mmol)溶于无水乙醇(25ml)中,添加2,6-二异丙基苯胺sm2(3.46ml,18.4mmol)。添加后加入几滴冰醋酸,将溶液回流过夜。点板反应完全后,冷却至室温后,产物从乙醇过滤后,黄色固体用冷乙醇洗涤并在真空烘箱(50℃)干燥过夜,得到3.54g的int1(收率80%)。
[0079]
2、钴催化剂[2-tbu pdi]cobr2的制备:在充满氮气的三口烧瓶中,将int1(3.54g,8.31mmol,1.0eq)、cobr2(无水)(1.97g,8.31mmol,1.0eq)、加入到干燥thf(15ml)中。将混合物在20-30℃之下搅拌24小时。24小时后,将混合物在真空下浓缩至干以产生芥黄色固体5.51g(收率100%),即为钴催化剂[2-t-bu pdi]cobr2。
[0080]
实施例1:
[0081][0082]
向3l三口烧瓶中加入n-boc-反式-4-羟基-l-脯氨酸甲酯(简称sm)(490g,2mol)和二氯甲烷(1.5l),然后加入三乙胺(262.6g,2.6mol)搅拌均匀,冰水浴下缓慢滴加甲基磺酰氯(251.9g,2.2mol),自然升温到25℃,搅拌2小时,tlc检测反应完全,滴加质量百分数为10%的柠檬酸水(1l),搅拌0.5小时,静置分层,水相用二氯甲烷(0.3l)萃取一次,合并有机相,有机相用饱和氯化钠水(0.5l)洗,分出有机相,用无水硫酸镁(20g)干燥,浓缩,得到中间体int2(640.3g,收率99%)。
[0083]
向3l三口烧瓶中加入int2(485.1g,1.5mol)和四氢呋喃(1.5l),搅拌均匀,冰水浴之下加入甲醇钠(243g,4.5mol),缓慢升温到35℃反应6h,tlc原料基本无剩余,降温至25℃,滴入乙酸(270g,4.5mol),加入碳酸钾粉末(276g,2mol),滴入硫酸二甲酯(189g,1.5mol),搅拌至反应完全,反应结束,加质量百分数为10%的柠檬酸水(1l),静置分层,水相用甲基叔丁基醚(0.3l)萃取一次,合并有机相,有机相用饱和氯化钠水(0.5l)洗,分出有机相,用无水硫酸镁(20g)干燥,浓缩,得到中间体int3(313.3g,收率92%)。
[0084]
向1l三口烧瓶中加入int3(227.3g,1.0mol)和干燥的四氢呋喃(0.65l),然后依次加入制备例1得到的钴催化剂(2.27g,0.0035mol)和溴化锌(225.2g,1.0mol),氮气置换,搅拌之下加入锌粉(97.5g,1.5mol),将反应混合物在室温搅拌约15分钟,溶液出现深紫色,滴加2,2-二氯丙烷(135.6g,1.2mol),然后升温到45℃反应8-10小时,原料消耗完全,抽滤,滤液浓缩至干,冰水浴之下,向旋干的油状物中滴加3n盐酸(0.5l),室温下搅拌2小时,冰水浴之下滴加6n氢氧化钠水溶液至ph到9-9.5,加入甲基叔丁基醚(0.5l)搅拌10分钟,静置分出有机相,水相用甲基叔丁基醚(0.5l)萃取一次,合并有机相,有机相用饱和氯化钠水(0.5l)洗,分出有机相,用无水硫酸镁(20g)干燥,搅拌之下向有机相中滴加4n的氯化氢丙醇溶液(0.3l),析出固体,抽滤,烘干,得产品为白色固体inta(135.8g,收率66%,光学纯度ee%为98.0%)。1h nmr(300mhz,cdcl3)10.80(d,1h,nh,j=0.06hz),9.64(s,1h),4.21(t,1h,j=0.06hz),4.00(m,1h),3.87(s,3h),3.31(t,1h,j=0.06hz),1.84(d,1h,j=0.06hz),1.74(t,1h,j=0.06hz),1.24(s,3h),1.09(s,3h)。
[0085]
需要说明的是,实施例2、实施例3和实施例4得到的白色固体inta的核磁共振氢谱图和液相色谱图与实施例1相似,后续不在逐一展示。
[0086]
实施例2:
[0087][0088]
向3l三口烧瓶中加入n-boc-反式-4-羟基-l-脯氨酸甲酯(简称sm)(490g,2mol)和二氯甲烷(1.5l),然后加入三乙胺(232.3g,2.3mol)搅拌均匀,冰水浴下缓慢滴加甲基磺酰
氯(240.5g,2.1mol),自然升温到25℃,搅拌2小时,tlc检测反应完全,滴加质量百分数为10%的柠檬酸水(1l),搅拌0.5小时,静置分层,水相用二氯甲烷(0.3l)萃取一次,合并有机相,有机相用饱和氯化钠水(0.5l)洗,分出有机相,用无水硫酸镁(20g)干燥,浓缩,得到中间体int2(633.3g,收率97.9%)。
[0089]
向3l三口烧瓶中加入int2(485.1g,1.5mol)和四氢呋喃(1.5l),搅拌均匀,冰水浴之下加入甲醇钠(226.8g,4.2mol),缓慢升温到35℃反应6h,tlc原料基本无剩余,降温至25℃,滴入乙酸(270g,4.5mol),加入碳酸钾粉末(276g,2mol),滴入硫酸二甲酯(189g,1.5mol),搅拌至反应完全,反应结束,加质量百分数为10%的柠檬酸水(1l),静置分层,水相用甲基叔丁基醚(0.3l)萃取一次,合并有机相,有机相用饱和氯化钠水(0.5l)洗,分出有机相,用无水硫酸镁(20g)干燥,浓缩,得到中间体int3(309.3g,收率90.7%)。
[0090]
向1l三口烧瓶中加入int3(227.3g,1.0mol)和干燥的四氢呋喃(0.65l),然后依次加入制备例1得到的钴催化剂(2.27g,0.0035mol)和溴化锌(225.2g,1.0mol),氮气置换,搅拌之下加入锌粉(97.5g,1.5mol),将反应混合物在室温搅拌约15分钟,溶液出现深紫色,滴加2,2-二溴丙烷(242.3g,1.2mol),然后升温到45℃反应8-10小时,原料消耗完全,抽滤,滤液浓缩至干,冰水浴之下,向旋干的油状物中滴加3n盐酸(0.5l),室温下搅拌2小时,冰水浴之下滴加6n氢氧化钠水溶液至ph到9-9.5,加入甲基叔丁基醚(0.5l)搅拌10分钟,静置分出有机相,水相用甲基叔丁基醚(0.5l)萃取一次,合并有机相,有机相用饱和氯化钠水(0.5l)洗,分出有机相,用无水硫酸镁(20g)干燥,搅拌之下向有机相中滴加4n的氯化氢丙醇溶液(0.3l),析出固体,抽滤,烘干,得产品为白色固体inta(139.5g,收率67.8%,光学纯度ee%为97.8%)。
[0091]
实施例3:
[0092][0093]
向3l三口烧瓶中加入n-boc-反式-4-羟基-l-脯氨酸甲酯(简称sm)(490g,2mol)和二氯甲烷(1.5l),然后加入三乙胺(262.6g,2.6mol)搅拌均匀,冰水浴下缓慢滴加甲基磺酰氯(251.9g,2.2mol),自然升温到25℃,搅拌2小时,tlc检测反应完全,滴加质量百分数为10%的柠檬酸水(1l),搅拌0.5小时,静置分层,水相用二氯甲烷(0.3l)萃取一次,合并有机相,有机相用饱和氯化钠水(0.5l)洗,分出有机相,用无水硫酸镁(20g)干燥,浓缩,得到中间体int2(620.9g,收率96%)。
[0094]
向3l三口烧瓶中加入int2(485.1g,1.5mol)和四氢呋喃(1.5l),搅拌均匀,冰水浴之下加入甲醇钠(243g,4.5mol),缓慢升温到35℃反应6h,tlc原料基本无剩余,降温至25℃,滴入乙酸(270g,4.5mol),加入碳酸钾粉末(276g,2mol),滴入硫酸二甲酯(189g,1.5mol),搅拌至反应完全,反应结束,加质量百分数为10%的柠檬酸水(1l),静置分层,水相用甲基叔丁基醚(0.3l)萃取一次,合并有机相,有机相用饱和氯化钠水(0.5l)洗,分出有机相,用无水硫酸镁(20g)干燥,浓缩,得到中间体int3(310.3g,收率91%)。
[0095]
向1l三口烧瓶中加入int3(227.3g,1.0mol)和干燥的四氢呋喃(0.65l),然后依次
加入制备例1得到的钴催化剂(2.47g,0.0038mol)和溴化锌(225.2g,1.0mol),氮气置换,搅拌之下加入铜粉(95.3g,1.5mol),将反应混合物在室温搅拌约15分钟,溶液出现深紫色,滴加2,2-二氯丙烷(135.6g,1.2mol),然后升温到45℃反应8-10小时,原料消耗完全,抽滤,滤液浓缩至干,冰水浴之下,向旋干的油状物中滴加3n盐酸(0.5l),室温下搅拌2小时,冰水浴之下滴加6n氢氧化钠水溶液至ph到9-9.5,加入甲基叔丁基醚(0.5l)搅拌10分钟,静置分出有机相,水相用甲基叔丁基醚(0.5l)萃取一次,合并有机相,有机相用饱和氯化钠水(0.5l)洗,分出有机相,用无水硫酸镁(20g)干燥,搅拌之下向有机相中滴加4n的氯化氢丙醇溶液(0.3l),析出固体,抽滤,烘干,得产品为白色固体inta(43.8g,收率21.3%,光学纯度ee%为95.0%)。
[0096]
实施例4:
[0097][0098]
向3l三口烧瓶中加入n-boc-反式-4-羟基-l-脯氨酸甲酯(简称sm)(490g,2mol)和二氯甲烷(1.5l),然后加入三乙胺(262.6g,2.6mol)搅拌均匀,冰水浴下缓慢滴加甲基磺酰氯(251.9g,2.2mol),自然升温到25℃,搅拌2小时,tlc检测反应完全,滴加质量百分数为10%的柠檬酸水(1l),搅拌0.5小时,静置分层,水相用二氯甲烷(0.3l)萃取一次,合并有机相,有机相用饱和氯化钠水(0.5l)洗,分出有机相,用无水硫酸镁(20g)干燥,浓缩,得到中间体int2(635.6g,收率98.3%)。
[0099]
向3l三口烧瓶中加入int2(485.1g,1.5mol)和四氢呋喃(1.5l),搅拌均匀,冰水浴之下加入甲醇钠(243g,4.5mol),缓慢升温到35℃反应6h,tlc原料基本无剩余,降温至25℃,滴入乙酸(270g,4.5mol),加入碳酸钾粉末(276g,2mol),滴入硫酸二甲酯(189g,1.5mol),搅拌至反应完全,反应结束,加质量百分数为10%的柠檬酸水(1l),静置分层,水相用甲基叔丁基醚(0.3l)萃取一次,合并有机相,有机相用饱和氯化钠水(0.5l)洗,分出有机相,用无水硫酸镁(20g)干燥,浓缩,得到中间体int3(304.8g,收率89.4%)。
[0100]
向1l三口烧瓶中加入int3(227.3g,1.0mol)和干燥的四氢呋喃(0.65l),然后依次加入制备例1得到的钴催化剂(2.00g,0.0031mol)和氯化锌(136.3g,1.0mol),氮气置换,搅拌之下加入锌粉(97.5g,1.5mol),将反应混合物在室温搅拌约15分钟,溶液出现深紫色,滴加2,2-二氯丙烷(135.6g,1.2mol),然后升温到45℃反应8-10小时,原料消耗完全,抽滤,滤液浓缩至干,冰水浴之下,向旋干的油状物中滴加3n盐酸(0.5l),室温下搅拌2小时,冰水浴之下滴加6n氢氧化钠水溶液至ph到9-9.5,加入甲基叔丁基醚(0.5l)搅拌10分钟,静置分出有机相,水相用甲基叔丁基醚(0.5l)萃取一次,合并有机相,有机相用饱和氯化钠水(0.5l)洗,分出有机相,用无水硫酸镁(20g)干燥,搅拌之下向有机相中滴加4n的氯化氢丙醇溶液(0.3l),析出固体,抽滤,烘干,得产品为白色固体inta(70.3g,收率34.3%,光学纯度ee%为96.0%)。
[0101]
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特
点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
[0102]
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
