通过检测mir-290家族表达鉴定胚胎发育潜能的方法
技术领域
1.本发明涉及生物技术领域。具体地说,本发明涉及一种通过检测mir-290家族表达来鉴定胚胎发育潜能的方法。
背景技术:
2.哺乳动物植入前胚胎发育包含从受精到着床等若干关键事件,各个时期均受严密的基因表达调控和时序调控,同时dna甲基化、组蛋白修饰、非编码rnas(non-coding rnas,ncrnas)等的转录后修饰调控亦起到关键的作用。在小鼠植入前胚胎发育过程中,合子基因组激活(zygotic genome activation,zga)是受精之后一个很关键的生物学事件,发生在2-细胞胚胎阶段,合子基因组激活的失败往往会导致胚胎发生“发育阻滞”现象,即2-细胞阻滞(2-cell block)。
3.micrornas(mirnas)是一类广泛存在于哺乳动物细胞中的内源性小非编码rna,是目前比较明确的一类非编码rnas,长度大约22nt,约占细胞总rnas的0.02%。mirnas的作用是转录后基因表达调节,主要通过抑制下游靶mrnas的翻译而发挥功能,大约60%编码蛋白的基因都会受到mirnas的调控。目前大量关于mirnas研究表明,mirnas在许多生物学过程中发挥功能,例如转录、翻译、染色质重塑等等。此外,mirnas在干细胞多能性维持和分化、细胞周期和凋亡中发挥重要的作用。在小鼠植入前胚胎中,mirnas的转录及其所发挥的功能已有被报道,但是mirnas如何参与调控合子基因组激活目前尚不明确。
4.目前对于胚胎发育潜能鉴定的方法中,并没有证明某个mirnas或者mirnas家族在胚胎发育中的功能及其对于胚胎发育的必要性。因此,本领域需要提供一种通过检测某个mirnas或者mirnas家族来进行发育潜能鉴定的方法。
技术实现要素:
5.本发明的目的在于提供一种通过检测mir-290家族表达来鉴定胚胎发育潜能的方法。
6.本发明的目的在于提供一种鉴定胚胎体外发育潜能的鉴定方法,具体的,以检测mir-290家族表达的鉴定胚胎体外发育潜能的方法。
7.在本发明的第一方面,提供了一种mirna或其检测试剂的用途,用于制备判断体外胚胎发育潜能的试剂盒,其中,所述的mirna为mir-290家族的mirna。
8.在另一优选例中,所述mir-290家族的mirna选自a组:mir-290a-3p、mir-291a-3p、mir-292a-3p、mir-291b-3p、mir-293-3p、mir-294-3p、mir-295-3p、mir-291a-5p、mir-293-5p、mir-294-5p、或其组合。
9.在另一优选例中,所述mir-290家族的mirna选自b组:mir-291a-5p、mir-292a-3p、mir-293-5p、mir-293-3p、mir-294-5p、mir-294-3p、或其组合。
10.在另一优选例中,所述的mirna包括选自a组或b组的部分或全部mirna,较佳地至少2种mirna,更佳地3、4、5或6种mirna。
11.在另一优选例中,所述mir-290家族来源于哺乳动物,优选为小鼠、大鼠或人。
12.在另一优选例中,所述“判断体外发育潜能”包括判断胚胎发育是否发生胚胎阻滞。
13.在另一优选例中,所述的判断包括预先判断。
14.在另一优选例中,所述试剂盒用于检测一样本,所述样本包括细胞或培养液。
15.在另一优选例中,所述体外胚胎为植入前胚胎。
16.在另一优选例中,所述体外胚胎为非人胚胎。
17.在另一优选例中,所述体外胚胎为非人哺乳动物的胚胎。
18.在另一优选例中,所述体外胚胎为啮齿动物的胚胎,优选为小鼠、大鼠。
19.在另一优选例中,所述体外胚胎选自下组中的一种或多种:原核期的胚胎、2-细胞阶段的胚胎、4-细胞阶段的胚胎、8-细胞阶段的胚胎、桑椹胚或囊胚。
20.在另一优选例中,所述体外胚胎选自2-细胞阶段的胚胎。
21.在另一优选例中,所述的培养液为培养所述体外胚胎所产生的培养液。
22.在另一优选例中,所述的试剂盒含有mir-291a-5p、mir-292a-3p、mir-293-5p、mir-293-3p、mir-294-5p、mir-294-3p、或其组合作为阳性对照。
23.在另一优选例中,所述mirna选自下组:
24.(a)seq id no:1-10任一所示的序列;
25.(b)与seq id no:1-10任一所示序列互补的10个互补序列中的任一序列;或
26.(c)来自(a)或(b)的组合,且来自(a)的序列与来自(b)的互补序列互相不为互补。
27.在另一优选例中,所述的检测试剂包括引物、反义核酸、探针或芯片。
28.在另一优选例中,所述的试剂盒还包括标准品(如质控标准品)。
29.在另一优选例中,所述的mirna被作为标准品。
30.在本发明的第二方面,提供了一种mirna芯片,所述的mirna芯片包括:
31.固相载体;以及
32.有序固定在所述固相载体上的寡核苷酸探针,所述的寡核苷酸探针特异性地对应于mir-290家族的mirna,所述mir-290家族mirna包括选自a组的至少二种mirna:mir-290a-3p、mir-291a-3p、mir-292a-3p、mir-291b-3p、mir-293-3p、mir-294-3p、mir-295-3p、mir-291a-5p、mir-293-5p、mir-294-5p、或其组合。
33.在另一优选例中,所述mir-290家族的mirna包括选自b组的至少二种mirna:mir-291a-5p、mir-292a-3p、mir-293-5p、mir-293-3p、mir-294-5p、mir-294-3p、或其组合。
34.在另一优选例中,所述的mirna包括选自a组或b组的3、4、5、或6种mirna。
35.在另一优选例中,所述的寡核苷酸探针含有:
36.互补结合区;和/或
37.与固相载体相连的连接区。
38.在本发明的第三方面,提供了一种试剂盒,所述的试剂盒含有mir-290家族或其检测试剂,和说明书,所述的说明书中描述了将所述的试剂盒用于判断体外胚胎发育潜能。
39.在另一优选例中,所述mir-290家族mirna选自下组:mir-291a-5p、mir-292a-3p、mir-293-5p、mir-293-3p、mir-294-5p、mir-294-3p、或其组合。
40.在另一优选例中,所述的使用说明书注明以下内容:
41.(a)当被检测的样本中,mir-290家族mirna的表达量ea与对照表达量ea0之比ea/ea0≤0.8,较佳地,≤0.5,更佳地,≤0.2,则提示对应于该被检测样本的体外胚胎发育阻滞;
42.(b)mir-290家族mirna的表达量ea与对照表达量ea0之比ea/ea0在0.8-1.5范围,则提示该体外胚胎发育潜能正常。
43.其中,所述对照表达量是对应于胚胎发育正常组的对照样本中的mir-290家族mirna的表达量。
44.在另一优选例中,所述样本包括组织或血浆。
45.在另一优选例中,所述的组织包括绒毛组织、蜕膜组织。
46.在本发明的第四方面,提供了一种体外非诊断性的判断体外胚胎发育潜能的方法,包括步骤:
47.(a)当被检测的样本中,mir-290家族mirna的表达量ea与对照表达量ea0之比ea/ea0≤0.8,较佳地,≤0.5,更佳地,≤0.2,则提示对应于该被检测样本的体外胚胎发育阻滞;
48.(b)mir-290家族mirna的表达量ea与对照表达量ea0之比ea/ea0在0.8-1.5范围,则提示该体外胚胎发育潜能正常。
49.在另一优选例中,所述mir-290家族选自下组:mir-291a-5p、mir-292a-3p、mir-293-5p、mir-293-3p、mir-293-5p、mir-294-3p、或其组合。
50.在另一优选例中,所述样本包括细胞或培养液。
51.在另一优选例中,所述的培养液为培养所述体外胚胎所产生的培养液。
52.在另一优选例中,所述测定是通过real-time pcr实现。
53.在本发明的第五方面,提供了一种非治疗的体外促进胚胎发育的方法,向体外培养胚胎的培养液中添加有mir-290家族的mirna,所述mir-290家族mirna包括选自a组的至少二种mirna:mir-290a-3p、mir-291a-3p、mir-292a-3p、mir-291b-3p、mir-293-3p、mir-294-3p、mir-295-3p、mir-291a-5p、mir-293-5p、mir-294-5p、或其组合。
54.在另一优选例中,所述mir-290家族的mirna包括选自b组的至少二种mirna:mir-291a-5p、mir-292a-3p、mir-293-5p、mir-293-3p、mir-294-5p、mir-294-3p、或其组合。
55.在本发明的第六方面,提供了一种用于体外培养胚胎的培养液,所述培养液中含有mir-290家族的mirna,所述mir-290家族mirna包括选自a组的至少二种mirna:mir-290a-3p、mir-291a-3p、mir-292a-3p、mir-291b-3p、mir-293-3p、mir-294-3p、mir-295-3p、mir-291a-5p、mir-293-5p、mir-294-5p、或其组合。
56.在另一优选例中,所述mir-290家族的mirna包括选自b组的至少二种mirna:mir-291a-5p、mir-292a-3p、mir-293-5p、mir-293-3p、mir-294-5p、mir-294-3p、或其组合。
57.在本发明的第七方面,提供了一种分离的mirna,所述的mirna选自:
58.(i)mir-290家族的mirna,或
59.(ii)与mir-290家族的mirna互补的mirna。
60.在另一优选例中,所述mir-290家族选自下组:mir-290a-3p、mir-291a-3p、mir-292a-3p、mir-291b-3p、mir-293-3p、mir-294-3p、mir-295-3p、mir-291a-5p、mir-293-5p、mir-294-5p或其组合。
61.在另一优选例中,所述mir-290家族选自下组:mir-291a-5p、mir-292a-3p、mir-293-5p、mir-293-3p、mir-293-5p、mir-294-3p、或其组合。
62.在另一优选例中,所述mirna选自下组:
63.(a)seq id no:1-10任一所示的序列;
64.(b)与seq id no:1-10任一所示序列互补的10个互补序列中的任一序列;或
65.(c)来自(a)或(b)的组合,且来自(a)的序列与来自(b)的互补序列互相不为互补。
66.在本发明的第八方面,提供了一种分离的或人工构建的前体mirna,所述的前体mirna能在人细胞内剪切并表达成本发明的第七方面所述的mirna。
67.在本发明的第九方面,提供了一种分离的多核苷酸,所述的多核苷酸能被人细胞转录成前体mirna,所述的前体mirna能在人细胞内被剪切且表达成本发明的第七方面所述的mirna。
68.在另一优选例中,所述的多核苷酸具有式i所示的结构:
69.seq
正向-x-seq
反向
70.式i
71.式i中,
72.seq
正向
为能在人细胞中表达成所述的mirna的核苷酸序列;
73.seq
反向
为与seq正向基本上互补或完全互补的核苷酸序列;
74.x为位于seq
正向
和seq
反向
之间的间隔序列,并且所述间隔序列与seq
正向
和seq
反向
不互补;
75.并且式i所示的结构在转入人细胞后,形成式ii所示的二级结构:
[0076][0077]
式ii中,seq
正向
、seq
反向
和x的定义如上述,
[0078]
||表示在seq
正向
和seq
反向
之间形成的碱基互补配对关系。
[0079]
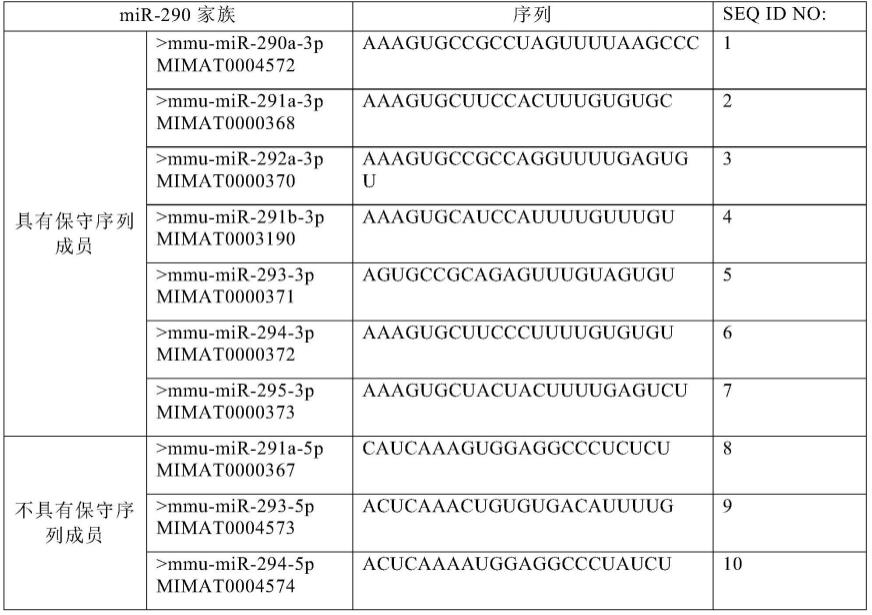
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
[0080]
图1为小鼠体外受精胚胎发育阶段及对应时间模式图。
[0081]
图2为原始体pri-mir-290的sirna干扰位置示意图。
[0082]
图3为原始体pri-mir-290的敲减效率检测图。
[0083]
图4为敲减pri-mir-290后成熟体分子的表达水平检测图。
[0084]
图5为敲减pri-mir-290后胚胎发育率统计曲线图。
[0085]
图6为敲减pri-mir-290后2-细胞期合子基因组激活相关基因和母源基因的表达检测图。
[0086]
图7为胚胎阻滞模型发育情况统计的模式图,图中比例尺为100μm,其中, p为正常
mksom-aa培养液中培养,-p为不添加丙酮酸的mksom-aa培养液中培养(胚胎阻滞)。
[0087]
图8为胚胎阻滞模型阻滞时期检测的免疫荧光图,caf1和cyclin b1分别为细胞周期中s期和g2期的标志物,γh2ax为dna损伤的标志物,图中比例尺为100μm,其中, p为正常mksom-aa培养液中培养,-p为不添加丙酮酸的mksom-aa培养液中培养(胚胎阻滞)。
[0088]
图9为阻滞胚胎合子基因组激活基因的表达水平检测图,其中, p为正常mksom-aa培养液中培养,-p为不添加丙酮酸的mksom-aa培养液中培养(胚胎阻滞)。
[0089]
图10为阻滞胚胎mir-290家族的表达水平检测图,其中, p为正常mksom-aa培养液中培养,-p为不添加丙酮酸的mksom-aa培养液中培养(胚胎阻滞)。
[0090]
图11为野生型和突变型荧光素酶载体测序比对图,其中,p21-3'utr-wt和p21-3'utr-mut分别为野生型和突变型载体,p21-3'utr-wt seq和p21-3'utr-wt seq为测序结果。
[0091]
图12为荧光素酶活性检测结果图,相较于其他组别,共转染mir-294-3p模拟物和p21-3'utr-wt的荧光素酶活性显著降低。
[0092]
图13为mir-294-3p在小鼠胚胎成纤维细胞中的过表达效率检测图。
[0093]
图14为小鼠胚胎成纤维细胞中转染mir-294-3p模拟物后的p21基因表达量检测图。
具体实施方式
[0094]
本发明人经过广泛而深入地研究,首次发现一类微小rna-290家族(mir-290家族)的表达可以用于鉴定胚胎发育的潜能。实验表明,在小鼠动物实验中,对mir-290家族的中的原始体分子pri-mir-290的敲减使得胚胎发育率显著下降(约62%);在利用阿非迪霉素构建的合子基因组激活损伤的胚胎发育阻滞模型中,mir-290家族的表达显著下降,说明mir-290家族的表达可以成为小鼠合子基因组激活的标志物。在此基础上完成了本发明。
[0095]
具体地,为了证明mir-290家族的表达可以成为小鼠合子基因组激活的标志物,首先对该家族的原始体分子pri-mir-290进行敲减,发现胚胎发育率显著下降约62%,zga相关基因merv-l、eif1a和hsp1b的表达水平显著下降,表明在缺失mir-290家族的胚胎中,zga的启动受到影响;进一步利用不添加丙酮酸的mksom-aa(-p)培养,所形成的阻滞胚胎作为阻滞模型,以正常培养液mksom-aa( p)作为对照,通过免疫荧光实验证明阻滞胚胎阻滞在细胞周期中的g2期,rt-qpcr实验表明阻滞胚胎中zga相关基因的表达显著下调,表明阻滞胚胎的合子基因组激活受到损伤;最后通过rt-qpcr实验表明,阻滞胚胎中mir-290家族的表达显著下降,表明mir-290家族的表达可以成为小鼠合子基因组激活的标志物,从而鉴定小鼠胚胎发育的潜能。
[0096]
术语
[0097]
胚胎发育潜能
[0098]
如本文所用,“胚胎发育潜能”指本发明中的胚胎经过合子基因组激活发育到囊胚阶段的能力。其中,“胚胎阻滞”、“发育阻滞”或“胚胎发育阻滞”可以互换使用,指合子基因组激活的失败导致胚胎发生“发育阻滞”的现象,即2-细胞阻滞(2-cell block)。
[0099]
如本文所用,“胚胎”包括不同发育阶段的胚胎,如原核期的胚胎、2-细胞阶段的胚胎、4-细胞阶段的胚胎、8-细胞阶段的胚胎、桑椹胚或囊胚。本发明中“胚胎”可以为非人哺乳动物的胚胎,如来自啮齿动物(如小鼠或大鼠)的胚胎。
[0100]
mirna及其前体
[0101]
mirna可从前体mirna(precursor mirna,pre-mirna)加工而来,所述的前体mirna可折叠成一种稳定的茎环(发夹)结构,所述的茎环结构长度一般在50-100bp之间。所述的前体mirna可折叠成稳定的茎环结构,茎环结构的茎部两侧包含基本上互补的两条序列。所述的前体mirna可以是天然的或是人工合成的。
[0102]
前体mirna可被剪切生成mirna,所述的mirna可与编码基因的mrna的至少一部分序列基本上互补。如本文所用,“基本上互补”是指核苷酸的序列是足够互补的,可以以一种可预见的方式发生相互作用,如形成二级结构(如茎环结构)。通常,两条“基本上互补”的核苷酸序列互相之间至少有70%的核苷酸是互补的;优选的,至少有80%的核苷酸是互补的;更优选的,至少有90%的核苷酸是互补的;进一步优选的,至少有95%的核苷酸是互补的;如98%、99%或100%。一般地,两条足够互补的分子之间可以具有最多40个不匹配的核苷酸;优选的,具有最多30个不匹配的核苷酸;更优选的,具有最多20个不匹配的核苷酸;进一步优选的,具有最多10个不匹配的核苷酸,如具有1、2、3、4、5、8、11个不匹配的核苷酸。
[0103]
如本文所用,“茎环”结构也被称作“发夹”结构,是指一种核苷酸分子,其可形成一种包括双链区域(茎部)的二级结构,所述的双链区域由该核苷酸分子的两个区域(位于同一分子上)形成,两个区域分列双链部分的两侧;其还包括至少一个“环”结构,包括非互补的核苷酸分子,即单链区域。即使该核苷酸分子的两个区域不是完全互补的,核苷酸的双链部分也可保持双链状态。例如,插入、缺失、取代等可导致一个小区域的不互补或该小区域自身形成茎环结构或其它形式的二级结构,然而,该两个区域仍可基本上互补,并在可预见的方式中发生相互作用,形成茎环结构的双链区域。茎环结构是本领域技术人员所熟知的,通常在获得了一条具有一级结构的核苷酸序列的核酸后,本领域技术人员能够确定该核酸是否能形成茎环结构。
[0104]
如本文所用,“分离的”是指物质从其原始环境中分离出来(如果是天然的物质,原始环境即是天然环境)。如活体细胞内的天然状态下的多聚核苷酸和多肽是没有分离纯化的,但同样的多聚核苷酸或多肽如从天然状态中同存在的其他物质中分开,则为分离纯化的。
[0105]
如本文所用,所述的“mirna”是指一种rna分子,从可形成mirna前体的转录物加工而来。成熟的mirna通常具有18-26个核苷酸(nt)(更特别的约19-22nt),也不排除具有其它数目核苷酸的mirna分子。mirna通常可被northern印迹检测到。
[0106]
本发明所述的mirna选自如seq id no:1-10所示的序列。为了提高mirna的稳定性或其它性质,还可在所述的mirna的至少一端加上至少一个保护性碱基等。
[0107]
micrornas(mirnas)作为表观遗传调节因子参与许多生物学过程和疾病,但是在植入前胚胎中的具体作用尚不明确,尤其在合子基因组激活中的作用。之前的研究表明mir-290家族可以通过增强核心转录因子oct3/4和cmyc维持胚胎干细胞的多能性。
[0108]
本发明所述的mir-290家族是小鼠合子基因组激活后首先表达的mirnas家族之一,具有保守基序“aagugc”,比较特殊的是,该家族成员的表达均来自同一个原始体分子pri-mir-290。此外,该家族的表达水平占胚胎mirnas总量的三分之一,表明mir-290家族可能通过其直接靶点调控植入前胚胎的发育,但是该家族在胚胎发育以及合子基因组激活中的具体作用机制有待进一步探讨。
[0109]
在本发明的一个优选实施例中,探索了mir-290家族在小鼠早期胚胎合子基因组激活(zga)中的作用及其调节机制。结果表明,mir-290家族成员从2-细胞阶段开始表达,直到囊胚阶段持续升高。原始体的pri-mir-290缺失导致胚胎发育率降低和大约62%的胚胎阻滞在2-细胞阶段s期。进一步研究发现mir-290家族成员的共同保守序列为“aagugc”,利用在线数据库预测并分析得到33个候选靶基因,利用荧光素酶和qpcr验证p21为该家族的一个直接靶基因。以上这些结果表明,mir-290家族直接作用于p21参与调控胚胎发育潜能。
[0110]
本发明中的mir-290家族中的序列信息如下:
[0111][0112]
mir-290家族原始体分子pri-mir-290的ncbi的参考序列号为nr_028425.1。
[0113]
反义寡核苷酸
[0114]
根据本发明所提供的mirna序列,可以设计出了其反义寡核苷酸,所述的反义寡核苷酸可在体内下调相应的mirna的表达。如本文所用,“反义寡核苷酸(antisense-oligonucleotides,as-ons或aso)”又称为“反义核苷酸”,是指长度约为18-26nt(更特别的约19-22nt)的dna分子或rna分子或其类似物。
[0115]
在本发明中,所述的“反义寡核苷酸”还包括采用如基于核酸锁或核酸链骨架修饰技术等手段获得的经修饰的反义核苷酸,所述的修饰基本不改变反义寡核苷酸的活性,更佳地,所述修饰可提高反义寡核苷酸的稳定性、活性或治疗效果。核酸锁(locked nucleic acid,lna)通常是指通过一个亚甲基桥将核糖的2'氧原子和4'碳原子连接起来的修饰技术。lna能延长mirna的血清半衰期,提高对靶标亲和性,减少脱靶作用的范围和程度。基于核酸链骨架的修饰技术发展出的反义药物在可溶性,抗核酸酶降解等方面大有改善,且易于大量合成。寡核苷酸的骨架修饰方法有多种,包括硫代法,例如将脱氧核苷酸链硫代修饰为硫代脱氧核苷酸链。该方法是将dna骨架上的磷酸键的氧原子用硫原子替代,可抵抗核酸酶降解。应理解,任何能够保持所述反义寡核苷酸的大部分或全部活性的修饰都包含在本
发明中。
[0116]
作为本发明的优选方式,对反义寡核苷酸进行核酸锁修饰;更佳地还进行硫代修饰。
[0117]
多核苷酸构建物
[0118]
根据本发明所提供的mirna序列,可设计出在被导入后可被加工成可影响相应的mrna表达的mirna的多核苷酸构建物,也即所述多核苷酸构建物能够在体内上调相应的mirna的量。因此,本发明提供了一种分离的多核苷酸(构建物),所述的多核苷酸(构建物)可被人或动物细胞转录成前体mirna,所述的前体mirna可被人或动物细胞剪切且表达成所述的mirna。
[0119]
作为本发明的一种优选方式,所述的多核苷酸构建物含有式i所示的结构:
[0120]
seq
正向-x-seq
反向
[0121]
式i
[0122]
式i中,
[0123]
seq
正向
为可在细胞中表达成所述的mirna的核苷酸序列,seq
反向
为与seq
正向
基本上互补的核苷酸序列;或者,seq
反向
为可在细胞中表达成所述的mirna的核苷酸序列,seq
正向
为与seq
正向
基本上互补的核苷酸序列;
[0124]
x为位于seq
正向
和seq
反向
之间的间隔序列,并且所述间隔序列与seq
正向
和seq
反向
不互补;
[0125]
式i所示的结构在转入细胞后,形成式ii所示的二级结构:
[0126][0127]
式ii中,seq
正向
、seq
反向
和x的定义如上述;
[0128]
||表示在seq
正向
和seq
反向
之间形成的碱基互补配对关系。
[0129]
通常,所述的多核苷酸构建物位于表达载体上。因此,本发明还包括一种载体,它含有所述的mirna,或所述的多核苷酸构建物。所述的表达载体通常还含有启动子、复制起点和/或标记基因等。本领域的技术人员熟知的方法能用于构建本发明所需的表达载体。这些方法包括体外重组dna技术、dna合成技术、体内重组技术等。所述的表达载体优选地包含一个或多个选择性标记基因,以提供用于选择转化的宿主细胞的表型性状,如卡拉霉素、庆大霉素、潮霉素、氨苄青霉素抗性。
[0130]
芯片
[0131]
microrna表达谱芯片通常含有多达几百个探针,涵盖多种microrna,利用dna双链同源互补的原理在全基因组水平上检测样本中所含各种microrna的含量。此外,小鼠中mir-290家族与人的mir-302家族具有保守的种子序列“aagugc”,因此在功能可能也存在保守性,可以应用到人的检测当中。因此,可在同一时间对待测样本中全基因组范围内的microrna的转录水平进行检测。
[0132]
表a.小鼠与人比较序列保守性:
[0133][0134]
其中,下划线为保守的种子序列。
[0135]
利用本发明所述的mirna序列,还可以制备相应的mirna芯片,进而研究其表达谱以及mirnas的调节方式。
[0136]
本发明的所述的mirna芯片包括固相载体以及有序固定在所述固相载体上的寡核苷酸探针。
[0137]
具体地,可根据本发明所述的mirna,设计出适合的探针,固定在固相载体上,形成“寡核苷酸阵列”。所述的“寡核苷酸阵列”是指具有可寻址位置(即以区别性的,可访问的地址为特征的位置)的阵列,每个可寻址位置均含有一个与其相连的特征性寡核苷酸。根据需要,可将寡核苷酸阵列分成多个亚阵。
[0138]
所述固相载体可采用基因芯片领域的各种常用材料,例如但不限于尼龙膜,经活性基团(如醛基、氨基等)修饰的玻片或硅片、未修饰的玻片、塑料片等。
[0139]
所述的mirna芯片的制备可采用本领域已知的生物芯片的常规制造方法。例如,如果固相载体采用的是修饰玻片或硅片,探针的5'端含有氨基修饰的聚dt串,可将寡核苷酸探针配制成溶液,然后采用点样仪将其点在修饰玻片或硅片上,排列成预定的序列或阵列,然后通过放置过夜来固定,就可得到本发明的mirna芯片。如果核酸不含氨基修饰,则其制备方法也可参照:王申五主编的《基因诊断技术-非放射性操作手册》;j.l.erisi,v.r.iyer,p.o.brown.exploring the metabolic and genetic control of gene expression on a genomic scale.science,1997;278:680和马立人,蒋中华主编.生物芯片.北京:化学工业出版社,2000,1-130。
[0140]
另一方面,本发明还提供了一种通过mirna芯片检测人组织中mirna表达谱的方法,包括步骤:
[0141]
(1)提供分离自人组织的rna样品,在所述的rna上设置标记物;
[0142]
(2)将(1)的rna与所述的芯片接触,使所述的rna与固相载体上的寡核苷酸探针发生杂交反应,从而在固相载体上形成“寡核苷酸探针-rna”二元复合物;
[0143]
(3)检测(2)形成的二元复合物的标记物,从而确定人组织中相应的mirna的表达谱。
[0144]
从人组织中提取rna的方法是本领域技术人员熟知的方法,包括trizol法。
[0145]
更优选的,在步骤(1)中,在从人组织组织中分离出rna样品后,对rna样品进行适当处理,以富集具有一定长度的rna,所述长度一般在10-100之间(小片段rna)。在经过上述处理后,利用这些小片段rna进行后续的杂交,这样可提高芯片捕获mirna的准确性。本领域人员可方便地分离出具有一定片段长度的rna,比如可采用凝胶电泳法来分离。
[0146]
对rna进行标记也是本领域技术人员熟知的方法,其可通过在杂交时加入与rna特异性结合的标记物的方法实现,所述标记物比如是标记基团。所述的标记基团包括但不限于:地高辛分子(dig)、生物素分子(bio)、荧光素及其衍生生物分子(fitc等)、其它荧光分子(如cy3、cy5等)、碱性磷酸酶(ap)、辣根过氧化物酶(hrp)等。这些标记及其标记方法都已是本领域众所周知的常规技术。
[0147]
将上述的rna与mirna芯片进行杂交时,可以先将mirna芯片与预杂交缓冲液进行预杂交。
[0148]
本发明所述的rna与mirna芯片之间的固相杂交按照本领域的经典方法进行,本领域一般人员依据经验容易确定有关缓冲液、探针和样本浓度、预杂交温度、杂交温度以及时间等的最适条件。或者也可以参照《分子克隆实验指南》中所述的。
[0149]
然后根据标记信号在mirna芯片上的位置、强度等信息获取待测信息。若扩增产物用荧光基团标记,也可直接用荧光检测设备(如激光共聚焦扫描仪scanarray 3000等)获取待测信息。
[0150]
检测试剂盒
[0151]
本发明还提供了一种试剂盒,所述的试剂盒中含有本发明的芯片。所述的试剂盒可用于检测mirna的表达谱;或用于诊断体外受精-胚胎移植的妊娠结局,优选的,所述的试剂盒中还含有用于标记rna样品的标记物,以及与所述标记物相对应的底物。
[0152]
此外,所述的试剂盒中还可包括用于提取rna、pcr、杂交、显色等所需的各种试剂,包括但不限于:抽提液、扩增液、杂交液、酶、对照液、显色液、洗液、抗体等。
[0153]
此外,所述的试剂盒中还可包括使用说明书和/或芯片图像分析软件。
[0154]
本发明的主要优点包括
[0155]
1.本发明阐明mir-290家族在小鼠植入前胚胎中的功能,提出通过检测mir-290家族的表达鉴定胚胎发育阻滞的新方法。
[0156]
2.本发明阐明mir-290家族可以成为小鼠合子基因组激活的标志物。
[0157]
3.本发明提供本领域急需的能够用于鉴定体外检测胚胎发育潜力的mirnas生物标志分子。
[0158]
4.本发明发现p21是mir-290家族的一个直接下游靶基因,mir-290家族通过直接作用p21基因影响胚胎发育潜能。
[0159]
下面结合具体实施例,进一步陈述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明详细条件的实验方法,通常按照常规条
件如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
[0160]
实验方法
[0161]
1、培养液配制
[0162]
培养液所需药品除特殊说明外,均购置于sigma公司。
[0163]
(1)htf培养液
[0164][0165]
注:na-lactate 60%syrup、丙酮酸钠和cacl2·
2h2o先单独溶于10ml胚胎水中,震荡混匀。
[0166]
(1)m2体外操作液
[0167]
浓储液种类及成分:
[0168]
[0169][0170]
m2体外操作液:
[0171][0172]
(3)mkosm-aa培养液
[0173]
浓储液种类及成分:
[0174]
[0175][0176]
注:*浓储液g为200
×
l-glutamax储液,购置于gibco公司。
[0177]
mksom-aa培养液:
[0178][0179]
注:*eaa和neaa为100
×
储液,购置于gibco公司。配制无丙酮酸的培养液(-p)时,浓储液c用ddh2o代替。
[0180]
2、体外受精
[0181]
(1)超数排卵
[0182]
选择鼠龄6-8周的雌鼠,在光控条件下进行常规饲养,皮下注射10ui pmsg,48h后腹腔注射10ui hcg。
[0183]
(2)受精液、获能液、发育液的预平衡
[0184]
在体外受精的前一天晚上,将配制好的受精液和获能液做滴,受精滴和获能滴为200μl、胚胎发育液做成微滴(50μl/滴)于falcon 60厘米皿中,然后盖上矿物油,放到37℃、5%co2培养箱中过夜平衡,以备用。
[0185]
(3)精子获能
[0186]
选择8-11周的雄鼠,采用颈椎脱臼法将其处死。在小鼠腹部靠下剪开一个小口,取出附睾尾将其放在过火灭菌的滤纸上,将附睾尾轻轻剪开一个小口,然后稍用力挤压附睾挤出精子,用玻璃针将精液挑出放入到提前平衡好的获能液中获能1-1.5h用于体外受精。
[0187]
(4)体外受精
[0188]
将进行过超排处理的雌鼠,采用颈椎脱臼法将其处死,然后在其背部剪开一个小口,取出其输卵管,在显微镜下将输卵管的膨大部用镊子撕开,释放出卵丘卵母细胞复合体。加入8-10μl的精子(2
×
10
5-1
×
106个),放入37℃5%co2培养箱中培养5.5-6h。
[0189]
3、胚胎体外培养
[0190]
将完成受精的胚胎使用m2体外操作液清洗胚胎3次,放入预先平衡好的胚胎培养液中继续培养。并分别在受精后(hours post ivf,hpi)10h、30h、48h、56h、76h、100h和120h
收集原核期、2-细胞、4-细胞、8-细胞、桑椹胚、囊胚和孵化囊胚阶段的胚胎(如图1)。
[0191]
4、显微注射
[0192]
将稀释好的si-control和sirna(001-003)溶液使用无酶上样枪头从注射针末端灌入,正置5min直到溶液流入针尖,使用显微操作臂将上述溶液注入小鼠原核期胚胎中。m2操作液清洗三遍放入mksom-aa培养液中培养。
[0193]
5、基因表达水平检测
[0194]
(1)mrnas提取:利用试剂盒rneasy
○
r micro kit(qiagen,74004)推荐的各试剂用量和提取方法提取总mrnas并测量总mrnas的浓度。
[0195]
(2)mrna反转录:按照试剂盒primescript
tm rt reagent kit with gdna eraser(takara,rr047a)推荐的两步法进行反转录。
[0196]
a.基因组dna去除反应体系
[0197][0198]
反应条件:42℃,2min。
[0199]
b.反转录反应体系
[0200][0201]
反应条件:37℃,15min;85℃,5s。
[0202]
(3)rt-qpcr:按照试剂盒kapafast qpcr kit master mix universal(kapa biosystem,kr0389)荧光染料法进行实验,通过2-δδct
法对各基因的mrna 相对表达量进行分析。
[0203]
rt-qpcr 反应体系
[0204][0205]
反应条件
[0206][0207]
6、免疫荧光染色
[0208]
(1)固定。室温下,胚胎经1
×
pbs清洗后,放置于4%多聚甲醛(pfa)孵育30min,湿盒避光。
[0209]
(2)通透。室温下,1
×
pbs清洗胚胎3次后,放置于if buffer中孵育30min。
[0210]
if buffer组分
[0211][0212]
(3)一抗孵育。将胚胎放置于用if buffer按比例稀释好的一抗工作液中,4℃避光过夜孵育。
[0213]
抗体名称、来源及稀释比例
[0214][0215]
(4)二抗孵育。室温下,if buffer清洗胚胎3次后,将胚胎放置于用if buffer按1:1000稀释好的二抗工作液中避光孵育1h。之后放置于用if buffer按1:5000稀释的dapi中避光染色10min。
[0216]
(5)封片。预先在载玻片上边缘滴凡士林(防止压片时将胚胎压碎),在载玻片中间位置放一滴防荧光淬灭剂。将胚胎转移到载玻片上的防荧光淬灭剂中,避免气泡,缓慢盖上盖玻片,边缘使用适量指甲油封片。待指甲油干燥后,-20℃保存或直接镜检。
[0217]
(6)共聚焦成像。使用内蒙古大学公共仪器平台a1共聚焦成像显微镜扫描成像。
[0218]
7、荧光素酶报告实验
[0219]
(1)序列设计。通过mirbase和target scan等数据库查找并设计p21-3'utr-wt(野生型)和p21-3'utr-mut(突变型),序列如下表。
[0220][0221]
(2)载体构建。将合成的p21-3'utr-wt和p21-3'utr-mut上下游序列经退火后形成的双链dna,与双酶切后的荧光素酶载体连接,转化工程菌dh5α,挑取单克隆后测序鉴定。
[0222][0223]
退火条件:90℃,3mins;37℃,15mins(水浴)。
[0224]
(3)转染。培养小鼠胚胎成纤维细胞至嵌合度80-90%,使用脂质体转染试剂lipofectamine 2000与构建成功的p21-3'utr-wt和p21-3'utr-mut载体按比例混合后加入到培养皿中,贴壁转染4h后换10%fbs/dmem培养液,继续培养24h,备用。
[0225]
(4)荧光素酶活性检测。制备被动裂解液(passive lysis buffer,plb)、荧光素酶实验试剂(luciferase assay reagents ii,lar ii)和stop&glo
○
r reagent;将plb加入到转染后的细胞中,培养皿置于摇床上室温裂解15mins;将溶解产物收集到1.5ml离心管中,最大转速4℃离心30s后,转移上清到新的离心管中,上机检测荧光素酶活性。
[0226]
8、数据统计与分析
[0227]
所有实验数据结果均通过spss statistics进行显著性差异分析,*表示p《0.05有差异,**表示p《0.01为差异显著,***表示p《0.001为差异极显著,不同字母表示有显著差异。
[0228]
实施例1.pri-mir-290的缺失影响合子基因组的激活
[0229]
设计并合成特异靶向pri-mir-290的三种sirnas和阴性对照si-control(如图2),注射到小鼠原核期胚胎中,24小时后收集100枚2-细胞胚胎进行干扰效率检测。结果显示,相较于si-control、sirna-001和sirna-003,在注射sirna-002的胚胎中pri-mir-290的表达水平降低>75%(如图3),同时mir-290家族成熟体分子mir-291a-5p、mir-292a-3p、mir-293-5p、mir-293-3p、mir-293-5p、mir-294-3p均有40%-80%的表达下调(如图4),表明sirna-002的干扰效率最佳,将sirna-002称作si-pri-290。进一步对注射si-pri-290的胚胎进行发育率统计,结果显示,注射si-pri-290后的各阶段胚胎发育率显著下降,约62%的胚胎阻滞在2-细胞阶段(如图5,表1)。合子基因组激活和母源相关基因表达水平检测结果显示,合子基因组激活相关基因merv-l、eif1a和hsp1b下调,而母源相关基因dppa3、gdf9和smarca4的表达上调(如图6)。上述结果表明,pri-mir-290的缺失影响合子基因组的激活。
[0230]
表1.胚胎发育率
[0231][0232]
实施例2.阻滞于细胞周期g2期的胚胎发育阻滞模型
[0233]
为了证明mir-290家族与合子基因组激活的关系,使用胚胎发育阻滞的模型(缺乏丙酮酸的培养液导致胚胎发育阻滞)进行实验。同时将体外受精后的胚胎放置于正常mksom-aa( p)和不添加丙酮酸的mksom-aa(-p)的培养液中,分别在受精后10h、30h、48h、56h、76h、100h观察 p和-p两个组中胚胎的发育情况(如图7),结果表明使用缺乏丙酮酸的mksom-aa所培养的胚胎阻滞在2-细胞胚胎阶段。进一步在受精后36h,即2-细胞阶段晚期收集 p和-p两个组的2-细胞胚胎进行免疫荧光实验和基因表达水平检测,分别使用caf1、cyclin b1和γh2ax抗体标记细胞周期中s期、g2期和dna损伤情况,结果显示,-p组中的胚胎被cyclin b1和γh2ax着色,表明-p组的胚胎阻滞在细胞周期中的g2期,dna存在损伤(如图8);另外,rt-qpcr结果显示,-p组中胚胎的合子基因组激活相关基因(zcsan4d、merv-l、eif1a和hsp1b)的表达水平较 p组显著降低(如图9)。
[0234]
以上结果表明,阻滞胚胎阻滞在细胞周期中的g2期,dna受到损伤,合子基因组激活受到影响。
[0235]
实施例3.阻滞胚胎中mir-290家族的表达显著下降
[0236]
使用胚胎发育阻滞的模型,进一步检测mir-290家族在阻滞胚胎和正常发育胚胎中的表达差异,结果显示,不论是原始体分子pri-mir-290还是成熟体分子mir-291a-5p、mir-292a-3p、mir-293-5p、mir-293-3p、mir-294-5p、mir-294-3p,阻滞胚胎中的表达均显著低于正常胚胎(如图10),表明合子基因组激活受到影响的情况下,mir-290家族的表达水平同样受到影响。
[0237]
实验结论
[0238]
通过上述实验结果,可以得出mir-290家族的表达可以作为鉴定小鼠合子基因组激活的标志物,为胚胎发育潜能的鉴定提供了新的检测方法。
[0239]
实施例4.mir-290家族与p21在胚胎中的相互作用关系
[0240]
为了进一步揭示mir-290家族引起胚胎发育阻滞的具体机制,利用在线数据库预测并通过荧光素酶实验证明细胞周期抑制因子p21是该家族的一个直接下游靶基因(如图12)。测序结果显示,p21-3'utr-wt(野生型)和p21-3'utr-mut(突变型)荧光素酶载体构建成功(如图11)。在小鼠胚胎成纤维细胞中转染mir-294-3p模拟物后,mir-294-3p的表达相较于对照组上调》3000倍(如图13),而p21的表达下调约50%(如图14)。
[0241]
这些结果表明,p21是mir-290家族的一个直接下游靶基因。mir-290家族通过直接作用p21基因影响胚胎发育潜能。
[0242]
本研究利用荧光素酶实验表明mir-290家族通过保守序列“aagugc”直接作用p21 mrna的3'utr。
[0243]
讨论:
[0244]
目前的研究已表明mirnas参与胚胎合子基因组激活(zga),许多mirnas在哺乳动物胚胎发育中的功能也被发现,例如mmu-mir-199a-5p,bta-mir-125b等等。然而,mirnas的作用机制并未研究透彻,包括mirnas自身调节和参与的信号通路。
[0245]
如前所述,mir-290家族是小鼠植入前胚胎中含量最丰富的mirnas之一,因此检测该家族中成熟体mirnas及其原始体pri-mir-290的表达动态,结果表明从该家族的表达从2-细胞阶段开始,直到囊胚阶段持续升高。这个结果符合之前已有的研究,但是目前未发现有关于pri-mir-290表达动态的报道。在斑马鱼中,母源mirnas对于斑马鱼早期胚胎发育至关重要,此外母源dicer因合成mir-430所必须也非常重要。在小鼠中,母源mirnas let-7可能通过lin28a和lin28b调控母源合子转变,但是合子转录的mir-290家族的具体作用尚不明确。
[0246]
mirnas及其靶基因的具体作用机制相对复杂,单个mirna可以同时调节多个mrna,而某个mrna也可能同时被多个mirnas调节。已有研究表明,母源或合子dgcr8敲除的胚胎同样可以发育到囊胚阶段。然而,pri-mir-290的缺失导致胚胎发育率从2-细胞阶段开始降低、zga起始异常,但是dna没有损伤。mir-290家族相较于其他mirna家族最大的特点在于,该家族成员均是由一个原始体分子pri-mir-290加工形成,因此基于这种碱基配对的原理,mir-290家族的成员可能发挥同样的作用。
[0247]
进一步为了探究mir-290家族的作用机制,利用在线数据库搜索了该家族的下游直接靶基因并且利用基因本体分析方法分析了这些基因。结果显示,p21是一个共同下游靶基因,p21参与到多个生物学过程和分子功能中。已有研究暗示mir-290家族可能在escs中通过调节细胞周期而维持多能性,但是直接作用关系并不明确。本研究利用荧光素酶实验表明mir-290家族通过保守序列“aagugc”直接作用p21 mrna的3'utr。
[0248]
综上所述,研究表明mir-290家族在小鼠植入前胚胎发育中发挥重要的作用。该家族表达的降低会影响zga的起始、zga marker基因的表达以及胚胎的发育潜能。对于mir-290家族功能在植入前胚胎中的研究,为进一步阐释mirnas参与调控zga过程和胚胎发育潜能的机制提供了新的认识。
[0249]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。