1.本发明涉及生物医药技术领域,尤其是涉及一种利用高效液相色谱测定注射用替奈普酶中聚山梨酯20含量的方法。
背景技术:
2.注射用替奈普酶(tnk-tpa)是迄今为止最安全有效且使用最方便的溶栓药,目前国内已上市的有第一代重组天然tpa类产品,商品名“爱通立”;第二代为采用大肠杆菌表达的tpa类产品,即瑞替普酶;而替奈普酶(tnk-tpa)是世贸天阶制药(江苏)有限责任公司生产的第三代tpa类产品,是目前可以单次静脉推注的溶栓药品种,其具有一针救命,使用方便的特点,更加适合急救,使得溶栓治疗在院外进行成为可能,具有划时代的意义。而为了提高替奈普酶(tnk-tpa)的质量标准,需要建立制剂中聚山梨酯20的检验方法和控制要求。
3.对于原辅料中聚山梨酯20的检测,2020版《中国药典》中收纳的方法为气相色谱测定脂肪酸组成,参照聚山梨酯80使用二氯甲烷萃取法测定含量、但由于生物制品中聚山梨酯20是作为辅料使用,含量较低,且生物制品中组分较为复杂,辅料之间存在一定影响,因此上述方法不适用于该产品中聚山梨酯20含量测定。
4.现有技术中公开了报道采用示差折光检测器检测聚山梨酯20含量,但仅适用于单一聚山梨酯20物质存在的前提下进行测定,由于生物制品中组分较为复杂,辅料之间存在一定影响,色图谱峰型较差、出峰时间长、准确度差等问题,因此该方法不适合用于替奈普酶(tnk-tpa)中聚山梨酯20含量的检测。
5.因此,针对上述问题,为了提高替奈普酶(tnk-tpa)制剂的质量,亟需提供一种特别适用于检测替奈普酶(tnk-tpa)中聚山梨酯20的检测方法。
技术实现要素:
6.本发明的目的在于提供一种利用高效液相色谱测定注射用替奈普酶中聚山梨酯20含量的方法。
7.为达到本发明之目的,采用如下技术方案:
8.一种利用高效液相色谱测定注射用替奈普酶中聚山梨酯20含量的方法,包括如下步骤:
9.a)将注射用替奈普酶样品用水溶解,得样品溶液;
10.b)将上述样品溶液注入高效液相色谱仪;
11.c)记录色谱图,根据外标法计算注射用替奈普酶样品中聚山梨酯20含量。
12.优选的,每瓶所述注射用替奈普酶样品中聚山梨酯20的含量为1.5~4.0mg。
13.优选的,所述步骤b)中,高效液相色谱仪的色谱条件如下:
14.色谱柱:混合型阴离子小柱;
15.流动相:a相为2%甲酸溶液,b相为2%甲酸异丙醇溶液;
16.柱温:25~35℃;
17.流速:0.9~1.1ml/min;
18.进样量:5μl。
19.优选的,所述色谱柱为waters oasis max。
20.优选的,所述色谱柱的规格为:30um,2.1
×
20mm
21.与现有技术相比,本发明具有如下有益效果:
22.本发明采用waters oasis max色谱柱,并采用2%甲酸溶液和2%甲酸异丙醇溶液作为流动相对注射用替奈普酶样品中聚山梨酯20的含量进行检测,与现有技术相比,无需进行柱前/柱后衍生化即可完成对注射用替奈普酶样品中聚山梨酯20的含量的检测;且本发明的方法具有检测专属性、重复性好、线性范围宽及精密度高等优点,为注射用替奈普酶产品制定了一个科学、严格的内控标准,有效的提高了注射用替奈普酶产品的质量。
附图说明
23.为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍。
24.图1为本发明实施例1的方法测定注射用替奈普酶样品的hplc图;
25.图2为本发明实施例1的方法测定相同浓度的聚山梨酯20标准品的hplc图;
26.图3为本发明实施例2的方法测定注射用替奈普酶样品的hplc图;
27.图4为本发明实施例3的方法测定注射用替奈普酶样品的hplc图;
28.图5为本发明实施例4的方法测定注射用替奈普酶样品的hplc图;
29.图6为本发明实施例4的方法测定测定相同浓度的聚山梨酯20标准品的hplc图;
30.图7为本发明实施例5的方法测定注射用替奈普酶样品的hplc图;
31.图8为本发明实施例5的方法测定测定相同浓度的聚山梨酯20标准品的hplc图;
32.图9为聚山梨酯20标准品的标准曲线图。
具体实施方式
33.为了使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的技术方案进行清楚、完整的描述,显然,所描述的实施例是本发明的部分实施例,而不是全部实施例。
34.本文中所述“注射用替奈普酶(tnk-tpa)”为世贸天阶制药(江苏)有限责任公司生产,规格为20mg/瓶;高效液相色谱检测仪为corona veo。
35.本发明提供的一种利用高效液相色谱测定注射用替奈普酶中聚山梨酯20含量的方法,包括如下步骤:
36.a)将注射用替奈普酶样品用水溶解,得样品溶液;
37.b)将上述样品溶液注入高效液相色谱仪;
38.c)记录色谱图,根据外标法计算注射用替奈普酶样品中聚山梨酯20含量。
39.其中,每瓶所述注射用替奈普酶样品中聚山梨酯20的含量为1.5~4.0mg。
40.所述步骤b)中,高效液相色谱仪的色谱条件如下:
41.色谱柱:混合型阴离子小柱;具体为waters oasis max,其规格为2.1
×
20mm;
42.流动相:a相为2%甲酸溶液,b相为2%甲酸异丙醇溶液;
43.柱温:25~35℃;
44.流速:0.9~1.1ml/min;
45.进样量:5μl。
46.实施例1
47.a)将注射用替奈普酶样品和聚山梨酯20标准品用水溶解,得样品溶液和标准品储备液;而后将标准品储备液用2%甲酸溶液分别稀释至200ug/ml、300ug/ml、400ug/ml、500ug/ml、600ug/ml、700ug/ml系列溶液作为对照溶液;
48.b)分别取上述样品溶液及对照溶液各5μl注入高效液相色谱仪;色谱条件如下:
49.色谱柱:waters oasis max,30um,2.1
×
20mm;
50.流动相:a相为2%甲酸溶液,b相为2%甲酸异丙醇溶液;
51.检测器:corona veo(cad);
52.柱温:30℃;
53.流速:1.0ml/min;
54.进样量:5μl。
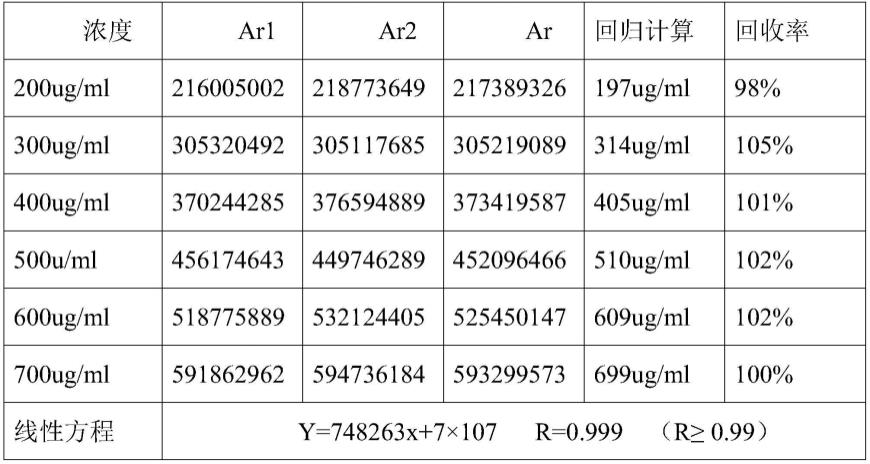
55.c)记录注射用替奈普酶样品和聚山梨酯20标准品色谱图,按照外标法以峰面积计算即得,分别如图1和图2所示;从图1中可以看出,采用本发明的方法对注射用替奈普酶样品的中聚山梨酯20进行检测时,聚山梨酯20与其他成分有良好的分离度,理论塔板和拖尾因子等系统适应性符合药典的要求;从图2可看出,注射用替奈普酶样品中聚山梨酯20的保留时间与聚山梨酯20标准品的保留时间一致。
56.实施例2
57.在实施例1的基础上,将色谱条件的中的流速修改为0.97ml/min,其余参数及操作如实施例1所示,测定结果如图3所示,从图3中可以看出,改变了流速后,聚山梨酯20的出峰时间略有延长,但各参数均符合要求。
58.实施例3
59.在实施例1的基础上,将色谱条件的中的流速修改为1.03ml/min,其余参数及操作如实施例1所示,测定结果如图4所示,从图4中可以看出,改变了流速后,聚山梨酯20的出峰时间略有缩短,但各参数均符合要求。
60.实施例4
61.在实施例1的基础上,将色谱条件的中的柱温修改为25℃,其余参数及操作如实施例1所示,测定结果如图5和图6所示,从图5和图6可以看出,改变了温度后,聚山梨酯20出峰时间略有缩短,但各参数均符合要求。
62.实施例5
63.在实施例1的基础上,将色谱条件的中的柱温修改为35℃,其余参数及操作如实施例1所示,测定结果如图7和图8所示,从图7和图8可以看出,改变了温度后,聚山梨酯20出峰时间略有缩短,但各参数均符合要求。
64.1、线性关系检测
65.采用高效液相色谱仪,按实施例1所述色谱条件进行检测,取聚山梨酯20标准品用2%甲酸稀释制成每1ml溶液中含200ug/ml、300ug/ml、400ug/ml、500ug/ml、600ug/ml、
700ug/ml的系列溶液作为对照溶液,绘制标准曲线并依次记录相应的峰面积,以峰面积为(y)纵坐标,其浓度(x)为横坐标进行线性回归,得回归方程y=748263x 7
×
107,r=0.999即浓度在200~700ug/ml之内,聚山梨酯20的含量与峰面积呈良好的线性关系,测试数据如表1所示,标准曲线图如图9所示。
66.表1
[0067][0068]
2、准确度检测
[0069]
采用高效液相色谱仪,按实施例1所述色谱条件进行检测,取注射用替奈普酶样品一支,加标示量水复溶后得到样品溶液,取样品溶液适量与对照溶液混合,分别制成含对照溶液为200ug/ml、400ug/ml、600ug/ml的质控样品溶液,计算对照溶液的回收率(%),结果如表2所示,结果显示本发明的方法准确度良好。
[0070]
表2
[0071][0072][0073]
所述对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。