1.本发明涉及新型超分子合成技术领域,具体为一种有机配体化合物、制备方法,以及由该有机配体化合物组装的四面体超分子及制备方法。
背景技术:
2.超分子化学作为一门研究非共价键作用的学科,越来越被人们所重视。在众多非共价键作用中,以金属配位键驱动的自组装方式具有定向性和可控性的优点,被广泛应用于超分子的构建当中。含氮的有机配体是大部分超分子组装常见的配体,分为单齿,双齿到三齿配体等。目前,科研工作者利用单齿类单吡啶配体和双齿类二联吡啶配体和三齿类三联吡啶配体,在过去几十年中成了许多优美的三维超分子结构。如四面体、立方八面体、多层柱状结构等。其中四面体是一种常见的立体结构,英国剑桥大学的nitschke教授利用吡啶亚胺体系合成了一系列的四面体结构;美国阿克隆大学newkome利用利用定向柔性策略,将三个夹角为60
°
的“v”型配体用三苯并-27-冠醚-9作为顶点连接起来作为配体,与zn
2
离子自组装形成了一个由四个不共边的三角形组成的四面体结构。
3.现有研究表明,三维金属超分子结构在光电催化、人工模拟酶、主客体识别、光电器件制备、荧光探针等应用领域有着潜在的研究价值,通过基于多角度配体配位体系构建了许多不同类型的四面体结构,然而基于两种两种以上类型配位体系形成的四面体结构却并不多见。这一构建方法不仅简单、有利于大规模的合成,同时,由于在超分子结构种同时引入了三联吡啶金属配位键和二联吡啶金属配位键两种结构,具有类型及性质各异的光敏性基团。因此,在尝试利用两种或两种以上的配位体系,合成一种带有多配位体系的四面体超分子结构,具有一定的创新意义。
技术实现要素:
4.本发明的目的在于提供了一种有机配体化合物及其组装的四面体超分子,以及二者的制备方法,以解决上述背景技术中所提出的问题。
5.为实现上述目的,本发明提供如下技术方案:
6.一种有机配体化合物,其具有式1的分子结构:
7.8.所述的有机配体化合物,是由具有分子结构为式2的化合物和式3的化合物进行偶联反应得到:
[0009][0010]
优选的,所述的式3化合物由式4化合物和式5化合物关环反应得到:
[0011][0012]
一种由前述有机配体化合物组装的四面体超分子,其具有式a的分子结构:
[0013][0014]
式a中的m为fe元素;m离子源为可溶性的亚铁源。
[0015]
该四面体超分子的制备方法,包括以下步骤:
[0016]
将有机配体化合物和m离子源在70
±
5℃下进行配位反应得到,有机配体化合物和m离子源的摩尔比为1:5/6。
[0017]
其中,配位反应的溶剂为氯仿和甲醇的混合溶剂,溶剂为能实现式2和式3原料溶解为宜;配位反应的时间不低于8h。
[0018]
本发明提供的有机配体化合物及其组装的四面体超分子,以及二者的制备方法,具备以下有益效果:
[0019]
本发明所述的配位反应,控制所述的配位离子、比例以及溶剂、温度等条件,有助于进一步改善形貌选择性,有助于进一步具有均四面体超分子,并且制备的四面体超分子可以进行分步的自组装。
附图说明
[0020]
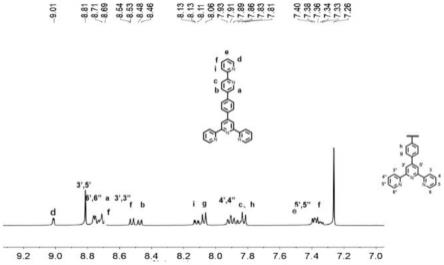
图1为本发明实施例1制备的化合物3的1hnmr谱图;
[0021]
图2为本发明为实施例1制备的有机配体l的1hnmr谱图;
[0022]
图3为本发明为实施例1制备的有机配体l的c谱图;
[0023]
图4为本发明为实施例2制备的含二联吡啶、三联吡啶有机配体化合物组装的四面体超分子的2d noesy谱图;
[0024]
图5为本发明为实施例2制备的含二联吡啶、三联吡啶有机配体化合物组装的四面体超分子的2d cosy图谱;
[0025]
图6为本发明为实施例2制备的含二联吡啶、三联吡啶有机配体化合物组装的四面体超分子的esi-ms谱图;
[0026]
图7为本发明为实施例3制备的含二联吡啶、三联吡啶有机配体化合物组装的四面体超分子的tem谱图;
[0027]
图8为本发明实施例2面体超分子的分步形成过程示意图;
[0028]
图9为本发明实施例3中有机配体化合物配位形成的二聚体的1hnmr谱图。
[0029]
图10为本发明实施例3中有机配体化合物配位形成的二聚体的高分辨质谱图。图11为本发明实施例2四面体超分子的循环伏安曲线。
[0030]
图12为本发明实施例2四面体超分子的紫外可见光谱图
具体实施方式
[0031]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。
[0032]
所述实施例的示例在附图中示出,其中自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。
[0033]
实施例:
[0034]
参见附图1-9,本发明提供的有机配体化合物,其具有式1的分子结构:
[0035][0036]
所述的有机配体化合物,是由具有分子结构为式2的化合物和式3的化合物进行偶联反应得到:
[0037][0038]
优选的,所述的式3化合物由式4化合物和式5化合物关环反应得到:
[0039][0040]
一种由前述有机配体化合物组装的四面体超分子,其具有式a的分子
[0041]
结构:
[0042][0043]
式a中的m为fe元素;m离子源为可溶性的亚铁源。
[0044]
该四面体超分子的制备方法,包括以下步骤:
[0045]
将有机配体化合物和m离子源在70
±
5℃下进行配位反应得到,有机配体化合物和m离子源的摩尔比为1:5/6。
[0046]
实施例1:本发明提供的有机配体化合物为有机配体l,其分子结构式及合成方法为:
[0047][0048]
化合物3的合成:取6.01g(40mmol)4-甲酰基苯硼酸,9.6g(240mmol)naoh加入到500ml单口圆底烧瓶中,加入200ml乙醇,在电磁搅拌下加入9.8ml(88mmol)2-乙酰基吡啶,于室温下反应20h。用恒压滴液漏斗缓慢滴加150ml氨水(28%),将温度升至80℃后回流20h,冷却至室温,过滤,得到浅紫色固体,将浅紫色固体转移到500ml单口瓶中,加入300ml异丙醇,于85℃下回流12h,抽滤,干燥,得到白色固体。1h nmr(400mhz,dmso-d6)δ8.95(d,j=8.1hz,2h,tpy-h6,6”),8.89(d,j=5.0hz,2h,tpy-h3,3”),8.84(s,2h,tpy-h 3’,5’),8.35(t,j=7.6hz,2h,tpy-h 4,4”),7.95(d,j=7.9hz,2h,ph-ha),7.83-7.76(m,2h,tpy-h5,5”),7.44(d,j=8.0hz,4h,ph-hb),2.42(s,2h,hc)。其分子结构式为:
[0049][0050]
有机配体l:配体1(200mg,0.85mmol)、4-三联吡啶苯硼酸(390mg,1.1mmol)和na2co3(900mg,8.5mmol)加入到250ml圆底烧瓶中,向其中加入60ml甲苯、20ml叔丁醇和60ml水作为反应溶剂,最后加入二价钯(60mg,0.08mmol),迅速重复抽真空通氮气的操作2-3次,并在85℃下反应24h。反应完成后,冷却至室温,旋干溶剂,用中性氧化铝拌粉过柱,旋干溶剂,得到的固体用二氯甲烷和甲醇重结晶,得到300mg白色固体。产率为75%。1h nmr(400mhz,chloroform-d)δ9.00(d,j=2.4hz,1h,hd),8.80(s,2h,tpy-h 3’,5’),8.76
–
8.74(m,2h,tpy-h6,6”)8.72(dd,j=5.2,1.6hz,1h,ha),8.69(d,j=7.9hz,2h,tpy-h3,3”),8.51(d,j=8.2hz,1h,hf),8.47(d,j=7.9hz,1h,hb),8.11-8.09(m,1h,hi),8.06(d,j=1.8hz,2h,hg),7.89(td,j=7.8,1.8hz,3h,tpy-h4,4”,),7.84(dd,j=7.7,1.8hz,1h,hc),7.80(d,j=8.2hz,2h,hh),7.38-7.34(m,2h,tpy-h5,5”),7.34-7.31(m,1h,he).13c nmr(101mhz,chloroform-d)δ156.21,156.09,155.87,155.24,149.45,149.28,149.17,147.63,138.31,138.21,136.98,136.91,135.74,135.18,128.07,127.55,123.90,123.77,121.41,121.16,121.06,118.74。
[0051]
实施例2:
[0052]
本发明提供的四面体超分子s,其具有如下的分子结构式:
[0053][0054]
四面体超分子s的合成:超分子s4的合成:取化合物8(12mg,0.026mmol)加入到100ml单口瓶中,加入15ml chcl3和10ml meoh将其溶解,然后滴加fecl2.4h2o(4.56mg,0.023mmol)的甲醇溶液(30ml),溶液由无色澄清变为深紫色溶液,于75℃下反应过夜。待其冷却到室温后向其中加入150mg nh4pf6,大量沉淀析出后继续搅拌2h。直至交换完全。将瓶
中固体抽滤,并用去离子水洗涤2-3次,出去过量的六氟膦酸铵盐,然后用甲醇洗涤2-3次,放入烘箱中进行干燥,最后得到紫色固体18mg,产率为80%。1h nmr(400mhz,acetonitrile-d3)δ9.27(s,1h),9.14(d,j=37.8hz,2h),8.77
–
8.26(m,9h),7.79(dd,j=94.3,49.9hz,8h),7.10(t,j=52.0hz,5h).esi-ms 9020.26.calcd.for c
396h276f120
fe
10n60
p
20
):m/z1659.32[m-5pf
6-]
5
(calcd.m/z:1659.05),1358.49[m-6pf
6-]
6
(calcd.m/z:11358.37),1143.72[m-7pf
6-]
7
(calcd.m/z:1143.60),982.63[m-8pf
6-]
8
(calcd.m/z:982.53),857.34[m-9pf
6-]
9
(calcd.m/z:857.25),750.79[m-10pf
6-]
10
(calcd.m/z:757.02)。
[0055]
实施例3:本发明提供的四面体的分步形成过程为:
[0056]
配体带有的二联吡啶部分和三联吡啶部分可以与金属fe
2
分别按照1/3和1/2的比例进行配位,我们猜想三联吡啶部分先与fe
2
进行配位,形成二聚体,然后二聚体的二联吡啶部分再与fe
2
进行配位,最终形成四面体结构。将配体和fecl2·
4h2o按照2:1的比例在三氯甲烷和甲醇中进行组装,利用柱相色谱对其进行纯化,并对其用质谱与核磁进行了表征,通过质谱与核磁进的分析,我们证明了结形成了二聚体结构。有机配体l的三联吡啶部分会先和金属fe2 发生配位形成二聚体,此时的二聚体带有2个未配位的二联吡啶配位位点.将二聚体和金属fe
2
按照3:2的比例在三氯甲烷和甲醇的溶剂中进行组装,我们得到了由6个二聚体和4个金属fe
2
而成的四面体。
[0057]
本发明实施例提供的四面体超分子,由两种含有多个三联吡啶的金属有机配体l和过渡金属离子fe
2
按1:5/6的比例进行配位而成,该四面体超分子也可以由配体进行分步自组装得到。本发明实施例采用的配位反应,控制所述的配位离子、比例以及溶剂、温度等条件,有助于进一步改善形貌选择性,有助于进一步具有均四面体超分子,并且制备的四面体超分子可以进行分步的自组装。
[0058]
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。