1.本发明涉及生物医药技术领域,尤其涉及一种靶向肠道菌群筛选影响黄嘌呤氧化酶活性药物的方法。
背景技术:
2.肠道中有各种各样的共生细菌和其他微生物。近年来,越来越多的研究表明肠道菌群与机体健康和疾病密切相关。药物治疗正在成为影响肠道菌群的一个重要因素,微生物与药物之间存在复杂的相互作用,即肠道菌群能通过代谢药物从而影响药理作用,而药物反过来也会改变肠道微生物的组成和功能,潜在地影响宿主的健康。随着肠道微生物生态系统和微生物途径逐渐成为药物治疗的新靶点,“药物微生物学”的理论随即被提出。“药物微生物学”即通过了解肠道菌群在药物治疗中的作用,促进靶向肠道菌群的治疗从而提高药物疗效
3.肠道菌群是一个复杂的微生物生态系统,参与机体的多项生理代谢活动,其中也包括嘌呤代谢,当嘌呤代谢紊乱时会导致尿酸升高,尿酸是嘌呤代谢的终产物,其中黄嘌呤氧化酶(xanthine oxidase,xo)是嘌呤代谢中一个关键的限速酶,可以将次黄嘌呤氧化为黄嘌呤,也可以将黄嘌呤氧化为尿酸。尿酸的产生和排泄失衡不仅会影响机体正常生理活动也会导致血液中尿酸水平升高引起高尿酸血症,长期的高尿酸血症会引起痛风并伴发多种疾病。肠道中嘌呤代谢失调也会影响肠道屏障促进肠道炎症。目前临床医学对于体内尿酸过高的治疗药物主要为以下几种:(1)通过抑制黄嘌呤氧化酶进而抑制尿酸生成(别嘌呤醇);(2)促进尿酸排泄(丙磺舒);(3)促进尿酸分解(普瑞凯希)。虽然这些药物对病情能起到缓解作用,但其对机体的副作用也较大,因此开发有效、副作用较小的方法来降低尿酸水平在临床治疗上非常重要。
4.目前有关影响尿酸代谢药物的研究,还是主要依赖于动物模型体内实验。通过促进尿酸生成、抑制尿酸排泄或抑制尿酸酶活性,从而建立高尿酸血症的动物模型,然后使用药物治疗,进行降尿酸药物的体内筛选,在药物筛选时不仅实验周期长、重复性差,还会存在成本高、操作复杂、效率低等问题;而且,目前药物的筛选较多针对于药物本身对酶活性的抑制作用,不同药物的体内代谢不同,药物进入肠道后与菌群相互作用的研究比较少。
5.肠道菌群可促进嘌呤和尿酸的分解代谢和排泄,在治疗中起着至关重要的作用,当肾脏出现问题时,肠道便成为代谢尿酸的主要途径,因此研究肠道菌群与尿酸代谢的关系可为相关疾病提供新的临床治疗靶点。基于此,我们提出了一种快速易行、简单高效的基于肠道菌群体外模型建立靶向肠道菌群的降尿酸药物体外筛选方法。
技术实现要素:
6.本发明目的在于针对上述问题,提出一种基于肠道菌群体外模型建立靶向肠道菌群的降尿酸药物体外筛选方法,提供一种靶向肠道菌群的影响黄嘌呤氧化酶活性体外药物筛选方法。
7.为了实现上述目的,本发明采用了以下技术方案:
8.一种靶向肠道菌群筛选影响黄嘌呤氧化酶活性药物的方法,包括如下步骤:
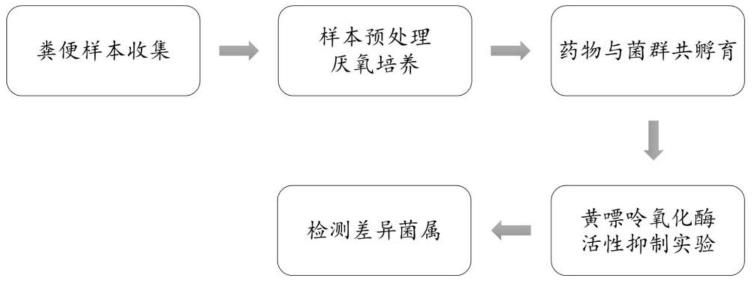
9.s1、配制肠道菌群体外模型培养基;
10.s2、收集小鼠新鲜粪便样本进行预处理,制备粪便微生物悬液,均在厌氧条件下进行;
11.s3、将步骤s2制备的粪便微生物接种至步骤s1所述培养基后加入供筛选药物共孵育,然后离心收集上清液;
12.s4、以别嘌呤醇为阳性对照,通过紫外分光光度法测定步骤s3所述供筛选药物自身及步骤s3所得上清液对黄嘌呤氧化酶的抑制活性,排除所述供筛选药物自身对黄嘌呤氧化酶的抑制作用,筛选出靶向肠道菌群影响黄嘌呤氧化酶活性的药物;
13.s5、检测步骤s4筛选出的药物与步骤s2制备的粪便微生物共孵育后样品中肠道菌群差异及优势菌群相对丰度的变化,判断所述供筛选药物对肠道菌群的影响。
14.作为本发明一种优选的技术方案,步骤s1所述培养基的配制方法包括如下步骤:在水中加入蛋白胨水、酵母提取物、l-半胱氨酸盐酸盐、nacl、k2hpo4、kh2po4、mgso4·
7h2o、cacl2·
2h2o、nahco3、氯化血红素、维生素k1、胆酸、鹅去氧胆酸、吐温80,其中不溶于水的物质均使用相应溶剂完全溶解后再加入培养基中,超声溶解,调节ph值至6.5
±
0.2,过滤除菌后,避光保存。
15.作为本发明一种优选的技术方案,所述培养基中各物质浓度为:蛋白胨水2.0g/l、酵母提取物2.0g/l、l-半胱氨酸盐酸盐0.5g/l、nacl 1.0g/l、k2hpo
4 0.4g/l、kh2po
4 0.4g/l、mgso4·
7h2o 0.1g/l、cacl2·
2h2o 0.1g/l、nahco
3 4.0g/l、氯化血红素5mg/l、维生素k1 10μl/l、胆酸0.25g/l、鹅去氧胆酸0.25g/l、吐温80 2ml/l。
16.作为本发明一种优选的技术方案,步骤s2所述粪便微生物悬液制备方法为:将粪便样品加入含有l-半胱氨酸盐酸盐磷酸盐缓冲液中混匀,经步骤s1所述培养基重复均质离心、合并上清液离心收集沉淀,使用所述培养基进行重悬,沉淀与培养基的比例为80:1~100:1(mg/ml)。
17.作为本发明一种优选的技术方案,步骤s3所述供筛选药物选自中草药提取物、化学合成药物、生物制剂中的一种。
18.作为本发明一种优选的技术方案,步骤s3所述粪便微生物接种的最终接种浓度为18%~23%(w/v),所述供筛选药物终浓度为95~100μm,厌氧共孵育48h。
19.本发明还提供了上述方法在筛选靶向肠道菌群的降尿酸药物中的应用。
20.与现有技术相比,本发明的有益效果是:
21.(1)本发明将肠道菌群体外模型与黄嘌呤氧化酶活性抑制实验相结合,提供一种靶向肠道菌群的影响尿酸代谢药物的筛选方法。弥补传统药物研究的不足,为体外研究药物与微生物互作、微生物代谢以及药物筛选提供理论与实践基础。
22.(2)本发明将来源于机体的菌群作为研究对象,以群体为单位构建体外模型,尽可能的保持菌群的多样性,研究微生物群落的共同作用,促进更精准的菌群导向性研究,并进一步将药物与菌群共培养后通过快速、易行的实验方法获得初步筛选结果,大大缩短了获得结果的时间,再根据所得结果使用更精密的检测手段进行深入研究,提高了研究意义。
附图说明
23.图1为本发明所述的筛选方法流程示意图。
24.图2为实施例1中大黄酸与肠道菌群共孵育后上清液对xo的相对抑制率柱状图。
25.图3为实施例1中大黄酸单独对xo的相对抑制率柱状图。
26.图4为实施例1中大黄酸处理后在肠道菌群微生物丰度变化图。
27.图5为实施例1中大黄酸处理后在肠道菌群微生物物种差异分析图。
28.图6为为实施例1中大黄酸处理组优势菌属相对丰度的变化图,t检验:*:p《0.05;**:p《0.01;***:p《0.001。
29.图7为本发明实施例2中7,8-二羟基黄酮与肠道菌群共孵育后上清液对xo的相对抑制率柱状图。
30.图8为本发明实施例2中7,8-二羟基黄酮单独对xo的相对抑制率柱状图。
31.图9为本发明实施例2中7,8-二羟基黄酮处理后肠道菌群平均相对丰度柱状图,其中,图9a是门水平微生物丰度分析(phylum);图9b是科水平微生物丰度分析(family);图9c是属水平微生物丰度分析(genus);control:空白对照组;7,8-dhf:7,8-二羟基黄酮组。
32.图10为本发明实施例2中7,8-二羟基黄酮处理后肠道菌群中差异物种lefse分析图。
33.图11为本发明实施例2中7,8-二羟基黄酮处理组菌属相对丰度的变化图,t检验:*:p《0.05;**:p《0.01;***:p《0.001。
具体实施方式
34.下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
35.本发明实施例中所使用的实验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
36.实施例1
37.在本实施案例中,我们选择以大黄酸作为待筛选药物,具体筛选方法包括以下步骤:
38.1、配制肠道菌群体外模型培养基
39.在灭菌超纯水中加入蛋白胨水(2.0g/l)、酵母提取物(2.0g/l)、l-半胱氨酸盐酸盐(0.5g/l)、nacl(1.0g/l)、k2hpo4(0.4g/l)、kh2po4(0.4g/l)、mgso4·
7h2o(0.1g/l)、cacl2·
2h2o(0.1g/l)、nahco3(4.0g/l)、氯化血红素(5mg/l)、维生素k1(10μl/l)、胆酸(0.25g/l)、鹅去氧胆酸(0.25g/l)、吐温80(2ml/l),其中不溶于水的物质均使用相应的溶剂完全溶解后再加入培养基中,超声完全溶解,使用ph计用稀盐酸调节ph值至6.5
±
0.2(25℃),用0.22μm滤头过滤除菌,4℃避光保存备用。
40.2、制备粪便微生物悬液
41.收集小鼠新鲜粪便样本:样品采集后的预处理均在厌氧工作站(10%h2,10%co2和80%n2,37℃)中进行,实验中所需的所有材料及试剂等均提前放入厌氧工作站中进行预还
原处理,具体方法步骤如下:
42.(1)收集新鲜小鼠粪便0.1g放入含有250μl0.1%l-半胱氨酸盐酸盐pbs溶液的无菌2ml离心管中。
43.(2)迅速转移至厌氧工作站,打开管盖,进行气体交换,充分涡旋混匀至接近均质状态。
44.(3)加入750μl培养基,以最大转速涡旋15s;室温,1000rpm,离心30s。
45.(4)将离心得到的上清(约750μl)转移至洁净无菌的2ml离心管a中。
46.(5)剩余沉淀中加入750μl培养基,以最大转速涡旋15s;室温,1000rpm,离心30s。
47.(6)将离心得到的上清(约750μl)转移至步骤“4”中的2ml离心管a中。
48.(7)剩余沉淀中加入750μl培养基,以最大转速涡旋15s;室温,1000rpm,离心30s。
49.(8)将离心得到的上清(约750μl)转移至洁净无菌的2ml离心管b中。
50.(9)剩余沉淀中加入750μl培养基,以最大转速涡旋15s;室温,1000rpm,离心30s。
51.(10)将离心得到的上清(约750μl)转移至步骤“8”中的2ml离心管b中(此时应有2个含有约1.5ml上清液的2ml离心管)。
52.(11)将含有约1.5ml上清液的2ml离心管a,室温,4,000
×
g离心5min。
53.(12)将离心后的上清液小心移出弃去,将含有约1.5ml上清液的2ml离心管b中液体转移至离心管a;室温,4,000
×
g离心5min。
54.(13)将离心后的上清液小心移出弃去,用1ml培养基重悬,得到小鼠粪便微生物悬液。
55.3、药物处理(大黄酸与肠道菌群共孵育)
56.(1)将按照处理后的小鼠粪便微生物悬液按照最终接种浓度为40%(w/v)立即接种至优化后的mipro培养基中,涡旋充分混匀。
57.(2)药物处理组:吸取500μl浓度为40%(w/v)的小鼠粪便微生物悬液至96深孔板中;每孔加入浓度为1mm的大黄酸工作液100μl以及400μl培养基。
58.(3)阳性对照组:吸取500μl浓度为40%(w/v)的小鼠粪便微生物悬液至96深孔板中;每孔加入浓度为1mm的别嘌呤醇工作液100μl以及400μl培养基。
59.(4)空白对照组:以不加药仅含有dmso处理的小鼠粪便悬液作为空白对照,实验条件下dmso的最终浓度为1%。
60.(5)静置在37℃、厌氧条件下共孵育48h。
61.4、大黄酸与肠道菌群孵育后上清对黄嘌呤氧化酶抑制活性的测定
62.(1)将各处理组样品孵育48h后快速取出并转移至洁净无菌的2ml离心管中,在室温下,5,000rpm离心10min,吸取样品上清进行检测,剩余样品于-80℃保存。
63.(2)取样品上清100μl加入96孔板中,再加入50μl黄嘌呤氧化酶(0.04u/ml),吹打混匀后,于37℃静置60min;加入50μl黄嘌呤(400μmol/l)启动反应,吹打混匀注意不要有气泡。
64.(3)使用多功能酶标仪检测20min内290nm处吸光值随时间的变化,每120s检测一次。实验结果经过三个生物学重复后进行统计分析。以反应时间为横坐标,吸光值为纵坐标作图并计算出曲线斜率,即样品组反应速率为as;空白对照组反应速率为ac;相对抑制率计算方法如下:
[0065][0066]
结果分析
[0067]
大黄酸与菌群共孵育后上清液对xo的相对抑制率计算结果如图2所示,阳性对照组别嘌呤醇与菌群共孵育后的上清液对黄嘌呤氧化酶的相对抑制率为(60.15%
±
0.66)%。大黄酸与菌群共孵育后的上清液对黄嘌呤氧化酶的相对抑制率为(57.50%
±
4.51)%。
[0068]
5、大黄酸单独对黄嘌呤氧化酶活性的抑制效果
[0069]
(1)实验中阳性对照组为别嘌呤醇,空白对照组为含有1%dmso的培养基,取大黄酸、别嘌呤醇(100μm)100μl加入96孔板中,再加入50μl黄嘌呤氧化酶(0.04u/ml),吹打混匀后,于37℃静置60min;加入50μl黄嘌呤(400μmol/l)启动反应,吹打混匀注意不要有气泡。
[0070]
(2)使用多功能酶标仪检测20min内290nm处吸光值随时间的变化,每120s检测一次。实验结果经过三个生物学重复后进行统计分析。以反应时间为横坐标,吸光值为纵坐标作图并计算出曲线斜率,即样品组反应速率为as;空白对照组反应速率为ac;相对抑制率计算方法如下:
[0071][0072]
结果分析
[0073]
大黄酸单独对xo的相对抑制率计算结果如图3所示,阳性对照组别嘌呤醇单独对黄嘌呤氧化酶的相对抑制率为(74.75%
±
4.63)%。大黄酸单独对黄嘌呤氧化酶无明显抑制作用,其相对抑制率为0%,排除了大黄酸自身对黄嘌呤氧化酶活性的抑制作用,判定该待筛选药物大黄酸为靶向肠道菌群影响黄嘌呤氧化酶活性的药物。
[0074]
6、大黄酸对肠道菌群的调节效果检测
[0075]
1实验材料
[0076]
qiaamp powerfecal pro dna kit,凯杰生物科技有限公司;sybr qpcr master mix,南京诺唯赞生物科技股份有限公司。
[0077]
2宏基因组测序
[0078]
(1)文库构建及上机测序
[0079]
使用dna提取试剂盒提取样本dna并检测合格后,使用超声破碎仪随机打断后进行文库构建。构建完成后,用qubit 2.0进行初步定量,稀释文库,随后检测文库的插入片段,并对文库的有效浓度进行定量。库检合格后,按照有效浓度及目标下机数据量的需求使用illumina pe150(2x150)平台测序。
[0080]
(2)数据预处理
[0081]
对测序获得的原始数据(raw data),进行预处理,包括质控和去宿主序列获取用于后续分析的有效序列(clean data)。
[0082]
(3)物种及功能注释与评估
[0083]
使用kraken2软件对有效序列进行物种注释分类,用bracken软件对样本中物种的实际丰度进行估计。使用humann2软件将质控和去宿主之后的序列与uniref 90进行比对,根据uniref 90id和各功能数据库的对应关系,得到各个功能数据库的注释信息和相对丰
度表。
[0084]
(4)数据处理
[0085]
采用lefse(linear discriminant analysis effect size,lefse)分析方法进行差异显著性分析,并根据线性判别分析(lda)对数据进行分类和评估差异显著物种的影响力(即lda score),lda阈值默认为2~4,绘制lda柱状图。
[0086]
结果分析
[0087]
药物处理后在肠道菌群微生物丰度变化结果如图4所示:
[0088]
图4a展示了大黄酸处理后菌群在门分类水平上物种丰度的变化情况。从图中可以看出菌群主要分属于变形菌门(proteobacteria)、厚壁菌门(firmicutes)、拟杆菌门(bacteroidetes)以及放线菌门(actinobacteria)。与空白对照组相比,大黄酸处理后引起菌群中厚壁菌门的丰度升高以及拟杆菌门丰度降低。
[0089]
图4b展示了大黄酸处理后肠道菌群在科分类水平上物种丰度的变化情况。从各组在科水平下的菌群相对丰度可知,肠杆菌科(enterobacteriaceae)在各组的检出率相似。与空白对照组相比,大黄酸处理组菌群中乳杆菌科(lactobacillaceae)平均相对丰度增加,拟杆菌科(bacteroidaceae)平均相对丰度降低。
[0090]
图4c展示了大黄酸处理后肠道菌群在属分类水平上物种丰度的变化情况。从各组在属水平下的菌群相对丰度可知,肠杆菌科的埃希菌属(escherichia)在各组的占比较为接近。而药物处理组的乳杆菌科的三个菌属(lactobacillus、limosilactobacillus以及ligilactobacillus)的平均相对丰度均高于空白对照组。
[0091]
药物处理后在菌群微生物物种差异分析结果:
[0092]
由图5可知,与空白对照组相比,经过大黄酸处理后肠道菌群中乳杆菌科lactobacillus菌属、limosilactobacillus菌属以及ligilactobacillus菌属的丰度显著升高,而菌群中phocaeicola菌属和parabacteroides菌属的丰度下降。
[0093]
3通过实时荧光定量pcr检测菌群中调节菌属在药物处理后相对丰度的变化:
[0094]
(1)药物与菌群培养后的沉淀物于-80℃储存的样品取出自然解冻。
[0095]
(2)按照qiaamp
○
r powerfecal
○
r pro dna kit粪便基因组提取试剂盒的说明书,提取样品dna。
[0096]
(3)通过琼脂糖凝胶电泳检测dna提取质量,并使用nano drop微量紫外分光光度计检测dna浓度和纯度,保存于-20℃冰箱备用。
[0097]
(4)采用sybr荧光染料法进行qpcr实验,将质检合格后的样本总dna,用无菌超纯水稀释至10ng/μl作为qpcr待测dna模板,检测拟杆菌属(bacteroides)、双歧杆菌属(bifidobacterium)、乳杆菌属(lactobacillus)、普雷沃菌属(prevotella);嗜黏蛋白阿克曼菌(akkermansia)、肠球菌属(enterococcus)、以及肠杆菌科(enterobacteriaceae),所有检测模板的不同引物均设置3个技术重复,且每个引物组都包含一个非模板阴性对照。
[0098]
(5)采用2-δδct法分析各菌属目的基因的相对差异倍数即相对丰度。δδct=(实验组目的基因ct值-实验组内参基因ct值)-(对照组目的基因ct值-对照组内参基因ct值),实验组与对照组目的基因相对表达的差异倍数计算公式为:
[0099]
fold change=2-δδct
[0100]
结果分析
[0101]
实时荧光定量pcr检测结果如图6所示,经大黄酸处理后肠道菌群中拟杆菌属(p《0.001)、普雷沃菌属(p《0.001)、肠杆菌科(p《0.01)细菌相对丰度显著下降,乳杆菌属、肠球菌属细菌相对丰度显著上升(p《0.001),对双歧杆菌属、嗜黏蛋白阿克曼菌丰度的影响差异不显著(p》0.05)。
[0102]
实施例2
[0103]
在本实施案例中,我们选择以7,8-二羟基黄酮作为待筛选药物,具体筛选方法及步骤与实施例1相同。
[0104]
结果分析
[0105]
7,8-二羟基黄酮与肠道菌群共孵育后上清液对xo的相对抑制率计算结果如图7所示,阳性对照组别嘌呤醇与肠道菌群共孵育后的上清液对黄嘌呤氧化酶的相对抑制率为(60.15%
±
0.66)%。7,8-二羟基黄酮与肠道菌群共孵育后的上清液对黄嘌呤氧化酶的相对抑制率为(50.57%
±
1.15)%。
[0106]
7,8-二羟基黄酮单独对xo的相对抑制率计算结果如图8所示,阳性对照组别嘌呤醇单独对黄嘌呤氧化酶的相对抑制率为(74.75%
±
4.63)%。7,8-二羟基黄酮单独对黄嘌呤氧化酶无明显抑制作用,其相对抑制率为(1.40%
±
1.80)%,判定该待筛选药物7,8-二羟基黄酮为靶向肠道菌群影响黄嘌呤氧化酶活性的药物。
[0107]
7,8-二羟基黄酮处理后在肠道菌群微生物丰度变化结果如图9所示:
[0108]
图9a展示了7,8-二羟基黄酮处理后肠道菌群在门分类水平上物种丰度的变化情况。从图中可以看出菌群主要分属于变形菌门(proteobacteria)、厚壁菌门(firmicutes)、拟杆菌门(bacteroidetes)以及放线菌门(actinobacteria)。与空白对照组相比,7,8-二羟基黄酮处理后引起菌群中厚壁菌门的丰度升高以及拟杆菌门丰度降低。
[0109]
图9b展示了7,8-二羟基黄酮处理后肠道菌群在科分类水平上物种丰度的变化情况。从各组在科水平下的菌群相对丰度可知,肠杆菌科(enterobacteriaceae)在各组的检出率相似。与空白对照组相比,7,8-二羟基黄酮处理组菌群中乳杆菌科(lactobacillaceae)平均相对丰度增加,拟杆菌科(bacteroidaceae)平均相对丰度降低。
[0110]
图9c展示了7,8-二羟基黄酮处理后肠道菌群在属分类水平上物种丰度的变化情况。从各组在属水平下的菌群相对丰度可知,肠杆菌科的埃希菌属(escherichia)在各组的占比较为接近。而药物处理组的乳杆菌科的三个菌属(lactobacillus、limosilactobacillus以及ligilactobacillus)的平均相对丰度均高于空白对照组。
[0111]
7,8-二羟基黄酮处理后在菌群微生物物种差异分析结果:
[0112]
由图10可知,与空白对照组相比,经过7,8-二羟基黄酮处理后肠道菌群中乳杆菌科lactobacillus菌属以及ligilactobacillus菌属的丰度显著升高;拟杆菌目(bacteroidales)的细菌丰度显著下降。
[0113]
实时荧光定量pcr检测结果如图11所示,7,8-二羟基黄酮处理后肠道菌群中拟杆菌属(p=0.004)相对丰度显著下降,乳杆菌属相对丰度显著上升(p=0.004),对双歧杆菌属、普雷沃菌属、嗜黏蛋白阿克曼菌、肠球菌属和肠杆菌科的影响差异不显著(p》0.05)。
[0114]
综上,大黄酸和7,8-二羟基黄酮单独对黄嘌呤氧化酶无明显抑制作用,而是通过调节肠道菌群对黄嘌呤氧化酶活性产生了抑制作用。至此,本发明利用构建的筛选方法实现了对化合物大黄酸和7,8-二羟基黄酮靶向肠道菌群影响黄嘌呤氧化酶活性进行了筛选
与效果验证。
[0115]
显然,本发明的上述实施例仅仅是为了清楚地说明本发明技术方案的所作的举例,而并非是对本发明的具体实施方式的限定。凡在本发明权利要求书的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。