一种缓释mrna的矿物包被微粒材料及其制备方法与应用
技术领域
1.本发明属于生物医药材料技术领域。更具体地,涉及一种治疗骨肿瘤的一种缓释mrna的矿物包被微粒材料及其制备方法与应用。
背景技术:
2.近几十年来肿瘤仍然是每年对人类健康构成的最大威胁和主要死亡原因之一,为患者自身和整个社会带来了沉重负担。事实上,被诊断出患有癌症的儿童超过165,000名,癌症的财务成本估计为每年1.16万亿美元。
3.巨噬细胞可塑性强。除了肿瘤微环境中促进肿瘤生长的表型外,巨噬细胞也可以转变为肿瘤杀伤性巨噬细胞(tumoricidal macrophages),且具有良好的治疗效果。相比改造t细胞,巨噬细胞能够以更直接的方式杀死肿瘤特异性抗原多余或未知的肿瘤细胞,从而使它们有可能在t细胞疗法不足的情况下取得成功。常规的改造方法为活性生物因子ifnγ刺激,但是活性生物因子的药物递送策略经常受到体内低生物活性的限制,这种限制导致提供超生理剂量的治疗性蛋白质,进而导致临床使用中经常出现负面副作用。
4.核酸递送是一种有吸引力的治疗方法,与其他核酸递送方法相比,mrna的非病毒递送具有许多吸引人的特征,这些特征可能结合了主动表达和安全稳定的特征。具体而言,mrna递送不需要将核酸转运至细胞核,因此,在非有丝分裂细胞群中mrna依旧可以有效表达。此外,mrna不是通过同源重组或插入诱变基因的方式表达,因此,mrna具有安全稳定性。
5.但是mrna存在不稳定的缺点。本发明使用矿物包被的微粒(mineral-coated microparticles,mcm)触发局部递送机制,稳定mrna,提高mrna转染效率,同时降低试剂相关的细胞毒性。此外,纳米结构的矿物涂层可以隔离和稳定不稳定的生长因子以防止变性,从而允许持续的蛋白质释放和延长预期生物反应的刺激。
技术实现要素:
6.为了克服现有重组蛋白效价低,现有mrna产品不稳定的缺点,无法根据实验需求实时调控巨噬细胞转变为肿瘤杀伤性巨噬细胞能力弱等不足,本发明提供一种新型的“负荷mrna的矿物包被微粒材料”的抗骨肿瘤材料。
7.本发明所采用的技术方案如下:
8.一种缓释mrna的矿物包被微粒材料,包括矿物包被的微粒mcm和包被于mcm中的mrna。
9.一种缓释mrna的矿物包被微粒材料的制备方法,包括以下步骤:
10.(1)制备脂质体:配制脂质-乙醇溶液和mrna-柠檬酸缓冲液,将两者进行微流控装置混合,得到mrna脂质体纳米颗粒;所述的脂质-乙醇溶液为可电离化阳离子脂质dlin-mc3-dma、磷脂酰乙醇胺hspe-mpeg2000、二硬脂酰磷脂酰胆碱dspc和胆固醇的乙醇溶液;
11.(2)制备mcm:将nacl、kcl、mgso4·
7h2o、mgcl2·
6h2o、nahco3、hepes、cacl2·
2h2o、kh2po4和naf溶于超纯水,得到改性模拟体液msbf;将羟基磷灰石粉末分散于所述改性模拟
体液msbf中,将所得悬浊液旋转并冻干,得到mcm;
12.(3)吸附:将所述的mcm和mrna脂质体纳米颗粒分别溶于pbs缓冲液中,两份溶液混合搅拌,得到所述的缓释mrna的矿物包被微粒材料。
13.进一步地,步骤(1)中,所述的脂质-乙醇溶液中,dlin-mc3-dma、hspe-mpeg2000、dspc和胆固醇的摩尔比为50:1.5:10:38.5,脂质-乙醇溶液的浓度为10mg/ml。
14.进一步地,步骤(1)中,所述的mrna-柠檬酸缓冲液的制备方法为:使用超纯水配制柠檬酸和柠檬酸钠的混合溶液,加入depc,静置30分钟后高压灭菌去除depc,灭菌后使用depc水定容,得到ph=4的柠檬酸缓冲液;使用柠檬酸缓冲液将mrna稀释至所需浓度,得到mrna-柠檬酸缓冲液;所述混合溶液中,柠檬酸和柠檬酸钠的摩尔比为33:17。
15.进一步地,步骤(1)的微流控装置混合具体为:分别将分别将脂质-乙醇溶液和mrna-柠檬酸缓冲液通过0.22微米滤膜过滤;将脂质-乙醇溶液和mrna-柠檬酸缓冲液分别吸入注射器中,并排出注射器中的空气;将注射器出口和样品导入管连接,并固定在注射泵上;根据具体需要来调整注射泵的流速和混合体积;运行,观察流出管流速稳定后,用收集管收集流出的液体;其中,混合的脂质-乙醇溶液和mrna-柠檬酸缓冲液体积之比为1:3。
16.更进一步地,用收集管收集流出的液体后,得到纳米颗粒,可以不过滤。如需进行过滤,则采用以下方法:样品收集后,立即用30倍体积的pbs将乙醇浓度稀释到1%以下,使用milipore 30kd超滤管,3000g离心20分钟进行超滤。
17.进一步地,步骤(2)中,nacl、kcl、mgso4·
7h2o、mgcl2·
6h2o、nahco3、hepes、cacl2·
2h2o、kh2po4和naf的摩尔比为141:4:0.5:1:4.2:20:5:2:1;羟基磷灰石粉末以1mg/ml的浓度悬浮在改性模拟体液msbf中。
18.进一步地,步骤(2)中,旋转并冻干的操作为:将所述悬浊液在37℃下旋转5天,5天后,用去离子水洗涤3次,通过40μm孔细胞过滤器过滤,悬浮在15ml蒸馏水中,冻干。
19.进一步地,步骤(3)中,混合液中mrna脂质体纳米颗粒与mcm的质量比为1:5,在4℃搅拌30min-1h。
20.本发明还提供所述缓释mrna的矿物包被微粒材料的应用,可以用于制备诱导细胞分化的药物,所述的细胞分化为:使巨噬细胞转变为肿瘤杀伤性巨噬细胞。
21.本发明的有益效果是:
22.1、本发明利用mrna的非病毒递送方式调控巨噬细胞tam的表型,拥有主动表达和安全稳定的特征,具体而言,mrna递送不需要将核酸转运至细胞核,因此,在非有丝分裂细胞群中mrna依旧可以有效表达。此外,mrna不是通过同源重组或插入诱变基因的方式表达,因此,mrna具有安全稳定性。
23.2、mrna存在不稳定的缺点。本发明提供的矿物包被的微粒(mineral-coated microparticles,mcm)可以触发局部递送机制,稳定mrna,提高mrna转染效率,同时降低试剂相关的细胞毒性。此外,纳米结构的矿物涂层可以隔离和稳定不稳定的生长因子以防止变性,从而允许持续的蛋白质释放和延长预期生物反应的刺激。
24.3、本发明的缓释mrna的矿物包被微粒材料精确高效地运送mrna进入肿瘤相关巨噬细胞内,并通过调控一系列基因表达,使tam分化为具有“抑癌”作用的m1型巨噬细胞,从而引发抗肿瘤免疫反应。
25.4、本发明不但为研制高效安全的mrna的矿物包被微粒材料供理论依据,还将为肿
瘤免疫治疗提供新策略。
附图说明
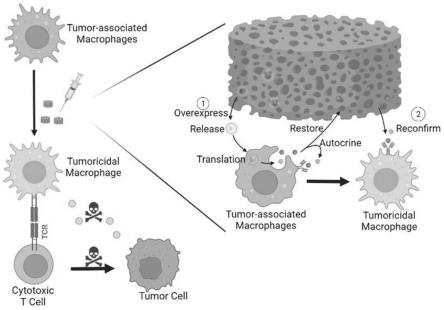
26.图1为缓释mrna的矿物包被微粒材料原理图;
27.图2为mrna脂质体纳米颗粒的透射电镜图;
28.图3为mcm的扫描电镜图;
29.图4为gfp mrna lnp@mcm转染效率;
30.图5为矿物包被微粒再吸附图;
31.图6为缓释mrna的矿物包被微粒材料促进tams活化;
32.图7为缓释mrna的矿物包被微粒材料诱导tams活化。
具体实施方式
33.结合附图,对本发明作详细说明,但本发明的保护范围不限于下述实施例,即但凡以本发明申请专利范围及说明书内容所作的简单的等效变化与修饰,皆仍属本发明专利涵盖范围之内。
34.实施例1:含mrna脂质体纳米颗粒制备
35.配制脂质-乙醇溶液:dlin-mc3-dma(分子量321.1mg/mmmol),hspe-mpeg2000(分子量37.6mg/mmmol),dspc(分子量79.0mg/mmmol),胆固醇(分子量148.9mg/mmmol),四者摩尔比50:1.5:10:38.5,总浓度约10mg/ml。
36.配制mrna-柠檬酸缓冲液:使用超纯水分别配制100mm的柠檬酸(分子量:210.14,称取1.05g)和柠檬酸钠(分子量:294.10,称取1.47g)溶液各50ml。取33.0ml柠檬酸溶液和17.0ml柠檬酸钠溶液,混合后加入depc,静置30分钟后高压灭菌去除depc,灭菌后使用depc水定容至100ml即得50mm ph=4的柠檬酸缓冲液。将mrna测定浓度后根据脂质浓度使用柠檬酸缓冲液稀释至所需浓度。
37.通过微流控装置进行操作:1.分别将分别将脂质-乙醇溶液和mrna-柠檬酸缓冲液通过0.22微米滤膜过滤。2.将脂质-乙醇溶液吸入1ml注射器中(根据需要,至少需要吸入0.5ml),将mrna-柠檬酸缓冲液吸入3ml注射器中(至少吸入1.5ml),并排出注射器中的空气。3.将注射器出口和样品导入管连接,并固定在注射泵上。4.根据具体需要来调整注射泵的流速和混合体积。5.运行,观察流出管流速稳定后,用收集管收集流出的液体。最终得到cmrna脂质体纳米颗粒,其透射电镜图如图2所示。
38.实施例2:mcm的制备及其表征
39.msbf(改性模拟体液)是由141mm nacl、4mm kcl、0.5mm mgso4·
7h2o、1mm mgcl2·
6h2o、4.2mm nahco 3
、20mm hepes、5mm cacl2·
2h2o、2mm kh
2 po4和1mm naf溶解于超纯水中形成。
40.mcm的制备,将羟基磷灰石粉末(plasma biotal limited)用作微粒核心,以1mg/ml的浓度悬浮于msbf中,37℃下旋转5天。5天后,用50ml去离子(di)水洗涤3次,通过40μm孔细胞过滤器过滤,悬浮在15ml蒸馏水中,冻干,得到mcm。然后分析冻干的mcms的纳米形貌和钙释放。使用jsm-6510lv电子显微镜(日本jeol)获得扫描电子显微镜(sem)图像,如图3所示。
41.实施例3:gfp mrna lnp@mcm转染效率
42.将含有gfp mrna的脂质体纳米颗粒(gfp mrna lnp),同mcm在4℃的去核酸酶的pbs缓冲液环境下搅拌30分钟,比例分别为1:0;1:1;1:5;1:10,得到gfp mrna lnp@mcm。将raw264.7细胞在完全培养基中,加入以上gfp mrna lnp@mcm,孵育24小时,通过倒置荧光显微镜,统计荧光强度。如图4所示,gfp mrna lnp在raw264.7中表达,但是表达略显微弱,而随着mcm含量的增加,gfp的表达逐渐增加,反映出mcm可以缓释隔离和稳定mrna lnp,从而促进mrna的表达。
43.实施例4:mcm的重新吸附实验
44.将gfp蛋白和mcm共同加入培养raw264.7的完全培养基中,通过48小时共同孵育后,通过倒置荧光显微镜,统计荧光强度。如图1、图5所示,mcm的颗粒荧光强度明显增加,强于周围液体,代表了mcm颗粒重新吸附了gfp蛋白,以隔离和稳定不稳定的游离蛋白以防止变性,从而允许持续的蛋白质释放和延长预期生物反应的刺激。
45.实施例5:缓释ifnγmrna的矿物包被微粒材料促进tams活化
46.将含有ifnγmrna的脂质体纳米颗粒(ifnγmrna lnp),同mcm在4℃的去核酸酶环境下搅拌30分钟,比例为1:5,得到ifnγmrna lnp@mcm。raw264.7在完全培养基中,加入以上ifnγmrna lnp@mcm,孵育48小时后通过流式细胞仪检测。如图6所示,对比ifnγmrna lnp组,ifnγmrna lnp@mcm组中表达inos和cd86的raw264.7细胞数目增加,代表具有肿瘤杀伤性的巨噬细胞增加。体现出ifnγmrna lnp@mcm通过重吸附和稳定不稳定的ifnγ以防止变性,从而允许持续的ifnγ释放和延长预期生物反应的刺激,从而达到高效抗肿瘤的潜在效果。
47.实施例6:缓释ifnγmrna的矿物包被微粒材料促进tams活化
48.将含有ifnγmrna的脂质体纳米颗粒(ifnγmrna lnp),同mcm在4℃的去核酸酶环境下搅拌30分钟,比例为1:5。raw264.7在完全培养基中,加入以上ifnγmrna lnp@mcm,孵育48小时后通过流式细胞仪检测。如图7所示,对比重组蛋白(recombinant)ifnγ组,ifnγmrna lnp@mcm组中表达inos和cd86的raw264.7细胞数目增加,代表具有肿瘤杀伤性的巨噬细胞增加。体现出ifnγmrna lnp@mcm通过自分泌ifnγ和重吸附后缓释的ifnγ,延长预期生物反应的刺激,从而达到高效抗肿瘤的潜在效果。
49.以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
