1.本发明属于医药技术领域,具体涉及一种负载藤黄酸的介孔纳米粒及其制备方法和在癌症治疗上的应用。
背景技术:
2.乳腺癌(breast cancer,bc)作为女性癌症的头号杀手,严重威胁着女性健康。通过不断的努力,乳腺癌的治疗取得了重大进展。根据乳腺癌的分期及类型不同,主要治疗手段有手术、化疗及放疗等。这些常见的传统治疗方法虽然取得了一定的治疗效果,但是仍旧存在很多挑战:(1)手术切除的局限性很大,仅限于早期的乳腺癌患者,且大都是全乳切除;(2)传统化疗的毒副作用很大,且易出现耐药性;(3)放疗的精准度不高、副作用大。所以,寻找有效的乳腺癌治疗药物及方法刻不容缓。近年来,越来越多的研究者利用纳米药物和免疫制剂治疗各种癌症,这也为乳腺癌的治疗带来了更多的可能性。
3.藤黄酸(gambogic acid,ga)是从中药藤黄中提取出的一种成分,研究表明ga对乳腺癌在内的多种癌症具有显著的治疗效果。有相关研究([1]y-z zhen,lin y-j,li k-j,et al.gambogic acid lysinate induces apoptosis in breast cancer mcf-7cells by increasing reactive oxygen species[j].evid based complement alternat med,2015,842091.[2]s wang,xu y,li c,et al.gambogic acid sensitizes breast cancer cells to trail-induced apoptosis by promoting the crosstalk of extrinsic and intrinsic apoptotic signalings[j].food chem toxicol,2018,119,334-341.)显示了ga在bc的治疗领域的潜力。但是,相关研究也同时报道了ga存在水溶性低、血管刺激性强、毒副作用大等缺陷,这极大地限制了ga的临床应用。
[0004]
光热治疗(photothermal therapy,ptt)是一种利用近红外激光产生局部过高热杀伤肿瘤的方法,具有非侵入性、高可控性和精确性等优势。近年来被越来越多的人研究用于癌症的治疗。光热剂是作为实现肿瘤光热消融的关键,通常被设计成纳米尺寸的粒子,使其具有更优越的特性,以及便于输送到病灶部位。目前,各种类型的无机和有机光热剂已被开发用于对肿瘤进行ptt。如碳纳米材料、金纳米材料、银纳米材料和锗纳米晶等光热剂,它们可以强烈吸收光并将光能转化为热疗,从而导致相邻细胞的热消融。此外,有研究报道ptt可以促进免疫原性细胞死亡,有激活抗肿瘤免疫的潜力。区别于其他的光热材料,聚多巴胺(pda)作为一种类黑色素的聚合物,由于其生物相容性好、制备简便和近红外吸收能力强,已被认为是生物医学应用领域内具有吸引力的光热材料。此外,介孔聚多巴胺纳米粒可以作为一种药物载体。
[0005]
然而,利用pda递送ga用于癌症治疗的研究还未见报道。pda载ga后会产生如何的相互作用未可知。如果利用pda载ga能够研究出一种治疗癌症效果优异的药物,对临床治疗癌症将具有重要意义。
技术实现要素:
[0006]
本发明的目的在于提供一种负载藤黄酸的介孔纳米粒及其制备方法和在癌症治疗上的应用。本发明负载藤黄酸的介孔纳米粒可用于癌症的化学-光热-免疫联合治疗。
[0007]
本发明提供了一种负载藤黄酸的介孔纳米粒,它是由如下重量配比的原料制备而成:
[0008]
介孔聚多巴胺纳米粒1~10份、藤黄酸1~100份。
[0009]
进一步地,前述的负载藤黄酸的介孔纳米粒是由如下重量配比的原料制备而成:
[0010]
介孔聚多巴胺纳米粒10份、藤黄酸8份。
[0011]
进一步地,所述介孔聚多巴胺纳米粒是由如下重量配比的原料制备而成:
[0012]
表面活性剂1~10份、多巴胺1~5份。
[0013]
进一步地,所述介孔聚多巴胺纳米粒是由如下重量配比的原料制备而成:
[0014]
表面活性剂2份、多巴胺1份。
[0015]
进一步地,所述表面活性剂为泊洛沙姆;优选地,所述表面活性剂为泊洛沙姆f127。
[0016]
进一步地,所述介孔聚多巴胺纳米粒的制备方法包括如下步骤:
[0017]
将表面活性剂和多巴胺溶于溶剂中,加入三甲基苯和氨水,反应结束后洗涤、离心,即得。
[0018]
进一步地,所述溶剂为水和乙醇混合溶液;
[0019]
和/或,所述多巴胺和三甲基苯的质量体积比为1g:(1~10)ml;
[0020]
和/或,所述多巴胺和氨水的质量体积比为1g:(1~50)ml;
[0021]
和/或,所述反应为室温搅拌1~5h;
[0022]
优选地,所述水和乙醇混合溶液中水和乙醇的体积比为1:1;
[0023]
和/或,所述多巴胺和三甲基苯的质量体积比为1g:(1~6)ml;
[0024]
和/或,所述多巴胺和氨水的质量体积比为1g:(5~40)ml;
[0025]
和/或,所述洗涤为使用乙醇洗涤。
[0026]
本发明还提供了前述的负载藤黄酸的介孔纳米粒的制备方法,它包括如下步骤:
[0027]
(1)将介孔聚多巴胺纳米粒在溶剂中分散均匀;
[0028]
(2)将藤黄酸或藤黄酸溶液加入步骤(1)得到的介孔聚多巴胺纳米粒分散液中溶解,然后室温下避光搅拌;
[0029]
(3)搅拌后离心、洗涤,即得。
[0030]
进一步地,
[0031]
步骤(1)中,所述溶剂为pbs、超纯水或甲醇;
[0032]
和/或,步骤(2)中,所述藤黄酸溶液为藤黄酸的dmso溶液
[0033]
和/或,步骤(2)中,所述搅拌时间为12~24h;
[0034]
和/或,步骤(3)中,所述离心为在10000~13000r/min条件下离心;
[0035]
优选地,步骤(1)中,所述溶剂为ph=7.4的pbs。
[0036]
本发明还提供了前述的负载藤黄酸的介孔聚多巴胺纳米粒在制备抗肿瘤药物中的用途;
[0037]
优选地,药物为光热治疗法治疗肿瘤的药物;
[0038]
更优选地,所述药物为治疗乳腺癌的药物。
[0039]
本发明为了增强对癌症的治疗效果,设计了一种负载藤黄酸的聚多巴胺纳米粒。该纳米粒可通过提高胞内ros水平、降低线粒体膜电位、提高胞内ca
2
浓度、诱导免疫原性细胞死亡等作用机制发挥抗肿瘤的功效。本发明纳米粒同时具有化疗作用、光热转换效应和免疫激活作用,因而起到协同增效的抗肿瘤作用,可为乳腺癌等肿瘤的临床治疗提供重要的借鉴意义。
[0040]
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
[0041]
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
[0042]
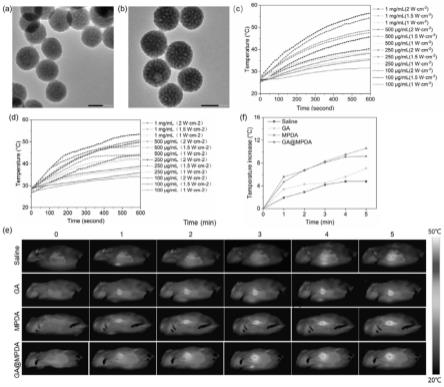
图1为纳米粒的体内外光热转换性能研究结果:a为mpda的透射电镜图,bar=100nm;b为ga@mpda的透射电镜图,bar=100nm;c为不同浓度mpda光热转换性能研究;d为不同浓度ga@mpda光热转换性能研究;e为荷瘤小鼠在激光照射5min内的光热图像;f为各组肿瘤部位的温度升高曲线。
[0043]
图2为纳米粒的抗肿瘤效果:a为活/死细胞染色分析,bar=200nm(绿色:活细胞,钙黄绿素;红色:死细胞,碘化丙啶);b为细胞的annexin v-fitc和pi共染的流式细胞图;c为乳腺癌模型小鼠的治疗方案示意图;d为治疗期间小鼠的肿瘤体积变化曲线;e为治疗结束后小鼠的肿瘤图片(1:生理盐水,2:mpda,3:ga,4:ga@mpda,5:mpda l,6:ga l,7:ga@mpda l);f为治疗结束后小鼠肿瘤重量;激光:808nm,0.5w
·
cm-2
,**p《0.01,***p《0.001。
[0044]
图3为乳腺癌细胞4t1胞内ros水平及线粒体损伤评价:a为4t1细胞在不同处理后经dcfh-da染色的共聚焦显微图,bar=100μm;b为4t1细胞在不同处理后经dcfh-da染色的流式细胞术分析及平均荧光强度统计图;c为4t1细胞在不同处理后经jc-1染色的流式统计图;d为4t1细胞在不同处理经fluo-4am染色的平均荧光强度统计图;e为4t1细胞在不同处理后经jc-1染色的共聚焦显微图,bar=100μm(红色:聚集体;绿色:单体);f为4t1细胞内ca
2
浓度的共聚焦图,bar=100nm(绿色:fluo-4 am探针);激光:808nm,0.5w
·
cm-2
,*p《0.05,**p《0.01,***p《0.001。
[0045]
图4为纳米粒介导的肿瘤细胞免疫原性死亡(icd)结果:a-c为血液中免疫因子检测;其中,a为il-6、b为tnf-α、c为ifn-γ的含量;d为hmgb1和crt免疫组化或免疫荧光染色,bar=200μm;激光:808nm,0.5w
·
cm-2
,*p《0.05,**p《0.01,***p《0.001。
具体实施方式
[0046]
本发明具体实施方式中使用的原料、设备均为已知产品,通过购买市售产品获得。
[0047]
实施例1、本发明介孔聚多巴胺纳米粒的制备
[0048]
介孔聚多巴胺纳米粒(mpda)的制备及纯化包括如下步骤:
[0049]
(1)取200mg普郎尼克f127(又称泊洛沙姆f127,f127)溶于5~20ml水和乙醇的混合溶液中(体积比=1:1);
[0050]
(2)在步骤(1)得到的溶液中加入0.1~0.3ml三甲基苯(tmb);
[0051]
(3)搅拌一定时间至搅拌均匀后加入多巴胺100mg和氨水0.5~2ml;
[0052]
(4)加入多巴胺和氨水后,室温搅拌1~5h左右,然后乙醇洗涤、离心,共三次;
[0053]
(5)将离心后得到的沉淀真空干燥,获得mpda。
[0054]
本发明制备mpda时采用一锅法制备而得。
[0055]
实施例2、本发明介孔聚多巴胺纳米粒的制备
[0056]
介孔聚多巴胺纳米粒(mpda)的制备及纯化包括如下步骤:
[0057]
(1)将100mg f127和50mg盐酸多巴胺溶解于5~20ml水和乙醇(体积比1∶1)混合液中,800~1500r/min搅拌至完全溶解。
[0058]
(2)在步骤(1)得到的溶液中加入0.1~0.3ml tmb,将混合物超声溶解,继续搅拌20~40min。
[0059]
(3)加入0.5~2ml氨水后,继续搅拌1~5h。
[0060]
(4)反应结束后,收集产物,为了纯化产物,乙醇洗涤、离心3次。
[0061]
(5)将离心后得到的沉淀真空干燥,获得mpda。
[0062]
实施例3、本发明负载藤黄酸的介孔聚多巴胺纳米粒的制备
[0063]
负载藤黄酸的介孔聚多巴胺纳米粒(ga@mpda)的制备及纯化包括如下步骤:
[0064]
(1)将实施例1制备得到的10mg mpda分散在5~15ml的pbs(ph=7.4)或超纯水中,探头超声3~10min使之分散均匀;
[0065]
(2)将8mg的藤黄酸(ga)溶解于100~500μl的dmso中,超声使其完全溶解;
[0066]
(3)将步骤(2)制备得到的ga溶液加入步骤(1)所得的mpda溶液中,在室温下避光搅拌12~24h;
[0067]
(4)搅拌后,在10000~13000r/min条件下,离心10~20min,在离心相同条件下用pbs或超纯水洗涤三次,获得ga@mpda。
[0068]
(5)将制备得到的ga@mpda在4℃保存待用。
[0069]
实施例4、本发明负载藤黄酸的介孔聚多巴胺纳米粒的制备
[0070]
负载藤黄酸的介孔聚多巴胺纳米粒(ga@mpda)的制备及纯化包括如下步骤:
[0071]
(1)将实施例1制备得到的10mg mpda分散在5~15ml的甲醇中,探头超声3~10min使之分散均匀;
[0072]
(2)将8mg的藤黄酸(ga)加入步骤(1)所得溶液中,搅拌使其完全溶解;
[0073]
(3)在室温下避光搅拌12~24h;
[0074]
(4)搅拌后,在10000~13000r/min条件下,离心10~20min,在离心相同条件下用pbs或超纯水洗涤三次,获得ga@mpda。
[0075]
(5)将制备得到的ga@mpda在4℃保存待用。
[0076]
以下通过具体试验例证明本发明的有益效果。
[0077]
试验例1、光热转换性能考察
[0078]
1、实验方法
[0079]
体外实验:采用实施例1制备得到的mpda和实施例3制备得到的ga@mpda进行实验,将mpda和ga@mpda均匀分散于超纯水中,配置成1mg/ml、0.5mg/ml、0.25mg/ml和0.01mg/ml的溶液。每次取3ml不同浓度的mpda和ga@mpda置于石英比色皿中,将温度探头竖直插入液
面以下合适位置,采用808nm激光器水平垂直照射石英皿,但避免激光器直射探头,通过温度计记录在不同激光功率(2w
·
cm-2
、1.5w
·
cm-2
、1w
·
cm-2
)照射下10min内不同浓度纳米粒的温度变化,每隔10s记录一次。记录温度变化值δt(计算方法如公式1),制作温度变化曲线。
[0080]
δt=t
’‑
t0ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
公式1
[0081]
公式1中,t’:10min内不同时间纳米粒的温度(℃);t0:纳米粒的起始温度(℃)
[0082]
体内实验:首先构建小鼠乳腺癌模型,选择处于对数生长期的、状态良好的4t1细胞经pbs清洗后,用含edta的胰酶消化下来,重悬在ph=7.4的pbs中,使其浓度为3
×
106个/ml。选择约6周龄、体重在18g及以上的balb/c雌鼠,将其左侧第二乳腺垫附近的毛刮净。在小鼠的第二乳腺垫皮下注射100μl浓度为3
×
106个/ml的4t1细胞悬液。待小鼠肿瘤体积达到约200mm3后,随机分为四组(saline、ga、mpda和ga@mpda)。分别尾静脉注射生理盐水、ga、mpda和ga@mpda,给药剂量:ga为2mg/kg,mpda为2.75mg/kg,ga@mpda为2.75mg/kg(ga@mpda中所含ga量为2mg/kg),注射量均为10μl/g,在注射完后6h麻醉小鼠,用红外激光器照射小鼠肿瘤部位(波长:808nm,功率:0.5w
·
cm-2
,时间:5min),同时用红外热成像仪记录5min肿瘤部位的温度变化。
[0083]
2、实验结果
[0084]
mpda和ga@mpda的tem图片如图1(a、b)所示,可以看出制备的mpda为表面多孔的均一球形结构。mpda的粒径约150nm,纳米粒表面有许多孔道且表面较为粗糙;与mpda相比,载药后ga@mpda的粒径略有增加且孔道变少,表面也变得更加光滑,这一结果说明ga成功地负载在了mpda的孔道及表面。
[0085]
mpda和ga@mpda的体外光热转换性能如图1(c、d)所示,可以看出,在10min内1mg/ml的mpda和ga@mpda在2w
·
cm-2
的红外光照射下温度分别可以上升29.8℃和25.3℃,说明mpda和ga@mpda均具有良好的光热效果。此外,在同一光照条件下,随着mpda和ga@mpda的浓度不断增加,纳米粒的温度变化(δt)也逐渐增加,说明mpda和ga@mpda的温度变化具有浓度依赖性。在同一浓度下,随着激光功率不断增加,δt也逐渐增加,说明mpda和ga@mpda的温度变化具有功率依赖性。这一结果说明mpda是具有优良光热性能的纳米粒,可以用作光热材料进行ptt。负载ga的mpda同样具有优良光热性能,也可以用作光热材料进行ptt。
[0086]
体内考察结果如图1(e、f)所示,和生理盐水组相比,mpda和ga@mpda组在激光照射后2分钟肿瘤部位温度升高迅速,且在照射后5min时分别达到41.3℃和39.2℃,分别升温了10.6℃和9.2℃。体内的光热性能和体外结果一致,进一步说明了mpda和ga@mpda都具有较好的光热性能,可用于ptt。此外,和mpda组相比,ga@mpda组的温度仅达到了39.2℃,温度上升得更缓慢,这说明ga@mpda可进一步降低光热治疗的温度。
[0087]
试验例2、本发明纳米粒在体内外的抗肿瘤作用研究
[0088]
本试验例使用的mpda为实施例1制备的mpda,使用的ga@mpda为实施例3制备的ga@mpda。
[0089]
1、实验方法
[0090]
(1)活死细胞染色实验:
[0091]
将处于对数生长期的、状态良好的4t1细胞以5000个/孔的接种在96孔板中,孵育24h后弃去旧培养基。分别给药ga(0.1μg/ml)、mpda(0.14μg/ml)和ga@mpda(0.14μg/ml,ga@
mpda中所含ga量为0.1μg/ml)各200μl孵育细胞,加激光的给药组在药物刺激4h后照射激光(0.5w
·
cm-2
,1min)。然后,不用激光照射和使用激光照射的每孔加入100μl钙黄绿素和pi染色液,37℃孵育15min后,用共聚焦显微镜观察。
[0092]
(2)细胞凋亡实验:
[0093]
将处于对数生长期的、状态良好的4t1细胞以80000个/孔接种在12孔板中,孵育24h后弃去旧培养基。pbs清洗一遍细胞后,分别给药ga(0.1μg/ml)、mpda(0.14μg/ml)和ga@mpda(0.14μg/ml,ga@mpda中所含ga量为0.1μg/ml)各1ml孵育细胞,加激光的给药组在药物刺激4h后照射激光(0.5w
·
cm-2
,1min)。然后,不用激光照射和使用激光照射的各组用pbs清洗细胞后消化细胞,300g/min离心5min后收集细胞。用pbs清洗细胞,300g/min离心5min后收集细胞,重复2次。加入100μl的binding buffer(1
×
)重悬细胞,加入2μl的annexin-v-fitc和4μl的pi staining solution轻轻混匀染色,避光孵育10min。最后加入400μl的binding buffer(1
×
),混匀后置于冰上,1h内用流式细胞仪上机检测。
[0094]
(3)体内抗肿瘤效果:
[0095]
按照试验例1所述方法构建小鼠乳腺癌模型,待小鼠肿瘤体积达到约70mm3后,随机分为7组(
①
saline;
②
ga;
③
ga l;
④
mpda;
⑤
mpda l;
⑥
ga@mpda;
⑦
ga@mpda l),每组6只小鼠。
①
静脉注射0.9%生理实验水;
②
静脉注射游离ga;
③
静脉注射游离ga后6h照射激光;
④
静脉注射游离mpda;
⑤
静脉注射mpda后6h照射激光;
⑥
静脉注射ga@mpda;
⑦
静脉注射ga@mpda后6h照射激光。
[0096]
给药方案:分别于第0天和第5天给药,ga的给药剂量为2mg/kg,mpda的给药剂量为2.75mg/kg,ga@mpda的给药剂量为2.75mg/kg(ga@mpda中所含ga量为2mg/kg),注射量为10μl/g,并在静脉给药后6h照射激光(0.5w
·
cm-2
,5min)。
[0097]
体内抗肿瘤效果评价方法:从第0天开始,每两天记录一次肿瘤的体积(公式2),并计算其抑瘤率(公式3)。在给药后第14天,处死小鼠,解剖出肿瘤,对肿瘤进行称重并拍照。最后将肿瘤用4%多聚甲醛固定24h后进行石蜡包封、切片,进行h&e染色、tunel和ki67染色。用光学显微镜或共聚焦显微镜观察。
[0098][0099][0100]
2、实验结果
[0101]
(1)如图2(a)所示,和control组(正常4t1细胞)相比,ga和ga@mpda均能引起细胞大面积的细胞死亡。细胞在1min激光照射后ga@mpda组的细胞死亡面积更大,ga和mpda组在1min激光照射后细胞死亡面积远小于ga@mpda组。活死细胞染色结果说明了ga@mpda对4t1细胞的杀伤性最大,且在经过激光照射后杀伤性会进一步增强。因而本发明纳米粒ga@mpda在808nm近红外激光照射下,能够通过藤黄酸和光热治疗协同杀伤肿瘤细胞,抑制肿瘤细胞生长。
[0102]
(2)如图2(b)所示,和control组(正常4t1细胞)相比,ga@mpda能显著促进细胞凋亡(p《0.001);在激光照射1min后,ga@mpda l组的细胞凋亡率相比于ga@mpda组有进一步提
升(p《0.01),这一结果和活死细胞染色结果一致,说明了激光照射可以和药物处理产生协同增强的作用,促进肿瘤细胞凋亡。
[0103]
(3)按照如图2(c)所示给药,肿瘤生长曲线如图2(d)所示,相比于其他组,ga@mpda l组的肿瘤生长速度一直处于较低水平,在治疗结束时,ga@mpda l组的平均肿瘤体积为276
±
56.92mm3远小于ga@mpda组(615.20
±
91.05mm3,p《0.001)和生理盐水组(1624.38
±
520.23mm3,p《0.001)等其他治疗组。和肿瘤生长曲线相似,ga@mpda l组的平均抑瘤率最高,达到83.01%,高于ga@mpda组(62.13%)及其他各治疗组。这一结果说明ga@mpda l组的抗肿瘤效果最好,藤黄酸和光热治疗具有协同增效的作用。
[0104]
(4)如图2(e、f)所示,治疗结束后对肿瘤重量进行统计,相比于其他组,ga@mpda l组的平均肿瘤重量最小(0.7246
±
0.26g),远低于ga@mpda组(1.64
±
0.28g,p《0.001)和生理盐水组(2.69
±
0.41mm3,p《0.001)等其他治疗组。这一结果和结束治疗时小鼠肿瘤的体积趋势一致,进一步说明了ga@mpda l组的抗肿瘤效果最好,藤黄酸和光热治疗具有协同增效的作用。
[0105]
本试验例结果说明:本发明提供的负载藤黄酸的介孔聚多巴胺纳米粒通过发挥化疗和光热治疗的联合作用,在体内外均显示出良好的抗肿瘤效果。本发明纳米粒可以在细胞水平上杀伤肿瘤细胞且促进肿瘤细胞凋亡;此外,纳米粒可通过静脉注射并对肿瘤部位进行局部激光照射(ga@mpda l)从而提高抗肿瘤治疗效果,且和单纯ptt治疗(mpda l)相比,ga@mpda l组上升更少的温度就可达到更好的抗肿瘤效果,这说明其抗肿瘤效果优异,临床应用前景佳。
[0106]
试验例3、本发明纳米粒对肿瘤细胞的ros水平及线粒体的影响
[0107]
本试验例使用的mpda为实施例1制备的mpda,使用的ga@mpda为实施例3制备的ga@mpda。
[0108]
1、实验方法
[0109]
(1)胞内ros水平实验:
[0110]
定量分析:将处于对数生长期的、状态良好的4t1细胞以80000个/孔接种在12孔板中,孵育24h后弃去旧培养基。pbs清洗一遍细胞后,分别给药ga(0.1μg/ml)、mpda(0.14μg/ml)和ga@mpda(0.14μg/ml,ga@mpda中所含ga量为0.1μg/ml)各1ml孵育细胞。然后,加激光的给药组在药物刺激4h后照射激光(0.5w
·
cm-2
,1min)。不用激光照射和使用激光照射的各组均弃去上清液,用10μm的dcfh-da探针37℃孵育30min。用pbs清洗细胞后消化细胞,300g/min离心5min后收集细胞。用pbs清洗细胞,300g/min离心5min后收集细胞,重复2次。最后重悬在500μl的pbs中,用流式细胞仪检测。
[0111]
定性分析:将处于对数生长期的、状态良好的4t1细胞以80000个/孔接种在共聚焦皿中,孵育48h后弃去旧培养基。pbs清洗一遍细胞后,分别给药ga(0.1μg/ml)、mpda(0.14μg/ml)和ga@mpda(0.14μg/ml,ga@mpda中所含ga量为0.1μg/ml)各2ml孵育细胞。然后,加激光的给药组在药物刺激4h后照射激光(0.5w
·
cm-2
,1min)。不用激光照射和使用激光照射的各组均弃去上清液,用10μm的dcfh-da探针37℃孵育30min。pbs清洗细胞5min,清洗3次。最后加入500μl的pbs,用共聚焦显微镜观察。
[0112]
(2)胞内线粒体膜电位实验:
[0113]
定量分析:将处于对数生长期的、状态良好的4t1细胞以80000个/孔接种在12孔板
中,孵育24h后弃去旧培养基。pbs清洗一遍细胞后,分别给药ga(0.1μg/ml)、mpda(0.14μg/ml)和ga@mpda(0.14μg/ml,ga@mpda中所含ga量为0.1μg/ml)各1ml孵育细胞。然后,加激光的给药组在药物刺激4h后照射激光(0.5w
·
cm-2
,1min)。不用激光照射和使用激光照射的各组均弃去上清液,pbs清洗细胞后用jc-1染色工作液37℃孵育20min。用jc-1染色缓冲液清洗细胞后消化细胞,600g/min离心3min后收集细胞。用jc-1染色缓冲液清洗细胞,600g/min离心3min后收集细胞,重复2次。最后重悬在500μl的jc-1染色缓冲液中,用流式细胞仪检测。
[0114]
定性分析:将处于对数生长期的、状态良好的4t1细胞以80000个/孔接种在共聚焦皿中,孵育48h后弃去旧培养基。pbs清洗一遍细胞后,分别给药ga(0.1μg/ml)、mpda(0.14μg/ml)和ga@mpda(0.14μg/ml,ga@mpda中所含ga量为0.1μg/ml)各2ml孵育细胞。然后,加激光的给药组在药物刺激4h后照射激光(0.5w
·
cm-2
,1min)。不用激光照射和使用激光照射的各组均弃去上清液,pbs清洗细胞后用jc-1染色工作液37℃孵育20min。用jc-1染色缓冲液清洗细胞2次后,用共聚焦显微镜观察。
[0115]
(3)胞内ca
2
浓度实验:
[0116]
定量分析:将处于对数生长期的、状态良好的4t1细胞以8
×
104个/孔接种在12孔板中,孵育24h后弃去旧培养基。pbs清洗一遍细胞后,分别给药ga(0.1μg/ml)、mpda(0.14μg/ml)和ga@mpda(0.14μg/ml,ga@mpda中所含ga量为0.1μg/ml)各2ml孵育细胞。然后,加激光的给药组在药物刺激4h后照射激光(0.5w
·
cm-2
,1min)。不用激光照射和使用激光照射的各组均弃去上清液,pbs清洗细胞后用0.5μm的fluo-4amt探针37℃孵育10min。用pbs清洗细胞后消化细胞,300g/min离心5min后收集细胞。用pbs清洗细胞,300g/min离心5min后收集细胞,重复2次。最后重悬在500μl的pbs中,用流式细胞仪检测。
[0117]
定性分析:将处于对数生长期的、状态良好的4t1细胞以8
×
104个/孔接种在共聚焦皿中,孵育48h后弃去旧培养基。pbs清洗一遍细胞后,分别给药ga(0.1μg/ml)、mpda(0.14μg/ml)和ga@mpda(0.14μg/ml,ga@mpda中所含ga量为0.1μg/ml)各2ml孵育细胞。然后,加激光的给药组在药物刺激4h后照射激光(0.5w
·
cm-2
,1min)。不用激光照射和使用激光照射的各组均弃去上清液,pbs清洗细胞后用0.5μm的fluo-4am探针37℃孵育10min。用pbs清洗细胞3次,每次5min,用激光共聚焦显微镜观察。
[0118]
2、实验结果
[0119]
(1)通过dcfh-da染色利用流式细胞术和激光共聚焦显微镜对细胞的ros水平进行定量和定性考察。定量结果如图3(b)所示,和control组(正常4t1细胞)相比,ga@mpda和ga@mpda l组的细胞ros水平有显著性的增加(p《0.001);ga@mpda组的ros水平也远超过ga组(p《0.01)。更重要的是,和ga@mpda组相比,ga@mpda l组细胞内ros水平提高了36%,说明激光可以促进细胞ros水平的提高。定性结果如图3(a)所示,各组的ros水平与流式的定量结果一致,ga@mpda l组的绿色荧光最强,进一步说明了ga@mpda在激光照射的情况下可以增强胞内ros水平。
[0120]
(2)由于线粒体是ros产生的主要场所,线粒体功能对ros的产生具有重要影响,且ptt治疗效果也和线粒体功能息息相关,所以接下来通过jc-1染色检测细胞线粒体膜电位(mmp)的变化。jc-1是阳离子线粒体选择性染料,在高mmp下产生红色荧光(jc-1聚集体),但在低mmp下产生绿色荧光(jc-1单体)。流式定量结果如图3(c)所示,和control组相比,ga
l、mpda l、ga@mpda和ga@mpda l组的绿色荧光增强,即mmp显著降低(p《0.001)。其中,ga@mpda l组的mmp下降最明显,下降至48.92%约为control组的3倍。和未加激光的组(ga、mpda、ga@mpda)相比,加激光的组(ga l、mpda l、ga@mpda l)绿色荧光更强,mmp更低,说明激光可以降低mmp。此外,和control组相比,ga组的mmp略有下降(p》0.05),mpda组和control组的mmp无差异,而ga@mpda组的mmp显著下降(p《0.001),说明ga可以降低mmp。定性结果如图3(e)所示,和control组相比,ga@mpda组的4t1细胞内可观察到明显的红色荧光降低,且ga@mpda组细胞在激光照射1min后红色荧光进一步降低,和流式定量的结果一致。
[0121]
(3)第二信使ca
2
参与了许多信号的传递过程,细胞内ca
2
超载也是造成线粒体膜电位下降的原因之一。上文已经得知纳米粒会降低mmp,接下来通过fluo-4am探针观察其对细胞内ca
2
水平的影响。定量结果如图3(d)所示,和control组相比,ga l、mpda l、ga@mpda和ga@mpda l组的细胞内ca
2
水平均显著增加(p《0.05)。其中,ga@mpda l组的ca
2
浓度增加最显著(p《0.001),为control组的2.21倍。和未加激光的组(ga、mpda、ga@mpda)相比,加激光的组(ga l、mpda l、ga@mpda l)细胞内ca
2
更高,说明激光可以促进细胞内ca2 内流。此外,和control组相比,ga组的ca
2
浓度略有增加(p》0.05),而ga@mpda组的ca
2
浓度显著增加(p《0.001),说明ga可以降低mmp,可能因为细胞对游离ga的摄取能力较弱所以没有显著性差异。定性结果如图3(f)所示,和control组相比,ga@mpda组的4t1细胞内可观察到明显的绿色荧光,且ga@mpda组细胞在激光照射1min后绿色荧光进一步增强,和流式定量的结果一致。
[0122]
本试验例结果说明:本发明提供的负载藤黄酸的介孔聚多巴胺纳米粒可通过提高胞内ros水平、降低线粒体膜电位、提高胞内ca
2
浓度等作用机制发挥抗肿瘤的功效,且其同时具有化疗作用和光热转换效应,起到协同增效的治疗作用。
[0123]
试验例4、本发明纳米粒诱导肿瘤部位的免疫原性细胞死亡
[0124]
本试验例使用的mpda为实施例1制备的mpda,使用的ga@mpda为实施例3制备的ga@mpda。
[0125]
1、实验方法
[0126]
按照试验例2“(3)体内抗肿瘤效果”所述方法构建小鼠乳腺癌模型、随机分为7组、并给药。在给药后第14天,处死小鼠,每组随机取3只小鼠,摘眼球取血,用1.5ml的ep管收集,静止2h后3000rmp/min离心10min取血清进行elisa检测,检测促炎因子il-6、ifn-γ和tnf-α水平。每组任选一只小鼠肿瘤进行crt和hmgb1染色。
[0127]
elisa:
[0128]
(1)复温:从冰箱中拿出试剂盒复温60min,确保充分复温到室温。
[0129]
(2)加样:标准品孔:每孔加不同浓度的标准品50μl;0值孔:加样本稀释液50μl;样本孔:每孔加待测样本50μl。
[0130]
(3)孵抗体:标准品孔、0值孔和样本孔,每孔加入辣根过氧化物酶(hrp)标记的检测抗体100μl后,用封板膜盖住反应板,37℃恒温箱孵育60min。
[0131]
(4)清洗:先配置洗涤液:浓缩洗涤液:up水=1:19。揭开封板膜,弃去液体后在吸水纸上拍干,每孔加满洗涤液,静置20s后弃去洗涤液,吸水纸上拍干,如此重复5次。最后一次洗涤完后充分拍干反应板。
[0132]
(5)底物的配置:底物液a:底物液b=1:1(混合后15min内使用)。所有孔中加入底
物混合液100μl。用封板膜盖住反应板,37℃水浴锅或恒温箱孵育15min
[0133]
(6)终止:所有孔加入50μl终止液,在酶标仪上读取各孔450nm处的吸光度(od值)。标准品浓度为纵坐标(6个标准品孔加1个0值孔),对应的od值为横坐标,利用origin软件,采用四参数logistic曲线拟合(4-pl),创建标曲,通过样本的od值,利用方程计算样品的浓度值。
[0134]
2、实验结果
[0135]
(1)通过elisa实验检测相关促炎因子的水平,各治疗组结果如图4(a-c)所示,相比于其他组,ga@mpda l组的il-6、tnf-α和ifn-γ平均水平远高于生理盐水组(p《0.01)等其他治疗组。其中,ga@mpda l组的tnf-α和ifn-γ水平远高于ga@mpda组,说明光热可以诱导细胞促炎因子水平上调。和mpda l组相比,ga@mpda l组的促炎因子水平更高(p《0.01),说明ga可以增强光热诱导icd的效果。
[0136]
(2)通过免疫组化和免疫荧光检测高迁移率蛋白(hmgb1)和钙网蛋白(crt)的表达,结果如图4(d)所示,与生理盐水组相比,ga@mpda l组更能促进hmgb1和crt在细胞上的表达。与ga@mpda相比,ga@mpda l组的hmgb1表达略低。可能是因为ga@mpda l对肿瘤细胞的杀伤性更强,大部分肿瘤细胞被杀死,细胞密度较低。综上,ga@mpda通过局部热消融可诱导强烈的icd,此外,多种促炎细胞因子水平上升,可能有进一步促进抗癌免疫治疗的作用。
[0137]
本试验例结果说明:本发明提供的负载藤黄酸的介孔聚多巴胺纳米粒在体内可以诱导肿瘤部位的免疫原性细胞死亡,具有增强抗肿瘤免疫的潜力,临床应用前景佳。
[0138]
综上,本发明为了增强对癌症的治疗效果,设计了一种负载藤黄酸的聚多巴胺纳米粒。该纳米粒可通过提高胞内ros水平、降低线粒体膜电位、提高胞内ca
2
浓度、诱导免疫原性细胞死亡等作用机制发挥抗肿瘤的功效。本发明纳米粒同时具有化疗作用、光热转换效应和免疫激活作用,因而起到协同增效的抗肿瘤作用,可为乳腺癌等肿瘤的临床治疗提供重要的借鉴意义。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。