1.本发明涉及核酸疫苗领域,具体涉及一种用于预防狂犬病毒感染的mrna疫苗。
背景技术:
2.狂犬病是由狂犬病病毒引起的侵犯中枢神经系统为主的急性人兽共患传染病,该病毒可由所有哺乳动物携带(通常通过唾液),并通过咬伤或抓伤直接感染人类,病死率为100%。据调查,全球每年约59000人死于狂犬病,大多集中在亚洲和非洲,且我国属于狂犬病高发地区。狂犬病病毒是狂犬病的致病病原体,结构呈子弹状,由rna基因组和5个结构蛋白g、n、p、m、l构成,其中狂犬病病毒借助g蛋白附着目的细胞,迅速进入外周细胞,在逆行轴突转运和跨突触扩散后,最终到达大脑。包膜病毒在神经细胞和神经运输囊泡中的运输躲避了适应性免疫的清除,因此狂犬病的有效免疫性防御必须拦截狂犬病毒阻止其造成神经感染。这就需要诱导宿主细胞产生抗体,立即中和狂犬病毒阻止其进入组织,因此g蛋白作为目标抗原被广泛用于狂犬病毒疫苗的开发。
3.传统的狂犬病预防性疫苗早期生产利用哺乳动物神经组织,之后更换为体外组织细胞和胚胎培养,产能低、造价高,造成疫苗短缺,无法体现疫苗的普适性。新型狂犬病毒疫苗类型包括亚单位疫苗,dna疫苗和病毒载体疫苗。尽管临床前验证了疫苗良好的免疫保护原性,然而尚无一款疫苗被批准用于人类狂犬病的预防。mrna疫苗通过直接免疫目的抗原的基因编码脚本,再由机体自身合成目的抗原蛋白,同时快速诱导产生中和性抗体发挥免疫保护作用和细胞免疫应答。与传统疫苗和dna疫苗、病毒载体疫苗相比,mrna疫苗制备方法简单、成本相对低廉、生产周期短、易实现量产与普及,且理论安全性高,适合狂犬病预防性疫苗的研制开发。
4.研发我国具有自主知识产权的狂犬病mrna疫苗,不仅对狂犬病的防治具有重要意义,还能丰富我国的疫苗储备。mrna疫苗的成功研制很大程度上取决于mrna自身序列的优化,包括抗原编码区和抗原编码区以外的骨架部分。采用优化的骨架序列,可以实现狂犬病mrna疫苗的快速研发。
技术实现要素:
5.本发明的目的在于提供一种用于预防狂犬病毒感染的mrna疫苗。
6.本发明提供一种mrna疫苗,所述疫苗的活性成分为mrna-1902p,所述mrna-1902p包括依次连接的5
’‑
utr、目的基因的mrna和3
’‑
utr和poly a,所述5
’‑
utr的序列为序列表中序列1的第1至46位中的t替换为u所得到的序列;所述3
’‑
utr的序列为序列表中序列1的第1637至1762位中的t替换为u所得到的序列;所述poly a的序列为序列表中序列1的第1763至1882位中的t替换为u所得到的序列;所述目的基因的mrna为序列表中序列1的第47至1636位中的t替换为u所得到的序列。
7.所述疫苗为用于预防狂犬病的mrna疫苗。
8.所述mrna的5’端连接有cap结构。
9.所述mrna的polya尾结构下游连接有识别位点序列。
10.上述疫苗在制备用于预防狂犬病毒感染的mrna疫苗中的应用也应在本发明的保护范围之内。
11.本发明提供一种用于mrna疫苗快速研发的骨架代码,包括所述的5
’‑
utr、3
’‑
utr和poly a。使用时,将目的基因的mrna插入到所述骨架的5
’‑
utr、3
’‑
utr之间。
12.所述的骨架代码在如下任一中的应用也应在本发明的保护范围之内:
13.1)制备mrna疫苗;
14.2)制备mrna抗体;
15.3)制备mrna细胞因子;
16.4)制备mrna疗法中使用的相关药物。
17.本发明提供一种与所述的疫苗相关的生物材料,所述生物材料为b1)-b6)中的任一种:
18.b1)编码所述mrna-1902p的核酸分子;
19.b2)含有b1)所述核酸分子的表达盒;
20.b3)含有b1)所述核酸分子的重组载体、或含有b2)所述表达盒的重组载体;
21.b4)含有b1)所述核酸分子的重组质粒、或含有b2)所述表达盒的重组质粒;
22.b5)含有b1)所述核酸分子的重组菌、或含有b2)所述表达盒的重组菌、或含有b3)所述重组载体的重组菌;
23.b5)含有b1)所述核酸分子的转基因细胞系、或含有b2)所述表达盒的转基因细胞系、或含有b3)所述重组载体的转基因细胞系。
24.所述重组载体为将序列表中序列1的所示序列插入到载体pcdna3.1( )的nhei
‑‑
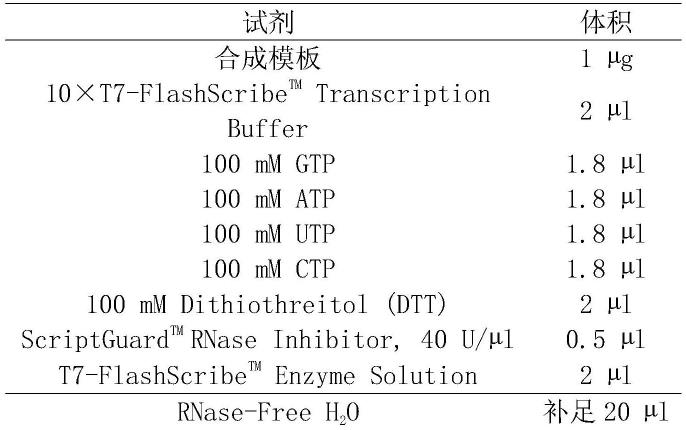
xhoi位点之间,并保持载体其他位点不变的序列。
25.上述生物材料在制备用于预防狂犬病毒感染的mrna疫苗中的应用也应在本发明的保护范围之内。
26.本发明的有益效果在于,本发明提供了狂犬病mrna候选疫苗mrna-1902p的序列信息。mrna-1902p采用最佳骨架代码以及优化的密码子编码序列构成。通过体外转染hek293t和hela细胞,检测到mrna-1902p可高效表达狂犬病毒g蛋白目的抗原。小鼠经mrna-1902p-lpp纳米疫苗制剂肌肉免疫两次后,检测到血清中高效价中和保护性抗体的产生。攻毒实验后,mrna-1902p免疫小鼠体重基本维持攻毒前体重且呈略微上升趋势,实现全体免疫性保护,无一例死亡发生,充分证明mrna-1902p狂犬mrna疫苗具备良好的免疫保护原性,对狂犬病的预防有重要意义。不仅如此,发明中得到的最佳骨架代码序列可以通用于其他传染病和癌症预防性和治疗性mrna疫苗的应急开发与储备。
附图说明
27.图1为本发明的狂犬病mrna疫苗mrna-1902p的结构示意图。
28.图2为本发明的实施例1中的质量分析结果图。
29.图3为本发明的实施例1中的细胞转染蛋白表达检测结果图。
30.图4为本发明的实施例2中的小鼠体内效力评价。
31.图5为本发明的实施例2中的攻毒实验的小鼠体重情况图。
32.图6为本发明的实施例2中的攻毒实验的小鼠存活情况图。
具体实施方式
33.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
34.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
35.实施例1、狂犬病mrna疫苗的序列设计、制备和体外多种细胞的抗原表达检测
36.一、狂犬病mrna疫苗的序列设计
37.狂犬病mrna疫苗的序列设计采用优化的mrna骨架代码序列,加强mrna的稳定性与蛋白表达效能。狂犬病mrna的cds由优化的密码子构成,决定了狂犬病毒g蛋白(rabv-g)的氨基酸序列(genbank登记号acr39382.1)。为实现mrna的体外转录,将狂犬病mrna疫苗序列模板构建在载体pcdna3.1( )的多克隆位点区域nhei
‑‑
xhoi位点之间得到重组质粒,利用载体序列上的t7启动子序列,在t7转录酶作用下启动体外转录。由此,设计优化得到狂犬病mrna疫苗mrna-1902p,如图1所示;狂犬病mrna疫苗mrna-1902p的序列如序列表中序列所示:
38.mrna-1902p序列:
39.自5’端第1至46为5
’‑
utr,第47至1636为cds(编码狂犬病毒ctn-1株g蛋白,genbank登记号acr39382.1),第1637至1762为3
’‑
utr,第1763至1882为poly a尾。
40.二、狂犬病mrna疫苗的体外合成
41.1.将设计的狂犬病mrna疫苗序列进行dna模板合成,并通过测序验证。
42.2.将步骤1合成的dna模板进行扩增:将dna模板连接到载体pcdna3.1( )的nhei
‑‑
xhoi位点之间,得到重组质粒。将重组质粒转化感受态细胞dh5α,通过对宿主大肠杆菌的培养,得到大量扩增菌体。借助无内毒素质粒大提试剂盒(天根生物科技(北京)有限公司,dp117)提取扩增菌体中扩增的重组质粒。将扩增的重组质粒进行线性化:利用xbai和sapi对提取的重组质粒进行酶切线性化,经纯化得到可用于mrna体外合成的模板,并采用qubit
tm
dsdna br assay kit(invitrogen,q32850)试剂盒进行定量。
43.3.以步骤2扩增的dna为mrna的体外合成模板,配制表1所示的反应体系,37℃孵育1h进行体外转录,得到大量体外转录rna,并采用qubit
tm
dsdna br assay kit(invitrogen,q32850)试剂盒进行定量。
44.表1.体外转录反应采用t7-flashscribe
tm transcription试剂盒(cellscript,c-asf3507)
[0045][0046]
4、将步骤3体外转录rna产物进行纯化:向转录反应体系中加入1μl rnase-free dnase i,37℃孵育15min,以去除体外转录产物体系中的dna模板,得到转录产物。再对得到的转录产物进行纯化,纯化方法如下:
[0047]
(1)向转录产物中加入rnase-free h2o补足体积200μl;
[0048]
(2)加入200μl混合液a(水饱和酚:氯仿:异戊醇,v:v:v,25:24:1),涡旋10s,4℃,13800
×
g离心5min,然后将管中上层水相移至新管中;
[0049]
(3)向新管中加入等体积混合液b(氯仿:异戊醇,v:v,24:1),涡旋10s,4℃,13800
×
g离心5min,然后将管中上层水相移至新管中;
[0050]
(4)向新管中加入等体积5m乙酸铵溶液,涡旋混匀后冰上放置15min后,4℃、13800
×
g离心15min,弃上清。
[0051]
(5)加入70%冰乙醇对rna进行清理后,弃去70%乙醇;,加适量rnase-free水(solarbio,r1600)重悬,并采用qubit
tm
rna br assay kit(invitrogen,q10211)试剂盒进行定量。
[0052]
5.对步骤4得到的rna转录纯化产物进行mrna加帽反应,具体步骤如下:
[0053]
(1)rna变性:取60μg转录纯化产物,65℃孵育15min进行变性处理,然后移至冰上。
[0054]
(2)mrna加帽反应:加入rna变性产物后,按照表2所示的配制反应体系,37℃孵育0.5h,得到mrna具有cap 1型结构的加帽产物。
[0055]
表2 mrna的cap 1加帽反应体系配制采用scriptcap
tm
cap 1capping system试剂盒(cellscript,c-sccs1710)。
[0056][0057]
6.mrna加帽产物纯化:同步骤4。
[0058]
7.mrna的质量分析
[0059]
采用安捷伦2100生物分析仪和rna nano 6000assay kit(aglient,5067-1511)对合成mrna进行质量分析,具体步骤如下:
[0060]
(1)mrna变性:将mrna和mrna ladder,70℃变性2min,然后立即冰浴。
[0061]
(2)准备凝胶:按说明将rna gel matrix加入过滤管中,1500
×
g室温离心10min,4℃保存备用。
[0062]
(3)准备凝胶-染料混合物:rna染料避光平衡30min,然后涡旋数秒,瞬时离心后以65:1比例配制凝胶染料混合物,将混合物涡旋混匀,13000
×
g室温离心10min。
[0063]
(4)加载凝胶-染料混合物:使用rna nano芯片之前,调节芯片制备器夹子到最上方的位置。将rna芯片放入芯片槽,在注明黑色g的孔中加入9μl凝胶-染料混合物(不要有气泡);注射器活塞在1ml位置处时关闭注胶器,按压注射器,用夹子固定30s后再松开,5s后将活塞拉回1ml处的位置;打开注胶器,在其它注明白色g的孔中加入9μl凝胶-染料混合物。
[0064]
(5)加载marker:在所有样品孔与ladder孔中各加入6μl rna marker。
[0065]
(6)加载ladder与mrna:在标有梯子图样的孔中加入1μl ladder,将mrna加入到剩余12个孔中(没有用到的孔可用rnase-free water代替),将芯片放到芯片涡旋振荡器上,2400r/min振荡1min,然后5min内将芯片放到agilent 2100仪中进行检测。
[0066]
结果如图2所示。结果显示,体外合成的狂犬病mrna-1902p条带与目标条带一致,浓度为2820ng/ul。
[0067]
三、mrna细胞转染蛋白表达检测
[0068]
1.接种细胞:将293t细胞、hela细胞(atcc)分别接种于12孔板中,每孔3
×
105个细胞,37℃,5%co2培养箱中至细胞达到80-90%融合度即可进行转染。
[0069]
2.配制转染复合物:采用-mrna transfection kit(mirus,mir 2250):100μl opti-mem 1μg mrna 2μl mrna boost reagent 2μl transit-mrna reagent,混匀、室温静置2-5min形成转染复合物。
[0070]
3.转染细胞:将转染复合物滴加到细胞并上下左右晃动使转染复合物均匀分布,37℃,5%co2孵育18h后收取细胞,转染前后无需更换细胞培养液。
[0071]
4.提取细胞总蛋白:细胞用pbs清洗两次后,利用细胞裂解液ripa(金普莱,
p06m11) 蛋白酶抑制剂100
×
(金普莱,p01c01),涡旋,以充分裂解细胞。冰浴30min后,4℃,离心13800
×
g,15min,取上清液。
[0072]
5.细胞总蛋白定量:利用bca蛋白定量试剂盒(金普莱,p06m16)对细胞裂解上清液中总蛋白进行定量。将细胞裂解上清液与bca工作液混匀,37℃,孵育45min,a
562nm
下检测吸光度,并计算细胞总蛋白浓度。
[0073]
6.western blotting(wb)检测目标蛋白表达:利用蛋白电泳预制胶bolt
tm
4 to 12%,bis-tris,1.0mm,mini protein gel(invitrogen,nw04120box)电泳(200v,22min)进行总蛋白(30μg)分离。将凝胶上的分离蛋白在梯度电压(20v,1min;23v,4min;25v,2min)作用下转移到iblot 2transfer stacks,pvdf(invitrogen,ib24001)膜上后,在含5%脱脂奶粉的1
×
tbst中室温摇育,20r/min,封闭1h。一抗采用狂犬病毒g蛋白鼠单抗稀释液(1:2000)(hytest,3r7-4f1),20r/min,室温摇育2h。用1
×
tbst清洗膜,60r/min,室温摇育10min,并重复3次,以彻底去除一抗残余。二抗采用辣根过氧化物酶(hrp)标记的山羊抗鼠igg二抗稀释液(1:10000),goat anti-mouse igg secondary antibody(hrp)(义翘神州,ssa007),20r/min,室温摇育1h。用1
×
tbst清洗膜,60r/min,室温摇育10min,并重复3次,以彻底去除二抗残余。利用ecl化学发光超敏显色试剂盒(翊圣生物,36208es60)与膜室温避光孵育3min,在化学发光仪中检测hrp标记的抗体结合抗原。通过曝光显现条带与蛋白marker,pageruler
tm
prestained protein ladder(invitrogen,26617)条带比对,验证目标抗原蛋白的表达。利用膜再生液(索莱宝,sw3020)去除膜上抗体,再次对膜进行封闭后,孵育内参抗体,以检测蛋白上样量的一致性。一抗采用β-actin兔单抗稀释液(1:50000),actb rabbit mab(abclonal,ac038),二抗采用辣根过氧化物酶(hrp)标记的山羊抗兔igg二抗稀释液(1:10000),goat anti-rabbit igg secondary antibody(hrp)(义翘神州,ssa004)。
[0074]
结果如图3所示,结果显示:体外合成的狂犬病mrna-1902p分别转染hek293t和hela细胞后,wb均检测到高效表达的狂犬病毒g蛋白目的抗原。
[0075]
实施例2、狂犬病mrna疫苗免疫小鼠后中和抗体产生的情况和免疫保护作用考察
[0076]
一、狂犬病mrna疫苗的高效递送制剂制备
[0077]
制剂制备与上海斯微生物公司合作制备狂犬病mrna-1902p-lpps脂质多聚物疫苗。
[0078]
二、狂犬病mrna疫苗的体内效力评价
[0079]
将实验动物balb/c小鼠(雌,6-8周,16-18g,北京斯贝福)随机分为mrna-1902p免疫组(免疫剂量为mrna-1902p=30μg/只)和、阴性对照组(pbs,ph=7.4)(每组6只,正常喂养)和市售人用狂犬疫苗(辽宁达成,1/6剂量免疫小鼠)对照组,以肌肉注射方式免疫小鼠。免疫两次,每次免疫间隔14天。每次免疫后的第10天采用眼眶取血获得足够量的小鼠血清。通过who公认的favn法检测免疫小鼠血清的狂犬病病毒中和抗体效价,对狂犬病mrna疫苗的体内免疫效力进行评价。
[0080]
依据标准《动物狂犬病病毒中和抗体检测技术》gb/t 34739-2017,对小鼠血清进行狂犬病病毒中和抗体检测。小鼠血清样品56℃灭活30min后开展favn实验:
[0081]
培养板中每孔加入100μl培养基,用50μl多道移液器对待检血清样品和标准血清对照进行连续的3倍稀释,每个待检样品稀释度设2孔,标准血清对照每个稀释度设4孔。弃掉最后一行孔中吸出的50μl液体。
[0082]
培养板中每孔加入150μl培养基,用50μl多道移液器对病毒进行4倍系列稀释,每个稀释度2孔。弃掉最后一行孔中吸出的50μl液体。
[0083]
同时培养板中空白区域设置细胞对照、培养基对照,培养基对照区每孔加入200μl培养基,细胞对照区每孔加入150μl培养基。
[0084]
待检血清样品孔、血清对照孔内全部各孔加入病毒50μl,病毒株采用狂犬病标准攻击毒株cvs-11,该病毒可经bhk-21乳仓鼠肾传代细胞系增殖培养,滴度不低于105tcid50/ml。置37℃温箱中,中和培育60min。
[0085]
将bhk-21细胞悬液密度调整为4.0
×
105个/ml。除培养基对照孔外,每孔加入50μl细胞悬液。培养板置37℃、5%二氧化碳培养箱中培养48h。
[0086]
培养板中液体弃与0.1%氢氧化钠溶液中。将培养板直接浸入第一个固定液容器内,片刻后取出,将孔中液体弃回固定液中。将培养板浸入第二个固定液容器中,20min后将孔中液体弃回至固定液中,自热干燥或用吸水纸吸干。
[0087]
用0.01m的pbs(ph7.4)稀释fitc标记的狂犬病病毒核蛋白荧光抗体(milipore5500)至工作浓度后加到检测细胞板中,50μl/孔,37℃温育60min。弃标记抗体于0.1%氢氧化的溶液中,用0.01m pbs洗2次,倒置于吸水纸上干燥。
[0088]
荧光显微观察染色情况,观察每孔所有视野,以“ ”表示1个以上的荧光细胞,表示未被中和的病毒。无荧光颗粒标记的细胞孔为
“‑”
。将观察的检测结果参数代入如下公式计算待检血清的中和抗体效价(e),单位为iu/ml:e=0.5
×
(at/ac)
×3(bt-bc)/4
。公式中at为待检血清整列孔均无荧光染色的血清最大稀释倍数;ac为阳性标准品整列均无荧光染色的血清最大稀释倍数;bt为待检血清在at稀释度后出现的无荧光染色的孔数;bc为标准品在ac稀释度后出现的无荧光染色的孔数。
[0089]
结果如图4显示:狂犬病mrna-1902p疫苗免疫两次后小鼠血清的狂犬病病毒中和抗体效价在30.77-121.5iu/ml,优于市售人用狂犬疫苗(辽宁达成,1/6剂量免疫小鼠),其中和抗体效价在0.38-10.26iu/ml。且mrna-1902p的中和抗体效价是who公认的有效保护性抗体阈值(0.5iu/ml)的61.54-243倍。
[0090]
三、狂犬病mrna疫苗的免疫保护作用考察
[0091]
对初免后43天的小鼠进行狂犬病毒攻毒实验。小鼠脑内注射25μl,病毒滴度50ld
50
的狂犬病毒株bd06。攻毒前后记录小鼠体重,观察生命状态。
[0092]
结果如图5显示:攻毒后,狂犬病mrna-1902p疫苗免疫小鼠基本维持攻毒前体重,阴性对照组小鼠体重在攻毒后第四天开始出现明显下降趋势。说明狂犬病mrna疫苗mrna-1902p具有良好的免疫保护作用。
[0093]
结果如图6显示:攻毒后,狂犬病mrna-1902p疫苗免疫的小鼠全部存活,相反阴性对照组小鼠分别在攻毒后第6、7、8天分别死亡3、2、1只小鼠。进一步证明狂犬病mrna疫苗mrna-1902p具有良好的免疫保护作用。
[0094]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,
可以进行一些基本特征的应用。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。