1.本发明涉及有机合成技术领域,尤其涉及一种含氧化合物脱氧甲基化方法。
背景技术:
2.羧酸及其衍生物的催化还原是有机化学中必不可少的转化过程。这些反应主要是通过使用贵重过渡金属配合物如ir和ru来实现的。此外,羧酸及其衍生物通常可以部分还原为醛、醇或醚。
3.另一方面,它们完全还原为甲基化化合物是非常少见的,仍然具有挑战性。传统的羧酸及其衍生物完全还原为甲基是在回流条件下使用过量的lialh4实现的,或通过逐步转化,包括还原、卤化和还原。文献报道中也有报道用硅烷作为还原剂对羧酸衍生物的脱氧甲基化例子很少,且底物范围很受限。由于羧基通过(双齿)羧酸盐与金属中心的过配位使催化剂失活,或破坏活性金属氢化物,导致羧酸的均相过渡金属催化反应更具挑战性。
技术实现要素:
4.本发明所要解决的技术问题是提供一种操作简单、成本低的含氧化合物脱氧甲基化方法。
5.为解决上述问题,本发明所述的一种含氧化合物脱氧甲基化方法,其特征在于:该方法是指将含氧化合物、钛金属催化剂、碱类化合物、硼烷类化合物和有机溶剂混合,在保护气氛中于加热条件下发生含氧化合物脱氧甲基化反应,即得芳甲基类化合物。
6.所述含氧化合物、钛金属催化剂、碱类化合物和硼烷类化合物的摩尔比为1:0~0.1:1:4~10。
7.所述含氧化合物具有如下所示结构:或其中,r1为芳基或芳香性杂环;r2为独立的芳基、烷基、烷氧基、羟基或氢中的一种。
8.所述r1为取代芳基,该取代芳基中的取代基为甲基、乙基、叔丁基、环己基、苯基、甲硫基、甲氧基、苯氧基、苄氧基、二甲胺基、氟、氯、2-噻吩基或吗啉基中的一种。
9.所述钛金属催化剂为三氯一茂钛、双(三氟甲磺酸)二茂钛或双(环戊二烯)二氯化钛中的一种。
10.所述碱类化合物为甲醇锂或叔丁醇锂。
11.所述硼烷类化合物为硼烷氨络合物。
12.所述有机溶剂为四氢呋喃、乙腈、环己烷、甲基叔丁基醚或1,4-二氧六环中的一种。
13.所述脱氧甲基化反应的条件是指温度为120~140℃,时间为36~48h。
14.所述保护气氛为氮气气氛或氩气气氛。
15.本发明与现有技术相比具有以下优点:
1、本发明使用相对廉价且自然界存在广泛的金属,降低了反应成本。
16.2、本发明操作简单,具有良好的官能团耐受性和广泛的底物范围。其中:酯、醛、醇类化合物合成芳甲基化合物可以得到中等至较高产率,利于产物分离纯化。虽然羧酸类化合物由于羧基通过(双齿)羧酸盐与金属中心的过配位使催化剂失活,或破坏活性金属氢化物,其还原难度较大,只能得到中等或者较低产率,但反应产物的选择性高,产物单一,利于产物分离纯化。
具体实施方式
17.一种含氧化合物脱氧甲基化方法,该方法是指将含氧化合物、钛金属催化剂、碱类化合物、硼烷类化合物和有机溶剂混合,含氧化合物、钛金属催化剂、碱类化合物和硼烷类化合物的摩尔比为1:0~0.1:1:4~10,优选1:0.1:1:4~10。在保护气氛为氮气气氛或氩气气氛中,于120~140℃发生含氧化合物脱氧甲基化反应,反应时间为36~48h,即得芳甲基类化合物。
18.该反应方程式为:r
2 = 烷氧基、羟基或氢 r
2 = 芳基或烷基其中:含氧化合物具有如下所示结构:或式中,r1为芳基或芳香性杂环;r2为独立的芳基、烷基、烷氧基、羟基或氢中的一种。r1优选为取代芳基,该取代芳基中的取代基为甲基、乙基、叔丁基、环己基、苯基、甲硫基、甲氧基、苯氧基、苄氧基、二甲胺基、氟、氯、2-噻吩基或吗啉基中的一种。
19.钛金属催化剂为三氯一茂钛、双(三氟甲磺酸)二茂钛或双(环戊二烯)二氯化钛中的一种,优选双(环戊二烯)二氯化钛。
20.碱类化合物为甲醇锂或叔丁醇锂,优选甲醇锂。
21.硼烷类化合物为硼烷氨络合物。
22.有机溶剂为四氢呋喃、乙腈、环己烷、甲基叔丁基醚或1,4-二氧六环。
23.含氧化合物的摩尔量与有机溶剂的体积比优选为0.2mmol:1 ml。
24.保护气氛的压强优选为1atm。
25.在本发明的具体实施例中,含氧化合物为苯甲酸甲酯、苯甲酸乙酯、苯甲酸苄酯、苯甲酸叔丁酯、苯甲酸苯酯、4-甲基苯甲酸甲酯、4-乙基苯甲酸甲酯、4-叔丁基苯甲酸甲酯、
4-环己基苯甲酸甲酯、4-苯基苯甲酸甲酯、4-甲硫基苯甲酸甲酯、4-苯氧基苯甲酸甲酯、4-二甲胺基苯甲酸甲酯、4-氯苯甲酸甲酯、4-(4-吗啉基)苯甲酸甲酯、4-(2-噻吩基)苯甲酸甲酯、3-苯基苯甲酸甲酯、2-苯基苯甲酸甲酯、2-氟-4-甲基苯甲酸甲酯、2-萘甲酸甲酯、2-萘甲酸乙酯、2-萘甲酸苄酯、2-萘甲酸叔丁酯、6-甲氧基-2-萘甲酸甲酯、6-氟-2-萘甲酸甲酯、1-萘甲酸甲酯、1-萘甲酸乙酯、苯并呋喃-2-羧酸甲酯、苯并噻吩-2-羧酸甲酯、5-苯基噻吩-2-羧酸甲酯、n-甲基吲哚-3-甲酸甲酯、2,3,3-三苯基丙烯酸甲酯、4-(1,2,2-三苯基乙烯基)苯甲酸甲酯、6-[3-(1-金刚烷)-4-甲氧基苯基]-2-萘甲酸甲酯、联苯双酯、4-(n,二丙基氨磺酰)苯甲酸甲酯、(8r,9s,13s,14s)-13-甲基-6,7,8,9,11,12,13,14,15,16-十氢螺环[a]菲-17,2'-[1,3]二氧戊环]-3-羧酸甲酯、苄醇、4-甲基苄醇、4-乙基苄醇、4-叔丁基苄醇、4-环己基苄醇、4-苯基苄醇、4-甲氧基苄醇、4-硫甲基苄醇、4-苯氧基苄醇、4-氟苄醇、4-氯苄醇、5-羟甲基苯并-1,3-二恶环戊烷、4-(4-吗啉基)苯甲醇、1-苯乙醇、二苯甲醇、三苯甲醇、2-萘甲醇、1-萘甲醇、6-甲氧基-2-萘甲醇、1-甲基吲哚-3-甲醇、1-(3,5,5,6,8,8-六甲基-5,6,7,8-四氢萘-2-基)乙烷-1-醇、苯甲醛、4-甲基苯甲醛、4-叔丁基苯甲醛、4-苯基苯甲醛、4-甲硫基苯甲醛、4-苯氧基苯甲醛、4-苄氧基苯甲醛、4-甲氧基苯甲醛、4-二甲氨基苯甲醛、4-氟苯甲醛、4-氯苯甲醛、2-苯基苯甲醛、3-苯基苯甲醛、3,4-二甲氧基苯甲醛、3-氯-5-甲氧基苯甲醛、7-甲氧基苯并[d][1,3]二氧杂环戊烷-5-甲醛、2-萘甲醛、1-萘甲醛、6-甲氧基-2-萘甲醛、2-噻吩甲醛、苯并[b]呋喃-2-甲醛、1-甲基吲哚-3-甲醛、苯乙酮、占吨酮、苯甲酸酐、3-苯基苯酞、n-boc-1,2,3,4-四氢喹啉、苯甲酸、4-苯基苯甲酸、4-环己基苯甲酸、4-苯氧基苯甲酸、4-(4-吗啉基)苯甲酸、2-苯基苯甲酸、3-苯基苯甲酸、4'-甲基联苯-2-羧酸、4'-三氟甲基联苯-4-甲酸、4-(戊氧基)-4'-联苯羧酸、6-甲氧基2-萘甲酸、中氮茚-7-羧酸、5-苯并噻吩-2-甲酸、二茂铁甲酸、丙磺舒、4-(1,2,2-三苯基乙烯基)苯甲酸、4-二苯基膦苯甲酸、芴-1-羧酸、1-芘甲酸。
[0026]
含氧化合物脱氧甲基化反应优选在搅拌的条件下进行,本发明对所述搅拌的条件没有任何特殊的限定,采用本领域技术人员熟知的过程进行即可。
[0027]
所述甲基化反应完成后,本发明还优选包括分离,本发明对所述分离没有任何特殊的限定,采用本领域技术人员熟知的过程柱层析和减压旋干进行即可。在本发明的实施例中,实施例1~10、15、18、20、21、26~31、33~36、45~47、50、51、53、54、57、58、60、61、65、67、69、72~75、78、79、81、82、84~87、79、82中未进行分离,直接得到芳甲基类化合物的产物体系,并通过气相检测或核磁分析所述产物体系中芳甲基类类化合物的产率。若需要对所述产物体系进行分离提纯,则参考上述分离方法进行即可。
[0028]
在本发明中,若无特殊说明,所有原料均为本领域技术人员熟知的市售产品。
[0029]
实施例1将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、苯甲酸甲酯(记为 1a,0.2mmol,27.2mg)和甲基叔丁基醚(记为 mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2a所示结构化合物(甲苯)的产物体系。gc-ms检测产率为97%。
[0030]
上述制备过程的化学反应式为:
实施例2将三氯一茂钛(记为cpticl3,0.02mmol,4.4mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、苯甲酸甲酯(记为 1a,0.2mmol,27.2mg)和甲基叔丁基醚(记为 mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2a所示结构化合物(甲苯)的产物体系。gc-ms检测产率为94%。
[0031]
上述制备过程的化学反应式为:实施例3将双(三氟甲磺酸)二茂钛(记为cp2ti(otf)2,0.02mmol,9.6mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、苯甲酸甲酯(记为 1a,0.2mmol,27.2mg)和甲基叔丁基醚(记为 mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2a所示结构化合物的(甲苯)产物体系。gc-ms检测产率为77%。
[0032]
上述制备过程的化学反应式为:实施例4将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、叔丁醇锂(记为
t
buoli,0.2 mmol,16.0mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、苯甲酸甲酯(记为 1a,0.2mmol,27.2mg)和甲基叔丁基醚(记为 mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2a所示结构化合物(甲苯)的产物体系。gc-ms检测产率为79%。
[0033]
上述制备过程的化学反应式为:实施例5将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、苯甲酸甲酯(记为 1a,0.2mmol,27.2mg)和四氢呋喃(记为thf,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,
得到含有式2a所示结构化合物(甲苯)的产物体系。gc-ms检测产率为68%。
[0034]
上述制备过程的化学反应式为:实施例6将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、苯甲酸甲酯(记为 1a,0.2mmol,27.2mg)和乙腈(记为ch3cn,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2a所示结构化合物(甲苯)的产物体系。gc-ms检测产率为79%。
[0035]
上述制备过程的化学反应式为:实施例7将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、苯甲酸甲酯(记为 1a,0.2mmol,27.2mg)和环己烷(记为cyclohexane,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2a所示结构化合物(甲苯)的产物体系。gc-ms检测产率为68%。
[0036]
上述制备过程的化学反应式为:实施例8将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、苯甲酸甲酯(记为 1a,0.2mmol,27.2mg)和1,4-二氧六环(记为1,4-dioxane,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2a所示结构化合物(甲苯)的产物体系。gc-ms检测产率为43%。
[0037]
上述制备过程的化学反应式为:实施例9将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,
0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.2 mmol,36.0mg)、苯甲酸乙酯(记为 1b,0.2mmol,30.0mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2a所示结构化合物(甲苯)的产物体系。gc-ms检测产率为90%。
[0038]
上述制备过程的化学反应式为:实施例10将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、苯甲酸苄酯(记为 1c,0.2mmol,42.4mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2a所示结构化合物(甲苯)的产物体系。gc-ms检测产率为83%。
[0039]
上述制备过程的化学反应式为:实施例11将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.2 mmol,36.0mg)、苯甲酸叔丁酯(记为 1d,0.2mmol,60.2mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2a所示结构化合物(甲苯)的产物体系。gc-ms检测产率为78%。上述制备过程的化学反应式为:实施例12将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、苯甲酸苯酯(记为 1e,0.2mmol,39.6mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2a所示结构化合物(甲苯)的产物体系。gc-ms检测产率为83%。
[0040]
上述制备过程的化学反应式为:
实施例13将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、4-甲基苯甲酸甲酯(记为 1f,0.2mmol,30.0mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2f所示结构化合物(对二甲苯)的产物体系。gc-ms检测产率为83%。
[0041]
上述制备过程的化学反应式为:实施例14将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、4-乙基苯甲酸甲酯(记为 1g,0.2mmol,32.8mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2g所示结构化合物(对甲乙苯)的产物体系。核磁分析产率为97%。
[0042]
上述制备过程的化学反应式为:实施例15将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、4-叔丁基苯甲酸甲酯(记为 1h,0.2mmol,38.4mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2h所示结构化合物(4-叔丁基甲苯)的产物体系。核磁分析产率为87%。
[0043]
上述制备过程的化学反应式为:实施例16将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、4-环己基苯甲酸甲酯(记为 1i,0.2mmol,43.6mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗
脱剂进行洗脱后,将溶剂减压旋干,得到含有式2i所示结构化合物(白色固体,4-环己基甲苯)。分离产率为69%。
[0044]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.10 (s, 4h), 2.51
ꢀ–ꢀ
2.39 (m, 1h), 2.31 (s, 3h), 1.84 (tq, j = 11.0, 3.9 hz, 4h), 1.77
ꢀ–ꢀ
1.69 (m, 1h), 1.47
ꢀ–ꢀ
1.31 (m, 4h), 1.31
ꢀ–ꢀ
1.16 (m, 1h). 13
c nmr (101 mhz, chloroform-d) δ 145.3, 135.3, 129.1, 126.8, 44.3, 34.7, 27.1, 26.3, 21.1。
[0045]
实施例17将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、4-苯基苯甲酸甲酯(记为 1j,0.2mmol,42.4mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式2j所示结构化合物(白色固体4-甲基联苯)。分离产率为76%。
[0046]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.62
ꢀ–ꢀ
7.53 (m, 2h), 7.52
ꢀ–ꢀ
7.45 (m, 2h), 7.41 (dd, j = 8.5, 6.9 hz, 2h), 7.35
ꢀ–ꢀ
7.27 (m, 1h), 7.23 (d, j = 7.9 hz, 2h), 2.38 (s, 3h). 13
c nmr (101 mhz, chloroform-d) δ 141.3, 138.5, 137.1, 129.6, 128.9, 127.1, 127.1, 127.1, 21.2。
[0047]
实施例18将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、4-甲硫基苯甲酸甲酯(记为 1k,0.2mmol,36.4mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2k所示结构化合物(1-甲基-4-甲硫基苯)的产物体系。核磁分析产率为84%。
[0048]
上述制备过程的化学反应式为:
实施例19将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、4-苯氧苯甲酸甲酯(记为 1l,0.2mmol,45.6mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式2l所示结构化合物(白色固体,4-甲基二苯基醚)。分离产率为63%。
[0049]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.30 (t, j = 7.9 hz, 2h), 7.13 (d, j = 8.3 hz, 2h), 7.06 (t, j = 7.4 hz, 1h), 6.97 (d, j = 8.1 hz, 2h), 6.91 (d, j = 8.4 hz, 2h), 2.33 (s, 3h). 13
c nmr (101 mhz, chloroform-d) δ 158.0, 154.8, 133.0, 130.4, 129.8, 123.0, 119.3, 118.5, 20.8。
[0050]
实施例20将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、4-二甲氨基苯甲酸甲酯(记为 1m,0.2mmol,35.8mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2m所示结构化合物(n,n-二甲基对甲苯胺)的产物体系。核磁分析产率为84%。
[0051]
上述制备过程的化学反应式为:;实施例21将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.2 mmol,36.0mg)、4-氯苯甲酸甲酯(记为 1n,0.2mmol,34.0mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2n所示结构化合物(4-氯甲苯)的产物体系。核磁分析产率为43%。
[0052]
上述制备过程的化学反应式为:实施例22
将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、4-(4-吗啉基)苯甲酸甲酯(记为 1o,0.2mmol,44.2mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚:乙酸乙酯(体积比5:1)作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式2o所示结构化合物(白色固体,4-(对甲苯基)吗啉)。分离产率为62%。
[0053]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.08 (d, j = 8.4 hz, 2h), 6.83 (d, j = 8.5 hz, 2h), 3.93
ꢀ–ꢀ
3.74 (m, 4h), 3.16
ꢀ–ꢀ
3.01 (m, 4h), 2.27 (s, 3h). 13
c nmr (101 mhz, chloroform-d) δ 149.3, 129.8, 129.7, 116.1, 67.1, 50.0, 20.5。
[0054]
实施例23将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、4-(2-噻吩基)苯甲酸甲酯(记为 1p,0.2mmol,43.6mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式2p所示结构化合物(白色固体4-(2-噻吩基)甲苯)。分离产率为80%。
[0055]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.55
ꢀ–ꢀ
7.43 (m, 2h), 7.24 (dd, j = 3.6, 1.2 hz, 1h), 7.21 (dd, j = 5.1, 1.2 hz, 1h), 7.16 (d, j = 7.9 hz, 2h), 7.04 (dd, j = 5.1, 3.6 hz, 1h), 2.34 (s, 3h). 13
c nmr (101 mhz, chloroform-d) δ 144.7, 137.4, 131.8, 129.7, 128.0, 126.0, 124.4, 122.7, 21.3。
[0056]
实施例24将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、3-苯基苯甲酸甲酯(记为 1q,0.2mmol,42.4mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式2q所示结构化合物(无色液体3-甲基联苯)。分
离产率为67%。
[0057]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.62
ꢀ–ꢀ
7.52 (m, 2h), 7.45
ꢀ–ꢀ
7.36 (m, 4h), 7.32 (tt, j = 7.0, 1.4 hz, 2h), 7.15 (d, j = 7.5 hz, 1h), 2.41 (s, 3h). 13
c nmr (101 mhz, chloroform-d) δ 141.5, 141.4, 138.5, 128.8, 128.8, 128.1, 128.1, 127.3, 127.3, 124.4, 21.7。
[0058]
实施例25将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、2-苯基苯甲酸甲酯(记为 1r,0.2mmol,42.4mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式2r所示结构化合物(无色液体,2-甲基联苯)。分离产率为92%。
[0059]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.39 (ddd, j = 9.2, 6.2, 1.0 hz, 2h), 7.32 (tt, j = 6.5, 1.3 hz, 3h), 7.28
ꢀ–ꢀ
7.20 (m, 4h), 2.26 (s, 3h). 13
c nmr (101 mhz, chloroform-d) δ 142.1, 142.1, 135.5, 130.4, 129.9, 129.3, 128.2, 127.4, 126.9, 125.9, 20.6。
[0060]
实施例26将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、2-氟-4-甲基苯甲酸甲酯(记为 1s,0.2mmol,33.6mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2s所示结构化合物(2-氟-1,4-二甲苯)的产物体系。核磁分析产率为56%。
[0061]
上述制备过程的化学反应式为:
实施例27将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、2-萘甲酸甲酯(记为 1t,0.2mmol,37.2mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2t所示结构化合物(2-甲基萘)的产物体系。核磁分析产率为68%。
[0062]
上述制备过程的化学反应式为:实施例28将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、2-萘甲酸乙酯(记为 1u,0.2mmol,40.0mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2t所示结构化合物(2-甲基萘)的产物体系。核磁分析产率为69%。
[0063]
上述制备过程的化学反应式为:实施例29将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、2-萘甲酸苄酯(记为 1v,0.2mmol,52.4mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2t所示结构化合物(2-甲基萘)的产物体系。核磁分析产率为53%。
[0064]
上述制备过程的化学反应式为:实施例30将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、2-萘甲酸叔丁酯(记为 1w,0.2mmol,45.6mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2t所示结构化合物(2-甲基萘)的产物体系。核磁分析产率为59%。
[0065]
上述制备过程的化学反应式为:
= 11.0, 9.4 hz).实施例33将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、1-萘甲酸甲酯(记为 1z,0.2mmol,37.2mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2z所示结构化合物(1-甲基萘)的产物体系。核磁分析产率为86%。
[0069]
上述制备过程的化学反应式为:实施例34将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、1-萘甲酸乙酯(记为 1aa,0.2mmol,40.0mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2z所示结构化合物(1-甲基萘)的产物体系。核磁分析产率为66%。
[0070]
上述制备过程的化学反应式为:实施例35将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、苯并呋喃-2-羧酸甲酯(记为 1ab,0.2mmol,35.2mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2ab所示结构化合物(2-甲基苯并呋喃)的产物体系。核磁分析产率为55%。
[0071]
上述制备过程的化学反应式为:实施例36将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、苯并噻吩-2-羧酸甲酯(记为 1ac,0.2mmol,38.4mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2ac所示结构化合物(2-甲基苯并噻吩)的产物体系。核磁分析
产率为81%。
[0072]
上述制备过程的化学反应式为:实施例37将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、5-苯基噻吩-2-羧酸甲酯(记为 1ad,0.2mmol,43.6mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式2ad所示结构化合物(白色固体,2-甲基-5-苯基噻吩)。分离产率为91%。
[0073]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.58
ꢀ–ꢀ
7.49 (m, 2h), 7.33 (t, j = 7.8 hz, 2h), 7.22 (td, j = 7.2, 1.5 hz, 1h), 7.09 (d, j = 3.5 hz, 1h), 6.71 (dd, j = 3.5, 1.4 hz, 1h), 2.49 (s, 3h). 13
c nmr (101 mhz, chloroform-d) δ 142.1, 139.6, 134.9, 128.9, 127.1, 126.3, 125.6, 123.0, 15.6。
[0074]
实施例38将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、n-甲基吲哚-3-甲酸甲酯(记为 1ae,0.2mmol,37.8mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式2ae所示结构化合物(无色液体,1,3-二甲基吲哚)。分离产率为78%。
[0075]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.56 (d, j = 7.9 hz, 1h), 7.21 (dq, j = 15.8, 8.1 hz, 2h), 7.09 (t, j = 7.7 hz, 1h), 6.77 (s, 1h), 3.68 (s, 3h), 2.31 (s, 3h). 13
c nmr (101 mhz, chloroform-d) δ 137.1, 128.8, 126.6, 121.5, 119.0, 118.6, 110.2, 109.1, 32.5, 9.6。
ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式2ah所示结构化合物(白色固体,1-(2-甲氧基-5-(6-甲基萘-2-基)苯基)金刚烷)。分离产率为67%。
[0081]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.93 (s, 1h), 7.78 (d, j = 7.4 hz, 2h), 7.68 (dd, j = 8.5, 1.6 hz, 1h), 7.64
ꢀ–ꢀ
7.56 (m, 2h), 7.51 (dd, j = 8.4, 2.2 hz, 1h), 7.34
ꢀ–ꢀ
7.28 (m, 1h), 6.96 (d, j = 8.4 hz, 1h), 3.87 (s, 3h), 2.51 (s, 3h), 2.18 (d, j = 2.0 hz, 6h), 2.09 (s, 3h), 1.79 (s, 6h). 13
c nmr(101 mhz, chloroform-d) δ 158.5, 138.9, 138.2, 135.3, 133.4, 132.6, 132.1, 128.6, 128.0, 127.7, 126.7, 126.0, 125.8, 125.6, 124.9, 112.2, 55.3, 40.7, 37.3, 29.3, 21.9。
[0082]
实施例42将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
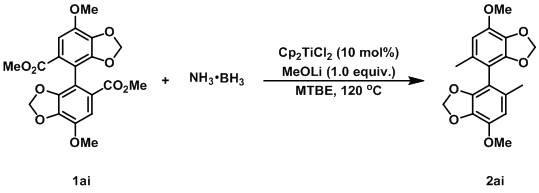
bh3,2.0 mmol,60.0mg)、联苯双酯(记为 1ai,0.2mmol,83.6mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚:乙酸乙酯(体积比40:1)作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式2ai所示结构化合物(白色固体,7,7
’‑
二甲氧基-5,5
’‑
二甲基-4,4
’‑
联苯并[d][1,3]二恶英)。分离产率为27%。
[0083]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 6.48 (s, 2h), 5.93 (dd, j = 9.4, 1.3 hz, 4h), 3.92 (s, 6h), 2.07 (s, 6h). 13
c nmr (101 mhz, chloroform-d) δ 147.0, 143.1, 132.9, 131.6, 110.1, 108.8, 101.5, 56.6, 19.5。
[0084]
实施例43将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、4-(n,二丙基氨磺酰)苯甲酸甲酯(记为 1aj,0.2mmol,59.8mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气
(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚:乙酸乙酯(体积比10:1)作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式2aj所示结构化合物(白色固体,地拖胺)的产物体系。分离产率为41%。
[0085]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.73
ꢀ–ꢀ
7.63 (m, 2h), 7.28 (d, j = 8.1 hz, 2h), 3.18
ꢀ–ꢀ
2.91 (m, 4h), 2.42 (s, 3h), 1.55 (dq, j = 14.9, 7.4 hz, 4h), 0.87 (t, j = 7.4 hz, 6h). 13
c nmr (101 mhz, chloroform-d) δ 143.0, 137.3, 129.7, 127.2, 50.2, 22.2, 21.6, 11.3。
[0086]
实施例44将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、(8r,9s,13s,14s)-13-甲基-6,7,8,9,11,12,13,14,15,16-十氢螺环[a]菲-17,2'-[1,3]二氧戊环]-3-羧酸甲酯(记为 1ak,0.2mmol,71.2mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式2ak所示结构化合物(白色固体(8r,9s,13s,14s)-3,13-二甲基-6,7,8,9,11,12,13,14,15,16-十氢螺环[环戊基]菲-17,2'-[1,3]二氧戊环])。分离产率为83%。
[0087]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.10 (d, j = 8.0 hz, 1h), 6.86 (d, j = 8.0 hz, 1h), 6.81 (s, 1h), 3.89
ꢀ–ꢀ
3.76 (m, 4h), 2.75 (dt, j = 7.5, 4.4 hz, 2h), 2.29
ꢀ–ꢀ
2.12 (m, 5h), 1.94 (ddd, j = 13.5, 10.3, 2.4 hz, 1h), 1.85
ꢀ–ꢀ
1.63 (m, 4h), 1.61
ꢀ–ꢀ
1.51 (m, 1h), 1.49
ꢀ–ꢀ
1.36 (m, 2h), 1.35
ꢀ–ꢀ
1.17 (m, 3h), 0.80 (s, 3h). 13
c nmr (101 mhz, chloroform-d) δ 137.5, 136.7, 135.1, 129.8, 126.5, 125.7, 119.5, 65.3, 64.7, 49.6, 46.3, 44.0, 39.1, 34.3, 30.9, 29.6, 27.1, 26.1, 22.5, 20.9, 14.4。
[0088]
实施例45将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,
0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,0.8 mmol,24.0mg)、苄醇(记为 3a,0.2mmol,21.6mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2a所示结构化合物(甲苯)的产物体系。gc-ms检测产率为97%。
[0089]
上述制备过程的化学反应式为:实施例46将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,0.8 mmol,24.0mg)、4-甲基苄醇(记为 3b,0.2mmol,24.4mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2f所示结构化合物(对二甲苯)的产物体系。gc-ms检测产率为91%。
[0090]
上述制备过程的化学反应式为:实施例46将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,0.8 mmol,24.0mg)、4-乙基苄醇(记为 3c,0.2mmol,27.2mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2g所示结构化合物(对甲乙苯)的产物体系。核磁分析产率为92%。
[0091]
上述制备过程的化学反应式为:实施例47将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,0.8 mmol,24.0mg)、4-叔丁基苄醇(记为 3d,0.2mmol,32.8mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2h所示结构化合物(4-叔丁基甲苯)的产物体系。核磁分析产率为74%。
[0092]
上述制备过程的化学反应式为:
实施例48将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,0.8 mmol,24.0mg)、4-环己基苄醇(记为 3e,0.2mmol,38.0mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式2i所示结构化合物(无色液体,4-环己基甲苯)。分离产率为57%。
[0093]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.10 (s, 4h), 2.51
ꢀ–ꢀ
2.39 (m, 1h), 2.31 (s, 3h), 1.84 (tq, j = 11.0, 3.9 hz, 4h), 1.77
ꢀ–ꢀ
1.69 (m, 1h), 1.47
ꢀ–ꢀ
1.31 (m, 4h), 1.31
ꢀ–ꢀ
1.16 (m, 1h). 13
c nmr (101 mhz, chloroform-d) δ 145.3, 135.3, 129.1, 126.8, 44.3, 34.7, 27.1, 26.3, 21.1。
[0094]
实施例49将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,0.8 mmol,24.0mg)、4-苯基苄醇(记为 3f,0.2mmol,36.8mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式2j所示结构化合物(白色固体,4-甲基联苯)。分离产率为51%。
[0095]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.62
ꢀ–ꢀ
7.53 (m, 2h), 7.52
ꢀ–ꢀ
7.45 (m, 2h), 7.41 (dd, j = 8.5, 6.9 hz, 2h), 7.35
ꢀ–ꢀ
7.27 (m, 1h), 7.23 (d, j = 7.9 hz, 2h), 2.38 (s, 3h). 13
c nmr (101 mhz, chloroform-d) δ 141.3, 138.5, 137.1, 129.6, 128.9, 127.1, 127.1, 127.1, 21.2。
[0096]
实施例50将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,0.8 mmol,24.0mg)、4-甲氧基苄醇(记为 3g,0.2mmol,27.6mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式4g所示结构化合物(4-甲氧基甲苯)的产物体系。核磁分析产率为82%。
[0097]
上述制备过程的化学反应式为:
实施例51将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,0.8 mmol,24.0mg)、4-硫甲基苄醇(记为 3h,0.2mmol,30.8mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2k所示结构化合物(4-甲硫基甲苯)的产物体系。核磁分析产率为94%。
[0098]
上述制备过程的化学反应式为:实施例52将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,0.8 mmol,24.0mg)、4-苯氧基苄醇(记为 3i,0.2mmol,40.0mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式2l所示结构化合物(白色固体,4-甲基二苯醚)。分离产率为71%。
[0099]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.30 (t, j = 7.9 hz, 2h), 7.13 (d, j = 8.3 hz, 2h), 7.06 (t, j = 7.4 hz, 1h), 6.97 (d, j = 8.1 hz, 2h), 6.91 (d, j = 8.4 hz, 2h), 2.33 (s, 3h). 13
c nmr (101 mhz, chloroform-d) δ 158.0, 154.8, 133.0, 130.4, 129.8, 123.0, 119.3, 118.5, 20.8。
[0100]
实施例53将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,0.8 mmol,24.0mg)、4-氟苄醇(记为 3j,0.2mmol,25.2mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式4j所示结构化合物(4-氟甲苯)的产物体系。核磁分析产率为47%。
[0101]
上述制备过程的化学反应式为:
实施例54将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,0.8 mmol,24.0mg)、4-氯苄醇(记为 3k,0.2mmol,28.4mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2n所示结构化合物(4-氯甲苯)的产物体系。核磁分析产率为67%。
[0102]
上述制备过程的化学反应式为:实施例55将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,0.8 mmol,24.0mg)、5-羟甲基苯并-1,3-二恶环戊烷(记为 3l,0.2mmol,30.4mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式4l所示结构化合物(无色液体,5-甲苯并[d][1,3]二恶英)。分离产率为59%。
[0103]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 6.70 (d, j = 7.8 hz, 1h), 6.66 (s, 1h), 6.61 (d, j = 8.5 hz, 1h), 5.90 (s, 2h), 2.27 (s, 3h). 13
c nmr (101 mhz, chloroform-d) δ 147.6, 145.4, 131.6, 121.6, 109.7, 108.2, 100.8, 21.3。
[0104]
实施例56将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,0.8 mmol,24.0mg)、4-(4-吗啉基)苯甲醇(记为 3m,0.2mmol,38.6mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚:乙酸乙酯(体积比10:1)作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式2o所示结构化合物(白色固体,4-(对甲苯基)吗啉)。分离产率为92%。
[0105]
上述制备过程的化学反应式为:
表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.08 (d, j = 8.4 hz, 2h), 6.83 (d, j = 8.5 hz, 2h), 3.93
ꢀ–ꢀ
3.74 (m, 4h), 3.16
ꢀ–ꢀ
3.01 (m, 4h), 2.27 (s, 3h). 13
c nmr (101 mhz, chloroform-d) δ 149.3, 129.8, 129.7, 116.1, 67.1, 50.0, 20.5。
[0106]
实施例57将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,0.8 mmol,24.0mg)、1-苯乙醇(记为 3n,0.2mmol,24.4mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式4n所示结构化合物(乙苯)的产物体系。gc-ms检测产率为62%。
[0107]
上述制备过程的化学反应式为:实施例58将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,0.8 mmol,24.0mg)、二苯甲醇(记为 3o,0.2mmol,36.8mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式4o所示结构化合物(二苯甲烷)的产物体系。核磁分析产率为55%。
[0108]
上述制备过程的化学反应式为:实施例59将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,0.8 mmol,24.0mg)、三苯甲醇(记为 3p,0.2mmol,52.0mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式4p所示结构化合物(白色固体,三苯甲烷)。分离产率为92%。
[0109]
上述制备过程的化学反应式为:
表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.26 (t, j = 7.3 hz, 6h), 7.20 (d, j = 7.3 hz, 3h), 7.11 (d, j = 7.2 hz, 6h), 5.54 (s, 1h). 13
c nmr (101 mhz, chloroform-d) δ 144.0, 129.6, 128.4, 126.4, 57.0。
[0110]
实施例60将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,0.8 mmol,24.0mg)、2-萘甲醇(记为 3q,0.2mmol,31.6mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2t所示结构化合物(2-甲基萘)的产物体系。核磁分析产率为92%。
[0111]
上述制备过程的化学反应式为:实施例61将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,0.8 mmol,24.0mg)、1-萘甲醇(记为 3r,0.2mmol,31.6mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2z所示结构化合物(1-甲基萘)的产物体系。核磁分析产率为94%。
[0112]
上述制备过程的化学反应式为:实施例62将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,0.8 mmol,24.0mg)、6-甲氧基-2-萘甲醇(记为 3s,0.2mmol,37.6mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式2x所示结构化合物(白色固体6-甲氧基-1-甲基萘)。分离产率为68%。
[0113]
上述制备过程的化学反应式为:
表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.64 (dd, j = 8.5, 3.0 hz, 2h), 7.53 (s, 1h), 7.27 (dd, j = 8.4, 1.8 hz, 1h), 7.11 (d, j = 8.7 hz, 2h), 3.89 (s, 3h), 2.47 (s, 3h). 13
c nmr (101 mhz, chloroform-d) δ 157.1, 133.2, 132.8, 129.3, 128.9, 128.7, 126.8, 126.7, 118.8, 105.8, 55.4, 21.6。
[0114]
实施例63将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,0.8 mmol,24.0mg)、1-甲基吲哚-3甲醇(记为 3t,0.2mmol,32.2mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式2ae所示结构化合物(无色液体,1,3-二甲基吲哚)。分离产率为67%。
[0115]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.56 (d, j = 7.9 hz, 1h), 7.21 (dq, j = 15.8, 8.1 hz, 2h), 7.09 (t, j = 7.7 hz, 1h), 6.77 (s, 1h), 3.68 (s, 3h), 2.31 (s, 3h). 13
c nmr (101 mhz, chloroform-d) δ 137.1, 128.8, 126.6, 121.5, 119.0, 118.6, 110.2, 109.1, 32.5, 9.6。
[0116]
实施例64将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,0.8 mmol,24.0mg)、1-(3,5,5,6,8,8-六甲基-5,6,7,8-四氢萘-2-基)乙烷-1-醇(记为 3u,0.2mmol,52.0mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式4u所示结构化合物(白色固体,6-乙基-1,1,2,4,4,7-六甲基-1,2,3,4-四氢萘)。分离产率为70%。
[0117]
上述制备过程的化学反应式为:
表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.11 (s, 1h), 7.08 (s, 1h), 2.58 (q, j = 7.6 hz, 2h), 2.26 (s, 3h), 1.86 (dqd, j = 13.4, 6.8, 2.5 hz, 1h), 1.63 (t, j = 13.2 hz, 1h), 1.34 (dd, j = 13.5, 2.5 hz, 1h), 1.30 (d, j = 8.3 hz, 6h), 1.25 (s, 3h), 1.22 (t, j = 7.6 hz, 3h), 1.06 (s, 3h), 0.97 (d, j = 6.8 hz, 3h). 13
c nmr (101 mhz, chloroform-d) δ 143.4, 142.3, 139.3, 133.1, 128.5, 125.7, 44.0, 37.4, 34.7, 34.2, 32.6, 32.2, 28.8, 26.0, 25.1, 19.2, 17.0, 14.4。
[0118]
实施例65将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、苯甲醛(记为 5a,0.2mmol,21.2mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2a所示结构化合物(甲苯)的产物体系。gc-ms检测产率为83%。
[0119]
上述制备过程的化学反应式为:实施例66将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、4-甲基苯甲醛(记为 5b,0.2mmol,24.0mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2f所示结构化合物(对二甲苯)的产物体系。gc-ms分析产率为90%。
[0120]
上述制备过程的化学反应式为:实施例67将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、4-叔丁基苯甲醛(记为 5c,0.2mmol,32.4mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2h所示结构化合物(4-叔丁基甲苯)的产物体系。核磁分析产率为76%。
[0121]
上述制备过程的化学反应式为:实施例68
7.13 (d, j = 8.3 hz, 2h), 7.06 (t, j = 7.4 hz, 1h), 6.97 (d, j = 8.1 hz, 2h), 6.91 (d, j = 8.4 hz, 2h), 2.33 (s, 3h)。
[0126]
实施例71将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、4-苄氧基苯甲醛(记为 5g,0.2mmol,42.4mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式6g所示结构化合物(白色固体,1-(苄氧基)-4-甲苯)。分离产率为74%。
[0127]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.44
ꢀ–ꢀ
7.25 (m, 5h), 7.07 (d, j = 8.4 hz, 2h), 6.86 (d, j = 8.5 hz, 2h), 5.01 (s, 2h), 2.27 (s, 3h). 13
c nmr (101 mhz, chloroform-d) δ 156.8, 137.4, 130.2, 130.0, 128.7, 128.0, 127.6, 114.8, 70.1, 20.6。
[0128]
实施例72将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、4-甲氧基苯甲醛(记为 5h,0.2mmol,27.2mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式4g所示结构化合物(4-甲氧基甲苯)的产物体系。核磁分析产率为82%。
[0129]
上述制备过程的化学反应式为:实施例73将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、4-二甲氨基苯甲醛(记为 5i,0.2mmol,29.8mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2m所示结构化合物(4-二甲氨基甲苯)的产物体系。核磁分析产率为94%。
[0130]
上述制备过程的化学反应式为:
实施例74将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、4-氟苯甲醛(记为 5j,0.2mmol,24.8mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式4j所示结构化合物(4-氟甲苯))的产物体系。核磁分析产率为58%。
[0131]
上述制备过程的化学反应式为:实施例75将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、4-氯苯甲醛(记为 5k,0.2mmol,28.0mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2n所示结构化合物(4-氯甲苯)的产物体系。核磁分析产率为65%。
[0132]
上述制备过程的化学反应式为:实施例76将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、2-苯基苯甲醛(记为 5l,0.2mmol,36.4mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2r所示结构化合物(无色液体,2-甲基联苯)。分离产率为83%。
[0133]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.39 (ddd, j = 9.2, 6.2, 1.0 hz, 2h), 7.32 (tt, j = 6.5, 1.3 hz, 3h), 7.28
ꢀ–ꢀ
7.20 (m, 4h), 2.26 (s, 3h). 13
c nmr (101 mhz, chloroform-d) δ 142.1, 142.1, 135.5, 130.4, 129.9, 129.3, 128.2, 127.4, 126.9, 125.9, 20.6。
[0134]
实施例77将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、3-苯基苯甲醛(记为 5m,0.2mmol,36.4mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式2q所示结构化合物(无色液体,3-苯基联苯)。分离产率为67%。
[0135]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.62
ꢀ–ꢀ
7.52 (m, 2h), 7.45
ꢀ–ꢀ
7.36 (m, 4h), 7.32 (tt, j = 7.0, 1.4 hz, 2h), 7.15 (d, j = 7.5 hz, 1h), 2.41 (s, 3h). 13
c nmr (101 mhz, chloroform-d) δ 141.5, 141.4, 138.5, 128.8, 128.8, 128.1, 128.1, 127.3, 127.3, 124.4, 21.7。
[0136]
实施例78将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、3,4-二甲氧基苯甲醛(记为 5n,0.2mmol,33.2mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式6n所示结构化合物(1,2-二甲氧基-4-甲苯)的产物体系。核磁分析产率为40%。
[0137]
上述制备过程的化学反应式为:实施例79将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、3-氯-5-甲氧基苯甲醛(记为 5o,0.2mmol,34.0mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式6o所示结构化合物(1-氯-3-甲氧基-5-甲苯)的产物体系。核磁分析产率为77%。
[0138]
上述制备过程的化学反应式为:实施例80
将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、7-甲氧基苯并[d][1,3]二氧杂环戊烷-5-甲醛(记为 5p,0.2mmol,36.0mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式6p所示结构化合物(无色液体,4-甲氧基-6-甲苯并[d][1,3]二恶英)。分离产率为54%。
[0139]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 6.34 (d, j = 11.1 hz, 2h), 5.92 (s, 2h), 3.88 (s, 3h), 2.27 (s, 3h). 13
c nmr (101 mhz, chloroform-d) δ 148.8, 143.5, 133.0, 132.4, 108.0, 103.2, 101.2, 56.6, 21.7。
[0140]
实施例81将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、2-萘甲醛(记为 5q,0.2mmol,31.2mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2t所示结构化合物(2-甲基萘)的产物体系。核磁分析产率为68%。
[0141]
上述制备过程的化学反应式为:实施例82将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、1-萘甲醛(记为 5r,0.2mmol,31.2mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2z所示结构化合物(2-甲基萘)的产物体系。核磁分析产率为87%。
[0142]
上述制备过程的化学反应式为:实施例83将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、6-甲氧基-2-萘甲醛(记为 5s,0.2mmol,37.2mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下
于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式2x所示结构化合物(白色固体,6-甲氧基-2-甲基萘)。分离产率为78%。
[0143]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.64 (dd, j = 8.5, 3.0 hz, 2h), 7.53 (s, 1h), 7.27 (dd, j = 8.4, 1.8 hz, 1h), 7.11 (d, j = 8.7 hz, 2h), 3.89 (s, 3h), 2.47 (s, 3h). 13
c nmr (101 mhz, chloroform-d) δ 157.1, 133.2, 132.8, 129.3, 128.9, 128.7, 126.8, 126.7, 118.8, 105.8, 55.4, 21.6。
[0144]
实施例84将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、2-噻吩甲醛(记为 5t,0.2mmol,22.4mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式6t所示结构化合物(2-甲基噻吩)的产物体系。核磁分析产率为44%。
[0145]
上述制备过程的化学反应式为:实施例85将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、苯并[b]呋喃-2-甲醛(记为 5u,0.2mmol,29.2mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2ab所示结构化合物(2-甲基苯并呋喃)的产物体系。核磁分析产率为50%。
[0146]
上述制备过程的化学反应式为:实施例86将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、1-甲基吲哚-3-甲醛(记为 5v,0.2mmol,31.8mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2az所示结构化合物(1,3-二甲基吲哚)的产物体系。核磁分析产率为75%。
[0147]
上述制备过程的化学反应式为:实施例87将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、苯乙酮(记为 5w,0.2mmol,24.0mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式4n所示结构化合物(乙苯)的产物体系。gc-ms检测产率为83%。
[0148]
上述制备过程的化学反应式为:实施例88将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、占吨酮(记为 5x,0.2mmol,39.2mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式6x所示结构化合物(白色固体,9h-黄嘌呤)。分离产率为47%。
[0149]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.22
ꢀ–ꢀ
7.12 (m, 4h), 7.02 (ddd, j = 14.6, 7.7, 1.3 hz, 4h), 4.04 (s, 2h). 13
c nmr (101 mhz, chloroform-d) δ 152.1, 129.1, 127.8, 123.1, 120.7, 116.6, 28.0。
[0150]
实施例89将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,2.0 mmol,60.0mg)、苯甲酸酐(记为 5y,0.2mmol,43.6mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,得到含有式2a所示结构化合物(甲苯)的产物体系。gc-ms检测产率为51%。
[0151]
上述制备过程的化学反应式为:
实施例90将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、3-苯基苯酞(记为 5z,0.2mmol,42.0mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式6z所示结构化合物(白色固体,1-苄基-2-甲苯)。分离产率为41%。
[0152]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.34
ꢀ–ꢀ
7.27 (m, 2h), 7.25
ꢀ–ꢀ
7.11 (m, 7h), 4.02 (s, 2h), 2.28 (s, 3h). 13
c nmr (101 mhz, chloroform-d) δ 140.6, 139.1, 136.8, 130.4, 130.1, 128.9, 128.5, 126.6, 126.1, 126.1, 39.6, 19.8。
[0153]
实施例91将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、n-boc-1,2,3,4-四氢喹啉(记为 5aa,0.2mmol,46.6mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式6aa所示结构化合物(白色固体,1-甲基-1,2,3,4-四氢喹啉)。分离产率为60%。
[0154]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.15
ꢀ–ꢀ
7.06 (m, 1h), 6.98 (dt, j = 7.1, 1.2 hz, 1h), 6.63 (t, j = 7.3 hz, 2h), 3.31
ꢀ–ꢀ
3.19 (m, 2h), 2.91 (s, 3h), 2.80 (t, j = 6.5 hz, 2h), 2.01 (dt, j = 11.8, 6.4 hz, 2h). 13
c nmr (101 mhz, chloroform-d) δ 146.9, 128.9, 127.2, 123.0, 116.3, 111.1, 51.4, 39.2, 27.9, 22.6。
1.47
ꢀ–ꢀ
1.31 (m, 4h), 1.31
ꢀ–ꢀ
1.16 (m, 1h). 13
c nmr (101 mhz, chloroform-d) δ 145.3, 135.3, 129.1, 126.8, 44.3, 34.7, 27.1, 26.3, 21.1。
[0160]
实施例95将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、4-苯氧基苯甲酸(记为 7d,0.2mmol,42.8mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式2l所示结构化合物(白色固体,4-甲基二苯醚)。分离产率为49%。
[0161]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.30 (t, j = 7.9 hz, 2h), 7.13 (d, j = 8.3 hz, 2h), 7.06 (t, j = 7.4 hz, 1h), 6.97 (d, j = 8.1 hz, 2h), 6.91 (d, j = 8.4 hz, 2h), 2.33 (s, 3h). 13
c nmr (101 mhz, chloroform-d) δ 158.0, 154.8, 133.0, 130.4, 129.8, 123.0, 119.3, 118.5, 20.8.实施例96将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、4-(4-吗啉基)苯甲酸(记为 7e,0.2mmol,41.4mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚:乙酸乙酯(体积比10:1)作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式2o所示结构化合物(白色固体,4-(对甲苯基)吗啉)。分离产率为51%。
[0162]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.08 (d, j = 8.4 hz, 2h), 6.83 (d, j = 8.5 hz, 2h), 3.93
ꢀ–ꢀ
3.74 (m, 4h), 3.16
ꢀ–ꢀ
3.01 (m, 4h), 2.27 (s, 3h). 13
c nmr (101 mhz, chloroform-d) δ 149.3, 129.8, 129.7, 116.1, 67.1, 50.0, 20.5.实施例97将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meona,0.2 mmol,10.8mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、2-苯基苯甲酸(记为 7f,0.2mmol,39.6mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于140℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行
洗脱后,将溶剂减压旋干,得到含有式2r所示结构化合物(无色液体,2-甲基联苯)。分离产率为51%。
[0163]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.39 (ddd, j = 9.2, 6.2, 1.0 hz, 2h), 7.32 (tt, j = 6.5, 1.3 hz, 3h), 7.28
ꢀ–ꢀ
7.20 (m, 4h), 2.26 (s, 3h). 13
c nmr (101 mhz, chloroform-d) δ 142.1, 142.1, 135.5, 130.4, 129.9, 129.3, 128.2, 127.4, 126.9, 125.9, 20.6。
[0164]
实施例98将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meona,0.2 mmol,10.8mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、3-苯基苯甲酸(记为 7g,0.2mmol,39.6mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于140℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式2q所示结构化合物(无色液体,3-甲基联苯)。分离产率为83%。
[0165]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.62
ꢀ–ꢀ
7.52 (m, 2h), 7.45
ꢀ–ꢀ
7.36 (m, 4h), 7.32 (tt, j = 7.0, 1.4 hz, 2h), 7.15 (d, j = 7.5 hz, 1h), 2.41 (s, 3h). 13
c nmr (101 mhz, chloroform-d) δ 141.5, 141.4, 138.5, 128.8, 128.8, 128.1, 128.1, 127.3, 127.3, 124.4, 21.7.实施例99将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、4'-甲基联苯-2-羧酸(记为 7h,0.2mmol,42.4mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌48h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式8h所示结构化合物(白色固体,2,4
’‑
二甲基-1,1
’‑
联苯)。分离产率为47%。
[0166]
上述制备过程的化学反应式为:
表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.27
ꢀ–ꢀ
7.19 (m, 8h), 2.40 (s, 3h), 2.27 (s, 3h). 13
c nmr (101 mhz, chloroform-d) δ 142.0, 139.2, 136.5, 135.5, 130.4, 130.0, 129.2, 128.9, 127.2, 125.9, 21.3, 20.6。
[0167]
实施例100将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meona,0.2 mmol,10.8mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、4'-三氟甲基联苯-4-甲酸、4-(戊氧基)-4'-联苯羧酸(记为 1i,0.2mmol,53.2mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于140℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式8i所示结构化合物(白色固体,4-甲基-4
’‑
(三氟甲基)-1,1
’‑
联苯)。分离产率为40%。上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.67 (s, 4h), 7.49 (d, j = 8.1 hz, 2h), 7.28 (d, j = 8.0 hz, 2h), 2.41 (s, 3h). 13
c nmr (101 mhz, chloroform-d) δ 144.8, 138.3, 137.0, 129.9, 123.2, 129.2 (d, j = 32.3 hz), 128.7 (d, j = 15.1 hz), 127.3 (d, j = 6.7 hz), 125.8 (q, j = 3.6 hz), 21.3. 19
f nmr (377 mhz, chloroform-d) δ
ꢀ‑
62.36。
[0168]
实施例101将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meona,0.2 mmol,10.8mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、4-(戊氧基)-4'-联苯羧酸(记为 7j,0.2mmol,56.8mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于140℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式8j所示结构化合物(白色固体,4-甲基-4
’‑
(戊氧基)-1,1
’‑
联苯)。分离产率为48%。
[0169]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.54
ꢀ–ꢀ
7.37 (m, 4h), 7.22 (d, j = 7.9 hz, 2h), 7.01
ꢀ–ꢀ
6.88 (m, 2h), 3.99 (t, j = 6.6 hz, 2h), 2.38 (s, 3h), 1.80 (dt, j = 14.5, 6.6 hz, 2h), 1.51
ꢀ–ꢀ
1.34 (m, 4h), 0.94 (t, j = 7.1 hz, 3h). 13
c nmr (101 mhz, chloroform-d) δ 158.7, 138.2, 136.4, 133.7, 129.6, 128.1, 126.7, 114.9, 68.2, 29.2, 28.4, 22.6, 21.2, 14.2.实施例102将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,
0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、6-甲氧基-2-萘甲酸(记为 7k,0.2mmol,40.4mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式2x所示结构化合物(白色固体,6-甲氧基-1-甲基萘)。分离产率为45%。
[0170]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.64 (dd, j = 8.5, 3.0 hz, 2h), 7.53 (s, 1h), 7.27 (dd, j = 8.4, 1.8 hz, 1h), 7.11 (d, j = 8.7 hz, 2h), 3.89 (s, 3h), 2.47 (s, 3h). 13
c nmr (101 mhz, chloroform-d) δ 157.1, 133.2, 132.8, 129.3, 128.9, 128.7, 126.8, 126.7, 118.8, 105.8, 55.4, 21.6。
[0171]
实施例103将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、中氮茚-7-羧酸(记为 7l,0.2mmol,32.2mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式8l所示结构化合物(黄色固体,7-甲基吲哚啉)。分离产率为34%。
[0172]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.81 (d, j = 7.1 hz, 1h), 7.21 (t, j = 2.0 hz, 1h), 7.11 (s, 1h), 6.73 (dd, j = 3.8, 2.6 hz, 1h), 6.33
ꢀ–ꢀ
6.23 (m, 2h), 2.26 (s, 3h). 13
c nmr (101 mhz, chloroform-d) δ 133.3, 126.9, 124.8, 117.3, 113.5, 113.1, 111.7, 97.2, 21.1.实施例104将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、5-苯并噻吩-2-甲酸(记为 7m,0.2mmol,40.8mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式2ad所示结构化合物(白色固体,2-甲基-5-苯基噻吩)。分离产率为37%。
[0173]
上述制备过程的化学反应式为:
7.4 hz, 4h), 0.87 (t, j = 7.4 hz, 6h). 13
c nmr (101 mhz, chloroform-d) δ 143.0, 137.3, 129.7, 127.2, 50.2, 22.2, 21.6, 11.3。
[0177]
实施例107将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、4-(1,2,2-三苯基乙烯基)苯甲酸(记为 7p,0.2mmol,75.2mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式2ag所示结构化合物(白色固体,1-(4-甲基苯基)-1,2,2-三苯乙烯)。分离产率为87%。
[0178]
上述制备过程的化学反应式为:表征数据为:1hnmr(400mhz,chloroform-d)δ7.12
–
7.00(m,15h),6.90(s,4h),2.24(s,3h).
13
cnmr(101mhz,chloroform-d)δ144.1,144.1,141.0,140.9,140.6,136.2,131.5,131.5,131.4,128.5,127.8,127.7,126.5,126.4,21.3。
[0179]
实施例108将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0mmol,30.0mg)、4-二苯基膦苯甲酸(记为7q,0.2mmol,61.2mg)和甲基叔丁基醚(记为mtbe,1ml)混合,在氩气(1atm)气氛下于120℃搅拌48h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式8q所示结构化合物(白色固体,二苯基(对甲苯基)膦)。分离产率为67%。
[0180]
上述制备过程的化学反应式为:表征数据为:1hnmr(400mhz,chloroform-d)δ7.35
–
7.26(m,10h),7.22(t,j=8.0hz,2h),7.15(d,j=7.5hz,2h),2.34(s,3h).
13
cnmr(101mhz,chloroform-d)δ139.0,137.8,137.7,134.2,134.0,133.9,133.7,129.5,129.5,128.7,128.6,128.5,21.4.
31
pnmr(162mhz,chloroform-d)δ-6.19。
[0181]
实施例109将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meona,0.2mmol,10.8mg)、硼烷氨络合物(记为nh3·
bh3,1.0mmol,30.0mg)、芴-1-羧酸(记为7r,0.2mmol,42.0mg)和甲基叔丁基醚(记为mtbe,1ml)混合,在氩气(1atm)气氛下于140℃搅
拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式8r所示结构化合物(白色固体1-甲基芴)。分离产率为42%。
[0182]
上述制备过程的化学反应式为:表征数据为:1h nmr (400 mhz, chloroform-d) δ 7.77 (d, j = 7.5 hz, 1h), 7.63 (d, j = 7.6 hz, 1h), 7.55 (d, j = 7.4 hz, 1h), 7.36 (t, j = 7.4 hz, 1h), 7.33
ꢀ–ꢀ
7.25 (m, 2h), 7.12 (d, j = 7.5 hz, 1h), 3.78 (s, 2h), 2.42 (s, 3h). 13
c nmr (101 mhz, chloroform-d) δ 143.2, 142.2, 142.2, 141.5, 134.4, 127.9, 127.2, 126.8, 126.7, 125.2, 120.2, 117.6, 36.0, 19.0。
[0183]
实施例110将双(环戊二烯)二氯化钛(记为cp2ticl2,0.02mmol,5.0mg)、甲醇锂(记为meoli,0.2 mmol,7.6mg)、硼烷氨络合物(记为nh3·
bh3,1.0 mmol,30.0mg)、1-芘甲酸(记为 7s,0.2mmol,49.6mg)和甲基叔丁基醚(记为mtbe,1 ml)混合,在氩气(1atm)气氛下于120℃搅拌36h,然后将反应温度降至室温用硅胶柱层析法提纯产物,采用石油醚作为洗脱剂进行洗脱后,将溶剂减压旋干,得到含有式8s所示结构化合物(白色固体,1-甲基芘)。分析产率为53%。上述制备过程的化学反应式为:表征数据为:1h nmr(400 mhz, chloroform-d) δ 8.17 (d, j = 9.2 hz, 1h), 8.11 (dd, j = 7.6, 3.1 hz, 2h), 8.03 (dd, j = 8.4, 6.5 hz, 2h), 7.96 (d, j = 2.9 hz, 2h), 7.93 (d, j = 7.6 hz, 1h), 7.80 (d, j = 7.7 hz, 1h), 2.92 (s, 3h). 13
c nmr (101 mhz, chloroform-d) δ 132.3, 131.6, 131.1, 129.9, 129.3, 128.0, 127.7, 127.2, 126.5, 125.9, 125.0, 125.0, 124.9, 124.9, 124.8, 123.8, 19.9。
[0184]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。