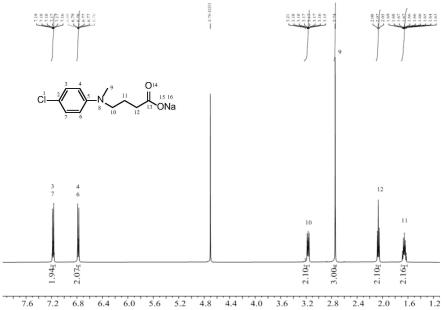
提高副干酪乳杆菌jy062胞外多糖产量的制法
技术领域
1.本发明涉及一种提高副干酪乳杆菌jy062胞外多糖产量的制法,属于微生物技术领域。
背景技术:
2.乳酸菌胞外多糖是乳酸菌在生长代谢过程中分泌到细胞壁外常渗于培养基的一类糖类化合物,是微生物适应环境的产物。近几十年来,由于微生物胞外多糖在产品结构、性能及生产方面所具有的特别优势而得到大力研究和开发,微生物胞外多糖的开发已成为工业微生物研究的热点之一。由于乳酸菌是食品级工业生产菌,与其他菌相比安全性高,所以近年来对乳酸菌胞外多糖的应用逐渐增多。乳酸菌胞外多糖可赋予发酵乳制品特殊的质构和风味,起到安全的食品添加剂的作用,它还能用于食品中以提高食品的增稠性、稳定性、乳化性、胶凝性、持水性等。胞外多糖还具有生物活性如免疫活性、抗肿瘤和抗溃疡,可应用于医药领域。
3.由于乳酸菌是食品级工业生产菌,安全性较高,副干酪乳杆菌属于乳杆菌属中的干酪乳杆菌群,广泛存在于奶酪、泡菜等发酵食品及人体胃肠道中,具有良好的耐酸及胆汁抗性,能降低血浆中胆固醇,具有促进人体肠道内病原体的清除、治疗肠道菌群紊乱从而防止食物过敏和急性腹泻、防止肿瘤产生等生理作用。
4.胞外多糖产量低,是制约胞外多糖大规模生产的主导因素。乳酸菌胞外多糖的产量易受不同因素影响,其中,近年来研究最多的影响因素有菌株种类、遗传特性以及发酵条件。乳酸菌菌种产胞外多糖的能力与菌种的遗传特性有关。胞外多糖的产量受到基因调控,外界环境的影响对乳酸菌胞外多糖的产量也起到非常重要的作用。培养基组成(碳源)与外界环境条件(发酵温度、发酵时间、ph)均能显著影响胞外多糖的生成。
技术实现要素:
5.本发明的目的是为了提供一种提高副干酪乳杆菌jy062胞外多糖产量的制法,该法可显著提高胞外多糖的产量。
6.为解决上述技术问题,本发明采用的技术方案为:本发明公开一种提高副干酪乳杆菌jy062胞外多糖产量的制法,包括以下步骤:步骤一,从基因层面和表型微生物碳源利用层面确定副干酪乳杆菌jy062(lactobacillus paracasei jy062)生成胞外多糖可利用的碳源;步骤二,胞外多糖制备工艺优化;步骤三,优化可利用的碳源。
7.所述可利用的碳源包括甘露糖、海藻糖、半乳糖、果糖、葡萄糖和乳糖。
8.所述基因层面的方法为:通过基因组分析,确定了副干酪乳杆菌jy062利用pts磷酸转移酶系统将甘露糖、海藻糖、半乳糖和果糖转运到细胞内,葡萄糖和乳糖通过渗透作用进入细胞内。
9.所述表型微生物碳源利用层面的方法为:将活化后的副干酪乳杆菌jy062菌株在平板上进行三区划线,固体培养基培养48h后,用inoculatorz棉签挑取直径3mm的菌落到接种液if3中,配成菌悬液;使用棉签少量多次蘸取菌落,将菌悬液轻轻搅拌均匀,保证菌悬液不起气泡,并用浊度仪检测,调节菌悬液的浓度至90-98%t;在biolog geniii微孔板中,每孔加入100
µ
l的菌悬液,之后将微孔板直接放入omnilog的孵育、读数仪中,37℃培养48h,分析菌株可利用的碳源。优化的胞外多糖制备工艺为:ph为6,34℃下发酵24h制备胞外多糖。
10.优化后的可利用的碳源包括:等质量添加的甘露糖、果糖、葡萄糖和半乳糖。
11.一种提高副干酪乳杆菌jy062胞外多糖产量的制法,采用初始ph为6,以甘露糖、果糖、葡萄糖和半乳糖为复合碳源的优化mrs培养基,34℃下发酵24h制备胞外多糖;胞外多糖的产量由7.70g/l提高到13.31g/l,产量提升72.85%,胞外多糖纯度由88.513μg/ml提升到93.852μg/ml。
12.同时,本发明公开一种采用提高副干酪乳杆菌jy062胞外多糖产量的制法获得的胞外多糖。
13.本发明具有以下有益效果:本发明以具有高产胞外多糖能力的副干酪乳杆菌jy062为发酵菌株,获取副干酪乳杆菌jy062的基因组信息,分析其胞外多糖的合成途径,确定副干酪乳杆菌jy062胞外多糖产生细菌所使用的合适碳源,并对其他发酵条件,发酵温度、发酵时间、发酵ph进行优化从而得到一种提高副干酪乳杆菌jy062胞外多糖产量的制法。本发明采用初始ph为6,以甘露糖、果糖、葡萄糖和半乳糖为复合碳源的优化mrs培养基,34℃下发酵24h制备胞外多糖。根据优化后的胞外多糖制备方案,经试验验证表明采用此优化的制备条件,胞外多糖的产量由7.70g/l提高到13.31g/l,产量提升了72.85%,胞外多糖纯度由88.513μg/ml提升到93.852μg/ml。
附图说明
14.图1为副干酪乳杆菌jy062碳源分析利用结果图;图2 为发酵温度优化图;图3为发酵时间优化图;图4为发酵ph优化图。
具体实施方式
15.下面结合附图对本发明作更进一步的说明。
16.本发明中,副干酪乳杆菌jy062的拉丁名为lactobacillus paracasei jy062,保藏于东北农业大学乳品重点实验室,本发明中的副干酪乳杆菌jy062的现有技术来源为:一株高产胞外多糖降血糖副干酪乳杆菌jy062(td062)的黏附性与耐受性评价[j].中国乳品工业,2022,50(4)。
[0017]
本发明以具有高产胞外多糖能力的副干酪乳杆菌jy062为发酵菌株,获取副干酪乳杆菌jy062的基因组信息,分析其胞外多糖的合成途径,确定副干酪乳杆菌jy062胞外多糖产生细菌所使用的合适碳源,并对其他发酵条件,发酵温度、发酵时间、发酵ph进行优化从而得到一种提高副干酪乳杆菌jy062胞外多糖产量的制法。
[0018]
本实施例的目的是为了提供一种提高副干酪乳杆菌jy062胞外多糖产量的制法,具体包括以下步骤:1.培养基碳源成分优化1.1副干酪乳杆菌jy062基因组测序用sds方法提取副干酪乳杆菌jy062基因组dna。使用pacbio sequel平台(10kb smrt bell)和illumina novaseq平台(350bp slice library)构建文库。 使用smrt link v5.1.0软件组装所有有效数据。通过使用kegg和cog系统来预测基因功能。分析糖的代谢途径,从基因层面确定副干酪乳杆菌jy062生成胞外多糖可利用的碳源。
[0019]
1.2副干酪乳杆菌jy062碳源利用情况将活化后的副干酪乳杆菌jy062菌株在平板上进行三区划线,固体培养基培养48h后,用inoculatorz棉签挑取直径3mm的菌落到接种液if3中,配成菌悬液。使用棉签少量多次蘸取菌落,将菌悬液轻轻搅拌均匀,保证菌悬液不起气泡,并用浊度仪检测,调节菌悬液的浓度至90-98%t。在biolog geniii微孔板中,每孔加入100
µ
l的菌悬液,之后将微孔板直接放入omnilog的孵育、读数仪中,37℃培养48h,分析菌株可利用的碳源。
[0020]
t为浊度单位,数值越小越浑浊,浊度仪检测前需检察、校准,使用标准比浊管(85%t或65%t),根据浊度仪的使用手册验证浊度仪已经校准且运行正常。使用未接种的含有接种液的干净接种管(擦去管壁污垢及指纹)调整浊度仪空白。由于每只管子在光学性能上并不完全相同,所以分别针对每只接种液来调空白,将浊度仪透光度指针调至100%t。
[0021]
副干酪乳杆菌jy062菌株的活化方法为:将菌种管顶端在火焰上加热,注意避免直接加热菌体或加热过度。用玻璃三角瓶121.0℃灭菌约20ml的生理盐水20~30分钟。将开封后的副干酪乳杆菌jy062冻干粉1~2g倒入生理盐水中,摇匀。用接种环沾取副干酪乳杆菌jy062冻干粉倒入生理盐水后形成的菌液,转接于mrs培养基平板上,在37℃中恒温培养48h,进行活化。
[0022]
接种液if3的配方如下:0.40% sodium chloride(氯化钠,nacl)(维持渗透压);0.03%pluronic f-68(聚醚f-68,e.g sigma#p7061)(一种非离子表面活性剂,可降低表面张力,使菌体易于分散在水中);0.02% gellan gum(结冷胶,e.g phytagelsigma#p8169)(一种食用胶,可增大液体粘度,使菌体均匀分散不易沉降)。制备过程如下:加0.2克gellangum至1升水中;煮沸并持续搅拌,直至gellan gum完全溶解;停止加热,继续搅拌;加4克nacl,搅拌至完全溶解;加0.3克聚醚f-68,搅拌至完全溶解;分装到20
×
150mm的试管中,每管装19ml左右;在121℃下灭菌30分钟。
[0023]
轻轻搅拌的速率为20~30r/min。
[0024]
2.胞外多糖制备工艺优化2.1发酵温度优化设定初始ph为6.5,接种2%的副干酪乳杆菌jy062,分别在28、31、34、37、40℃温度下发酵24 h,测定其胞外多糖产量,确定制备胞外多糖的最佳发酵温度。
[0025]
2.2发酵时间优化设定改良培养基的初始ph为6.5,接种2%的副干酪乳杆菌jy062,在37℃温度下分别发酵6h、12h、24h、36h和48h,测定其胞外多糖产量,确定制备胞外多糖的最佳发酵时间。
[0026]
2.3 ph优化
分别设定改良基础培养基的初始ph为5.0、5.5、6.0、6.5及7.0,接种2%的副干酪乳杆菌jy062,37℃温度下发酵24 h,测定其胞外多糖产量,确定制备胞外多糖的最佳ph。
[0027]
2.4培养基碳源优化利用基因组和biolog geniii碳源分析结果,将副干酪乳杆菌jy062可利用的6种碳源,分别组合加入到无碳源的mrs培养基中,制备优化后的mrs培养基。以胞外多糖产量为筛选条件,确定适合于副干酪乳杆菌jy062的最适培养基碳源。具体碳源组合见下表1。
[0028]
表1 培养基碳源优化方案
如表2所示,通过基因组分析发现副干酪乳杆菌jy062可以利用pts磷酸转移酶系统将甘露糖、海藻糖、半乳糖和果糖转运到细胞内,且葡萄糖和乳糖可以通过渗透作用进入胞内,因此副干酪乳杆菌jy062可以利用甘露糖、海藻糖、半乳糖、果糖、葡萄糖和乳糖产生六种糖核苷酸,即udp-葡萄糖、udp-乳糖、udp-木糖、gdp-甘露糖、gdp-海藻糖和gdp-乙酰葡糖胺。 这些糖核苷酸可以形成胞外多糖的重复单元。
[0029]
表2 副干酪乳杆菌jy 062中磷酸转移酶系统(pts)相关的基因
如图1所示,结合对副干酪乳杆菌jy062的表型微生物分析其可利用的碳源结果,发现副干酪乳杆菌jy062可以利用甘露糖、海藻糖、果糖、葡萄糖、乳糖和半乳糖。与基因分析结果一致,证明副干酪乳杆菌jy062可以利用甘露糖、海藻糖、果糖、葡萄糖、乳糖和半乳糖为碳源。
[0030]
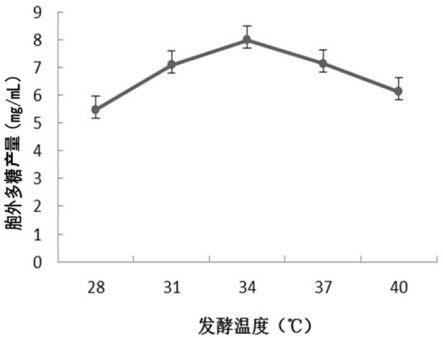
为确定制备胞外多糖的最适发酵温度,进行发酵温度优化试验。如图2所示,试验结果发现发酵温度处于28-34℃之间时,胞外多糖的产量随温度升高而增大,在34℃时达到最高点,为7.98mg/ml,随后逐渐下降,表明34℃为最优发酵温度。
[0031]
如图3所示,分别在培养6、12、24、36及48h时测定胞外多糖产量,可知其值先上升后下降,在培养时间为24h时得到峰值。由此趋势可知,发酵时间较短时,副干酪乳杆菌jy062代谢产物处于累积期;发酵12-36h时,随着时间的增长,胞外多糖产量逐渐稳定下来,且维持最大合成量;当发酵时间较长时,菌株进入衰亡期并分解部分胞外多糖,导致胞外多糖产量降低。因此确定24h为制备胞外多糖的最佳时间。
[0032]
如图4所示,当ph在5.0-5.5之间时,胞外多糖的产量较低,可能由于培养条件过酸,使生成胞外多糖过程中的中间体减少,不利于胞外多糖的产生。当ph=6.0时胞外多糖的产量最高,达到8.02mg/ml。ph继续增加时,胞外多糖的产量呈现下降趋势,原因可能是在此ph下不适合副干酪乳杆菌jy062生长繁殖,并对其代谢产物积累产生不利影响。因此,确定ph为6时为制备胞外多糖的最佳ph。
[0033]
以此结果优化mrs培养基的碳源来作为制备胞外多糖的培养基,根据基因分析结
果和表型微生物碳源利用结果,优化的mrs培养基成分对比如表3所示。
[0034]
表3 优化的mrs培养基成分对比以及胞外多糖产量表
原理:经基因组分析发现,预测副干酪乳杆菌jy062可以利用甘露糖、海藻糖、果糖、葡萄糖、乳糖和半乳糖为碳源,其中海藻糖和乳糖均为双糖,双糖属于碳水化合物的一种。双糖是一种水解后可产生两个分子单糖的糖。其既可由两个相同的,又可由两个不同的单糖分子结合而成。双糖是指单糖分子中的半缩醛的羟基和另一个单糖分子的羟基共失一分子水而生成的化合物。但是双糖必须先消化成单糖后才能被吸收与利用,所以被利用的效率低,因此选择单糖:甘露糖、果糖、葡萄糖和半乳糖为碳源,产出的胞外多糖量最多,也是培养基最佳碳源。
[0035]
综合以上结果,初步确定一种可以提高胞外多糖产量的制法:采用初始ph为6,以甘露糖、果糖、葡萄糖和半乳糖为复合碳源的优化mrs培养基, 34℃下发酵24h制备胞外多糖。如表4所示,根据优化后的胞外多糖制备方案,经试验验证表明采用此优化的制备条件,胞外多糖的产量由7.70g/l提高到13.31g/l,产量提升了72.85%,胞外多糖纯度由88.513μg/ml提升到93.852μg/ml。
[0036]
表4 优化制备条件前后胞外多糖产量及胞外多糖纯度表5显示出了优化前、普通mrs培养基的成分和优化后的mrs两种培养基的组成(g / l)。
[0037]
表5普通mrs和优化的mrs两种培养基的组成(g/l)注意:其中复合糖由果糖、甘露糖、葡萄糖和半乳糖等量添加。
[0038]
以上所述仅是本发明的优选实施方式,应当指出:对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。