一种靶向mtor的耐受性树突状细胞及其制备方法与应用
技术领域
1.本发明是关于一种耐受性树突状细胞及其制备方法与应用,具体而言,本发明是关于一种靶向mtor的耐受性树突状细胞(rapa-toldc)及其制备方法与应用,属于器官移植免疫细胞及其应用技术领域。
背景技术:
2.器官移植是终末期器官病变的最佳治疗手段,但移植排斥反应是影响受者生活质量和长期存活的主要原因。近30年免疫抑制剂的不断发展,显著改善了移植受者的短期生存获益,但远期生存率并没有明显改变。目前临床常用的免疫抑制方案也存在许多缺陷,长期免疫抑制所致的移植物慢性失功、代谢性疾病、移植物损伤、机会感染、恶性肿瘤严重威胁患者的长期存活,且需终生服用免疫抑制剂。
3.诱导免疫耐受是控制排斥反应、维持受者无免疫制长期生存的最理想治疗选择。成功建立免疫耐受不仅可以解决长时间应用免疫抑制剂带来的并发症及副作用,还可以维持移植物的长期存活,具有显著医疗经济效益。然而,目前尚缺乏可应用于临床的可操作性移植免疫耐受方案,开发安全、有效诱导器官移植免疫耐受的新型技术方案,促使受体建立对供体特异性的免疫耐受状态,使免疫耐受方案转化成功应用于人,将具有重要的研究价值、巨大的临床应用前景和社会经济效益。
4.调节性树突状细胞(tolerogenic dendritic cells,toldc)是具有负向免疫调节功能,通过抑制t细胞增殖、抑制抗原特异性t细胞活化、介导t细胞凋亡、诱导调节性t细胞等方式发挥诱导免疫耐受的作用。应用toldc免疫细胞过继回输治疗诱导免疫耐受是目前研究的热点。小剂量免疫抑制剂联合或单独回输toldc均可以改善移植肝、肾、心脏的存活;活体肝移植患者单次回输利用il-10、维生素d3联合细胞因子诱导pbmc来源toldc安全、有效,但并未解决is戒断,达到免疫耐受的结局。无论是否负载供体抗原,回输自体或同基因型toldc均可以改善移植物的存活。这些均提示,过继输注toldc有望成为解决免疫耐受的理想方案。但是,可用于临床治疗的、抑制性强大而功能稳定的toldc相关报道较少。
5.诱导产生具有供体特异性免疫抑制的toldc是目前临床研究面临的首要问题。在目前临床常用的多种免疫抑制剂中,rapa能诱导具有耐受性的抗成熟toldc,促进treg的分化、增殖与抑制性,csa没有作用,激素与mpa有抑制效应;雷帕霉素(rapa)戒断具有促进长期生存肝移植产生免疫耐受的优势,虽然样本量小,但提示rapa可能在诱导免疫耐受方面具有独特的优势;rapa同时能诱导功能稳定的抗成熟性toldc,促进treg的分化,而临床常用的csa没有作用,激素与mpa有抑制效应。但是目前关于rapa诱导的toldc临床研究的尚无报道,在动物肝移植中的研究也较少。
6.如何选择合适的药物以制备耐受性稳定的toldc、如何确定细胞治疗的剂量、时间与频率以建立标准化的治疗方案;toldc治疗后在体内的迁移及定植规律、诱导的免疫耐受是否具有供体特异性、是否需要联用合适的免疫抑制方案、克服免疫记忆等均是解决toldc免疫治疗所面临的重要问题。
技术实现要素:
7.本发明的一个目的在于提供一种靶向mtor的耐受性树突状细胞(rapa-toldc)。
8.本发明的另一目的在于提供一种制备所述靶向mtor的耐受性树突状细胞的方法。
9.本发明的另一目的在于提供所述靶向mtor的耐受性树突状细胞的应用。
10.为了提供一种耐受性稳定的toldc,本发明采用雷帕霉素修饰细胞因子(gm-csf和il-4)诱导树突状细胞的分化,制备出的耐受功能稳定的靶向mtor的耐受性dc(rapa-toldc),并阐明了该rapa-toldc的转录谱、分子特征及负向调控效应,进一步基于该rapa-toldc的特性,诱导出不同类型的调节性免疫细胞,并进一步建立制备出具有供体特异性新型cd8
调节性t细胞,为解决免疫耐受诱导中供体特异性的问题奠定基础。
11.具体而言,一方面,本发明提供了一种靶向mtor的耐受性树突状细胞,其具有siglec1、spp1等基因下调的转录谱,pi3k/mtor表达缺失,具有选择性的负向调控效应。
12.根据本发明的具体实施方案,本发明的靶向mtor的耐受性树突状细胞,表达dc的标记cd11c,与成熟dc相比,低表达表面共刺激分子cd80、cd86及mhc-ii,分泌相对较高的il-10和低水平的inf-γ;能诱导产生多种类型调节性免疫细胞,能产生具有供体特异性的cd8
调节性t细胞。
13.另一方面,本发明还提供了制备所述的靶向mtor的耐受性树突状细胞的方法,该方法包括:取骨髓间充质干细胞或外周血pmbc,以含1%-10%的fbs的无酚红的培养液贴壁培养获取dc的前体细胞,加入含有gm-csf和il-4的完全培养基;培养第2天全量换液,第4天半量换液,并补充细胞因子gm-csf与il-4,维持浓度不变,并且在第2天与第4天换液时加入雷帕霉素;培养至第6天,半量换液,补充gm-csf维持浓度不变,并且加入lps,继续培养。
14.根据本发明的具体实施方案,本发明的靶向mtor的耐受性树突状细胞的制备方法中,gm-csf的浓度为1-40ng/ml,il-4的浓度为0.5-20ng/ml。优选地,gm-csf与il-4的浓度比例为2:1。
15.根据本发明的具体实施方案,本发明的靶向mtor的耐受性树突状细胞的制备方法中,雷帕霉素的浓度为1-40nm。优选地,所述雷帕霉素的浓度为1-10nm。
16.根据本发明的具体实施方案,本发明的靶向mtor的耐受性树突状细胞的制备方法中,lps浓度为0.01-1μg/ml。
17.根据本发明的具体实施方案,本发明的靶向mtor的耐受性树突状细胞的制备方法中,gm-csf与il-4的浓度比例为2:1;在第2天与第4天换液时加入雷帕霉素的浓度分别为10nm,第6天lps的加入量为0.05μg/ml。
18.本发明中,除特别注明外,上述各物质的浓度是指各物质在培养体系中的添加浓度。
19.根据本发明的具体实施方案,本发明的靶向mtor的耐受性树突状细胞的制备方法中,培养第6天制备得到靶向mtor的未成熟dc(本发明中命名为rapa-imdc),培养第7天制备得到靶向mtor的耐受性dc(本发明中命名为rapa-toldc)。本发明中,所述耐受性树突状细胞包括cd11c
靶向mtor的耐受性dc及其中cd4 、cd4-细胞、cd8 、cd8-的不同细胞亚群,或者由单核细胞培养出来的树突状细胞或由骨髓干细胞诱导分化出来的树突状细胞,或者由雷帕霉素、或依维莫司诱导分化出来的树突状细胞。
20.另一方面,本发明还提供了所述的靶向mtor的耐受性树突状细胞在制备具有免疫耐受功能的树突状细胞制品中的应用。
21.根据本发明的具体实施方案,本发明的所述的靶向mtor的耐受性树突状细胞的应用中,所述的树突状细胞制品是用于预防和/或治疗自身免疫性疾病、移植物抗宿主病和/或器官移植排斥。
22.根据本发明的具体实施方案,本发明的所述的靶向mtor的耐受性树突状细胞的应用中,所述移植包括细胞移植、器官移植或组织移植;其中细胞移植包括干细胞移植、调节性细胞移植、胰岛细胞移植或效应性细胞移植;器官移植包括肾移植、肝移植、心脏移植、小肠移植、肺移植、胰腺移植、或者联合器官移植;组织移植包括角膜移植、肢体移植或脸移植。
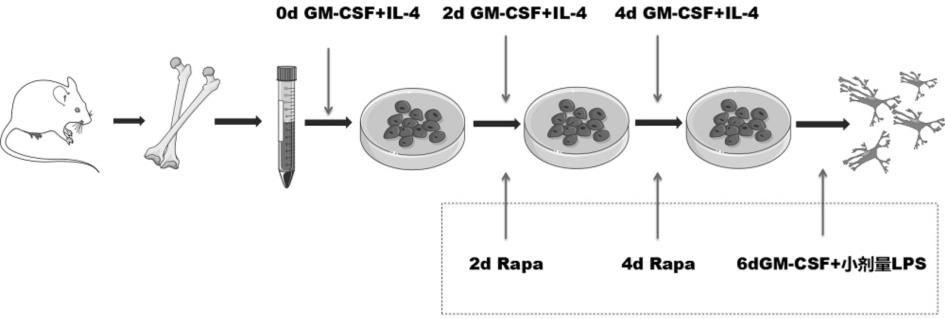
23.另一方面,本发明还提供了所述的靶向mtor的耐受性树突状细胞在制备用于诱导移植受体免疫耐受的调节性细胞中的应用。
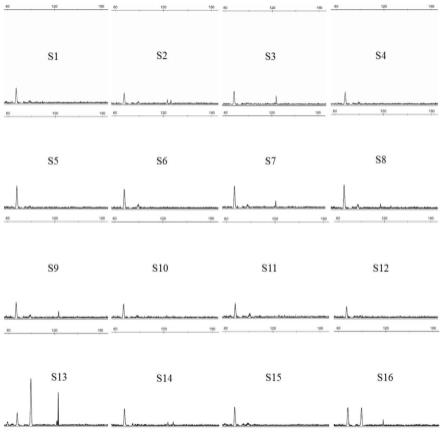
24.根据本发明的具体实施方案,本发明的所述的靶向mtor的耐受性树突状细胞的应用中,所述调节性细胞包括cd4 cd25 调节性t细胞、cd8
调节性t细胞、foxp3
调节性t细胞、调节性b细胞、non-t淋巴细胞、调节性nk细胞或调节性巨噬细胞。
25.本发明中,rapa-toldc是具有致耐受性的耐受性dc细胞亚群,具有诱导供体特异性cd8
cd45rc
low/-treg产生,建立移植免疫耐受的功能。
26.在本发明的一些具体实施方案中,本发明通过“小剂量rapa联合低浓度gm-csf il-4”的优化方案(图1),诱导出致耐受性稳定的rapa-toldc(图3-图4),该rapa-toldc具有稳定的负向免疫调节作用(图5),明确了rapa-toldc的转录谱、分子特征(图6),有效解决了目前制备toldc过程中诱导药物选择困难、方案不统一、性质不稳定等问题,且本发明具有操作简单、制备周期短、成本低、可重复性强的优点。
27.本发明所制备的rapa-toldc具有稳定的免疫调节功能,能诱导产生不同类型的调节性t细胞(图7),诱导产生cd4
treg和分泌il-10的breg(图8);诱导产生具有供体特异性的高分泌il-10的cd8
cd45rc
low/-treg(图9);同时该发明方案所制备的pbmc来源的rapa-toldc,其可以诱导产生分泌il-10的foxp3
调节性t细胞(图10)。
附图说明
28.构成本发明的一部分的附图用来提供对本发明技术方案的进一步理解,使得本发明的其它特征、目的和优点变得更明显。本发明的示意性实施例附图及其说明用于解释本发明,并不构成对发明范围的不当限定。
29.图1是根据本发明一实施例的一种靶向mtor的耐受性dc(rapa-toldc)的制备技术方案流程示意图。
30.图2是不同浓度gm-csf方案诱导的树突状细胞的流式结果图。
31.图3是不同方案诱导靶向mtor的耐受性dc的流式结果图。
32.图4是靶向mtor的耐受性dc与成熟树突状细胞差异的流式结果图。
33.图5显示本发明的rapa-toldc促进淋巴细胞的凋亡。
34.图6是本发明的rapa-toldc的转录谱和分子特征结果图。
35.图7是根据本发明一实施例的一种靶向mtor的耐受性dc(rapa-toldc)的应用的流
程示意图。
36.图8是图7实施例中应用rapa-toldc诱导产生cd4
treg、分泌il-10的breg的结果图。
37.图9是图7实施例中应用rapa-toldc诱导产生具有供体特异性的高分泌il-10的cd8
cd45rc
low/-treg的结果图。
38.图10是以外周血pbmc诱导产生靶向mtor的耐受性dc的结果图,显示利用本发明方案可以制备产生的pbmc来源的rapa-toldc,可以诱导产生分泌il-10的foxp3
调节性t细胞。
具体实施方式
39.为了对本发明的技术特征、目的和有益效果有更加清楚的理解,现结合具体实施例及附图对本发明的技术方案进行更详细地描述。显然,所描述的实施例仅仅是本发明一部分的实施例,本发明并不受限于此。基于本发明中的实施例,本领域技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本发明的保护范围。
40.需要说明的是,实施例中所用到的各种生物试剂、材料的取得途径仅是提供一种实验获取的途径以达到发明具体公开的目的,不应成为对本发明生物材料来源的限制。实际上,任何不违法法律和伦理道德能够获取的生物试剂、材料,包括来源于大鼠、小鼠、猪等哺乳动物或人的离体细胞、或从细胞库取得、或从商业途径购买获得、或按照已有文献制备获取,均可以按照本发明中实施例中的提示进行替换使用。
41.实施例中未特别注明的方法操作,按照所属领域现有技术的常规操作或商厂说明书建议的操作进行。
42.实施例1、靶向mtor的耐受性树突状细胞的制备与表型鉴定1.1 不同gm-csf il-4方案制备bm-mscs来源的树突状细胞参见如图1所示的制备流程,首先获取骨髓间充质肝细胞,步骤如下:spf级、体重为200-350g的雄性lewis大鼠,购自北京维通利华实验动物中心,全麻后拉颈处死,四肢及躯干剃毛、消毒,超净台中用无菌剪刀、镊子等手术器械分离获取股骨(包含上下关节),置于细胞培养液中。在细胞培养间超净台中剔除多余的肌肉、脂肪等组织,1
×
pbs(购自中国索莱宝公司)冲洗股骨表面;无菌外科剪刀去除上下关节,留股骨干。用无酚红的rpmi-1640(购自美国gibco公司)反复冲洗骨髓腔直至颜色发白(3-5次),200目筛网过滤,离心,弃上清,1
×
红细胞裂解液(购自美国bd公司)5ml吹打混匀骨髓细胞沉淀,4℃避光孵育10min,离心,弃上清,以1
×
pbs清洗一次,去除残余红细胞(如红细胞多可以用红细胞裂解液去除);其次,贴壁获取单个核细胞,步骤如下:用1
×
pbs预润培养皿,将上述离心后的细胞按照1.5-2
×
106/ml的浓度接种于含2ml的不含fbs的无酚红rpmi-1640培养液的平底6孔板(购自美国康宁公司),置于37.5℃、5%co2的细胞孵箱中培养2h。2h后弃掉未贴壁的细胞,加入2ml含10�s(购自美国gibco公司)的无酚红rpmi-1640培养液,同时分别加入不同浓度的gm-csf与il-4(购自美国peprotech公司,gm-csf与il-4的浓度比例为2:1,gm-csf的浓度分别为1ng/ml、10ng/ml、20ng/ml、40ng/ml,对应的il-4的浓度分别为0.5ng/ml、5ng/ml、10ng/ml、20ng/ml),置于37.5℃、5%co2的细胞孵箱继续培养6天。从加入gm-csf与il-4起计算,第2天全量换液,第4天半量换液,换液同时补充足量的细胞因子,以维持gm-csf与il-4
浓度不变;第6天半量换液,仅补充gm-csf,维持浓度不变,同时添加高浓度(1μg/ml)的lps(购自美国invvivogen公司)刺激,置于37.5℃、5%co2的细胞孵箱继续培养24小时。
43.1.2 bm-mscs来源的树突状细胞流式细胞表型鉴定收集lps刺激后培养至第7天(即加入lps后继续培养24小时)的细胞,离心,弃上清,1
×
pbs清洗一次,离心,弃上清;300μl 1
×
pbs充分吹打混匀为单细胞悬液,等分为3份,分别加入3个流式上样管中,标记为1号标准对照管,加入fitc-igg、pe-igg和apc-igg(购自美国bd公司)各5μl;2号检测样品管1,加入小鼠抗大鼠的单克隆抗体fitc-cd86,pe-cd11c和apc-cd80(购自美国bd公司各5μl);3号检测样品管2,加入小鼠抗大鼠的单克隆抗体pe-cd11c和apc-mhc-ii(购自美国bd公司)各5μl。充分混匀后,室温、避光孵育15min,加入1ml 1
×
pbs吹打混匀,离心,弃上清,用流式细胞仪(bd canto ii,美国)检测树突状细胞表面标记。
44.流式细胞技术检测所诱导的树突状细胞表面分子的表达,结果如图2所示,图2中从左至右a-d四个图片,所应对的gm-csf的浓度分别为1ng/ml、10ng/ml、20ng/ml、40ng/ml,所对应的il-4的浓度分别为0.5ng/ml、5ng/ml、10ng/ml、20ng/ml。图中结果显示,不同浓度gm-csf il-4均可以诱导bm-mscs向树突状细胞分化,在lps刺激下,可以分化为成熟的树突状细胞。随着gm-csf刺激浓度的不断增加,所诱导分化的树突状细胞表面mhc-ii与共刺激分子cd86/cd80的表达水平越高,可达90%以上(图2),符合经典具有抗原提呈效应的树突状细胞的分子表现。
45.1.3 优化靶向mtor的耐受性dc的制备方案根据图1的示意图所示,间充质干细胞的获取方法同1.1,不同浓度gm-csf il-4干预的时间点不变,在培养第2天、第4天分别加入小剂量(第2天10 nm,第4天10nm)的雷帕霉素,第六天lps的刺激为小剂量(0.05μg/ml),lps刺激的时间为24h,将培养至第7天的细胞(rapa-toldc)用于流式细胞检测,染色和检测方案同1.2。
46.另以发明人的既往方案作为对照toldc:间充质干细胞的获取方法同1.1,gm-csf(1ng/ml) il-4(0.5ng/ml)干预的时间点不变,在培养第2天加入10ng/ml的雷帕霉素,第6天加入0.1μg/ml lps刺激,刺激48小时收获培养的细胞,用于流式细胞检测,染色和检测方案同1.2。
47.流式检测树突状细胞表面标记,随着gm-csf il-4刺激浓度的不断增加(gm-csf的浓度分别为1ng/ml、10ng/ml、20ng/ml),在培养第6天(在加入lps刺激前取样),rapa两次干预修饰后的dc表面共刺激分子cd86/cd80与mhc-ii表达逐步上调(图3中的图片a),抵抗lps刺激的能力越弱,表型越趋势成熟(图3中的图片b)。检测结果表明,经过优化的小剂量的rapa修饰低浓度方案可以诱导产生表型更稳定的靶向mtor的耐受性dc。
48.与既往方案相比,优化方案诱导rapa-toldc产生率较高,表现cd11c的表达显著增加(87.86
±
1.70 vs. 60.50
±
5.84,p<0.001),同时mhc-ii(30.40
±
8.67 vs. 38.70
±
3.87,p=0.038)的水平下调,表面共刺激分子cd80、cd86表达仍处于较低水平,无明显差异。
49.1.4 靶向mtor耐受性dc与成熟dc的表型差异gm-csf高浓度诱导bm-mscs分化的未成熟树突状细胞在lps的刺激下容易分化为成熟的dc,而rapa干预可以抑制未成熟树突状细胞的成熟,使其具有稳定稳定抵抗lps刺激的效应,低浓度的gm-csf所诱导的靶向mtor的耐受性dc表型更趋于未成熟状态,分别利用
高浓度、低浓度gm-csf方案制备树突状细胞,步骤同1.1与1.3,流式染色同1.2。
50.流式检测结果如图4所示,rapa修饰的低浓度(10ng/ml)gm-csf il-4刺激bm-mscs向树突状细胞分化,培养6天后向cd11
dc分化,表现为未成熟状态(本发明称之为rapa-imdc),低表达共刺激分子cd86/cd80与mhc-ii(图4中的图片a);其能抵抗lps刺激的成熟效应,仍表达较低水平的共刺激分子cd86/cd80与mhc-ii(图4中的图片a),而lps刺激rapa修饰的高浓度(40ng/ml)gm-csf il-4方案诱导的imdc更容易向成熟dc分化,cd80/cd86及mhc-ii表达均处于较高水平,其更趋向于高浓度gm-csf诱导的成熟dc分化的表型(图4中的图片b)。此外,rapa-toldc吞噬能力较成熟dc下降,表现为右旋糖酐的摄取力下降(63.42% vs. 95.04%)。
51.实施例2、靶向mtor的耐受性dc具有稳定的负向调节作用本实施例中,考察了本发明的靶向mtor的耐受性dc(rapa-toldc)的负向调节作用。同时采用对照toldc(既往方案)进行比较。
52.本实施例及后续各实施例中,除特别注明外,考察的本发明的rapa-toldc均是按照实施例1中1.3方案制备得到,其中gm-csf浓度10ng/ml il-4浓度5ng/ml,第2天与第4天分别加入rapa 10nm,lps浓度0.05μg/ml。
53.靶向mtor的耐受性dc分泌较高水平的il-10留取靶向mtor的耐受性dc培养上清液,利用elisa试剂盒检测(按照说明书进行操作)实施例1中方案制备rapa-toldc分泌il-10的水平;检测结果发现,与对照组toldc相比,分泌il-10的水平显著增加(767.8
±
63.02 vs. 256.9
±
57.87)pg/ml。
54.靶向mtor的耐受性dc刺激淋巴细胞增殖的能力减弱利用丝裂霉素c灭活实施例1中方案制备rapa-toldc,与磁珠分选的t细胞混合培养48h,然后加入cck-8,37℃孵育2h,于450nm处检测od值,并计算刺激指数。
55.与对照toldc相比,本发明中rapa-toldc刺激t细胞增殖的si指数更低(0.93
±
0.05 vs. 1.22
±
0.42,p=0.046),说明其抗原提呈能力越弱,而负向调节能力增强,是符合诱导免疫耐受需求的。
56.靶向mtor的耐受性dc促进淋巴细胞的凋亡效应增强利用实施例1中方案制备rapa-toldc,按照1:10的比例,与pbmc共培养3天,流式细胞检查效应t细胞的凋亡情况。
57.结果显示,pbmc共培养3天后,与对照toldc相比(17.7%),发现rapa-toldc促进效应t细胞的凋亡的作用明显增加(33.7%),差异显著(p<0.01)(图5中的图片a-图片c)。
58.以上这些均提示,本发明所制备的靶向mtor的耐受性dc具有较强的负向免疫调控效应,满足诱导免疫耐受的要求。
59.实施例3、转录组测序技术明确靶向mtor的耐受性dc的分子特征和转录谱利用实施例1中1.1方案制备imdc与matdc,1.3的方案制备rapa-imdc与rapa-toldc,离心、弃上清,获得1
×
106以上的目的细胞,利用trizol法提取总rna,agilent 2100 bioanalyzer进行rna浓度检测;rnase-h法去除rrna,建立转录组文库,agilent 2100 bioanalyzer检测文库的插入片段范围,并使用abi steponeplus real-time pcr system(taqman probe)检测文库浓度;采用illumina测序技术sbs试剂进行上机测序。测序结果提示,与matdc相比,rapa-toldc中pi3k/mtor通路主要基因缺失或下调(图6),同时发现spp1、
phlda3在调控rapa-toldc的分化中发挥关键作用;这提示rapa修饰的靶向mtor的耐受性dc具有特殊的分化路径和致免疫耐受特性。
60.实施例4、靶向mtor的耐受性dc诱导产生不同表型的cd4
treg如图7所示,利用实施例1中的方案制备靶向mtor的耐受性dc,以anti-rat pe cd11c磁珠(购自德国美天旎公司)分选获取纯度>95%以上的cd11c
rapa-toldc,anti-rat pe cd4与cd8磁珠(购自德国美天旎公司)分选,分别获取纯度>95%以上的cd4
t与cd8
t细胞,按照1:4的比例混合培养7天,收集混合培养的细胞,离心,弃上清,100μl 1
×
pbs重悬,分别加入5μl小鼠抗大鼠的单克隆抗体fitc-cd4,pe-cd25,pe-cd45rc和percp-tcrαβ(购自美国bd公司)充分混匀后,室温、避光孵育15min,离心,弃上清,以1
×
pbs 500μl吹打混匀,用流式细胞仪检测cd4
cd45rc
low/-treg、cd4
cd25
treg的表达水平。
61.流式细胞检测结果显示,与对照组相比,靶向mtor的耐受性dc显著上调cd4
cd45rc
low/-treg(78.58
±
10.23 vs. 51.30
±
2.26)、cd4
cd25
treg(60.02
±
8.50 vs. 19.95
±
4.17)的表达水平;检测结果表明,该靶向mtor的耐受性dc具有诱导产生不同cd4
treg的能力(图8中的图片a)。
62.实施例5、靶向mtor的耐受性dc诱导产生高分泌il-10的breg如图7所示,利用实施例1中的方案制备靶向mtor的耐受性dc,以anti-rat pe cd11c磁珠(购自德国美天旎公司)分选获取纯度>95%以上的cd11c
rapa-toldc,anti-rat pe cd45ra磁珠(购自德国美天旎公司)分选获取纯度>95%以上的b细胞,按照1:4的比例混合培养7天,收集混合培养的细胞,离心,弃上清,无酚红的1640培养,莫能霉素、离子霉素刺激6h,离心,弃上清,100μl 1
×
pbs重悬,分别加入5μl小鼠抗大鼠的单克隆抗体fitc-cd1d,pe-cd5和pb-cd45ra(购自美国bd公司)充分混匀后,室温、避光孵育15min,破膜后加入5μl小鼠抗大鼠的单克隆抗体af647-il-10(购自美国bd公司),充分混匀后,室温、避光孵育60min,加入破膜缓冲液2ml,离心,弃上清,以1
×
pbs 500μl吹打混匀,用流式细胞仪检测cd45ra
cd5
cd1d
il-10
breg的表达水平。
63.流式细胞检测结果显示,与对照组相比,靶向mtor的耐受性dc能够诱导b细胞向表型为cd45ra
cd5
cd1d
il-10
breg分化,il-10的分泌水平可达20%-70%,随着培养时间的延长,分泌il-10的水平越高。检测结果表明,该靶向mtor的耐受性dc具有诱导高分泌il-10的cd45ra
cd5
cd1d
breg产生的能力(图8中的图片b)。
64.实施例6、靶向mtor的耐受性dc诱导产生具有供体特异性抑制效应的高分泌il-10的cd8
cd45rc
low/-treg靶向mtor的耐受性dc诱导产生高分泌il-10的cd8
cd45rc
low/-treg利用实施例4中的方案诱导cd8
cd45rc
low/-treg,培养第7天收集混合培养的细胞,离心,弃上清,5%无酚红的rpmi-1640 500μl吹打混匀细胞沉淀,加入离子霉素、pma、莫能霉素,置于37.5℃、5%co2的细胞培养箱继续孵育6h,离心,弃上清,分别加入5μl小鼠抗大鼠的单克隆抗体fitc-cd8,pe-cd45rc和percp-tcrαβ(购自美国bd公司)充分混匀后,室温、避光孵育15min,破膜后加入5μl小鼠抗大鼠的单克隆抗体af647-il-10(购自美国bd公司),充分混匀后,室温、避光孵育60min,加入破膜缓冲液2ml,离心,弃上清,以1
×
pbs 500μl吹打混匀,用流式细胞仪检测cd8
cd45rc
low
treg、il-10的表达水平。
65.流式细胞检测结果显示,正常大鼠脾脏cd8
cd45rc
low/-treg所占比例约15-20%,分
选纯化后比例可上升至40%左右,rapa-toldc可以显著上调cd8
cd45rc
low/-treg的表达水平,大于80%(图9中的图片a),高于既往方案诱导的表达水平(72.6%);核因子染色结果显示,cd8
cd45rc
low/-treg高分泌il-10,是il-10分泌的主要来源(图9中的图片b)。以上检测结果表明,rapa-toldc具有诱导高分泌il-10的cd8
cd45rc
low/-treg产生的能力。
66.高分泌il-10的cd8
cd45rc
low
treg能特异性的抑制效应t细胞增殖制备供体来源的cd11
rapa-toldc与受体来源的cd8
t细胞按照1:4的比例混合培养6天,去除混合培养体系中cd45rc
high
效应t细胞,利用cfse标记同种受体、第三方的效应t细胞,按照1:4的比例混合培养,同时向对照组加入受体来源的matdc,混合培养3天后向受体效应t细胞加入第三方来源的matdc,继续培养至6天,利用流式细胞技术检测效应t细胞的增殖情况。
67.流式细胞检测结果显示,与受体matdc显著刺激cd4
cd25-效应t细胞增殖相比,rapa-toldc诱导的cd8
cd45rc
low/-treg可以显著抑制大鼠cd4
cd25-效应t细胞的增殖,抑制同种增殖效应优于异种大鼠,加入第三方来源的matdc后抑制同种属cd4
cd25-效应t细胞的增殖效应被削弱(图9中的图片c)。检测结果提示,rapa-toldc诱导的cd8
cd45rc
low/-treg具有供体特异性的抑制效应(图9中的图片d),为移植免疫耐受的诱导奠定理论基础。
68.实施例7、制备外周血pbmc来源的靶向mtor的耐受性树突状细胞将实施例1中骨髓间充质干细胞替换为外周血pbmc,制备外周血pbmc来源的靶向mtor的耐受性树突状细胞。具体步骤为:外周血5-10ml,以生理盐水等比例稀释,利用外周血淋巴细胞分离液(天津灏阳生物技术有限公司),按照分离液与外周血2:1的比例,以密度梯度离心法获取外周血pbmc,1
×
pbs清洗一次,红细胞裂解液去除多余红细胞,无血清1640清洗一次;贴壁去除多余淋巴细胞,刺激方案等同实施例1中1.3,培养第7天,流式细胞检测表型,方案同实施例1。进一步将诱导的rapa-toldc与磁珠分选纯度>95%以上的cd4
t细胞,按照1:4的比例混合培养7天,收集混合培养的细胞,离心,弃上清,100μl 1
×
pbs重悬,流式细胞检测cd4
cd25
foxp3
treg的表达及il-10的分泌水平。
69.流式细胞结果显示,利用实施例1中的方案,可以获取表型类似的外周血pbmc来源的靶向mtor的耐受性dc,具体表现为,低表达hla-dr、cd1a以及共刺激分子cd83、cd80/cd86(图10);并可以诱导产生分泌il-10的cd4
cd25
foxp3
treg,直接效应大于间接效应;提示本发明所提供的技术方案,可以诱导不同前体细胞分化为耐受性树突状细胞。
70.以上实施例仅是为了充分说明本发明所列出的较优的具体实施例,本发明的保护范围不限于此。本领域技术人员,在本发明基础上所进行的任何修改、等同替代或变换,均在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。