高产
β-葡萄糖苷酶乳酸菌固定化细胞合成栀子蓝色素和栀子红色素的方法
技术领域
1.本发明属于微生物技术领域,具体涉及高产β-葡萄糖苷酶乳酸菌固定化细胞合成栀子蓝色素和栀子红色素的方法。
背景技术:
2.栀子蓝色素和栀子红色素是一种环保、无毒、稳定的天然食品着色剂。栀子蓝色素是栀子苷经过β-葡萄糖苷酶水解得到京尼平,后者与氨基酸反应得到。栀子红色素是在京尼平苷在碱性条件下水解为京尼平苷酸,后者在酶的作用下去糖为京尼平酸,与伯氨化合物在有氧条件下缩合而成。β-葡萄糖苷酶是决定色素性质的关键酶。
3.栀子蓝色素和栀子红色素已被用于饮料、葡萄酒等食品中的添加剂。它还用于染色许多织物,包括棉花、丝绸和羊毛。除了天然色素外,它们还表现出一些其他的生物活性,如抗炎作用、抗肿瘤活性等。采用酶解法或细菌转化法制备栀子蓝和红色素是最有效方法之一。
4.为了满足无毒无害的生产工艺,乳杆菌是生产栀子蓝和栀子红色素的新的潜在候选者。乳杆菌用作各种发酵食品的发酵剂,已认为是安全(gras)菌株,表现出优异的益生菌特性。然而,目前还未使用乳酸菌制备栀子蓝色素和栀子红色素。
5.因此,如何筛选出新的高产β-葡萄糖苷酶乳酸菌,并利用该高产β-葡萄糖苷酶乳酸菌合成栀子蓝色素和栀子红色素的意义重大。
技术实现要素:
6.针对现有技术存在的问题,本发明的目的在于设计提供高产β-葡萄糖苷酶乳酸菌固定化细胞合成栀子蓝色素和栀子红色素的方法的技术方案,本技术利用高产β-葡萄糖苷酶乳酸菌固定化细胞进行栀子蓝色素和栀子红色素的合成,安全有效,且能够有效得到高质量的色素。
7.本发明通过以下技术方案实现:
8.本发明一方面提供高产β-葡萄糖苷酶乳酸菌固定化细胞合成栀子蓝色素的方法,其包括以下步骤:
9.1)高产β-葡萄糖苷酶乳酸菌固定化处理得到固定化细胞,所述高产β-葡萄糖苷酶乳酸菌为植物乳植杆菌lactiplantibacillus plantarum s3,其保藏号为cgmcc no.24649;
10.2)取栀子苷加入到磷酸缓冲液中,并加入谷氨酸钠和步骤1)的固定化细胞,进行反应得到栀子蓝色素。
11.进一步,所述的步骤1)中固定化处理包括以下步骤:
12.a将高产β-葡萄糖苷酶乳酸菌接种到mrs培养基培养,作为种子液,利用5%种子液在mrs培养基进行扩大培养,扩大培养得到的菌液离心处理,再用无菌水洗涤,离心处理,得
到湿菌体,湿菌体加入无菌生理盐水,制备得到0.1~0.5g/ml菌悬液;
13.b取菌悬液与固定化溶液a和固定化溶液b进行混合反应,得到固定化细胞,所述菌悬液、固定化溶液a和固定化溶液b的体积比为1~3:10:10,所述固定化溶液a为海藻酸钠和聚乙烯醇水溶液;固定化溶液b为cacl2和硼酸水溶液。
14.进一步,所述的步骤2)中栀子苷、固定化细胞与谷氨酸钠的质量比1:2:2~4,优选为1:2:2.6。
15.进一步,所述的步骤2)中反应温度为30℃~50℃,优选为40℃。
16.进一步,所述的步骤2)中反应ph值为6~8,优选为7。
17.进一步,所述的固定化溶液a为含2%海藻酸钠和7%聚乙烯醇的水溶液;固定化溶液b为含3%cacl2和6%硼酸的水溶液。
18.本发明另一方面提供高产β-葡萄糖苷酶乳酸菌固定化细胞合成栀子红色素的方法,其特征在于包括以下步骤:
19.1)高产β-葡萄糖苷酶乳酸菌固定化处理得到固定化细胞,所述高产β-葡萄糖苷酶乳酸菌为植物乳植杆菌lactiplantibacillus plantarum s3,其保藏号为cgmcc no.24649;
20.2)取浓度为5%~10%的栀子苷水溶液,加入栀子苷4倍摩尔浓度的naoh,在35℃~45℃温度下水解2~3h;
21.3)再步骤2)的水解溶液中加入柠檬酸钠调节ph值至4~6,加入步骤1)的与栀子苷等质量的固定化细胞及栀子苷2倍摩尔浓度的谷氨酸,在45℃~50℃条件下反应得到栀子红色素。
22.进一步,所述的步骤1)中固定化处理包括以下步骤:
23.a将高产β-葡萄糖苷酶乳酸菌接种到mrs培养基培养,作为种子液,利用5%种子液在mrs培养基进行扩大培养,扩大培养得到的菌液离心处理,再用无菌水洗涤,离心处理,得到湿菌体,湿菌体加入无菌生理盐水,制备得到0.1~0.5g/ml菌悬液;
24.b取菌悬液与固定化溶液a和固定化溶液b进行混合反应,得到固定化细胞,所述菌悬液、固定化溶液a和固定化溶液b的体积比为1~3:10:10,所述固定化溶液a为海藻酸钠和聚乙烯醇水溶液;固定化溶液b为cacl2和硼酸水溶液。
25.进一步,所述的固定化溶液a为含2%海藻酸钠和7%聚乙烯醇的水溶液;固定化溶液b为含3%cacl2和6%硼酸的水溶液。
26.本发明利用高产β-葡萄糖苷酶乳酸菌lactiplantibacillus plantarum s3固定化细胞高效制备栀子蓝色素和栀子红色素,短时间转化效率高,同时保证了转化过程中的安全性。进一步优化反应条件,在最优反应条件下高效率生产栀子蓝、栀子红色素,可应用于天然色素工业生产中。
附图说明
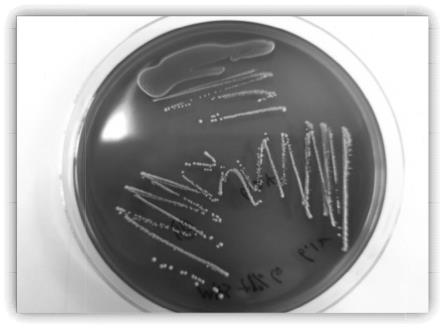
27.图1为高产β-葡萄糖苷酶乳酸菌筛选图;
28.图2筛选菌株的系统树;
29.图3为高产β-葡萄糖苷酶乳酸s3菌株的酶活性、生长曲线图;
30.图4为高产β-葡萄糖苷酶乳酸s3菌株水解栀子苷为京尼平的转化能力图;
31.图5为高产β-葡萄糖苷酶乳酸s3菌株的固定化细胞;
32.图6为利用固定化细胞生成栀子蓝色素的影响因素分析;
33.图7为谷氨酸钠比例、反应温度、反应ph值,各两因素交互作用响应面图;
34.图8为利用固定化细胞转化栀子苷生成纸质红色素。
具体实施方式
35.以下结合实施例来进一步说明本发明。
36.本发明实施例中所用到的培养基以及试剂如下:
37.培养基的配方:
38.分离β-葡萄糖苷酶活性乳酸菌的培养基基:蛋白胨1%,牛肉膏1%,酵母粉0.5%,k2hpo
4 0.2%,柠檬酸二铵0.2%,乙酸钠0.5%,葡萄糖2%,吐温80 0.1ml,mgso4·
7h20 0.058%,mnso4·
4h2o 0.025%,琼脂2%,栀子苷1%。本文中培养基中的“%”含义指100ml培养基中含有某成分多少g。
39.mrs培养基:蛋白胨1%,牛肉膏1%,酵母粉0.5%,k2hpo
4 0.2%,柠檬酸二铵0.2%,乙酸钠0.5%,葡萄糖2%,吐温80 0.1ml,mgso4·
7h20 0.058%,mnso4·
4h2o 0.025%,琼脂2%。本文中培养基中的“%”含义指100ml培养基中含有某成分多少g。
40.磷酸缓冲液:nah2po
4 0.265%,na2hpo
4 0.825%。本文中培养基中的“%”含义指100ml水中含有某成分多少g。
41.实施例1:高产β-葡萄糖苷酶乳酸菌的筛选
42.(1)发酵食品中乳酸菌的初筛
43.选取泡菜、酸奶两种发酵食品,分别吸取100μl泡菜汁、酸奶加入900μl 0.85%nacl溶液稀释至不同浓度(10-2
~10-4
),涂布到平板上,做好标记,在37℃培养24h后观察并挑选菌落。结果,在泡菜和酸奶样品生长的培养基上分别挑选10个和8个单独的菌落,编号p1~p10、s1~s8。
44.(2)高产β-葡萄糖苷酶乳酸菌的复筛
45.栀子苷被β-葡萄糖苷酶水解后生成葡萄糖和京尼平,再与氨基酸反应生成栀子蓝色素。因此,在上述分离高产β-葡萄糖苷酶乳酸菌的培养基平板上,划线接种初筛得到的18个菌种的稀释液,在37℃培养48h后观察其是否菌落的周围出现了蓝色物质。
46.测定结果:如图1所示,s3菌落周围蓝色最明显,说明该菌株的β-葡萄糖苷酶活性高。
47.实施例2:高产β-葡萄糖苷酶乳酸菌的鉴定
48.将筛选得到的菌株通过测试16s rrna测序做菌株的鉴定。测序序列结果与ncbi数据库中进行blast同源序列比对,以确定菌株的种属,同源性超过99%即可鉴定至种。与同源性较高的菌株利用软件mega-x中的临位相连法构建系统进化树。
49.测定结果:筛选菌株的16s rrna测序结果如下。
50.筛选菌株s3的16s rrna的基因序列(如seq id no.1所示):
51.[0052][0053]
如表1所示,筛选菌株s3菌株为lactiplantibacillus plantarum,与标准菌株lactobacillus plantarum imau98319有99.79%的同源性。
[0054]
表1高产β-葡萄糖苷酶植物乳植杆菌鉴定结果
[0055][0056]
如图2所示,筛选菌株lactiplantibacillus plantarum s3与lb.plantarum imau98319的进化距离最小,与其他的lb.plantarum spp.,lb.plantarum sourdough,lb.pentosus的进化距离相对远。
[0057]
同时,将该菌株lactiplantibacillus plantarum s3保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址为北京市朝阳区北辰西路1号院3号,保藏名称为植物乳植杆菌(lactiplantibacillus plantarum),保藏时间为:2022年04月06日,菌种保藏编号为cgmcc no.24649。
[0058]
实施例3:lactiplantibacillus plantarum s3的生长曲线及β-葡萄糖苷酶活性曲线
[0059]
pnpg(对硝基苯酚葡萄糖苷)作为底物,测定lactiplantibacillus plantarum s3的β-葡萄糖苷酶活性及生长曲线。在mrs培养基中培养24h,离心(7000g,15min,4℃)收集细胞,在pbs溶液(50mm,ph 7.0)超声细胞,得到粗酶。将粗酶(0.1ml)添加到1ml底物溶液中(2mm pnpg在pbs缓冲液中,ph 7.0),使用酶标仪在405nm测定o.d值。酶活性定义为每分钟产生1μmol pnp所需的酶量。在600nm测定生长曲线(图3)。
[0060]
测定结果:lactiplantibacillus plantarum s3菌株在生长3h后进入对数生长期,菌体急剧增加,12h~24h达到生长稳定期,此时活菌数保持相对稳定。其酶活性在培养大约9h后开始有酶活性,酶活性随着时间增加,最高达到1.01unit/ml。
[0061]
实施例4:lactiplantibacillus plantarum s3对49种碳水化合物利用能力
[0062]
利用api 50ch测定lactiplantibacillus plantarum s3对碳水化合物的利用能力。菌株在mrs培养基中培养24h活化,制备两个麦氏浊度的悬浮液,然后将悬浮液加到试剂条上的50个微生化管中。当细菌可利用底物中的不同物质为唯一碳源时,如细菌能够利用
或生长,颜色就改变,以阳性( )表示,颜色稍有改变,以(
±
)表示,如细菌不能利用碳源,颜色没有改变,以阴性(-)表示。
[0063]
测定结果:lactiplantibacillus plantarum s3能够利用48种碳水化合物,不能利用葡萄糖酸酯(gluconate)(表2)
[0064]
表2 lactiplantibacillus plantarum s3对不同碳水化合物及衍生物的发酵能力
[0065][0066]
实施例5:lactiplantibacillus plantarum s3对栀子苷的转化能力
[0067]
将活化好的菌株经过离心(7000g,10min)后将上清液丢弃,用缓冲溶液(50mm phosphate溶液)洗涤,得到活菌(浓度达到50mg/ml)。加入栀子苷进行24h的转化。分别于0、1、2、3、6、12、24h取样2ml,离心后取上清液,0.22μm过滤待用。
[0068]
高效色谱检测,色谱条件如下:色谱柱:tc-c18(250
×
4.6mm,5μm);检测器:紫外检测器;检测波长:238nm;流动相:甲醇:水=45:55,流速:0.8ml/min。
[0069]
对产生的栀子蓝色素,利用色差仪测定色素的色差(a,b,l值)。
[0070]
测定结果:如图4所示,lactiplantibacillus plantarum s3菌株24h转化之后,所有的栀子苷转化为京尼平和栀子蓝色素。6h,栀子苷转化率达到64%;12h,栀子苷转化率达到92%;24h,栀子苷的转化率达到100%。产生的栀子蓝色素的色差为:l值44.44;a值-0.25;b值-4.02。
[0071]
实施例6:制备高产β-葡萄糖苷酶植物乳植杆菌固定化细胞
[0072]
将高产β-葡萄糖苷酶植物乳植杆菌(lactiplantibacillus plantarums3)活化,接种到100ml的mrs培养基培养(作为种子液),利用5%种子液在mrs培养基培养中进行扩大培养。扩大培养的菌液4000rpm/min、离心25min,用无菌水洗涤,离心,得到湿菌体,加入适量的无菌生理盐水,制备0.2g/ml菌悬液。固定化溶液a:海藻酸钠(质量浓度2%)和聚乙烯醇(质量浓度7%)加入100ml水,进行灭菌。固定化溶液b:cacl2(质量浓度3%)和硼酸(质量浓度6%)加入100ml水,进行灭菌。15ml菌悬液加入到100ml a溶液,混匀,再加入到100ml b溶液,室温下固定20h,得到固定化细胞,固定化酶(图5)。
[0073]
实施例7:利用固定化细胞生产栀子蓝色素影响因素分析
[0074]
取栀子苷(磷酸缓冲液质量1%)加入到磷酸缓冲液(50mm,20ml),加入实施例6得到的固定化酶4g,加入不同比的谷氨酸钠,不同ph、不同温度下反应,测定色差和吸光值(584nm)。栀子苷与谷氨酸钠不同比例:1:2、1:3、1:4、1:5、1:6;不同温度:20℃、30℃、40℃、50℃、60℃;不同ph值:4、5、6、7、8、9。结果显示,lactiplantibacillus plantarum s3菌株在栀子苷与谷氨酸钠比例在1:2和1:4的时候吸光值最高(图6a)。温度对栀子蓝色素的吸光值影响最大。如图6b所示,两个菌株都在40℃的时候,吸光值达到最高,与其他温度相比明显增加。温度对栀子蓝色素产物的影响直接与β-葡萄糖苷酶的热稳定性和两个菌株的生长温度有关,植物乳杆菌的最适温度在37℃。最后,测定ph值对栀子蓝色素的影响,如图6c所示,在ph 7.0条件下生成的栀子蓝色素的吸光值最高,这与β-葡萄糖苷酶的最适ph有关。偏酸性ph值对lactiplantibacillus plantarum s3的β-葡萄糖苷酶的影响较大,ph值小于6.0明显影响酶活性;ph值偏碱性(ph 8.0,ph 9.0)对酶活性几乎没有影响。
[0075]
实施例8:利用固定化细胞生产栀子蓝色素
[0076]
利用响应曲面分析法,选择rsm中box-behnken试验设计,以栀子蓝色素色素的o.d值为最终响应值,以谷氨酸钠比例(a)、反应温度(b)和反应ph值(c)为3个不同因素。得到二次多项回归方程为:o.d=7.884
–
0.6425a 0.06625b 0.86625c 0.2175ab-0.3425ac-0.215bc-1.232a
2-2.2496b
2-2.3245c2。二项式回归方程的f值为1006.28,且p值《0.0001,差异极显著。此外,a、b、c、a2、b2、和c2的p值均小于0.01,说明其对试验结果影响极显著,且温度(b)是影响栀子蓝色素o.d值的最主要影响。根据回归方程绘制响应值与3个因素的响应面图(图7)。因此,回归模型预测的最佳反应参数为:栀子苷:谷氨酸钠=1:2.6、40℃、ph=7.0。在最优反应条件下得到栀子蓝色素的o.d值为8.07,栀子蓝色素的产量达到2.17mg/ml。对产生的栀子蓝色素,利用chroma metercr-400测定色素的色差(a,b,l值)。得到栀子蓝色素的l值为12.79;a值为0.16;b值为-2.26。
[0077]
实施例9:利用固定化细胞生产栀子红色素
[0078]
栀子红色素是在京尼平苷在碱性条件下水解为京尼平苷酸,后者在酶的作用下去糖为京尼平酸,与伯氨化合物在有氧条件下缩合而成。加入1g栀子苷到20ml蒸馏水,加入栀子苷4倍摩尔浓度的naoh,在40℃温度下进行水解。水解基本在2-3h完成。加入1m柠檬酸钠调节ph值至5左右,加入1g实施例6得到的固定化酶及栀子苷2倍摩尔浓度的天冬氨酸(或谷氨酸)在48℃条件下搅拌反应。测定栀子红色素在528nm和581nm条件下的吸光值,a
581nm
/a
528nm
判断红色素。o.d值数值越小,表示红色素颜色更亮,紫色含量越小。谷氨酸和天冬氨酸都属于酸性氨基酸,具有两个羧基,可能是生成的产物由于含有较多羧基,发生红移变为红色。结果显示,12h后可观察到栀子红色色素,lactiplantibacillus plantarum s3与谷氨酸得到的栀子红色素亮度比与天冬氨酸得到的色素亮度高(表3,图8)。
[0079]
表3高产β-葡萄糖苷酶lactiplantibacillus plantarum s3固定化细胞转化栀子红色素
[0080]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。