1.本发明属于食品加工技术领域,具体涉及一种浓厚感肽及其制备方法与应用。
背景技术:
2.社会的飞速发展带来的是人民生活水平的日益提高,在饮食上除了满足饱腹的基本要求,有着更多对于口感、滋味的追求。同时也更注重于食物的风味及其营养价值。除了酸、甜、苦、咸、鲜这五种基本味觉感受之外,人们渴望感受到更加丰富的滋味体验。浓厚味本身并不属于某一种特定的味觉,但是它可以增强其它五种基本味觉感受的强度,具备浓厚味性质的物质比较丰富,在目前的研究中,肽类较为广泛,γ-谷氨酰肽为一类重要的浓厚感肽。它在自然界和很多食物中存在,分布广泛,随着科学技术的发展,一系列食品中的γ-谷氨酰肽会渐渐地被发现,具有广泛的开发前景。
3.在当代社会,减盐少脂是人们越来越推崇的生活方式,但是,调味料和脂肪的存在能够为食品提供一些独特的风味,在追求美味和健康之间人们要做出一定的选择。γ-谷氨酰肽具备的独特的呈味特性能够有效解决这一矛盾,将γ-谷氨酰肽加入食品中,既可以改善食品风味,还可以通过“增咸”作用降低盐等调味料在食品中的使用,达到“减盐”的效果,能够满足一些特殊人群的口感需求,具有很大的前景。因此,如何有效地提高食品中的γ-谷氨酰肽的含量,成为亟需解决的关键问题。在合适的条件下,借助γ-谷氨酰转肽反应,以谷氨酰胺为反应供体,蛋白水解物中的游离氨基酸或多肽为受体,可以制备γ-谷氨酰肽。
4.小麦面筋蛋白是小麦淀粉加工的副产物,由于疏水性氨基酸含量高导致溶解性差,限制其在食品工业中的广泛应用。利用蛋白酶酶解小麦面筋蛋白可以改善其溶解性,且氨基酸组成中富含谷氨酰胺和谷氨酸,可以作为γ-谷氨酰肽的良好原料。风味蛋白酶具有内肽酶和外肽酶活性,可以有效释放原料中的谷氨酰胺,进而作为γ-谷氨酰肽转肽反应的供体。
技术实现要素:
5.针对上述的问题,本发明提供一种浓厚感肽及其制备方法与应用,为γ-谷氨酰转肽反应提供理论基础、为制备以γ-谷氨酰肽为原料的调味产品提供参考。
6.为实现上述目的,本发明采取以下技术方案:
7.一种浓厚感肽的制备方法,所述方法包含以下步骤:
8.(1)小麦面筋蛋白酶解产物的制备:取小麦面筋蛋白与去离子水按照1:10的质量比例混合均匀并调节ph至7.0后添加2%的风味蛋白酶,在50℃的条件下酶解1~7h,酶解结束后,在沸水浴中灭酶15min,冷却,8000r/min离心15min,取上清液即为小麦面筋蛋白酶解产物;
9.(2)浓厚感肽的制备:取200ml步骤(1)中的小麦面筋蛋白酶解产物,调节ph值至10.0,然后加入酶浓度为0~2.0u/g的γ-谷氨酰胺转肽酶,在37℃恒温条件下反应1~6h,反应结束后在沸水浴中灭酶15min,得到γ-谷氨酰肽,即为浓厚感肽。
10.进一步地,所述的一种浓厚感肽的制备方法,其特征在于,步骤(1)中所述酶解时间为6h;
11.步骤(2)中所述γ-谷氨酰胺转肽酶的酶浓度为1.2u/g,所述反应时间为3h。
12.进一步地,所述的一种浓厚感肽的制备方法获得的浓厚感肽。
13.进一步地,所述的浓厚感肽在调味品中的应用。
14.采用以上方案,本发明具有如下优点:
15.1、本发明以小麦面筋蛋白为原料,首先采用风味蛋白酶水解制备小麦蛋白水解物,通过优化反应条件,使小麦蛋白水解物中产生更多的游离谷氨酰胺或其他氨基酸以及多肽;其次,通过向小麦蛋白水解物中加入γ-谷氨酰胺转肽酶,在优化后的条件下,借助γ-谷氨酰转肽反应,以谷氨酰胺为反应供体,蛋白水解物中的基酸或多肽为受体,制备γ-谷氨酰肽,为γ-谷氨酰肽转肽反应提供理论基础、为制备以γ-谷氨酰肽为原料的调味产品提供参考。
16.2、本发明制备γ-谷氨酰肽需要大量游离谷氨酰胺,以小麦面筋蛋白为原料,其氨基酸含量丰富,尤其是谷氨酰胺含量很高,应用广泛,物美价廉,节约成本。
17.3、本发明制备小麦面筋蛋白水解物的最佳反应条件为:ph 7.0,50℃,2%风味蛋白酶,水解6h,γ-谷氨酰胺转肽的最佳反应条件为:ph 10.0,37℃,酶浓度1.2u/g,转肽反应时间3h。
18.4、本发明发生转肽反应后的样品游离谷氨酰胺和游离氨基的含量都显著下降,说明游离的谷氨酰胺作为供体参与了γ-谷氨酰肽的生成。样品本身具有低苦味、高鲜味,带有一定的咸味,且具有一定浓厚味,将其加入鲜味、咸味的鸡汤模型后,模型的鲜味、咸味都显著提升,鲜味提升21.6%,咸味提升13.8%,具有增咸、提鲜的效果。
19.5、转肽反应后,样品前后的挥发性成分的关键物质发生了改变,醛类物质的含量下降,一些异味物质的含量也下降。转肽反应后生成了更多的2-戊基呋喃,香气发生变化。γ-谷氨酰肽的转肽反应能改善样品的不良气味。
20.6、对转肽反应后的样品进行液相色谱质谱联用分析,鉴定了γ-谷氨酰肽的序列。转肽后发生了γ-谷氨酰转肽反应,生成了具有γ-谷氨酰结构的小分子寡肽,其氨基酸组成主要包括苯丙氨酸、亮氨酸、脯氨酸、酪氨酸、缬氨酸、异亮氨酸、甘氨酸等。
21.本发明的其他优点、目标和特征在某种程度上将在随后的说明书中进行阐述,并且在某种程度上,基于对下文的考察研究对本领域技术人员而言将是显而易见的,或者可以从本发明的实践中得到教导。
附图说明
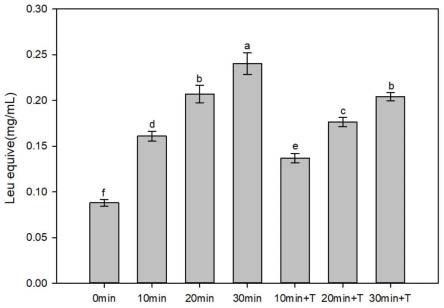
22.图1为γ-谷氨酰肽加入不同鸡汤模型下的味觉强度。
23.图2为挥发性化合物的主成分分析。
24.图3为不同水解反应时间下的水解度。
25.图4为不同水解反应时间下的分子量分布。
26.图5为不同水解反应时间下的游离谷氨酰胺浓度。
27.图6为不同酶浓度下样品液的游离谷氨酰胺浓度。
28.图7为不同酶浓度下样品液的游离氨基浓度。
29.图8为不同时间下样品液的游离谷氨酰胺浓度。
30.图9为不同时间下样品液的游离氨基浓度。
31.图10为小麦面筋蛋白酶解物感官品质评价图(线性标度法)。
32.图11为小麦面筋蛋白酶解物的味觉强度雷达图。
33.图12为不同酶浓度下转肽反应后样品液的感官评分结果。
34.图13为不同反应时间下转肽反应后样品液的感官评分结果。
具体实施方式
35.下面结合附图和实施例对本发明的进行详细的描述,但实施例并不对本发明作任何形式的限定,除非特别说明,本发明所涉及的试剂、方法和设备为本技术领域常规试剂、方法和设备。
36.实施例1:酶解时间对水解度的影响
37.1、实验方法
38.(1)小麦面筋蛋白酶解产物的制备:
39.分别取7份15g的小麦面筋蛋白与去离子水按照1:10的质量比例混合均匀并调节ph至7.0后添加2%的风味蛋白酶在50℃下分别酶解1h、2h、3h、4h、5h、6h和7h,酶解结束后,在沸水浴中灭酶15min,冷却,8000r/min离心15min,分别取上清液即为不同水解时间的小麦面筋蛋白酶解物。
40.(2)水解度的测定
41.opa试剂:准确称取40mg邻苯二甲醛溶解于1ml甲醇中,分别加入20%(w/w)的十二烷基硫酸钠2.5ml,0.1mol/l的四硼酸钠25ml以及100μlβ-巯基乙醇,最后用蒸馏水定容到50ml;
42.测定时,分别取7份2ml opa试剂与100μl不同水解时间的小麦面筋蛋白酶解物样品液(稀释25倍)注入试管中反应2min,在340nm下测定吸光值。利用一系列浓度的亮氨酸标准液测定的吸光值绘制自由氨基浓度标准曲线,再通过计算绘制水解度随酶解时间变化趋势曲线。水解度的计算如下:
[0043][0044]
式中:h为每克蛋白质中部分被水解的肽键数(mmol/g);h
tot
为每克蛋白质中总的肽键数(mmol/g);[nh2]为酶解物中游离氨基浓度(mmol/ml);v1为样品酶解物体积(ml);m1为样品质量(g);
[0045]htot
的测定方法:分别称取0.2g不同水解时间的小麦面筋蛋白酶解物样品于水解管中,分别加入15ml6 mol/l的盐酸溶液,然后将重复抽真空3次封口后水解管放在110℃
±
1℃的电热鼓风恒温箱内水解22h后过滤、洗涤,再将水洗液移入50ml容量瓶中定容后用opa法在340nm下测定其吸光值。再根据标准曲线计算样品中总的游离氨基浓度。
[0046]
(3)分子量分布测定
[0047]
采用排阻色谱柱的hplc系统测定分子量分布。样品制备:分别吸取2ml不同水解时间的小麦面筋蛋白酶解物样品于10ml量瓶中,用流动相稀释至刻度,膜过滤后供进样。
[0048]
测试条件如下:色谱柱为biobasic sec120(7.8
×
300mm,5μm);检测波长:214nm;样品浓度:1mg/ml;柱温:25℃;流动相为乙腈:水:tfa=30:70:0.1(v/v);流速:0.5ml/min;进样量:20μl。分子量校正曲线所用标准品:细胞色素c(12500da)、杆菌酶(1450da)、乙氨酸-乙氨酸-酪氨酸-精氨酸(451da)、乙氨酸-乙氨酸-乙氨酸(189da)。
[0049]
(4)游离态谷氨酰胺含量的测定
[0050]
配制衍生剂:称取25g邻苯二甲醛溶于1ml甲醇溶液中,用0.4mol/l硼酸缓冲溶液(ph=9.5)定容至10ml,再加入10μlβ-巯基乙醇。配制200ml、0.01mol/l硼酸缓冲溶液。
[0051]
衍生:分别取500μl(稀释50倍)不同水解时间的小麦面筋蛋白酶解物样品加入配制好的衍生opa试剂反应70s,再加入500μl磷酸(ph=4.0)缓冲溶液,终止反应。
[0052]
hplc分析:hplc仪,紫外检测器340nm下检测,symmetry反相c18柱(2.1
×
50mm,3.5μm)分离,柱温常温,流速0.8ml/min,进样量10μl。流动相配制:溶剂a:0.01mol/l磷酸缓冲液,ph=6.85,配制:0.2mol/l十二水磷酸氢二钠溶液,0.2mol/l二水磷酸二氢钠;溶剂b:甲醇水溶液。
[0053]
2、实验结果
[0054]
如图3所示,随着反应的进行,水解度在初始阶段(1-3h)增长趋势较快,随后逐渐稳定,在7h时达到最大。但是6h时产物的水解度和7h产物的水解度没有显著性差异,在考虑水解反应的反应程度和节省时间的要求下,选择6h为最佳反应时间,水解度达到18.78%;
[0055]
如图4所示,不同时间下水解后的酶解产物的不同肽段占总肽量的比例各不相同,但是可以通过比较看出,在水解时间不断增加时,分子量小于3kda的的肽段在水解物中的比重不断上升,在6h到7h时增速放缓。因此,反应时间越久,游离的谷氨酰胺、游离氨基酸和小分子肽含量在水解物中含量越多。在6h时,在其中分子量在1-3kda和小于1kda的肽段占总肽段的比例占到了24.95%和56.10%,表面含有较多的谷氨酰胺、游离氨基酸和小分子肽;
[0056]
如图5所示,随着反应的进行,游离谷氨酰胺的浓度在0.5-1h上升速度较快,随后2-5h增速平缓,在5-6h时增速最快,游离谷氨酰胺浓度也达到了最大(p《0.05),达到了25μg/ml,6-7h后谷氨酰胺浓度变低。为了后续转肽反应创造良好的条件,使体系中含有较多的谷氨酰胺和游离的氨基酸、小分子多肽,选择6h为最佳水解时间。
[0057]
实施2:酶浓度对浓厚感肽产率的影响
[0058]
1、实验材料
[0059]
实施例1中水解6h时的小麦面筋蛋白酶解物。
[0060]
2、实验方法
[0061]
(1)浓厚感肽的制备:分别取6份200ml小麦面筋蛋白酶解物,分别调节ph值至10.0,再分别加入酶浓度为0u/g、0.4u/g、0.8u/g、1.2u/g、1.6u/g和2.0u/g的γ-谷氨酰转肽酶,以此为反应起点,在37℃恒温下反应3h。反应结束后在沸水浴中灭酶15min,分别得到不同酶浓度下的γ-谷氨酰肽,即为不同酶浓度下的浓厚感肽。
[0062]
(2)游离氨基含量的测定
[0063]
现用现配opa试剂:准确称取40mg邻苯二甲醛溶解于1ml甲醇中,分别加入20%(w/w)的十二烷基硫酸钠2.5ml,0.1mol/l的四硼酸钠25ml以及100μlβ-巯基乙醇,最后用蒸馏水定容到50ml;
[0064]
测定时,分别取7份2ml opa与100μl不同酶浓度的γ-谷氨酰肽样品液(稀释25倍)注入试管中反应2min,在340nm下测定吸光值。利用一系列浓度的亮氨酸标准液测定的吸光值绘制自由氨基浓度标准曲线,再通过计算绘制水解度随酶解时间变化趋势曲线;
[0065]
(3)游离态谷氨酰胺含量的测定
[0066]
配制衍生剂:称取25g邻苯二甲醛溶于1ml甲醇溶液中,用0.4mol/l硼酸缓冲溶液(ph=9.5)定容至10ml,再加入10μlβ-巯基乙醇。配制200ml 0.01mol/l硼酸缓冲溶液。
[0067]
衍生:分别取500μl(稀释50倍)不同酶浓度的γ-谷氨酰肽样品加入配制好的衍生opa试剂反应70s,再加入500μl磷酸(ph=4.0)缓冲溶液,终止反应。
[0068]
hplc分析:hplc仪,紫外检测器340nm下检测,symmetry反相c18柱(2.1
×
50mm,3.5μm)分离,柱温常温,流速0.8ml/min,进样量10μl。流动相配制:溶剂a:0.01mol/l磷酸缓冲液,ph=6.85,配制:0.2mol/l十二水磷酸氢二钠溶液,0.2mol/l二水磷酸二氢钠;溶剂b:甲醇水溶液。
[0069]
(4)根据步骤(2)和(3)中得到的游离氨基含量和hplc分析谷氨酰胺含量。得到反应前游离谷氨酰胺的含量,以及水解、转肽后的谷氨酰胺含量,两者差值就为γ-谷氨酰肽的产量。按照以下公式计算反应的产率:
[0070][0071]
3、实验结果
[0072]
在研究γ-谷氨酰肽的酶法合成时,前期研究证明γ-谷氨酰胺转肽酶的转肽反应最适ph为10.0,温度为37℃,因此,在此条件下,继续优化实验,如图6所示,随着酶浓度的增加,游离谷氨酰胺浓度在逐渐下降,当酶浓度到达1.2u/g时,游离谷氨酰胺浓度达到最小(p《0.05),为17.75μg/ml,之后游离谷氨酰胺浓度开始上升,酶反应发生了抑制,后续虽然有降趋势,但没有达到1.2u/g的程度;
[0073]
游离氨基浓度也随着酶浓度的增加发生了变化,如图7所示,酶浓度在逐渐增大,游离氨基含量在逐渐降低,在浓度为0.8u/g到1.2u/g之间下降最快,游离氨基浓度在1.2u/g时达到最小(0.27mol/l),随着酶浓度继续增大,游离氨基浓度开始上升,增速较快。因此,在酶浓度为1.2u/g的条件下,谷氨酰胺浓度和游离氨基浓度都达到最低(p《0.05),反应的最佳酶浓度条件为1.2u/g,此时体系中γ-谷氨酰肽的产率最大。通过计算得在反应3h,ph 10.0,37℃,最佳酶浓度1.2u/g下的产率为29%。
[0074]
实施例3:反应时间对γ-谷氨酰胺转肽酶反应的影响
[0075]
1、实验材料
[0076]
实施例1中水解6h时的小麦面筋蛋白酶解物。
[0077]
2、实验方法
[0078]
(1)浓厚感肽的制备:分别取6份200ml小麦面筋蛋白酶解物,分别调节ph值至10.0,再分别酶浓度为1.2u/g的γ-谷氨酰转肽酶,以此为反应起点,在37℃恒温下分别反应1h、2h、3h、4h、5h和6h。反应结束后在沸水浴中灭酶15min,分别得到不同反应时间的γ-谷氨酰肽,即为不同反应时间的浓厚感肽。
[0079]
(2)游离氨基含量的测定
[0080]
现用现配opa试剂:准确称取40mg邻苯二甲醛溶解于1ml甲醇中,分别加入20%(w/
w)的十二烷基硫酸钠2.5ml,0.1mol/l的四硼酸钠25ml以及100μlβ-巯基乙醇,最后用蒸馏水定容到50ml;
[0081]
测定时,分别取7份2ml opa与100μl不同反应时间的γ-谷氨酰肽样品液(稀释25倍)注入试管中反应2min,在340nm下测定吸光值。利用一系列浓度的亮氨酸标准液测定的吸光值绘制自由氨基浓度标准曲线,再通过计算绘制水解度随酶解时间变化趋势曲线;
[0082]
(3)游离态谷氨酰胺含量的测定
[0083]
配制衍生剂:称取25g邻苯二甲醛溶于1ml甲醇溶液中,用0.4mol/l硼酸缓冲溶液(ph=9.5)定容至10ml,再加入10μlβ-巯基乙醇。配制200ml 0.01mol/l硼酸缓冲溶液。
[0084]
衍生:分别取500μl(稀释50倍)不同反应时间的γ-谷氨酰肽样品加入配制好的衍生opa试剂反应70s,再加入500μl磷酸(ph=4.0)缓冲溶液,终止反应。
[0085]
hplc分析:hplc仪,紫外检测器340nm下检测,symmetry反相c18柱(2.1
×
50mm,3.5μm)分离,柱温常温,流速0.8ml/min,进样量10μl。流动相配制:溶剂a:0.01mol/l磷酸缓冲液,ph=6.85,配制:0.2mol/l十二水磷酸氢二钠溶液,0.2mol/l二水磷酸二氢钠;溶剂b:甲醇水溶液。
[0086]
3、实验结果
[0087]
在最适温度和ph值条件下,研究不同时间对γ-谷氨酰转肽反应产率的影响,酶浓度选择1.2u/g,测定谷氨酰胺浓度和游离氨基浓度的变化。如图8所示,随着反应的继续,谷氨酰胺浓度先渐渐上升后再下降,在3h达到最低,达到19.1mol/l。之后增加反应时间,谷氨酰胺浓度不再下降。在图9中,转肽反应3h时,游离氨基浓度同样达到最低(p《0.05),为0.23mol/l。当反应时间达到3h时,游离谷氨酰胺浓度和游离氨基浓度都达到最低,说明在反应中,消耗了较多的供体游离的谷氨酰胺,产生了γ-谷氨酰肽。因此,反应的最佳时间条件为3h。
[0088]
实施例4:小麦面筋蛋白的基本成分和氨基酸组成分析测定
[0089]
1、实验方法
[0090]
参照gb5009.5-2016,测定蛋白质含量,称取0.3g小麦面筋蛋白试样、0.4g硫酸铜固体和6.0g硫酸钾固体及量取20.0ml硫酸溶液于消化管中,再放至消化炉中消化;消化完毕后,取出冷却,加入50.0ml水,于自动凯氏定氮仪上实现加液、蒸馏和滴定,记录数据。试样中蛋白质的含量按式计算:
[0091][0092]
式中:v1为滴定时试样消耗硫酸标准液的体积,单位ml;v2为滴定时空白试剂消耗硫酸标准液的体积,单位ml;c为0.1mol/l;m为试样的质量,单位g;v为吸取消化液的体积,单位ml;f取5.7;
[0093]
参照gb 5009.4-2016,进行灰分的测定,称取2g烘干后的小麦面筋蛋白试样,放置在马弗炉中,在550℃
±
25℃下高温灼烧至灰色粉末。冷却至200℃时取出,冷却后称量。试样中灰分的含量按式计算:
[0094][0095]
式中:m1为坩埚和灰分的质量,单位为g;m2为坩埚的质量,单位为g;m3为坩埚和试
样的质量,单位为g;
[0096]
参照gb 5009.6-2016,使用索氏抽提法进行脂肪测定,称取混匀后的小麦面筋蛋白试样3份,每份2g(精确至0.001g),全部移入滤纸筒内。105℃下烘干4h,将滤纸筒放入全自动脂肪仪内进行抽提,完毕后取下接收瓶,回收石油醚,再在烘箱中干燥1h,冷却后称量。重复以上操作直至恒重(两次称量差不超过2mg)。试样中脂肪的含量按式计算:
[0097][0098]
式中:m1为恒重后接收瓶和脂肪的含量,单位为g;m0为接收瓶的质量,单位为g;m2为试样的质量,单位为g;
[0099]
使用苯酚-硫酸法测定总糖。制作标准曲线:分别吸取0、0.2、0.4、0.6、0.8、1.0ml的葡萄糖标准溶液至试管中,用蒸馏水添加至1.0ml。再加入1.0ml 5%苯酚溶液和5.0ml浓硫酸(p=1.84g/ml)反应10min,摇匀后再置于30℃水浴锅中反应20min。然后于490nm处测吸光度。以葡萄糖质量浓度为横坐标,吸光度值为纵坐标,制定标准曲线。制样:按照gb/t 5009.3规定方法测定含水量;然后称取0.25g(精确至0.001g)过筛后的试样和量取50ml水和15ml浓盐酸(p=1.18g/ml),倒入锥形瓶中,装上冷凝回流装置,置100℃水浴中水解3h。冷却至室温后过滤,洗涤滤渣,合并滤液及洗液,用水定容至250ml,此溶液为试样测试液。准确吸取试样测试液0.2ml于10ml试管中,用蒸馏水补至1.0ml,以空白溶液调零,测得吸光度,以标准曲线计算总糖含量。结果计算(总糖含量以质量分数ω计,数值以百分率表示):
[0100][0101]
式中:v1为样品定容体积,单位为ml;v2为比色测定时所移取样品测定液的体积,单位为ml;m1为样品测定液中的含糖量,单位为μg;m2为样品质量,单位为克g;ω为样品含水量;
[0102]
采用全自动氨基酸分析仪来测定,准确称取0.2g小麦面筋蛋白样品,和1.5ml 6mo1/l的盐酸溶液一起放于水解管中,将水解管放入冷冻剂中3-5min,抽真空,充高纯氮气三次,封管后将样品放于恒温干燥箱内水解22h,再过滤、干燥,最后用1ml,ph=2.2的盐酸缓冲液溶解,测定样品的氨基酸组成。
[0103]
2、实验结果
[0104]
表1小麦面筋蛋白的基本成分
nacl进行咸味辨认及排序;对3mmol/l、2mmol/l、1mmol/l咖啡因进行苦味辨认及排序;对30mmol/l、20mmol/l、10mmol/l谷氨酸钠进行鲜味辨认及排序。
[0118]
数据分析:依次取准确度高的五名男生和五名女生组成感官评鉴小组。
[0119]
②
感官鉴评小组的培训:
[0120]
感官鉴评小组成员5男5女。每天进行时间大于1h的感官鉴评训练,为期两个月。在配制好的鲜味模型(10mmol/l谷氨酸钠 20mmol/l nacl)中添加5mmol/l的谷胱甘肽来训练浓厚感滋味的鲜味提升作用;在配制好的空白鸡汤溶液(10mmol/l nacl 450g鸡汤)中添加5mmol/l的谷胱甘肽来训练浓厚感滋味的复杂口感作用。训练环境在25~30℃,所有训练分3个部分。鼻夹用于整个感官实验过程以防止潜在的滋味与气味间的相互作用。每次实验感官员将大约10ml样品置于口中,与口腔充分接触10s后吐出,每个部分间隔5min用清水漱口。记录各个样品的基本味觉评分。
[0121]
(2)滋味轮廓分析
[0122]
采用qda法对各组小麦面筋蛋白酶解物存在的呈味特性进行感官定量描述分析。具体做法如下:
[0123]
建立评分标准:以柠檬酸(50mmol/l)、蔗糖(50mmol/l)、咖啡因(1mmol/l)、氯化钠(25mmol/l)、谷氨酸钠(3mmol/l)为酸味、甜味、苦味、咸味、鲜味的评价标准品。采用15cm线性标度法,0分表示被检测样品没有味道,标准品呈味得分设置为7.5分,以柠檬酸(100mmol/l)、蔗糖(100mmol/l)、咖啡因(2mmol/l)、氯化钠(50mmol/l)、谷氨酸钠(6mmol/l)设置为15分,如图10所示。
[0124]
定量描述分析方法:取制备好的小麦面筋蛋白酶解物1ml,将小麦面筋蛋白酶解物用纯净水稀释到1%,然后感官评定小组开始对小麦面筋蛋白酶解物的感官特性指标酸、甜、苦、咸、鲜味逐一进行打分,所有评分结束后,收集10位评价员的评价表,进行汇总计算分析。
[0125]
建立评分标尺:实验采用线性标度为评分标尺,即在一条15cm线段上面标记出能代表某感官性质强度或数量的位置,线段最左端代表“没有”或者“0”,最右端代表“最强”。用直尺把每种强度转化成相应的数值,然后进行分析。分别对小麦面筋蛋白的感官特性酸、甜、苦、咸、鲜味进行评价。
[0126]
(3)转肽产物的浓厚感呈味特性
[0127]
①
转肽反应后的小麦面筋蛋白酶解物基本味觉感官评价:选用转肽反应后的小麦面筋蛋白酶解物母液1ml,用空白。稀释到1%,让感官评价人员品尝配好的溶液,通过qda法和15cm线性标度法对呈味特性进行感官评价。每次实验感官员将大约10ml样品置于口中,与口腔充分接触10s后吐出,品尝样品前使用超纯水充分漱口并至少休息30s。评价指标包括酸味、甜味、苦味、咸味、鲜味。
[0128]
①
不同反应下转肽后的小麦面筋蛋白酶解物对浓厚感的影响:分别取不同反应时间和酶浓度的转肽反应后的小麦面筋蛋白酶解物,让感官评价人员分别品尝溶液,分别采用1.0g/l,1.5g/l和2.0g/l的谷胱甘肽的鸡汤溶液作为浓厚感的5分、10分和15分强度的参比样品,通过15cm线性标度法对浓厚味特性进行感官评价。
[0129]
③
氯化钠、谷氨酸钠协同效果:
[0130]
建立模型溶液:
[0131]
空白鸡汤模型溶液:450g鸡胸肉用6l水煮沸3h,然后用滤纸过滤200ml,将样品的ph调至7.0。
[0132]
咸味鸡汤模型:200ml空白鸡汤加入1.6g/l nacl模型溶液;
[0133]
鲜味鸡汤模型:空白鸡汤加入0.80g/l谷氨酸钠模型溶液;
[0134]
混合鸡汤模型:空白鸡汤 1.6g/l nacl 0.80g/l谷氨酸钠模型溶液。
[0135]
建立评价标准:
[0136]
将筛选出的转肽后的小麦面筋蛋白酶解物,分别加入200ml空白鸡汤模型溶液、咸味鸡汤模型溶液、鲜味鸡汤模型溶液、混合鸡汤模型溶液中。以空白鸡汤作为空白对照,咸味鸡汤模型中加入0.8g/l、1.6g/l和2.5g/l的nacl作为咸味强度5、10、15分的强度参考;鲜味鸡汤模型中加入的0.40g/l、0.80g/l和1.20g/l谷氨酸钠作为鲜味强度5、10、15分的强度参考,分别对鲜味模型、咸味模型和混合模型加入转肽后的小麦面筋蛋白酶解物,通过15cm线性标度法进行感官评价。感官评定小组对模型溶液的咸、鲜味指标逐一进行定量描述分析打分,所有评分结束后,收集所有评价员的评价表,进行汇总计算分析。
[0137]
(4)气相色谱-质谱联用分析
[0138]
gc条件:采用db-5ms(30m
×
0.25mm,0.25μm)色谱柱。升温程序:初始温度40℃保持2min,以5℃/min升温至70℃,3℃/min升温至120℃,5℃/min升温至150℃,2℃/min升温至165℃,15℃/min升温至210℃,10℃/min升温至250℃保持5min,进样口温度250℃。载气(he)总流量50ml/min。
[0139]
ms条件:离子源温度:250℃;接口温度:250℃;溶剂延迟:2min;质量扫描范围:35-500m/z。采集方式为全扫描,所得数据由nist08标准质谱图数据库检索鉴定,取相似度高于90%进行定性鉴定,利用峰面积归一化法对各成分进行定量分析。
[0140]
(5)液相色谱-质谱联用分析
[0141]
各取转肽前样品和转肽后样品150μg,0.1%fa/h2o彻底复溶,10k超滤后使用c18脱盐柱对样本进行脱盐:样品过10k超滤膜收集滤液后使用c18脱盐柱进行脱盐;加入200μl甲醇对c18脱盐柱进行活化;加入200μl 0.1%tfa/ddh2o进行色谱柱平衡;然后上样;使用200μl 0.1%tfa/ddh2o进行清洗;加入200μl 80%acn/0.1%tfa进行洗脱;收集洗脱液,冻干备用。
[0142]
高效液相色谱仪:easy nlc1200,色谱柱:c18,3μm,75μm
×
15cm,流动相:溶剂a:0.1%formic acid in water;溶剂b:0.1%formicacid in 80%acetonitrile/h 2
o。
[0143]
液质联用仪:thermo scientific orbitrapfusion lumos;ms1 agc:4e5,离子注入时间:50ms;喷雾电压:2.0kv;毛细管温度:320℃;ms2 agc:1e5,离子注入时间:50ms;分辨率设置:一级120,000@m/z 200,离子筛选窗口:1.6m/z;二级30,000@m/z 200,碎裂模式:hcd,能量nce 35,母离子扫描范围:m/z 350-1550;data
–
dependent ms/ms:top 20;子离扫描范围:start from m/z 50;动态排除时间:60s。
[0144]
2、实验结果
[0145]
表3γ-谷氨酰转肽反应前后样品的gc/ms分析
[0146]
[0147]
[0148][0149]
表4γ-谷氨酰转肽反应后的样品的lc-ms/ms分析
[0150][0151][0152]
如图11所示,使用滋味轮廓分析和定量描述分析对转肽后的蛋白酶解物的进行基本五味的味觉强度评分,其中表现出强度较高的是苦味、鲜味,强度值为3、2.4,带有少量的咸味,强度值为1,以及非常微弱的甜、酸味,强度值分别为0.4和0.7;
[0153]
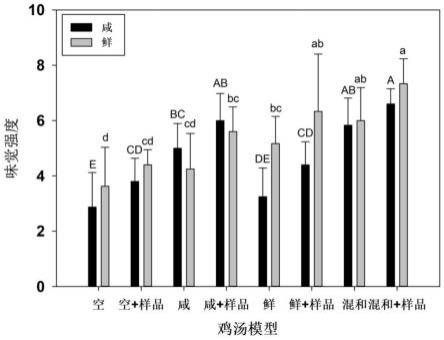
在进行转肽反应条件优化时,对不同反应条件下的转肽后样品液进行鲜味、咸味、浓厚味味觉强度的味觉感官分析,如图12所示,在优化酶浓度条件的实验中,选择1.2u/g作为最佳反应条件,反应消耗最多谷氨酰胺和游离氨基酸,且此时样品的咸味最强(2.1),鲜味和浓厚味也较高;如图13所示,在优化时间条件的实验中,3h是反应的最佳时间,样品中剩余谷氨酰胺和游离氨基酸最少,反应最完全,此时样品的咸味最强(3.7),鲜味和浓厚味的味觉强度也较强;
[0154]
如图1所示,在咸味模型中添加转肽后的样品前后,咸味的味觉强度增强20%,存在显著性差异(p《0.05),明显增强了样品的咸味,浓厚感肽的添加对鲜味物质强度的影响在图1中,在鲜味模型中添加转肽后的样品前后,鲜味的味觉强度增强23.5%,存在显著性差异,明显增强了样品的鲜味。上述结论可得,在空白样品对照下,在咸味模型中加入转肽后的样品液,对模型溶液的咸味有显著增强的效果,而在鲜味模型中加入转肽后的样品液,鲜味模型的鲜味也有一定的加强。在混合样品中,既存在鲜味又存在咸味,添加转肽后的样品,咸味和鲜味都有一定程度的增强,鲜味的味觉强度有21.6%的增大,咸味的味觉强度有13.8%的增加,存在一定的差异,提高了样品的鲜、咸味。因此,γ-谷氨酰肽具有增咸、提鲜的作用;
[0155]
如图2所示,“转肽前”为发生转肽反应前的样品挥发性成分,“转肽后”为发生转肽反应后的样品挥发性成分,它们落在不同的区域,表示样品反应前后样品挥发性成分的含量差异较大。由表3可知,共鉴定出46种成分,其中醛酮类19种、醇类6种、酯类5种、酸类2种、烃类13种、其他1种。在发生转肽反应前,气味活性较强的正己醛、苯乙醛与样品落在同一区域,具有相关性,说明这两种关键物质在水解反应发生过程中最大程度产生,相对含量为25.87%和14.48%,发生转肽反应后,2-戊基呋喃和苯甲醛与样品相近,说明它们具有相关性,转肽反应后的样品的风味贡献度较大,相对含量为16.06%和36.61%;反应前后样品的挥发性成分发生了很大变化,醛类的含量下降,一些异味物质的含量也大大下降,样品的气味得到了改善;
[0156]
由表4可知,转肽反应前后生成了新的肽类物质,肽的数量、种类都有增加,主要生成有肽段长度8到15的小分子肽,都是一些含有γ-谷氨酰键的寡肽,且含有苯丙氨酸、亮氨酸、脯氨酸、酪氨酸、缬氨酸、异亮氨酸、甘氨酸等受体氨基酸。在γ-谷氨酰转肽反应中,γ-谷氨酰胺残基通过和这些游离氨基酸结合,生成带有以上氨基酸的γ-谷氨酰肽。反应后产生的浓厚味与生成的这些呈味肽有很大联系。
[0157]
最后说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行同等替换。凡在本发明的精神和原则之内,所作的任何修改、同等替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。