1.本发明属于食品加工技术领域,具体涉及一种基于限制性酶解耦合糖基化反应的蚕蛹蛋白修饰方法。
背景技术:
2.随着人口的增长,如何有效利用现有的蛋白质资源,开发新的蛋白质资源市场,是解决蛋白质资源匮乏的有效途径。除了传统的蛋白质来源,已有新的蛋白质来源被提出作为动物源性蛋白进入食品市场,如昆虫、藻类等。蚕蛹是卫生部批准的“普通食品管理的食品新资源名单”中唯一的昆虫食品,是营养食品和功能食品的优良添加剂,蚕蛹中含有丰富的氨基酸、脂肪酸、矿物质和维生素等营养成分,蚕蛹含有人体所需的所有氨基酸,蚕蛹的氨基酸评分和蛋白质消化率校正后的氨基酸评分分别为100和86,是一种完全蛋白质,一般来说,昆虫蛋白质是高度可消化的,因此,家蚕作为我国桑蚕产业的大宗副产物,资源丰富,蛋白质含量高,必需氨基酸比例合理,生物活性丰富多样,是一种优质的食品蛋白新资源,可以作为人类营养的替代蛋白质来源。
3.从蚕蛹中提取蛋白质或其他生物活性化合物,可以提高消费者的接受度。但是,蚕蛹蛋白在提取过程中会产生一种腥臭味,限制了它在食品当中的应用,同时,对包括蚕蛹在内的新蛋白质来源而言,主要瓶颈问题在于它们可能导致食物过敏。因此,要充分地开发和利用蚕蛹蛋白资源,同时考虑到食品安全性,必须在评估和解决蚕蛹蛋白的致敏性问题的同时掩盖它本身的腥臭味。近年来,在食品技术加工过程中,针对降低食品过敏原的研究越来越细致广泛。然而,在蚕蛹蛋白中至今只有27kda的血淋巴糖蛋白被确定为蚕蛹的热稳定过敏原。在食品加工中,只有水解和发酵能够将食物致敏性降低到不会引起症状的程度。
4.生物酶法是最常见的改善蛋白致敏性的方法,生物酶法可水解蚕蛹蛋白,改变其致敏原致敏表位,进而有效降低其致敏性。蚕蛹蛋白经适度酶解后各功能性质有显著改善,继续增加水解度,起泡性等功能性质反而下降,而限制性水解对蛋白致敏性的降低效果有限。因此,引入美拉德反应进一步修饰蚕蛹蛋白。糖基化作为化学改性的重要手段之一,可以使致敏原中的氨基酸残基被还原糖修饰,改变蚕蛹蛋白致敏原致敏表位。此外,美拉德反应能有效形成风味物质,从而掩盖蚕蛹蛋白腥臭味。
5.综上,提出在充分地开发和利用蚕蛹蛋白资源的同时考虑到食品安全性、掩盖它本身的腥臭味的研究方案。
技术实现要素:
6.针对上述的问题,本发明提供一种基于限制性酶解耦合糖基化反应的蚕蛹蛋白修饰方法,其既可以为降低蚕蛹蛋白致敏性提供新思路,又可以为未来蚕蛹蛋白资源高值化利用提供理论依据,具有潜在的应用价值。
7.为实现上述目的,本发明采取以下技术方案:
8.一种基于限制性酶解耦合糖基化反应的蚕蛹蛋白修饰方法,包含以下步骤:
9.(1)蚕蛹蛋白的提取:取100g粗蚕蛹粉加入1l质量分数为0.3%的氢氧化钠溶液,得到混合液ⅰ,将得到的混合液ⅰ在功率为400w的条件下超声处理15min,再用300目网筛过滤,得到碱提蚕蛹蛋白混合液,调节碱提蚕蛹蛋白混合液ph值至4.5,在4℃环境下静置2h后,室温下以4000r/min的转速离心15min分离液体和沉淀,沉淀冷冻干燥后制得碱法提取的蚕蛹蛋白质;
10.(2)蚕蛹蛋白的限制性酶解:取5.00g步骤(1)中碱法提取的蚕蛹蛋白质加入100ml超纯水混合均匀后调整ph值至8.0,得到混合液ⅱ,将混合液ⅱ中加入50μl碱性蛋白酶,在水浴温度为55℃的条件下水解10-30min,水解结束后得到混合液ⅲ;
11.(3)限制性酶解耦合糖基化反应改性修饰蚕蛹蛋白:在步骤(2)中得到的混合液ⅲ中加入1g木糖,然后在沸水浴中进行灭酶处理同时使蛋白诱导美拉德反应,反应1h后迅速冷却,得到改性修饰的蚕蛹蛋白。
12.进一步地,所述的修饰方法得到的蚕蛹蛋白在制备食品蛋白原料中的应用。
13.采用以上方案,本发明具有如下优点:
14.1、本发明先提出“限制性酶解耦合糖基化反应修饰蚕蛹蛋白”的科学假设,然后采用碱法提取蚕蛹蛋白,通过限制性酶解耦合糖基化修饰后,评价修饰蛋白的结构特征与功能性质,在此基础上进一步评估其致敏性和挥发性成分。因此,本研究既可以为降低蚕蛹蛋白致敏性提供新思路,又可以为未来蚕蛹蛋白资源高值化利用提供理论依据,具有潜在的应用价值。
15.2、本发明采用限制性酶解耦合糖基化反应对蚕蛹蛋白进行改性修饰后,通过测定修饰后蚕蛹蛋白的结构特征、蛋白质功能性质、致敏性以及挥发性成分,本发明修饰后的蚕蛹蛋白改善了气味、过敏源种类减少,致敏性降低,本发明既可以为未来食品工业中应用修饰蚕蛹蛋白作为食品原料提供理论依据,同时也又可以为蚕桑资源的综合利用提供新的思路。
16.3、本发明为蚕蛹的加工及综合利用提供了一种新的途径,提高蚕蛹的附加值,对于拓宽蚕桑资源的多元化利用具有重要的意义。
17.本发明的其他优点、目标和特征在某种程度上将在随后的说明书中进行阐述,并且在某种程度上,基于对下文的考察研究对本领域技术人员而言将是显而易见的,或者可以从本发明的实践中得到教导。
附图说明
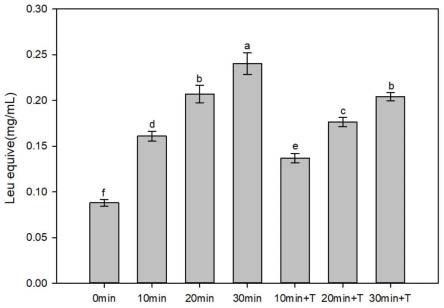
18.图1为不同蚕蛹蛋白样品的游离氨基的浓度。
19.图2为不同水解时间的糖基化蚕蛹蛋白紫外吸收光谱。
20.图3为不同水解时间的糖基化蚕蛹蛋白荧光光谱图。
21.图4为不同水解时间的糖基化蚕蛹蛋白红外光谱图。
22.图5为sds-page电泳图。
23.图6为不同水解时间的蚕蛹蛋白糖基化反应前后的分子量分布。
24.图7为依据pca分析修饰前后蚕蛹蛋白挥发性成分。
25.图8为不同水解时间的蚕蛹蛋白糖基化反应后的溶解度。
26.图9为不同水解时间的蚕蛹蛋白糖基化反应后乳化性。
27.图10为不同水解时间的蚕蛹蛋白糖基化反应后起泡性和起泡稳定性。
28.图11为不同水解时间的蚕蛹蛋白糖基化反应后的消化率。
具体实施方式
29.下面结合附图和实施例对本发明的进行详细的描述,但实施例并不对本发明作任何形式的限定,除非特别说明,本发明所涉及的试剂、方法和设备为本技术领域常规试剂、方法和设备。
30.实施例1:基于限制性酶解耦合糖基化反应修饰的蚕蛹蛋白
31.包含以下步骤:
32.(1)蚕蛹蛋白的提取:取100g粗蚕蛹粉加入1l质量分数为0.3%的氢氧化钠溶液,得到混合液ⅰ,将得到的混合液ⅰ在功率为400w的条件下超声处理15min,再用300目网筛过滤,得到碱提蚕蛹蛋白混合液,调节碱提蚕蛹蛋白混合液ph值至4.5,在4℃环境下静置2h后,室温下以4000r/min的转速离心15min分离液体和沉淀,沉淀冷冻干燥后制得碱法提取的蚕蛹蛋白(作为对照组的0min样品);
33.(2)蚕蛹蛋白的限制性酶解:分别取3份5.00g步骤(1)中碱法提取的蚕蛹蛋白加入100ml超纯水混合均匀后调整ph值至8.0,得到3份混合液ⅱ,分别将3份混合液ⅱ中加入50μl碱性蛋白酶,在水浴温度为55℃的条件下分别水解10,20,30min,水解结束后得到3份不同水解时间的混合液ⅲ,即分别为水解10min的蚕蛹蛋白(10min样品)、水解20min的蚕蛹蛋白(20min样品)、水解30min的蚕蛹蛋白(30min样品);
34.(3)限制性酶解耦合糖基化反应改性修饰蚕蛹蛋白:在步骤(2)中得到的3份不同水解时间的混合液ⅲ中分别加入1g木糖,然后在沸水浴中进行灭酶处理同时使蛋白诱导美拉德反应,反应1h后迅速冷却,得到3份改性修饰的蚕蛹蛋白,即分别为水解10min美拉德反应1h的蚕蛹蛋白(10min t样品)、水解20min美拉德反应1h的蚕蛹蛋白(20min t样品)、水解30min美拉德反应1h的蚕蛹蛋白(30min t样品)。
35.实施例2:修饰后蚕蛹蛋白结构与性质分析测定
36.1、实验材料
37.待测蛋白:实施例1中所制得的0min样品、10min样品、20min样品、30min样品、10min t样品、20min t样品、30min t样品。
38.2、实验方法
39.1)氨基酸组成分析
40.准确称取10mg、0min样品于小玻璃瓶中,加入1ml浓盐酸(6mol/l)溶解,放在烘箱中,温度设定为110℃,放置24h。反应后调节溶液ph值(ph=7),用10ml容量瓶定容,按照gb5009.124—2016方法测量蛋白质氨基酸含量,使用氨基酸自动分析仪进行氨基酸组成分析,做3个平行组;
41.2)游离氨基分析
42.配制opa混合液(20ml):硼酸(15ml):0.392g/50ml水溶液;sds(1ml):0.5g/2.5ml水溶液;opa(2ml):0.0335g/5ml甲醇溶液;nacys(2ml):0.0408g/5ml水溶液,将配制好的opa混合液放在磁力搅拌上搅拌,玻璃瓶外包上锡纸注意避光,反应1小时。将各待测蛋白质分别与纯水按1:5(w/w)稀释,取各待测蛋白样品溶液10μl于离心管,每隔1min加入opa试剂
(1.2ml),振荡摇匀,在340nm处测定吸光度。每种样品做3个平行组。每个样品中加入1.2ml的opa溶液,测量340nm处的吸光度;
43.标准曲线:取适量蛋白质溶于纯水,得到蚕蛹蛋白样品溶液。取10μl蚕蛹蛋白样品溶液加入1.2ml的opa试剂,混匀后于室温下避光2min,在340nm处测定其吸光值。以亮氨酸作标准曲线,根据标准曲线计算游离氨基的含量,得到回归方程:y=0.433x 0.0513,r2=0.9992;
44.3)紫外光谱分析
45.以5mg/ml、0min样品溶液为原料,采用紫外分光光度计进行200~600nm波长扫描,以去离子水为参比溶液,绘制了酶法耦合糖基化反应后蚕蛹蛋白的全波长扫描曲线。对修饰后蚕蛹蛋白10min t样品、20min t样品、30min t样品的反应程度进行了分析;
46.4)荧光光谱分析
47.分别制备5mg/ml修饰后蚕蛹蛋白10min t样品、20min t样品、30min t样品溶液。用荧光分光光度计在激发波长347nm、发射波长400-600nm范围内观察荧光吸收情况;
48.5)红外光谱分析
49.将修饰后的蚕蛹蛋白10min t样品、20min t样品、30min t样品去水,取2mg样品并加入适量溴化钾粉置于研钵中,在红外灯照射下混合均匀,放入压片模具中制成样品薄片,在400-4000cm-1
下测定其透过率。
50.6)蛋白质电泳分析
51.制备由12%分离凝胶和5%浓缩胶构成的聚丙烯酰胺凝胶。配制蛋白浓度为50mg/ml的蛋白溶液(0min样品、10min t样品、20min t样品、30min t样品),将蛋白溶液与上样缓冲液充分混合后沸水浴,得到电泳样液,样品上样量为10μl。用考马斯亮蓝染色液对凝胶进行染色,并用甲醇和乙酸混合溶液进行脱色。
52.7)分子排阻色谱分析
53.使用分子排阻色谱法测定蚕蛹蛋白0min样品、10min t样品、20min t样品、30min t样品的分子量分布。色谱条件:biobasic sec 120 300
×
7.8mm,5μm液相色谱柱;流动相:30%乙腈(含0.1%三氟乙酸,v/v);流速:0.5ml/min;温度:25℃;进样量:20μl;检测波长:214nm。
54.8)lc-ms/ms分析
55.液相色谱仪:easy-nlc 1200系统;色谱柱:c18色谱柱(3μm,75μm
×
15cm);流动相a:0.1%甲酸的超纯水;流动相b:80%的乙腈水溶液。0min样品、10min t样品、20min t样品、30min t样品进样量为5μl,流速为0.3ml/min。质谱数据使用orbitrap fusion lumos在高能离解(hcd)状态下进行检测。具体参数如下:喷雾电压:2.0kv;毛细管温度:320℃;分辨率设置:一级120000(m/z 200),二级30000(m/z 200);离子扫描范围:350~1550m/z;ms1自动增益控制(agc):4e5。
56.质谱数据:采用silkdb数据库。搜库参数如下:可变修饰选择氧化(m)和乙酰化(n-term),酶切位点选择胰蛋白酶。式中:ibaq为蚕蛹蛋白过敏原丰度值;ibaq0为总蛋白丰度。
[0057][0058]
9)gc-ms/ms分析
[0059]
使用固相微萃取系统吸附取样,然后用gc-ms对0min样品、10min t样品、20min t样品、30min t样品水解物中挥发性化合物进行分析。
[0060]
3、实验结果
[0061]
1)氨基酸组成分析
[0062]
表1提取的蚕蛹蛋白氨基酸组成
[0063][0064]
由表1可知,人体不能合成的必须氨基酸在碱法提取的蚕蛹蛋白中含量较高,为40.98%,与非必须氨基酸质量的比值为0.69。碱法提取的蚕蛹蛋白的氨基酸组成与who/fao提出的参考蛋白模式非常接近(必需氨基酸占比40%,其与非必须氨基酸的质量比约为0.6)。
[0065]
2)游离氨基分析
[0066]
如图1所示,与对照组(0min样品)相比,游离氨基酸的浓度随水解时间的增大(30min》20min》10min),其中对照组的leu当量值最低,为0.088mg/ml,30min样品的leu当量值最高,为0.23mg/ml。糖基化反应耦合酶法修饰的蚕蛹蛋白游离氨基酸的浓度低于仅用酶法修饰酶解时间相同的蚕蛹蛋白,但仍大于对照组。其中10min t相比于10min游离氨基显著浓度降低12.8%(p《0.05);20min t相比于20min氨基浓度显著降低14.8%(p《0.05);30min t相比于30min游离氨基浓度显著降低12.1%(p《0.05),经碱性蛋白酶酶解处理后,大分子蛋白质被碱性蛋白酶分解为低分子量的肽,游离氨基酸当量浓度有明显提高。经糖基化处理后蚕蛹蛋白水解物游离氨基酸当量浓度下降,证明样品发生了美拉德反应。
[0067]
3)紫外光谱分析
[0068]
如图2所示,蚕蛹蛋白在200-300nm范围中有较多吸收峰,214nm左右为肽键的强吸收峰,通常与多肽中的羰基、羧基以及肽键(酰胺键)等相关,水解和糖基化反应可能导致原有吸收峰的移动、消失或新吸收峰的出现。相比碱法提取的蚕蛹蛋白,修饰后蚕蛹蛋白样品在320nm和420nm处的吸光度显著增加,其中10min t的吸光度略低于20min t和30min t样品,20min t和30min t样品吸光度差别不大。这可能是由于木糖中的羰基与蚕蛹蛋白中的氨基酸残基发生反应,形成了多个共轭体系。水解增加了蚕蛹蛋白氨基酸残基数量,使得美拉德反应程度随水解时间增加而增加。但过度水解时蚕蛹蛋白的空间位阻效应限制了糖基化反应,使20min t和30min t的吸光度差别不大。随着水解时间的增加,amadori化合物的含量增加,320nm和420nm吸光度的增加,证明反应出现了棕色类黑精的高分子量聚合物,少量美拉德反应发展到高级阶段。
[0069]
4)荧光光谱分析
[0070]
如图3所示,与对照组的最大荧光发射波长423nm相比,修饰后的蚕蛹蛋白最大荧光发射波长发生了蓝移,这可能是因为木糖上的羰基妨碍了分子的电子共轭性,使最大荧
光发射波长蓝移,降低了荧光效率;也可能是因为木糖与部分氨基酸结合,分子中引入了较大的取代基团后,由于空间位阻的原因,分子共面性下降,从而发生蓝移。30min t的最大荧光发射波长422nm相较于10min t的最大荧光发射波长419nm的发生了轻微红移。与未糖基化修饰蚕蛹蛋白相比,修饰蛋白的荧光强度明显增强,不同条件修饰蛋白荧光强度差距不大。可能是由于与修饰后蚕蛹蛋白与木糖反应后生成具有荧光性的美拉德反应产物,增强了荧光强度。而水解10min后的蚕蛹蛋白与木糖发生反应的程度比水解20min后的蚕蛹蛋白和水解30min后的蚕蛹蛋白弱,但酶解10min后的蚕蛹蛋白水解程度有限,蛋白质高级结构未被破坏,分子刚性更强,许多暴露的荧光氨基酸残基未与木糖反应,使其得到的能量更强。
[0071]
5)红外光谱分析
[0072]
如图4所示,相较于碱法提取的蚕蛹蛋白,修饰后蛋白图像中953~1180cm-1
区域的吸收明显增加,说明修饰后的蚕蛹蛋白上附着有多聚糖载体。4000~1300cm-1
的区域为官能团区,其中1320~1430cm-1
,1650~1690cm-1
,2944~3480cm-1
区域强度随水解时间的增加逐渐增大。这些变化表明蚕蛹蛋白和木糖之间发生了交联反应,标志着蚕蛹蛋白在美拉德反应过程中某些官能团的消耗和其他官能团的出现。1640~1560cm-1
区域归属于n-h,与蛋白质中氨基酸,尤其是赖氨酸有关。1320~1430cm-1
中等强度的吸收峰归属于官能团-cho和c-n,是美拉德反应中期产物amadori化合物(c=o)和吡嗪(c-n)的特征峰。1690~1640cm-1
区域的吸收峰归属于c=n,是美拉德反应前期产物席夫碱的特征峰。2944~3480cm-1
宽吸收带归属于缔合的氢键,与美拉德反应进行程度有关。1640~1560cm-1
区域修饰蛋白的吸收强度明显低于碱法提取的蚕蛹蛋白,且水解时间越长强度越低,证明修饰后蚕蛹蛋白损失了氨基酸,发生了美拉德反应,且美拉德反应程度随水解时间增大而增大。1320~1430cm-1
区域修饰后蛋白吸收强度明显高于修饰前吸收强度,但不同修饰条件的蚕蛹蛋白吸收强度相当。1690~1640cm-1
区域修饰后蛋白吸收强度略高于修饰前吸收强度,但不同修饰条件的蚕蛹蛋白吸收强度相当。2944~3480cm-1
区域修饰后蛋白吸收强度明显高于修饰前吸收强度,但不同修饰条件的蚕蛹蛋白吸收强度相当,表明木糖或其降解产物以共价键的形式与蚕蛹蛋白及其水解物交联,且美拉德反应可能已经进行到了中期。
[0073]
6)蛋白质电泳分析
[0074]
如图5所示,总体条带背景颜色较深,与对照组相比,修饰后蛋白的条带背景和上样孔周围颜色明显变浅,说明酶解效果显著,大分子量物质明显减少。对比标准蛋白,可以发现碱法提取的蚕蛹蛋白亚基主要分布在85kda、30~40kda和25kda之间,其中30~40kda的组分含量最高。修饰后蚕蛹蛋白的85kda条带几乎消失,30~40kda和25kda条带随水解时间逐渐变浅,10kda和15kda的条带颜色变深,可能是由于蛋白质酶解产生了小分子量的蛋白降解产物。
[0075]
7)分子排阻色谱分析
[0076]
如图6所示,对照组上清液中主要由分子量1-3kda(46.4%)和《1kda(35.0%)的蛋白组成,含有少部分分子量《0.5kda(7.9%)、3-5kda(8.4%)和5-10kda(2%)的蛋白质和肽,仅含有少量分子量》10kda(0.1%)的蛋白质,酶法耦合糖基化修饰蚕蛹蛋白后,上清液的分子量《0.5kda的肽的比例明显增加,其中10min t样品中含有的分子量《0.5kda肽的比例最大(46.3%);分子量《1kda的肽的比例也有少许增加,其中10min t样品中含有的分子
量《1kda肽的比例最大(48.4%)。而分子量为1-3kda、3-5kda和5-10kda的肽的比例明显降低,其中10min t样品中含有的分子量《1-3kda肽的比例最低(4.0%),30min t样品中含有的分子量3-5kda肽的比例最低(0.9%),30mim t样品中含有的分子量5-10kda肽的比例最低(0.3%)。总体来说,修饰后蚕蛹蛋白分子量降低,主要由分子量《1kda的肽组成。
[0077]
8)lc-ms/ms分析
[0078]
由表2可知,本发明所采用的蚕蛹蛋白中共匹配出8类已经有免疫反应的潜在过敏原,包括30k家族蛋白(包括4种具体蛋白),几丁质酶(id:ref|np_001166832.1)、卵黄原蛋白(id:ref|np_001037309.1)、热休克蛋白(id:bgibmga004541)、表皮蛋白(包括2种具体蛋白)、硫醇过氧化还原酶(id:bgibmga002186)、化学感受蛋白(id:bgibmga004065)和loc蛋白(id:ref|xp_021205460.1);
[0079]
表2不同样品中潜在过敏原的分布情况
[0080][0081][0082]
修饰前后蚕蛹蛋白都含有致敏原,其中对照组致敏原含量最高,为22.21%,所包括致敏蛋白种类也最多,含十二种已检出的致敏原。修饰后的三种蚕蛹蛋白中均未检出硫醇过氧化还原酶(id:bgibmga002186)、卵黄原蛋白(id:ref|np_001037309.1)和相对分子质量为28.68kda的30k家族蛋白(id:ref|np_001095199.1),致敏蛋白含量和总蛋白丰度降低,但仍存在致敏原。其中,10min t样品中致敏原含量最高(13.04%),含有3种30k家族蛋白、热休克蛋白(id:bgibmga004541)、化学感受蛋白(id:bgibmga004065)、loc蛋白(id:ref|xp_021205460.1)和2种表皮蛋白;20min t样品中致敏蛋白种类最少,有3种30k家族蛋白、1种表皮蛋白、几丁质酶和化学感受蛋白,但总蛋白丰度最高;30min t样品中致敏原含量相对较低(1.10%),含有3种30k家族蛋白、几丁质酶(id:ref|np_001166832.1)、热休克蛋白(id:bgibmga004541)、2种表皮蛋白和化学感受蛋白(id:bgibmga004065),其总蛋白丰度也最低。基于以上数据分析,酶法耦合糖基化修饰蚕蛹蛋白能够有效减少蚕蛹蛋白中的致敏原种类,降低致敏蛋白丰度和相对含量。
[0083]
9)gc-ms/ms分析
[0084]
表3不同水解时间的蚕蛹蛋白糖基化反应前后的挥发性物质组成
[0085]
[0086]
[0087][0088]
如图7所示,与对照组相比,修饰后的蚕蛹蛋白与二甲基三硫、二甲基二硫、乙酸乙酯等风味物质更相关。由表3可知,经热处理后样品的酮类、醇类、酯类、酸类、烃类和醛类挥发性风味物质种类和含量均得到提高。修饰后蚕蛹蛋白的苯甲醛和3-糠醛含量显著高于碱法提取的蚕蛹蛋白,对照样品中不含糠醛,而30min t样品中糠醛含量增加为0.24%;30min t样品中苯甲醛含量为control样品的2.43倍。有研究发现,含硫的挥发性化合物能够赋予食物烧烤味和肉味,二甲基二硫化物和二甲基三硫化物具有较低的气味阈值,对食物的整体感官风味影响较大,因此修饰后蚕蛹蛋白中二甲基二硫和二甲基三硫含量显著增加,有利于改善蛋白风味。
[0089]
实施例3:修饰后蚕蛹蛋白的功能性质分析测定
[0090]
1、实验材料
[0091]
待测蛋白:实施例1中所制得的0min样品、10min t样品、20min t样品、30min t样品。
[0092]
2、实验方法
[0093]
1)溶解性
[0094]
表4双缩脲试剂配比
[0095][0096]
采用双缩脲法测定蛋白浓度,以酪蛋白作为标准蛋白,先配制10mg/ml的酪蛋白溶液,按表4分别向每只试管加入各试剂,摇匀,并绘制标准曲线(y=0.0825x-0.0526);取每种待测样品0.02g分别溶于2ml水中,振荡1h离心取上清液1ml,分别加入4ml的双缩脲试剂,在540nm处测吸光值,根据吸光值带入标准曲线公式求待测蛋白质浓度。每种待测样品做3组平行实验。
[0097]
2)乳化性
[0098]
取每种待测样品0.1g分别溶解于15ml tris-hcl缓冲溶液中。加入5毫升大豆油,以10000rpm的速度将体系分散,制备乳液(ulrike et al.,2005)。乳状液稳定性计算公式如下:
[0099]
用0.1mol/l的pbs缓冲液将样品浓度稀释至1mg/ml,样品和大豆油按体积比3:1混合,以10000r/min转速均质1min,制备乳液。取底部乳液并加入sds溶液混合均匀,测500nm波长的吸光度a0。每种待测样品做3个平行组。
[0100][0101]
n稀释倍数;c蛋白质浓度g/ml;油的体积分数。
[0102]
3)起泡性和起泡稳定性
[0103]
取20ml质量分数为1%的各待测蛋白质溶液,记录液面高度h0,用高速均质机在10000r/min下均质2min,均质后迅速倒入量筒记录泡沫高度h1,静置30min后记录泡沫高度h2。每组待测样品做4个平行组。
[0104][0105][0106]
4)体外消化率
[0107]
将胃蛋白酶溶于10mmol/l的盐酸溶液中浓度为1mg/ml,胰蛋白酶溶于水中浓度为1mg/ml,取每种待测样品5g分别溶于37ml的盐酸溶液(10mmol/l)中,加入配好的胃蛋白酶溶液8ml振荡1.5h,调节ph到7.5,然后加入15ml胰蛋白酶溶液,振荡3.5h,加入10%的tca溶液1ml,使蛋白酶灭活,将样品装入离心管中,以10000r/min离心2min,取上清液进行测定。
[0108][0109]n0-消化前蛋白质样品中tca沉淀物中的氮含量(mg)
[0110]nt-消化后的tca沉淀物中的氮含量(mg)
[0111]ntot-蛋白质样品中的总氮含量(mg)。
[0112]
3、实验结果
[0113]
1)溶解性
[0114]
如图8所示,经过糖基化反应处理后蚕蛹蛋白质的溶解性改善效果明显,溶解性随水解时间增加而提高。其中30min t的溶解度提升显著(p《0.05),为28.6%,是粗提蚕蛹蛋白溶解性(4.7%)近5倍。证明水解和糖基化都有利于蚕蛹蛋白溶解性的改善。综上所述,由于美拉德反应,蚕蛹蛋白和木糖共价交联,随着更多羟基的引入,蛋白分子亲水性基团增加,溶解度增加。
[0115]
2)乳化性
[0116]
如图9所示,通过糖基化处理的蚕蛹蛋白水解物乳化性下降,且与水解时间负相关。与对照组的乳化性相比(39.0m2/g),30min t的乳化性(24.1m2/g)下降了38.2%。美拉德反应后蛋白质的分子形状逐渐变为球体且分子质量增加,从而使蛋白质乳化性降低。
[0117]
3)起泡性和起泡稳定性
[0118]
如图10所示,经糖基化处理后的蚕蛹蛋白水解物相较于碱法提取的蚕蛹蛋白,起泡性略微提高。其中不同水解时间的修饰蚕蛹蛋白起泡性随水解时间增加而提高,30min t的起泡性(135%)是对照组起泡性(112%)的1.21倍;
[0119]
修饰后蚕蛹蛋白的泡沫稳定性降低,其中不同水解时间的修饰蚕蛹蛋白起泡稳定性随水解时间增加而降低,30min t样品的起泡稳定性(77%)相比对照组的起泡稳定性(96%)降低了1.25倍。
[0120]
4)体外消化率
[0121]
如图11所示,水解后修饰后的蚕蛹蛋白消化率显著提高(p《0.05),且随水解时间延长而增大,即(10min t《20min t《30min t),与对照组相比提高了1.34-1.44倍。其中对照组消化率为63.2%,30min t消化率最高,为91.2%。图中20min t和30min t样品消化率相差不大,表明在本实验中影响消化率最主要的因素还是是消化蛋白酶水解,糖基化可能限制了消化酶水解。
[0122]
最后说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行同等替换。凡在本发明的精神和原则之内,所作的任何修改、同等替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。