1.本发明涉及生物医学检测技术领域,特别是涉及一种磁性量子点编码微球及制备方法和高通量检测用装置。
背景技术:
2.高通量检测技术包括固相芯片和液相芯片技术。固相芯片使用位置编码,解码方式简单,但是其集成在平面的编码方式限制了检测方案的灵活性,面对不同的检测需求需要制备不同分析阵列的固相芯片,同时检测过程中待测物结合到芯片基底上的速度较慢,影响检测速度,且固相芯片采用的同一基底对于不同类型的生物靶分子的匹配性不同。液相芯片灵活性好,灵敏度和检测精度高,但是以没有磁性的有机染料编码微球为载体,需要流式细胞仪作为基本分析仪器,而流式细胞仪主要由液流系统、光源系统和检测分析系统构成,光源系统需要集成与编码微球相对应的特定激光源,设备的制造技术门槛较高,使用成本高昂并具有一定体积,阻碍了其在即时检测和不发达地区的广泛普及。目前将悬浮检测和阵列分析结合起来,即将编码微球在平面上排列,把传统流式荧光的逐个解码微球替换为平面批量解码微球,已经成为研究热点。
3.现有的基于编码微球平面固定的技术方案中,使用的微球主要包括两种,一种为不具有磁性的单一的荧光编码微球,一种为简单混合磁性纳米颗粒和荧光编码材料的微球。
4.现有的基于编码微球平面固定的技术方案中,使用的固定方案包括如下两种:
5.方案一是利用磁场固定具有磁性的编码微球,微球在溶液中捕获待测物后,施加磁场使微球从溶液中沉降到基地上并呈二维排布。示意图如图1所示。
6.方案二是使用不具有磁性的荧光编码微球,将微球预先固定在微孔薄膜中并封装顶部形成一个半封闭空间,将所需检测的样本从入口通入,微球捕获溶液中的待测物,再通入缓冲液洗涤微球。示意图如图2所示。
7.方案一的缺点包括:使用的是简单混合磁性纳米颗粒和编码材料的微球,磁性材料会吸收编码材料的荧光,荧光强度与磁性材料的量成反比,导致微球难以包覆较多的磁性材料。利用磁场固定微球,微球之间距离太近导致的重叠不可避免,微球在垂直方向的堆叠同样存在,导致较大的荧光干扰,影响检测精度,且微球在平面上的分布不均匀。
8.方案二的缺点包括:固定在孔中的微球结合待测物的速度相比于微球在溶液中运动捕获待测物的速度较慢。微球仅仅依靠微孔的束缚,容易不停移动,在拍摄时会导致残影,影响图片质量和检测精度。微球是预先固定并封装的,检测能力在封装完成时已经确定,难以根据实际检测需求灵活调节微球的种类和比例,灵活性较差。
技术实现要素:
9.为了弥补上述背景技术的不足,本发明提出一种磁性量子点编码微球及制备方法和高通量检测用装置,以解决微球难以包覆较多的磁性材料、检测用装置检测精度低和灵
活性差的问题。
10.本发明的技术问题通过以下的技术方案予以解决:
11.本发明公开了一种磁性量子点编码微球的制备方法,包括如下步骤:
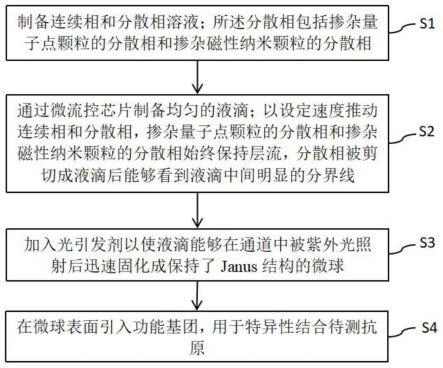
12.s1、制备连续相和分散相溶液;所述分散相包括掺杂量子点颗粒的分散相和掺杂磁性纳米颗粒的分散相;
13.s2、通过微流控芯片制备均匀的液滴;以设定速度推动连续相和分散相,掺杂量子点颗粒的分散相和掺杂磁性纳米颗粒的分散相始终保持层流,分散相被剪切成液滴后能够看到液滴中间明显的分界线;
14.s3、加入光引发剂以使液滴能够在通道中被紫外光照射后迅速固化成保持了janus结构的微球;
15.s4、在微球表面引入功能基团,用于特异性结合待测抗原。
16.在一些实施例中,步骤s1中,所述分散相主体为可光聚合的聚合物单体。
17.在一些实施例中,步骤s1中,所述掺杂量子点颗粒的分散相和掺杂磁性纳米颗粒的分散相的制备方法包括:通过溶剂挥发法将油溶性的量子点颗粒和磁性纳米颗粒均匀分散在分散相主体中。
18.进一步地,还包括:改变掺杂在分散相主体中的量子点的种类和质量获取多组量子点编码。
19.在一些实施例中,步骤s3中,所述光引发剂的比例为1%-5%。
20.在一些实施例中,步骤s4具体为:加入马来酸酐和光聚合单体下共聚以在微球表面引入功能基团;将微球在碱性溶液中部分水解将酸酐基团水解为羧基,与特异性抗体共价偶联,用于特异性结合待测抗原。
21.本发明还公开了一种磁性量子点编码微球,采用如上任一项所述的方法制备所述微球,所述微球包括微球主体,所述微球主体包括两部分,两部分均呈半球形,一个半球内包覆有用于编码的油溶性量子点颗粒;另一个半球内包覆有油溶性磁性纳米颗粒;微球表面富含羧基,微球表面能够共价偶联特异性抗体,用于特异性结合待测抗原;所述微球具有janus结构,用于将量子点编码和磁性集成在微球上。
22.本发明还公开了一种高通量检测用装置,包括微孔阵列薄膜以及如上所述的微球,所述微孔阵列薄膜的一面设有多个微孔,每个微孔内至多容纳一个微球,微球被固定在微孔中,不同微球处于同一个水平面。
23.在一些实施例中,还包括磁铁,所述磁铁放置于所述微孔阵列薄膜下方。
24.在一些实施例中,所述微孔阵列薄膜的成分为聚二甲基硅氧烷。
25.本发明与现有技术对比的有益效果包括:
26.采用本发明提供的磁性量子点编码微球的制备方法所制备的微球,可以在碱性溶液中部分水解将酸酐基团水解为羧基,在合适的反应条件下与特异性抗体共价偶联,用于特异性结合待测抗原。
27.在一些实施例中,通过改变掺杂在分散相主体中的量子点的种类和质量获取多组量子点编码,从而灵活改变微球的数量和种类,提高检测的灵活性。
28.本发明提供的磁性量子点编码微球上集成有量子点编码和磁性,减少了因磁性纳米颗粒吸光导致的量子点淬灭,使微球可以包覆较多的磁性材料,微球的磁性能可以简化
后续免疫反应时的清洗和分离步骤,在磁场作用下微球可以定向移动或固定。
29.本发明提供的高通量检测用装置,使用具有微孔阵列薄膜固定微球,每个微孔内最多容纳一个微球,微球彼此之间没有重叠互不干扰,减小了荧光干扰和检测误差,提升了检测精度。
30.在一些实施例中,使用微孔阵列薄膜和磁场联合固定微球,在磁场作用下微球能够保持固定位置不会移动,避免了荧光图像上的残影,进一步提升了检测精度。
附图说明
31.图1是本发明现有技术中基于编码微球平面固定方案一的示意图。
32.图2是本发明现有技术中基于编码微球平面固定方案二的示意图。
33.图3是本发明实施例的磁性量子点编码微球的制备方法流程图。
34.图4是本发明实施例的通过微流控芯片制备微球的示意图。
35.图5是本发明实施例的微球的扫描电镜图像。
36.图6是本发明实施例的具有janus结构的磁性量子点编码微球示意图。
37.图7是本发明实施例的具有微孔阵列的聚二甲基硅氧烷薄膜示意图。
38.图8是本发明实施例的具有微孔阵列的聚二甲基硅氧烷薄膜俯视图。
39.图9是本发明实施例的具有微孔阵列的聚二甲基硅氧烷薄膜剖视图。
40.图10是本发明实施例的具有微孔阵列的聚二甲基硅氧烷薄膜的扫描电镜图像。
41.图11是本发明实施例的微孔阵列薄膜固定多种微球的示意图。
42.图12是本发明实施例的微孔阵列薄膜固定微球的扫描电镜图像。
43.图13是本发明实施例的使用高通量检测用装置获取图像用于检测的示意图。
具体实施方式
44.下面对照附图并结合优选的实施方式对本发明作进一步说明。需要说明的是,在不冲突的情况下,本技术中的实施例及实施例中的特征可以相互组合。
45.需要说明的是,本实施例中的左、右、上、下、顶、底等方位用语,仅是互为相对概念,或是以产品的正常使用状态为参考的,而不应该认为是具有限制性的。
46.如图3所示,本发明实施例提供一种磁性量子点编码微球的制备方法,包括如下步骤:
47.s1、制备连续相和分散相溶液。分散相包括掺杂量子点颗粒的分散相和掺杂磁性纳米颗粒的分散相。分散相主体为可光聚合的聚合物单体。
48.具体地,掺杂量子点颗粒的分散相和掺杂磁性纳米颗粒的分散相的制备方法包括:通过溶剂挥发法将油溶性的量子点颗粒和磁性纳米颗粒均匀分散在分散相主体中,改变掺杂在分散相主体中的量子点的种类和质量获取多组量子点编码。
49.s2、通过微流控芯片制备均匀的液滴;以设定速度推动连续相和分散相,掺杂量子点颗粒的分散相和掺杂磁性纳米颗粒的分散相始终保持层流,分散相被剪切成液滴后能够看到液滴中间明显的分界线。
50.s3、加入光引发剂以使液滴能够在通道中被紫外光照射后迅速固化成保持了janus结构的微球。光引发剂的比例为1%-5%。
51.s4、在微球表面引入功能基团,用于特异性结合待测抗原。
52.具体地,加入马来酸酐和光聚合单体下共聚以在微球表面引入功能基团,将微球在碱性溶液中部分水解将酸酐基团水解为羧基,与特异性抗体共价偶联,用于特异性结合待测抗原。
53.在一些实施例中,磁性量子点编码微球的制备过程如下:
54.如图4所示,为通过微流控芯片制备微球的示意图。通过pdms(聚二甲基硅氧烷)基的微流控芯片制备高度均匀的液滴,液滴在紫外光照下固化成坚固的球。微流控芯片的制作采用成熟工艺,芯片内通道改性为亲水的。制备微球需要连续相和分散相溶液,连续相为加了表面活性剂的水溶液,分散相主体为可光聚合的聚合物单体,通过溶剂挥发法可将油溶性的量子点和磁性纳米粒子均匀分散在聚合物单体中,改变掺杂在聚合物单体中的量子点荧光材料的种类和质量可以获取多组量子点荧光编码。加入1%-5%的光引发剂以使液滴能够在通道中被紫外光照射后迅速固化,加入马来酸酐和光聚合单体下共聚以在微球表面引入功能基团。使用注射泵以设定速度推动连续相和分散相,掺杂量子点颗粒的分散相和掺杂磁性纳米颗粒的分散相始终保持层流,分散相被剪切成液滴后可以看到液滴中间明显的分界线,液滴经过紫外光区域后被固化成球保持了janus结构。制备的微球大小均匀,变异系数小,在磁场作用下可以定向移动或固定,表现出良好的磁响应性,包覆的荧光材料发出的荧光明亮。制备的微球可以在碱性溶液中部分水解将酸酐基团水解为羧基,在合适的反应条件下与特异性抗体共价偶联,用于特异性结合待测抗原。为同时检测多种待测抗原浓度,需要制备多种编码微球,不同种类的编码微球上连接不同的抗体。微球的扫描电镜图像如图5所示。
55.在一个实施例中,连续相为2%聚乙烯醇-3%聚(乙二醇)-block-聚(丙二醇)-block-聚(乙二醇)的水溶液,分散相中以丙烯酸酯类化合物作为聚合单体,马来酸酐为共聚单体,二苯基(2,4,6-三甲基苯甲酰基)氧化膦作为光引发剂,量子点使用的是发射峰分别为450纳米和640纳米的两种油溶性cdse/cds/zns量子点,磁性纳米颗粒为油溶性的平均粒径为10纳米的四氧化三铁颗粒。通过溶剂挥发法将甲苯溶液中的量子点和磁性纳米粒子分散到单体中,加入4%的光引发剂,通过改变掺杂在单体中两种量子点的比例制备了多种编码微球。将完全固化的微球置于氢氧化钠溶液中浸泡,微球球体共聚物中的酸酐基团在强碱溶液中缓慢水解成为羧基基团,微球表面的羧基便于连接不同类型的靶分子。
56.采用本发明实施例提供的磁性量子点编码微球的制备方法所制备的微球,可以在碱性溶液中部分水解将酸酐基团水解为羧基,在合适的反应条件下与特异性抗体共价偶联,用于特异性结合待测抗原。进一步地,通过改变掺杂在分散相主体中的量子点的种类和质量获取多组量子点编码,从而灵活改变微球的数量和种类,提高检测的灵活性。
57.本发明实施例还提供一种磁性量子点编码微球,采用上述任一项磁性量子点编码微球的制备方法制备,磁性量子点编码微球上集成有量子点编码和磁性,减少了因磁性纳米颗粒吸光导致的荧光淬灭,微球的磁性能可以简化后续免疫反应时的清洗和分离步骤,在磁场作用下微球可以定向移动或固定。
58.如图6所示,本发明实施例提供的磁性量子点编码微球呈球形,直径在50-100微米内可以调控,微球大小均匀、外表光滑、有一定机械强度。其包括微球主体,微球主体包括两部分,两部分均大致呈半球形,一个半球内包覆有用于编码的油溶性量子点颗粒,通过将不
同发射波长的量子点以不同比例和不同质量组合可以获取多种编码。另一个半球内包覆有油溶性磁性纳米颗粒,磁性纳米颗粒赋予微球以超顺磁性,在磁场作用下微球可以定向运动或固定,便于洗涤和分离;微球在碱性溶液中浸泡后,共聚物中的酸酐基团水解使得微球表面富含羧基,在合适的反应条件下微球表面可以共价偶联特异性抗体,用于特异性结合待测抗原。微球具有janus结构,用于将量子点编码和磁性集成在微球上。
59.本发明实施例还提供一种高通量检测用装置,包括微孔阵列薄膜以及如上的微球,微孔阵列薄膜的一面设有多个微孔,每个微孔内容纳一个微球,微球被固定在微孔中,不同微球处于同一个水平面。
60.在一些实施例中,高通量检测用装置还包括磁铁,磁铁放置于微孔阵列薄膜下方。
61.具体地,微孔阵列薄膜成分为聚二甲基硅氧烷,微孔阵列薄膜的一面有呈周期性排布的微孔,假设制备的微球直径为d,则微孔直径d1为1d至1.5d之间,微孔间隔d2为1/3d至1/2d之间,微孔深度h2为0.5d至1d之间时,微孔固定微球的效果较好。微孔阵列薄膜尺寸l1和l2视需固定的微球数量灵活调节,需固定的微球数越多则l1和l2应越大,微孔数量与所需固定的微球数量相近时固定效率较高。微孔阵列薄膜高度h1对固定效果影响较小,一般在0.5毫米至3毫米之间。微孔排布呈蜂窝状。具有微孔阵列的聚二甲基硅氧烷薄膜在使用前需表面改性为亲水的以使富含微球的溶液更好平铺在微孔阵列薄膜表面。
62.进一步地,微孔的大小被设计为刚好能容纳一个微球,直径略大于微球直径,深度约为微球直径的一半,避免了一个孔中容纳多个微球现象的发生,微孔间距较小以减少微球分布在微孔之外的可能性。微球具有磁性,在磁场作用下微球从溶液中更快地进入微孔被固定住,同时磁场作用力确保了在拍摄过程中微球位置的固定。滴加微球溶液时将微孔阵列薄膜有微孔阵列的一面朝上,使用磁铁来辅助固定微球,磁铁置于微孔阵列薄膜下方,微球在磁场作用下更快地从溶液中运动到微孔阵列薄膜上,微球被微孔固定住后磁场进一步限制了微球的移动。
63.其中,具有微孔阵列的聚二甲基硅氧烷薄膜制备方法如下:
64.通过光刻工艺制备具有微柱阵列结构的硅模具,对硅模具进行表面氟化处理,将二甲基硅氧烷的单体和交联剂按质量比10:1混合并倒在硅模具上,加热固化,倒模后得到具有微孔阵列的聚二甲基硅氧烷薄膜。将薄膜表面改性为亲水的。
65.在一个实施例中,使用su 82000系列的负性光刻胶通过光刻工艺在硅片上获得呈蜂窝状密集排布的微柱阵列,微圆柱的直径为60微米,高度为30微米,微柱间距为20微米。使用1h,1h,2h,2h-全氟癸基三氯硅烷对硅片进行氟化处理后,倒入少量道康宁184的单体和交联剂的混合物,加热固化后揭下具有微孔阵列的聚二甲基硅氧烷薄膜完成倒模。微孔阵列的聚二甲基硅氧烷薄膜在用于固定微球之前需要在氧等离子体中处理2分钟,薄膜表面亲水利于微球进入微孔。制得的具有微孔阵列的聚二甲基硅氧烷薄膜如图7至图10所示。
66.使用该高通量检测用装置进行检测时,将含微球的溶液滴加在氧等离子体处理过的微孔阵列薄膜上,微孔阵列薄膜下方放置磁铁,微球在重力和磁场作用力下进入微孔。由于微孔的结构设计,每个微孔内至多容纳一个微球,微球被固定在微孔中,不同微球处于同一个水平面,易于对焦。
67.如图11至图12所示,微球a、b、c为三种不同的微球,三种微球具有相同的结构,都有一个包覆量子点编码材料的半球和一个包覆磁性纳米颗粒的半球,区别在于所包覆的量
子点编码材料的种类和质量。由于微球具有janus结构,固定过程中,包覆有磁性纳米颗粒的半球被磁铁吸引而翻转至与磁铁相对,而包覆有量子点编码材料(荧光编码材料)的半球朝上。分别用紫外光和报告分子的激发光照射微球,用显微镜拍摄微球的荧光图像,拍摄的图像能够同时获取视野内所有微球的信息。
68.在一个实施例中,如图13所示,微球被微孔和磁场固定在薄膜上呈规则排布后,对同一片区域分别用紫外光和荧光标记抗体对应的激发光照射微球获取两张荧光图像。微球在二维平面呈规则排列,彼此之间没有重叠,极大减小了荧光干扰,相比已有的单纯依靠磁场聚集微球的方法成像质量更高,不需要对重叠微球做图像分割处理,极大简化了后续算法。拍摄平面排列的微球得到两组荧光图像后,第一组紫外光激发获取的量子点荧光图像用于解码微球,不同比例和数量的量子点混合后发光的色调和强度不同,分析发射光的颜色和强度来解码。第二组荧光图像用于计算每种待测物浓度,相同位置下拍摄的两组荧光图像中,微球的位置保持不变,首先对第二组荧光图像进行分类,分类依据为第一组图像解码后的微球位置分布,将第二组图像中同种编码微球的荧光图像汇总,利用同种编码微球上报告分子的平均荧光强度计算待测物浓度。
69.本发明实施例的高通量检测用装置使用具有janus结构的磁性量子点编码微球为载体,使用具有微孔阵列的聚二甲基硅氧烷薄膜在磁场作用下固定微球用于高通量检测分析,在荧光显微镜下拍摄排布在平面的微球的照片用于分析。
70.微球利用janus结构将量子点编码和磁性集成在微球上,janus结构减少了因磁性纳米颗粒吸光导致的荧光淬灭,微球的磁性能简化后续免疫反应时的清洗和分离步骤,在磁场作用下微球可以定向移动或固定。
71.微球在溶液中捕获待测物后再被固定到平面上分析,捕获待测物速度比方案二更快,同时可以根据检测需求灵活改变微球的数量和种类,灵活性好。
72.使用具有微孔阵列的聚二甲基硅氧烷薄膜和磁场联合固定微球,每个微孔内最多容纳一个微球,微球彼此没有重叠互不干扰,在磁场作用下微球能够保持固定位置不会移动,避免了荧光图像上的残影。
73.以上内容是结合具体的优选实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的技术人员来说,在不脱离本发明构思的前提下,还可以做出若干等同替代或明显变型,而且性能或用途相同,都应当视为属于本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
