hcdr1、seq id no:2所示的hcdr2、seq id no:3所示的hcdr3、seq id no:4 所示的lcdr1、seq id no:5所示的lcdr2和seq id no:6所示的lcdr3。
7.在一些实施方案中,所述抗tigit抗体或抗原结合片段的重链可变区包含seq idno:7所示的氨基酸序列,或与seq id no:7所示序列相比具有至少80%同一性的氨基酸序列,或与seq id no:7所示序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
8.在一些实施方案中,所述抗tigit抗体或抗原结合片段的轻链可变区包含seq idno:8所示的氨基酸序列,或与seq id no:8所示序列相比具有至少80%同一性的氨基酸序列,或与seq id no:8所示序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
9.在一些实施方案中,所述抗tigit抗体或抗原结合片段的重链可变区包含seq idno:7所示的氨基酸序列,或与seq id no:7所示序列相比具有至少80%同一性的氨基酸序列,或与seq id no:7所示序列相比具有一个或多个保守氨基酸取代的氨基酸序列;所述抗tigit抗体或抗原结合片段的轻链可变区包含seq id no:8所示的氨基酸序列,或与seq id no:8所示序列相比具有至少80%同一性的氨基酸序列,或与seqid no:8所示序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
10.在一些实施方案中,所述抗tigit抗体或抗原结合片段的重链可变区包含seq idno:7所示的氨基酸序列,所述抗tigit抗体或抗原结合片段的轻链可变区包含seq idno:8所示的氨基酸序列。
11.在一些实施方案中,所述抗tigit抗体的重链包含seq id no:9所示的氨基酸序列,或与seq id no:9所示序列相比具有至少80%同一性的氨基酸序列,或与seq idno:9所示序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
12.在一些实施方案中,所述抗tigit抗体的轻链包含seq id no:10所示的氨基酸序列,或与seq id no:10所示序列相比具有至少80%同一性的氨基酸序列,或与seqid no:10所示序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
13.在一些实施方案中,所述抗tigit抗体的重链包含seq id no:9所示的氨基酸序列,或与seq id no:9所示序列相比具有至少80%同一性的氨基酸序列,或与seq idno:9所示序列相比具有一个或多个保守氨基酸取代的氨基酸序列;所述抗tigit抗体的轻链包含seq id no:10所示的氨基酸序列,或与seq id no:10所示序列相比具有至少80%同一性的氨基酸序列,或与seq id no:10所示序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
14.在一些实施方案中,所述抗tigit抗体为抗体h10d8of或h10d8ofkf,抗体 h10d8of和h10d8ofkf的重链包含如seq id no:9所示的氨基酸序列,抗体 h10d8of和h10d8ofkf的轻链包含如seq id no:10所示的氨基酸序列;抗体 h10d8of和h10d8ofkf分别含有两条序列相同的重链和两条序列相同的轻链。
15.在一些实施方案中,所述抗tigit抗体(例如抗体h10d8ofkf)或抗原结合片段的岩藻糖基化水平为0-10%。在一些实施方案中,所述抗tigit抗体(例如抗体 h10d8ofkf)或抗原结合片段的岩藻糖基化水平为0-5%。在一些实施方案中,所述抗tigit抗体(例如抗体h10d8ofkf)或抗原结合片段的岩藻糖基化水平为约0、约 0.1%、约0.5%、约0.8%、约1%、约1.3%、约1.6%、约2.1%、2.9%、约3%、约3.3%、 3.8%、约4%、约4.2%、4.3%、约4.6%、约5%或这些数值中任何两个值之间的范围 (包括端点)或其中任何值。在一些实施
方案中,所述抗tigit抗体(例如抗体 h10d8ofkf)或抗原结合片段没有结合岩藻糖。在一些实施方案中,所述抗tigit抗体(例如抗体h10d8ofkf)或抗原结合片段具有增强的adcc效应(antibody-dependentcell-mediated cytotoxicity)。
16.抗tigit抗体或抗原结合片段可以通过基因工程在cho细胞或hek293细胞中表达,并通过纯化获得;纯化可以采用常规方法进行,例如先离心细胞悬液并收集上清液,再次离心进一步去除杂质。proteina亲和柱和离子交换柱等方法可以用于纯化抗体蛋白。
17.在一些实施方案中,低岩藻糖基化或无岩藻糖基化的抗tigit抗体或抗原结合片段由α-(1,6)-岩藻糖基转移酶基因敲除的细胞系表达。在一些实施方案中,抗体 h10d8ofkf由α-(1,6)-岩藻糖基转移酶基因敲除的细胞系表达,例如α-(1,6)-岩藻糖基转移酶基因敲除的cho细胞。
18.在一些实施方案中,所述方法或用途包括:向有需要的患者施用有效量的抗tigit 抗体或抗原结合片段。在一些实施方案中,所述抗tigit抗体为抗体h10d8of或 h10d8ofkf。在一些实施方案中,抗tigit抗体或抗原结合片段施用的有效剂量为每剂约9mg至1200mg。
19.在一些实施方案中,患者患有肿瘤或癌症。在一些实施方案中,肿瘤和癌症包括但不限于血液癌症、实体瘤。在一些实施方案中,血液癌症包括但不限于白血病、淋巴瘤和骨髓瘤。在一些实施方案中,白血病包括急性淋巴细胞性白血病(all)、急性骨髓性白血病(aml)、慢性淋巴细胞性白血病(cll)、慢性骨髓性白血病(cml)和骨髓性增生疾病/肿瘤(mpds)。在一些实施方案中,淋巴瘤包括霍奇金淋巴瘤、无痛性和侵袭性非霍奇金淋巴瘤、伯基特淋巴瘤和滤泡性淋巴瘤(小细胞和大细胞)。在一些实施方案中,骨髓瘤包括多发性骨髓瘤(mm)、巨细胞骨髓瘤、重链骨髓瘤和轻链或本斯
‑ꢀ
琼斯骨髓瘤。在一些实施方案中,实体瘤包括乳腺癌、卵巢癌、胰腺癌、前列腺癌、黑素瘤、结直肠癌、结肠癌、肺癌、头颈癌、膀胱癌、食道癌、肝癌和肾癌。在一些实施方案中,肿瘤和癌症为尚无有效治疗手段的经病理学确诊的局部晚期或转移性恶性实体肿瘤。
20.在一些实施方案中,本发明公开了一种用于治疗有需要患者的肿瘤或癌症的方法,其包括施用有效量的抗tigit抗体或抗原结合片段,其中抗tigit抗体或抗原结合片段施用的有效量为约9mg至1200mg每个治疗周期。在一些实施方案中,一个治疗周期为1周、2周、3周、4周、1个月、5周、6周、7周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值。在一些实施方案中,所述抗tigit抗体为抗体h10d8of或h10d8ofkf。
21.在一些实施方案中,可以将抗tigit抗体配制成药物组合物,并以适合于所选给药途径的多种形式向患者给药,给药途径例如肠胃外、静脉内(iv)、肌肉内、局部或皮下。在一些实施方案中,可以将抗tigit抗体静脉输注。抗tigit抗体的给药量将取决于药物的性质、细胞表面触发药物的内在化、运输和释放的程度,以及所治疗的疾病和患者的状况(如年龄、性别、体重等)。
22.在一些实施方案中,每次施用的抗tigit抗体(如抗体h10d8of或h10d8ofkf) 或抗原结合片段为0.01mg/kg至26mg/kg或含此剂量抗tigit抗体或抗原结合片段的制剂。在一些实施方案中,每次施用的抗tigit抗体或抗原结合片段为约0.01mg/kg、约0.02mg/kg、约0.03mg/kg、约0.06mg/kg、约0.08mg/kg、约0.1mg/kg、约0.2mg/kg、约0.3mg/kg、约0.5mg/kg、约0.9mg/kg、约1mg/kg、约1.6mg/kg、约2mg/kg、约 2.5mg/kg、约3mg/kg、约4mg/kg、约5mg/kg、约6mg/kg、约7mg/kg、约8mg/kg、约9mg/kg、约10mg/kg、约11mg/kg、约12mg/kg、约
13mg/kg、约14mg/kg、约 15mg/kg、约16mg/kg、约17mg/kg、约18mg/kg、约19mg/kg、约20mg/kg、约21 mg/kg、约22mg/kg、约23mg/kg、约24mg/kg、约25mg/kg、约26mg/kg,或这些数值中任何两个值之间的范围(包括端点)或其中任何值,或含此剂量抗tigit抗体或抗原结合片段的制剂。在一些实施方案中,约1周、约2周、约3周、约4周、约 5周、约6周或约7周给药1次。
23.在一些实施方案中,本发明公开了一种用于治疗肿瘤或癌症的方法,所述方法包括:每3周向有需要的患者给予约0.01mg/kg、约0.02mg/kg、约0.03mg/kg、约0.06 mg/kg、约0.08mg/kg、约0.1mg/kg、约0.2mg/kg、约0.3mg/kg、约0.5mg/kg、约 0.9mg/kg、约1mg/kg、约1.6mg/kg、约2mg/kg、约2.5mg/kg、约3mg/kg、约4mg/kg、约5mg/kg、约6mg/kg、约7mg/kg、约8mg/kg、约9mg/kg、约10mg/kg、约11mg/kg、约12mg/kg、约13mg/kg、约14mg/kg、约15mg/kg、约16mg/kg、约17mg/kg、约 18mg/kg、约19mg/kg、约20mg/kg、约21mg/kg、约22mg/kg、约23mg/kg、约24 mg/kg、约25mg/kg、约26mg/kg的抗tigit抗体或抗原结合片段,或这些数值中任何两个值之间的范围(包括端点)或其中任何值,或含此剂量抗tigit抗体或抗原结合片段的制剂。
24.在一些实施方案中,本发明公开了一种用于治疗肿瘤或癌症的方法,所述方法包括:每3周向有需要的患者给予约0.01mg/kg、约0.02mg/kg、约0.03mg/kg、约0.06 mg/kg、约0.08mg/kg、约0.1mg/kg、约0.2mg/kg、约0.3mg/kg、约0.5mg/kg、约 0.9mg/kg、约1mg/kg、约1.6mg/kg、约2mg/kg、约2.5mg/kg、约3mg/kg、约4mg/kg、约5mg/kg、约6mg/kg、约7mg/kg、约8mg/kg、约9mg/kg、约10mg/kg、约11mg/kg、约12mg/kg、约13mg/kg、约14mg/kg、约15mg/kg、约16mg/kg、约17mg/kg、约 18mg/kg、约19mg/kg、约20mg/kg、约21mg/kg、约22mg/kg、约23mg/kg、约24 mg/kg、约25mg/kg、约26mg/kg的抗体h10d8of,或含此剂量抗体h10d8of的制剂。
25.在一些实施方案中,本发明公开了一种用于治疗肿瘤或癌症的方法,所述方法包括:每3周向有需要的患者给予约0.01mg/kg、约0.02mg/kg、约0.03mg/kg、约0.06 mg/kg、约0.08mg/kg、约0.1mg/kg、约0.2mg/kg、约0.3mg/kg、约0.5mg/kg、约 0.9mg/kg、约1mg/kg、约1.6mg/kg、约2mg/kg、约2.5mg/kg、约3mg/kg、约4mg/kg、约5mg/kg、约6mg/kg、约7mg/kg、约8mg/kg、约9mg/kg、约10mg/kg、约11mg/kg、约12mg/kg、约13mg/kg、约14mg/kg、约15mg/kg、约16mg/kg、约17mg/kg、约 18mg/kg、约19mg/kg、约20mg/kg、约21mg/kg、约22mg/kg、约23mg/kg、约24 mg/kg、约25mg/kg、约26mg/kg的抗体h10d8ofkf,或含此剂量抗体h10d8ofkf 的制剂。
26.在一些实施方案中,本发明公开了一种治疗肿瘤或癌症的方法,其包括向有需要的患者施用有效量的抗tigit抗体或抗原结合片段(或制剂);其中,抗tigit抗体或抗原结合片段的有效量为单次给药9mg至1200mg(或含此剂量抗tigit抗体或抗原结合片段的制剂)。剂量时间表和给药方式取决于某些患者群中的抗tigit抗体或抗原结合片段(或制剂)的获益风险评估和一般临床实践指南。
27.在一些实施方案中,患者每个治疗周期内抗tigit抗体或抗原结合片段施用的有效量为9mg至1200mg(或含此剂量抗tigit抗体或抗原结合片段的制剂)。
28.在一些实施方案中,患者每个治疗周期内施用抗tigit抗体(如抗体h10d8of 或h10d8ofkf)或抗原结合片段的有效量为约9mg、约10mg、约18mg、约26mg、约30mg、约38mg、约45mg、约60mg、约70mg、约80mg、约100mg、约120mg、约180mg、约200mg、约250mg、约290mg、约
300mg、约330mg、约380mg、约400mg、约434mg、约480mg、约500mg、约567mg、约580mg、约600mg、约700mg、约800mg、约900mg,或这些数值中任何两个值之间的范围(包括端点) 或其中任何值,或含此剂量抗tigit抗体或抗原结合片段的制剂。在一些实施方案中,一个治疗周期为1周至7周给药1次。在一些实施方案中,每个治疗周期内施用抗tigit 抗体或抗原结合片段的有效量为约10mg至900mg,或含此剂量抗tigit抗体或抗原结合片段的制剂;其中,一个治疗周期为约1周、约2周、约3周、约4周、约5周、约6周、约7周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值。在一些实施方案中,一个治疗周期为约1周、约2周、约3周或约4周。在一些实施方案中,患者每个治疗周期内施用抗tigit抗体或抗原结合片段的有效量为约10mg 至约300mg,或含此剂量抗tigit抗体或抗原结合片段的制剂;其中,一个治疗周期为约1周、约2周、约3周、或约4周。在一些实施方案中,患者每个治疗周期内施用抗tigit抗体或抗原结合片段的有效量为约10mg、约30mg、约40mg、约50mg、约78mg、约82mg、约96mg、约100mg、约124mg、约143mg、约157mg、约 180mg、约196mg、约200mg、约226mg、约240mg、约260mg、约286mg、约 300mg,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值,或含此剂量抗tigit抗体或抗原结合片段的制剂;其中,一个治疗周期为约1周、约2周、约3周或约4周。在一些实施方案中,患者每个治疗周期内施用抗tigit抗体或抗原结合片段的有效量为约300mg至600mg,或含此剂量抗tigit抗体或抗原结合片段的制剂;其中,一个治疗周期为约1周、约2周、约3周、或约4周。在一些实施方案中,患者每个治疗周期内施用抗tigit抗体或抗原结合片段的有效量为约300mg、约355mg、约360mg、约380mg、约390mg、约400mg、约420mg、约460mg、约480mg、约500mg、约520mg、约540mg、约580mg、约600mg,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值,或含此剂量抗tigit抗体或抗原结合片段的制剂;其中,一个治疗周期为约1周、约2周、约3周或约4周。在一些实施方案中,患者每个治疗周期内施用抗tigit抗体或抗原结合片段的有效量为约600mg至900mg,或含此剂量抗tigit抗体或抗原结合片段的制剂;其中,一个治疗周期为约1周、约2周、约3周或约4周。在一些实施方案中,患者每个治疗周期内施用抗tigit抗体或抗原结合片段的有效量为约600mg、约630mg、约642mg、约660mg、约680mg、约700mg、约734mg、约750mg、约780mg、约790mg、约800mg、约820mg、约844mg、约878mg、约900mg,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值,或含此剂量抗tigit抗体或抗原结合片段的制剂;其中,一个治疗周期为约1周、约2周、约3周或约4周。
29.在一些实施方案中,患者每个治疗周期内施用抗tigit抗体(如抗体h10d8of 或h10d8ofkf)或抗原结合片段的有效量为约9mg至13mg,或含此剂量抗tigit 抗体或抗原结合片段的制剂;比如约10mg给药1次。在一些实施方案中,患者每个治疗周期内施用抗tigit抗体或抗原结合片段的有效量为约10mg,或含此剂量抗 tigit抗体或抗原结合片段的制剂;其中,一个治疗周期为约1周、约2周、约3周或约4周。
30.在一些实施方案中,患者每个治疗周期内施用抗tigit抗体(如抗体h10d8of 或h10d8ofkf)或抗原结合片段的有效量为约25mg至33mg,或含此剂量抗tigit 抗体或抗原结合片段的制剂;比如约30mg给药1次。在一些实施方案中,患者每个治疗周期内施用抗tigit抗体或抗原结合片段的有效量为约30mg,或含此剂量抗 tigit抗体或抗原结合片段的制剂;其中,一个治疗周期为约1周、约2周、约3周或约4周。
31.在一些实施方案中,患者每个治疗周期内施用抗tigit抗体(如抗体h10d8of 或
h10d8ofkf)或抗原结合片段的有效量为约89mg至120mg,或含此剂量抗tigit 抗体或抗原结合片段的制剂;比如约100mg给药1次。在一些实施方案中,患者每个治疗周期内施用抗tigit抗体或抗原结合片段的有效量为约100mg,或含此剂量抗 tigit抗体或抗原结合片段的制剂;其中,一个治疗周期为约1周、约2周、约3周或约4周。
32.在一些实施方案中,患者每个治疗周期内施用抗tigit抗体(如抗体h10d8of 或h10d8ofkf)或抗原结合片段的有效量为约289mg至314mg,或含此剂量抗tigit 抗体或抗原结合片段的制剂;比如约300mg给药1次。在一些实施方案中,患者每个治疗周期内施用抗tigit抗体或抗原结合片段的有效量为约300mg,或含此剂量抗 tigit抗体或抗原结合片段的制剂;其中,一个治疗周期为约1周、约2周、约3周或约4周。
33.在一些实施方案中,患者每个治疗周期内施用抗tigit抗体(如抗体h10d8of 或h10d8ofkf)或抗原结合片段的有效量为约390mg至410mg,或含此剂量抗tigit 抗体或抗原结合片段的制剂;比如约400mg给药1次。在一些实施方案中,患者每个治疗周期内施用抗tigit抗体或抗原结合片段的有效量为约400mg,或含此剂量抗 tigit抗体或抗原结合片段的制剂;其中,一个治疗周期为约1周、约2周、约3周或约4周。
34.在一些实施方案中,患者每个治疗周期内施用抗tigit抗体(如抗体h10d8of 或h10d8ofkf)或抗原结合片段的有效量为约580mg至740mg,或含此剂量抗tigit 抗体或抗原结合片段的制剂;比如约600mg给药1次。在一些实施方案中,患者每个治疗周期内施用抗tigit抗体或抗原结合片段的有效量为约600mg,或含此剂量抗 tigit抗体或抗原结合片段的制剂;其中,一个治疗周期为约1周、约2周、约3周或约4周。
35.在一些实施方案中,患者每个治疗周期内施用抗tigit抗体(如抗体h10d8of 或h10d8ofkf)或抗原结合片段的有效量为约748mg至833mg,或含此剂量抗tigit 抗体或抗原结合片段的制剂;比如约800mg给药1次。在一些实施方案中,患者每个治疗周期内施用抗tigit抗体或抗原结合片段的有效量为约800mg,或含此剂量抗 tigit抗体或抗原结合片段的制剂;其中,一个治疗周期为约1周、约2周、约3周或约4周。
36.在一些实施方案中,患者每个治疗周期内施用抗tigit抗体(如抗体h10d8of 或h10d8ofkf)或抗原结合片段的有效量为约872mg至943mg,或含此剂量抗tigit 抗体或抗原结合片段的制剂;比如约900mg给药1次。在一些实施方案中,患者每个治疗周期内施用抗tigit抗体或抗原结合片段的有效量为约900mg,或含此剂量抗 tigit抗体或抗原结合片段的制剂;其中,一个治疗周期为约1周、约2周、约3周或约4周。
37.在一些实施方案中,抗tigit抗体(如抗体h10d8of或h10d8ofkf)或抗原结合片段施用的有效量为9mg至600mg每3周一次。在一些实施方案中,抗tigit抗体施用的有效量为约9mg、约10mg、约16mg、约18mg、约30mg、约60mg、约 100mg、约180mg、约200mg、约300mg、约400mg、约500mg或约600mg每3 周一次。在一些实施方案中,抗tigit抗体或抗原结合片段施用的有效量为约10mg、约30mg、约100mg、约300mg或约600mg每3周一次。在一些实施方案中,抗tigit 抗体或抗原结合片段施用的有效量为约600mg至1200mg每3周一次。在一些实施方案中,抗tigit抗体或抗原结合片段施用的有效量为约700mg、约800mg、900mg 或约1200每3周一次。
38.在一些实施方案中,患者每个治疗周期内给药一次抗tigit抗体或抗原结合片段 (或制剂)。在一些实施方案中,每个治疗周期内多次给药抗tigit抗体或抗原结合片段(或
制剂),例如2次、3次、4次或5次。在一些实施方案中,患者每个治疗周期只能给药1次或4次。
39.在一些实施方案中,患者接受一个治疗周期治疗。在一些实施方案中,患者接受多个(例如2个、3个或4个)治疗周期治疗。在一些实施方案中,患者接受治疗直至病症得到缓解而不再需要治疗。
40.在一些实施方案中,本发明公开了一种用于治疗肿瘤或癌症的方法,所述方法包括:每3周向有需要的患者给予约9mg至30mg、约30mg至100mg、约100mg至 300mg、约300mg至600mg、约600mg至900mg或约900mg至1200mg,比如约 9mg、约10mg、约18mg、约20mg、约30mg、约60mg、100mg、约180mg、约 200mg、约300mg、约400mg、约500mg、约600mg、约900mg或约1200mg(或这些数值中的任何两个值之间的范围(包括端点)或其中任何值)的抗tigit抗体或抗原结合片段,或含此剂量抗tigit抗体或抗原结合片段的制剂。在一些实施方案中,抗tigit抗体为抗体h10d8of。在一些实施方案中,抗tigit抗体为抗体h10d8ofkf。
41.在一些实施方案中,每3周一次给药抗tigit抗体或抗原结合片段约9mg。在一些实施方案中,每3周一次给药抗tigit抗体或抗原结合片段约10mg。在一些实施方案中,每3周一次给药抗tigit抗体或抗原结合片段约18mg。在一些实施方案中,每3周一次给药抗tigit抗体或抗原结合片段约20mg。在一些实施方案中,每3周一次给药抗tigit抗体或抗原结合片段约30mg。在一些实施方案中,每3周一次给药抗tigit抗体或抗原结合片段约60mg。在一些实施方案中,每3周一次给药抗tigit 抗体或抗原结合片段约100mg。在一些实施方案中,每3周一次给药抗tigit抗体或抗原结合片段约300mg。在一些实施方案中,每3周一次给药抗tigit抗体或抗原结合片段约600mg。在一些实施方案中,每3周一次给药抗tigit抗体或抗原结合片段约900mg。在一些实施方案中,每3周一次给药抗tigit抗体或抗原结合片段约1200 mg。
42.在一些实施方案中,单剂量给药后,患者的症状得到缓解。在一些实施方案中,单剂量给药后,患者后的症状未得到预期缓解,再对患者给药约9mg至1200mg或约10mg至900mg抗tigit抗体或抗原结合片段,直至患者的症状得到缓解。
43.在一些实施方案中,抗tigit抗体或抗原结合片段(或制剂)是通过皮下(s.c.) 注射、腹膜内(i.p.)注射、肠胃外注射、动脉内注射或静脉内(i.v.)注射等方式进行给药。在一些实施方案中,抗tigit抗体或抗原结合片段(或制剂)是输液方式进行给药。在一些实施方案中,抗tigit抗体或抗原结合片段(或制剂)是推注方式进行给药。
44.在一些实施方案中,抗tigit抗体或抗原结合片段(或制剂)是通过静脉内(i.v.) 输液方式(即静脉输注)进行给药。在一些实施方案中,静脉内输液持续时间为约50 分钟、约55分钟、约60分钟、约65分钟、约70分钟、约75分钟、约81分钟、约87分钟、约90分钟、约95分钟,或这些数值中任何两个值之间的范围(包括端点) 或其中任何值。在一些实施方案中,静脉输液持续时间≥60分钟。
45.在一些实施方案中,抗tigit抗体或抗原结合片段(或制剂)与其他治疗方法联合用于治疗肿瘤或癌症,例如化疗、放疗、免疫治疗、激素治疗、靶向治疗、生物治疗和手术治疗等。在一些实施方案中,抗tigit抗体或抗原结合片段(或制剂)与其他肿瘤或癌症治疗剂联合治疗肿瘤或癌症,如激素、治疗肿瘤或癌症的抗体等。
46.另一方面,本发明公开了抗tigit抗体或抗原结合片段在制备用于治疗肿瘤或癌症的药物中的应用。在一些实施方案中,用于治疗肿瘤或癌症的药物包括抗tigit抗体或抗
原结合片段。在一些实施方案中,抗tigit抗体为抗体h10d8of。在一些实施方案中,抗tigit抗体为抗体h10d8ofkf。在一些实施方案中,抗体h10d8ofkf岩藻糖基化水平为0-10%。
47.另一方面,本发明还公开了一种试剂盒,试剂盒包含抗tigit抗体或抗原结合片段(或制剂)和用于指导有需要患者给药抗tigit抗体或抗原结合片段(或制剂)的说明书。在一些实施方案中,抗tigit抗体为抗体h10d8of。在一些实施方案中,抗tigit抗体为抗体h10d8ofkf。在一些实施方案中,抗体h10d8ofkf岩藻糖基化水平为0-10%。
48.另一方面,本发明还公开了包含抗tigit抗体或抗原结合片段的适合注射用的药物组合物,如推注型药物组合物或输液(滴注)型药物组合物。适于注射用途的药物组合物包括无菌水性溶液(在此是水溶性的)或分散体以及用于即时制备无菌注射液或分散体的无菌粉末。对于静脉内施用,合适的载体包括生理盐水、抑菌水或磷酸盐缓冲盐水(pbs)、乙醇、多元醇(例如,甘油、丙二醇和液体聚乙二醇等)的溶剂或分散介质,及其适宜的混合物。在一些实施方案中,药物组合物还包括药学可接受的载体。在一些实施方案中,药学上可接受的载体可以包含抗细菌剂和/或抗真菌剂,如对羟基苯甲酸酯、氯代丁醇、苯酚、抗坏血酸、硫柳汞等来实现。在一些实施方案中,药学上可接受的载体可以包含等渗剂,如糖、多元醇(诸如甘露糖醇、山梨醇)、氯化钠。在一些实施方案中,药物组合物至少包含0.1%的抗tigit抗体或抗原结合片段。抗体的百分比可以变化,并且为给定剂型重量的约2%至90%之间。这种治疗上有用的药物组合物中抗tigit抗体或抗原结合片段的量可以为给药的有效量。在一些实施方案中,抗tigit抗体为抗体h10d8of。在一些实施方案中,抗tigit抗体为抗体 h10d8ofkf。在一些实施方案中,抗体h10d8ofkf由α-(1,6)-岩藻糖基转移酶基因敲除的细胞系表达。在一些实施方案中,抗体h10d8ofkf由α-(1,6)-岩藻糖基转移酶基因敲除的cho细胞表达。
49.另一方面,本发明还公开了上述药物组合物的制备方法:分别将本文所述的抗tigit抗体或抗原结合片段与药学上可接受的适合注射用的载体(例如注射用水,生理盐水等)混合。上述抗tigit抗体或抗原结合片段与药学上可接受的载体的混合方法是本领域通常已知的。
50.本发明抗tigit抗体或抗原结合片段(或制剂)可用于肿瘤或癌症的治疗。
附图说明
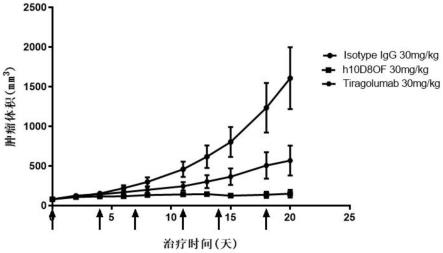
51.图1a和1b显示抗tigit抗体抑制肿瘤细胞的增殖;其中,isotype igg 30mg/kg 表示g1组,h10d8of 30mg/kg表示g2组,h10d8ofkf 10mg/kg表示g3组, h10d8ofkf 30mg/kg表示g4组,tiragolumab 30mg/kg表示g5组。
52.术语
53.除非另作说明,否则下列的每一个术语应当具有下文所述的含义。
54.定义
55.应当注意的是,术语“一种”实体是指一种或多种该实体,例如“一种抗体”应当被理解为一种或多种抗体,因此,术语“一种”(或“一个”)、“一种或多种”和“至少一种”可以在本文中互换使用。
56.本文所用的术语“包含”或“包括”意味着组合物和方法等包括所列举的元素,例如组份或步骤,但不排除其它。“基本上由
……
组成”意味着组合物和方法排除对组合的特征
有根本影响的其它元素,但不排除对组合物或方法无本质上影响的元素。“由
……
组成”意味着排除未特别列举的元素。
57.术语“多肽”旨在涵盖单数的“多肽”以及复数的“多肽”,并且是指由通过酰胺键(也称为肽键)线性连接的氨基酸单体构成的分子。术语“多肽”是指两个或更多个氨基酸的任何单条链或多条链,并且不涉及产物的特定长度。因此,“多肽”的定义中包括肽、二肽、三肽、寡肽、“蛋白质”、“氨基酸链”或用于指两个或多个氨基酸链的任何其他术语,并且术语“多肽”可以用来代替上述任何一个术语,或者与上述任何一个术语交替使用。术语“多肽”也意在指多肽表达后修饰的产物,包括但不限于糖基化、乙酰化、磷酸化、酰胺化、通过已知的保护/封闭基团衍生化、蛋白水解切割或非天然发生的氨基酸修饰。多肽可以源自天然生物来源或通过重组技术产生,但其不必从指定的核酸序列翻译所得,它可能以包括化学合成的任何方式产生。
[0058]“氨基酸”是指既含氨基又含羧基的有机化合物,比如α-氨基酸,其可直接或以前体的形式由核酸编码。单个氨基酸由三个核苷酸(所谓的密码子或碱基三联体)组成的核酸编码。每一个氨基酸由至少一个密码子编码。相同氨基酸由不同密码子编码称为“遗传密码的简并性”。氨基酸包括天然氨基酸和非天然氨基酸。天然氨基酸包括丙氨酸(三字母代码:ala,一字母代码:a)、精氨酸(arg,r)、天冬酰胺(asn,n)、天冬氨酸(asp,d)、半胱氨酸(cys,c)、谷氨酰胺(gln,q)、谷氨酸(glu,e)、甘氨酸(gly, g)、组氨酸(his,h)、异亮氨酸(ile,i)、亮氨酸(leu,l)、赖氨酸(lys,k)、甲硫氨酸(met, m)、苯丙氨酸(phe,f)、脯氨酸(pro,p)、丝氨酸(ser,s)、苏氨酸(thr,t)、色氨酸(trp, w)、酪氨酸(tyr,y)和缬氨酸(val,v)。
[0059]“保守氨基酸取代”是指一个氨基酸残基被另一个含有化学性质(例如电荷或疏水性)相似的侧链(r基团)的氨基酸残基所取代。一般而言,保守氨基酸取代不大会在实质上改变蛋白质的功能性质。含有化学性质相似侧链的氨基酸类别的实例包括:1) 脂族侧链:甘氨酸、丙氨酸、缬氨酸、亮氨酸和异亮氨酸;2)脂族羟基侧链:丝氨酸和苏氨酸;3)含酰胺的侧链:天冬酰胺和谷氨酰胺;4)芳族侧链:苯丙氨酸、酪氨酸和色氨酸;5)碱性侧链:赖氨酸、精氨酸和组氨酸;6)酸性侧链:天冬氨酸和谷氨酸。
[0060]“vl、vh的保守氨基酸取代”的氨基酸数目可为约1个、约2个、约3个、约4 个、约5个、约6个、约8个、约9个、约10个、约11个、约13个、约14个、约 15个保守氨基酸取代,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值。“重链或轻链的保守氨基酸取代”的氨基酸数目可为约1个、约2个、约3个、约4个、约5个、约6个、约8个、约9个、约10个、约11个、约13个、约14个、约15个、约18个、约19个、约22个、约24个、约25个、约29个、约31个、约 35个、约38个、约41个、约45个保守氨基酸取代,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值。
[0061]
术语“编码”应用于多聚核苷酸时,是指被称为“编码”多肽的多聚核苷酸,在其天然状态或当通过本领域技术人员公知的方法操作时,经转录和/或翻译可以产生该多肽和/或其片段。
[0062]
本发明公开的抗体、抗原结合片段或衍生物包括但不限于多克隆、单克隆、多特异性、全人源、人源化、灵长类化、嵌合抗体、单链抗体、表位结合片段(例如类fab、类fab'和类f(ab')2)、类单链fvs(scfv)。
[0063]
术语“重组”涉及多肽或多聚核苷酸,意指天然不存在的多肽或多聚核苷酸的形
式,不受限制的实施例可以通过组合产生通常并不存在的多聚核苷酸或多肽。
[0064]“同一性”是指两个肽之间或两个核酸分子之间的序列相似性。可以通过比较每个序列中可以比对的位置来确定同源性。当被比较的序列中的位置被相同的碱基或氨基酸占据时,则分子在该位置是同源的。序列之间的同源程度是由序列共有的匹配或同源位置的数目组成的一个函数。
[0065]“至少80%同一性”为约80%同一性、约81%同一性、约82%同一性、约83%同一性、约85%同一性、约86%同一性、约87%同一性、约88%同一性、约90%同一性、约91%同一性、约92%同一性、约94%同一性、约95%同一性、约98%同一性、约 99%同一性,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值。
[0066]
多聚核苷酸或多聚核苷酸序列(或多肽或抗体序列)与另一序列有具有一定百分比(例如90%、95%、98%或者99%)的“同一性”或“序列同一性”是指当序列比对时,所比较的两个序列中该百分比的碱基(或氨基酸)相同。可以使用目测或本领域已知的软件程序来确定该比对同一性百分比或序列同一性,比如ausubel et al.eds.(2007) 在current protocols in molecular biology中所述的软件程序。优选使用默认参数进行比对。其中一种比对程序是使用默认参数的blast,例如blastn和blastp,两者使用下列默认参数:geneticcode=standard;filter=none;strand=both;cutoff=60; expect=10;matrix=blosum62;descriptions=50sequences;sortby=highscore; databases=non-redundant;genbank embl ddbj pdb genbankcdstranslations swi ssprotein spupdate pir。生物学上等同的多聚核苷酸是具有上述指定百分比的同一性并编码具有相同或相似生物学活性的多肽的多聚核苷酸。
[0067]“抗体”、“抗原结合片段”是指特异性识别和结合抗原的多肽或多肽复合物。抗体可以是完整的抗体及其任何抗原结合片段或其单链。因此术语“抗体”包括分子中含有具有与抗原结合的生物学活性的免疫球蛋白分子的至少一部分的任何蛋白质或肽。抗体和抗原结合片段包括但不局限重链或轻链或其配体结合部分的互补决定区(cdr)、重链可变区(vh)、轻链可变区(vl)、重链恒定区(ch)、轻链恒定区(cl)、框架区(fr)或其任何部分,或结合蛋白的至少一部分。cdr区包括轻链的cdr区 (lcdr1-3)和重链的cdr区(hcdr1-3)。
[0068]
术语“抗体”包括可以在生物化学上区分的各种广泛种类的多肽。本领域技术人员将会理解,重链的类别包括gamma、mu、alpha、delta或epsilon(γ、μ、α、δ、ε),其中还有一些亚类(例如γ1-γ4)。该链的性质决定了抗体的“种类”分别为igg、igm、 iga、igg或ige。免疫球蛋白亚类(同种型),例如igg1、igg2、igg3、igg4、igg5 等已被充分表征并且赋予的功能特异性也已知。所有的免疫球蛋白种类都在本发明公开的保护范围内。在一些实施方案中,免疫球蛋白分子为igg种类。
[0069]
轻链可以分为kappa(κ)或lambda(λ)。每个重链可以与κ或λ轻链结合。一般来说,当由杂交瘤,b细胞或基因工程宿主细胞生产免疫球蛋白时,其轻链和重链通过共价键结合,两条重链的“尾巴”部分通过共价二硫键或非共价键结合。在重链中,氨基酸序列从y构型的叉状末端的n末端延伸至每条链底部的c末端。免疫球蛋白κ轻链可变区为vκ;免疫球蛋白λ轻链可变区为v
λ
。
[0070]
轻链和重链都分成结构和功能同源性的区域。术语“恒定的”和“可变的”根据功能被使用。轻链可变区(vl)和重链可变区(vh)决定了抗原识别和特异性。轻链恒定区(cl)和
重链恒定区(ch)赋予重要的生物学性质,如分泌、经胎盘移动、fc 受体结合、补体结合等。按照惯例,恒定区的编号随着它们变得更远离抗体的抗原结合位点或氨基末端而增加。n端部分是可变区,c端部分是恒定区;ch3和cl结构域实际上分别包含重链和轻链的羧基端。
[0071]
在本领域中使用和/或接受的术语有两个或多个定义的情况下,除非明确地对立指出,否则本文使用的术语的定义包括所有这些含义。一个具体的例子是使用“互补决定区”(“cdr”)一词来描述在重链和轻链多肽的可变区内发现的非连续的抗原结合位点。这一特定区域在kabat et al.,u.s.dept.of health and human services,sequences ofproteins of immunological interest(1983)和chothia等在j.mol.biol.196:901-917 (1987)有相关描述,其通过引用全部并入本文。
[0072]
根据kabat和chothia定义的cdr包括相互比较时的氨基酸残基的重叠或子集。尽管如此,应用任一定义来指代抗体或其变体的cdr都在本发明范围内。包含特定 cdr的确切残基编号将根据cdr的序列和大小而变化。本领域技术人员通常可以根据抗体的可变区氨基酸序列确定出cdr包含哪些特定的残基。
[0073]
kabat等人还定义了适用于任何抗体的可变区序列的编号系统。本领域普通技术人员可以不依赖于序列本身以外的其他实验数据将该“kabat编号”系统应用到任何可变区序列。“kabat编号”是指由kabat et al.,u.s.dept.of health and human services在“sequence of proteinsof immunological interest”(1983)提出的编号系统。抗体还可以用 eu或chothia编号系统。
[0074]“治疗”是指治疗性治疗和预防性或防治性措施,其目的是预防、减缓、改善和停止不良的生理改变或紊乱,例如疾病的进程,包括但不限于以下无论是可检测还是不可检测的结果,症状的缓解、疾病程度的减小、疾病状态的稳定(即不恶化)、疾病进展的延迟或减缓、疾病状态的改善或缓和,减轻或消失(无论是部分还是全部)、延长与不接受治疗时预期的生存期限等。需要治疗的患者包括已经患有病症或紊乱的患者,容易患有病症或紊乱的患者,或者需要预防该病症或紊乱的患者,可以或预期从施用本发明公开的抗体或组合物用于检测、诊断过程和/或治疗中受益的患者。
[0075]“患者”指需要诊断、预后或治疗的任何哺乳动物,包括人类、狗、猫、豚鼠、兔子、大鼠、小鼠、马、牛等。在一些实施方案中,患者为人。
[0076]“约”指相关技术领域技术人员容易知道的相应数值的常规误差范围。在一些实施方式中,本文中提到“约”指所描述的数值以及其
±
10%、
±
5%或
±
1%的范围。
[0077]“有效量”是指活性化合物或药剂的量,其能引起组织、系统、动物、个体或人类的生物学或医学反应;有效量由研究人员、兽医、医生或其他临床医生寻求的。
[0078]“ic
50”表示50%抑制浓度,即对指定的生物过程抑制一半时所需的药物或者抑制剂的浓度。
[0079]
如本文所用,术语“有需要”是指已将患者鉴定为需要特定方法或治疗。在一些实施例中,可以通过任何诊断方式进行识别。在本文描述的任何方法和治疗中,患者可能需要。
[0080]
可以按常规方法根据本文所述抗体氨基酸序列设计合成编码抗体的dna,将其置入表达载体中,然后转染宿主细胞,在培养基中培养被转染的宿主细胞产生单克隆抗体。在一些实施方案中,表达抗体载体包括至少一个启动子元件,抗体编码序列,转录终止信号和
polya尾。其他元件包括增强子,kozak序列及插入序列两侧rna剪接的供体和受体位点。可以通过sv40的前期和后期启动子,来自逆转录病毒的长末端重复序列如rsv、htlv1、hivi及巨细胞病毒的早期启动子来获得高效的转录,也可应用其它一些细胞的启动子如肌动蛋白启动子。合适的表达载体可包括pires1neo, pretro-off,pretro-on,plxsn,或者plncx,pcdna3.1( /-),pcdna/zeo( /-), pcdna3.1/hygro( /-),psvl,pmsg,prsvcat,psv2dhfr,pbc12mi和pcs2等。常使用的哺乳动物细胞包括hek293细胞,cos1细胞,cos7细胞,cv1细胞,鼠l 细胞和cho细胞等。
具体实施方式
[0081]
以下通过具体的实施例进一步说明本发明的技术方案,具体实施例不代表对本发明保护范围的限制。其他人根据本发明理念所做出的一些非本质的修改和调整仍属于本发明的保护范围。
[0082]
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0083]
实施例1抗体的制备方法
[0084]
根据cho密码子偏爱性优化抗体的重链和轻链dna序列。用pcr引物修饰dn a序列的5’端,在轻链和重链dna序列的5’端添加kozak序列及信号肽dna序列,再克隆到现有表达载体中,通过测序分析验证重组质粒的正确构建。将上述重组质粒转染表达细胞中进行表达,收集上清液、纯化获得抗体蛋白样品,并用于下面各种实施例。
[0085]
其中,1)抗体h10d8of制备过程中,采用的表达载体为pcdna3.1
tm
( )(invitr ogen公司,货号为v79020),表达细胞为cho细胞;2)抗体h10d8ofkf制备过程中,采用的表达载体为pcdna3.1
tm
( ),表达细胞为α-(1,6)-岩藻糖基转移酶基因敲除的cho细胞,经测试岩藻糖基化水平约为0;3)参照抗体tiragolumab制备过程中,采用的表达载体为pcdna3.1
tm
( ),表达细胞为cho细胞。抗体h10d8of和h10d8 ofkf的氨基酸序列见表1(抗体h10d8of和h10d8ofkf的序列是相同的),参照抗体tiragolumab的氨基酸序列见表2,抗体h10d8of和h10d8ofkf的dna序列见表3(抗体h10d8of和h10d8ofkf的序列是相同的)。
[0086]
抗体h10d8of和h10d8ofkf的轻链dna序列的5’端添加的dna序列为端添加的dna序列为如seq id no: 19所示,kozak序列用下划线示出,信号肽用斜体示出;重链dna序列的5’端添加的dna序列为如 seq id no:20所示,kozak序列用下划线示出,信号肽用斜体示出。参照抗体tira golumab的轻链dna序列的5’端添加的dna序列为端添加的dna序列为如seq id no:21所示,kozak序列用下划线示出,信号肽用斜体示出;重链dna序列的5’端添加的dna序列为端添加的dna序列为如seq id no:22所示,ko zak序列用下划线示出,信号肽用斜体示出。
[0087]
表1抗体h10d8of和h10d8ofkf的氨基酸序列
[0088][0089][0090]
表2参照抗体tiragolumab的氨基酸序列
[0091][0092]
表3抗体h10d8of和h10d8ofkf的dna序列
[0093]
[0094][0095]
实施例2阻断tigit与配体pvr结合试验
[0096]
采用流式细胞术检测抗tigit抗体阻断游离的pvr-fc与tigit-jurkat细胞表面的tigit的结合。试验步骤为:取活力良好(细胞活力大于90%)的tigit-jurkat细胞,离心后用pbs重悬为密度1000万/ml,加入到96孔尖底板中,每孔50μl,即每孔细胞数量为50万;取适量的生物素化的pvr-fc(即pvr-fc-bio),用pbs(磷酸缓冲液)进行稀释,配制成pvr-fc-bio稀释液,终浓度为12.5nm;取适量抗tigit 抗体或参照抗体tiragolumab,用pvr-fc-bio稀释液进行稀释,抗体起始浓度为200 nm,2倍梯度稀释,共10个浓度梯度,每个浓度点设3个复孔;2-8℃条件下孵育1 个小时,然后用pbs洗涤2次,加入1:1000稀释的荧光二抗streptavidin-pe(ebioscience, cat#12-4317-87)稀释液,每孔100μl,2-8℃孵育30min;然后pbs洗涤2次,采用流式分析仪检测荧光强度(mean pe-a)。
[0097]
pvr-fc-bio的制备方法为:人pvr胞外区的核酸序列添加酶切位点(hindiii和 ecori),通过连接子与人igg1重链恒定区的核酸序列进行融合;融合之后的序列被插入到pcdna3.1
tm
( )载体中,然后瞬时转染hek293f细胞;培养完成的细胞上清通过proteina亲和层析纯化,纯化得到的融合蛋白命名为pvr-fc;取适量pvr-fc蛋白,使用thermo scientific公司的生物素标记试剂盒( hsulfo-nhs-lc-biotinylationkit,
货号:21435),按照说明书中的操作步骤对pvr-fc 进行生物素化标记,标记后的蛋白命名为pvr-fc-bio。其中,人pvr胞外区的氨基序列如seq id no:13所示,连接子的核苷酸序列如seq id no:14所示,连接子的氨基酸序列如seq id no:23所示,人igg1重链恒定区的氨基酸序列如seq id no:15 所示,pvr-fc的氨基酸序列如seq id no:24所示(见表4)。
[0098]
tigit-jurkat细胞的制备方法为:用人全长tigit基因替换pcmv2-cfd-flag(义翘神州,货号:hg10160-m-f)上的目的基因得到重组质粒,用限制性内切酶clai (bsu15i)将重组质粒线性化之后采用电穿孔法进行转染jurkat细胞系(atcc,clone e6-1,tib-152
tm
)。筛选压为潮霉素,得到阳性细胞株再进行亚克隆进而得到可以稳定表达人tigit细胞系,即:tigit-jurkat细胞。其中,人全长tigit基因的序列如 seq id no:16所示(见表4)。
[0099]
1)在同样条件下,抗体h10d8of和抗体tiragolumab均可以有效地阻断tigit 与pvr-fc的结合,两者的ic
50
值分别为0.4409nm和2.820nm;抗体h10d8of的阻断能力要优于抗体tiragolumab。
[0100]
2)在同样条件下,抗体h10d8ofkf和抗体tiragolumab均可以有效地阻断tigit 与pvr-fc的结合,两者的ic
50
值分别为0.742nm和2.820nm;抗体h10d8ofkf的阻断能力要优于抗体tiragolumab。
[0101]
表4相关序列
[0102]
[0103][0104]
实施例3体内药效试验
[0105]
人源化小鼠balb/c-hpd1/htigit(江苏集萃药康生物科技股份有限公司)皮下接种ct26结肠癌肿瘤细胞;接种肿瘤细胞后,当小鼠的平均肿瘤体积为79.65mm3时,进行分组,每组10只。分组当天定义为d0天,并于d0天、d4天、d7天、d11天、d14天、d18天采用腹腔注射(i.p.)方式进行给药,给药的剂量为10mg/kg或30mg/kg。给药方案见表5。
[0106]
表5给药方案
[0107][0108]
细胞接种后,每周常规监测肿瘤对动物正常行为的影响;具体指标包括:小鼠的活动性,摄食和饮水情况,体重增加或降低情况,眼睛、被毛及其它异常情况。肿瘤体积(mm3)为0.5
×
(肿瘤长径
×
肿瘤短径2),各组小鼠的肿瘤体积以平均值
±
标准误差(mean
±
sem)表示。tgitw(肿瘤重量的抑制率)计算公式为:
[0109]
tgitw=(1-(mean tw
给药组
)/(mean tw
对照组
))
×
100%;mean tw
给药组
:给药组小鼠终点处理时肿瘤重量的平均值,mean tw
对照组
:对照组小鼠终点处理时肿瘤重量的平均值。
[0110]
1)如图1a所示,抗体h10d8of和抗体tiragolumab都可以抑制ct26结肠癌增长,并且抗体h10d8of抑制肿瘤增长的效果优于抗体tiragolumab;在30mg/kg剂量下,试验终点(d20天)时相对肿瘤抑制率tgitw(%)前者为92.89%,后者为71.07%。
[0111]
2)如图1b所示,抗体h10d8ofkf和抗体tiragolumab都可以抑制ct26结肠癌增长,并且抗体h10d8ofkf抑制肿瘤增长的效果优于抗体tiragolumab。h10d8ofkf 在10mg/kg和30mg/kg剂量下以及tiragolumab在30mg/kg剂量下,试验终点时(d20 天)相对肿瘤抑制率tgitw(%)分别为92.39%、95.94%和71.07%。
[0112]
实施例4药代动力学和毒理试验
[0113]
4a)本研究采用18只食蟹猴(雌雄各半),随机分为3组,每组雌性和雄性动物各3只;每组动物未禁食单次静脉输注分别给予2、12和24mg/kg抗体(抗体h10d8of 或h10d8ofkf)注射液,共给药1次,静脉输注30min
±
10s;给药结束后血样采集至29天。通过血药浓度数据,运用phoenix7.0软件采用非房室模型计算其主要药代动力学参数。
[0114]
如表6和表7所示,在2-24mg/kg给药剂量范围内,未禁食后单次静脉输注给予 食蟹猴注射液后,血清中抗体(抗体h10d8of和h10d8ofkf)的系统暴露量无明显 性别差异,并且血清中系统暴露量与给药剂量呈正相关。
[0115]
表6食蟹猴给予抗体h10d8of注射液后的药代动力学参数
[0116][0117]
表7食蟹猴给予抗体h10d8ofkf注射液后的药代动力学参数
[0118]
[0119][0120]
4b)考察食蟹猴静脉输注给予抗tigit抗体后急性毒性反应。试验共设计4组,每组雌性各1只。给药剂量分别为0、100、200、400mg/kg,静脉输注给药,共给药一次,输注30min
±
10s;给药后连续观察22天。
[0121]
食蟹猴单次静脉输注30min给予100、200、400mg/kg抗体(抗体h10d8of或 h10d8ofkf)注射液后,食蟹猴能较好耐受;与同期对照组相比,抗体h10d8ofkf 注射液所有剂量组中,食蟹猴在给药后出现与抗体供试品相关的耗食量下降,后呈现恢复趋势且缺乏关联性,不被认为是有害的;抗体h10d8of各剂量组未见耗食量明显异常变化;无其它与抗体供试品相关的生存率、临床观察、体重、体温、心电图、临床病理及肉眼解剖变化出现。因此,本试验条件下,抗体注射液静脉单次给药的最大耐受剂量(mtd)大于400mg/kg。
[0122]
4c)食蟹猴每周静脉输注给予抗体(抗体h10d8of或h10d8ofkf)注射液一次,共重复五次后评估毒性反应及其毒代动力学;恢复四周后观察损害的可逆情况或可能的迟发毒性反应。给药结束后每组每性别解剖3只动物,恢复期结束每组每性别解剖剩余2只动物。
[0123]
如表8和表9所示,首次给药及第4次给药后血清中抗体(抗体h10d8of或 h10d8ofk)暴露量(以auc
(0-t)
计)随剂量的增加而增加。试验期间,试验组动物均 未观察到与给予抗体(抗体h10d8of或h10d8ofk)相关的体重、耗食量、给药部位 刺激、眼科、呼吸、血液学、血清生化、凝血、尿液、细胞因子、淋巴细胞表型及脏 器重量等指标的异常变化。
[0124]
静脉给予10、30、100mg/kg的抗体h10d8of或h10d8ofkf注射液5次后,抗体供试品未引起明显或严重的毒性反应,推测抗体h10d8of和h10d8ofkf注射液未观察到有损伤作用的剂量水平(noael)为100mg/kg。
[0125]
免疫原性结果表明,1)食蟹猴在重复给药毒性试验中给予10、30、100mg/kg的抗体h10d8of后,10、30mg/kg剂量组抗药物抗体(ada)的阳性率分别为50%和 25%,高剂量组未检测到ada;2)食蟹猴在重复给药毒性试验中给予10、30、100mg/kg 的抗体h10d8ofkf后,10、30、100mg/kg剂量组抗药物抗体的阳性率分别为70%、 33%、50%。
[0126]
表8食蟹猴长期毒性试验中抗体h10d8of的毒代动力参数
[0127][0128]
表9食蟹猴长期毒性试验中h10d8ofkf的毒代动力参数
[0129][0130]
4d)采用新西兰兔血红细胞进行溶血试验。当抗体(抗体h10d8of或h10d8ofkf) 注射液(25mg/ml)稀释超过10倍时,不会引起兔红细胞的溶血或凝集。
[0131]
实施例5抗体h10d8of和h10d8ofkf的临床研究
[0132]
本研究是两项分别评价抗体h10d8of和h10d8ofkf注射液在晚期恶性实体肿瘤患者中的安全性、耐受性、药代动力学(pk)特征和初步临床有效性的多中心、开放性、剂量递增的i期临床试验;探索最大耐受剂量(mtd)或最大给药剂量(mad)。
[0133]
抗体h10d8of临床研究分为两个阶段,第一阶段是基于加速滴定方法和“3 3”的剂量递增规则来探索安全剂量范围,主要分为:30mg(起始剂量)组、100mg组采用加速滴定方法进行剂量递增研究;300mg组、600mg组、900mg组按标准“3 3”规则进行剂量递增研究;第二阶段,剂量扩展研究,进一步研究抗体注射液的安全性和临床有效性。
[0134]
抗体h10d8ofkf临床研究分为两个阶段,第一阶段是基于加速滴定方法和“3 3”的剂量递增规则来探索安全剂量范围,主要分为:10mg(起始剂量)组、30mg组、 100mg组采用加速滴定方法进行剂量递增研究;300mg组、600mg组、900mg组按标准“3 3”规则进行剂量递增研究;第二阶段,剂量扩展研究,进一步研究抗体注射液的安全性和临床有效性。
[0135]
三组采用加速滴定的剂量递增方案即队列规模=1。首先纳入1例受试者,在dlt 评估期内如果未观察到dlt事件,则可直接进入下一组进行剂量递增,以此规则 (“1 1”)类推,加速递增至(300mg)剂量组。在加速递增过程中,若在某一组别观察到与研究药物相关的2级及以上毒性反应,则停止加速剂量递增,转为标准“3 3”剂量递增(即队列规模=3)规则。
[0136]
每3周以静脉输注给药1次,为1个周期(疗程),输注时长可≥60分钟。如果患者出现输液相关反应并能够继续治疗,可基于临床实际情况可以使用苯海拉明或对乙酰氨基酚等进行预防给药。研究药物治疗应持续至出现:疾病进展、或不可耐受的毒性而退出、或因无疗效获益而接受新的抗肿瘤治疗、或撤回知情同意以及其它原因主动退出、或最长17个周期(约1年),以先出现者为准。dlt评估期:为第1个治疗周期(从首次给药至给药后21天)。
[0137]
耐受性评价指标涉及:剂量限制性毒性(dlt)事件及其发生率;安全性评价指标涉及:生命体征与体格检查、实验室检查(血常规、血生化、甲状腺功能、凝血常规、尿常规、便常规、妊娠试验)、ecog评分、心电图、不良事件(包括免疫相关不良事件)等。
[0138]
药效学受体占有率(ro)研究:抗体注射液的受体占有率研究是通过检测外周血中t细胞表面tigit受体结合来实现的。所有剂量组的受试者在治疗期间的特定时间点需要收集血样。药效学受体占有率研究只在剂量递增受试者中开展。每个时间点计划采集2ml血样,分别于第1周期给药前、给药结束时、168h、336h密集采样,第2 至第6个周期给药前采样。
[0139]
免疫原性评价指标涉及:抗药抗体(ada)的样品阳性率和个体阳性率,ada阳性样品的滴度,ada阳性的样本将继续检测是否为中和抗体(nab)。
[0140]
所有剂量组的受试者在治疗期间(前3个治疗周期)的规定时间点需要收集血样。给药前60分钟内监测血浆浓度(c
trough
)。每个时间点计划采2ml血样,检测血清药物的浓度水平,研究药代动力学(pk)特征。pk涉及的参数有:单次给药时,参数包括c
max
、t
max
、t
1/2
、cl、vd、ke、mrt、auc
(0-τ)
、auc
(0-∞)
;多次给药时,参数包括c
max,ss
、c
avg,ss
、c
min,ss
、auc
(0-τ)
,ss、au
c(0-∞)
,ss、tmax,ss、t
1/2
,ss、cl、vss、ke、 mrt、蓄积指数(rac)、波动指数df。
[0141]
临床有效性评价:客观缓解率(orr)、缓解持续时间(dor)、疾病控制率(dcr)、无进展生存期(pfs)及总生存期(os)。
[0142]
客观缓解率(objective response rate,orr):为完全缓解(cr)和部分缓解(pr) 的受试者的比例;缓解持续时间(duration ofresponse,dor):为肿瘤第一次评估为客观缓解(objective response,or)至第一次评估为pd(progressive disease)或pd前任何原因死亡的时间,反映orr的持续时间;无进展生存期(progression-free survival: pfs):为从首次给药至出现肿瘤客观进展或全因死亡的时间(以先发生者为准)。“mtd”为某一剂量组在dlt评估期内观察到≤1/6的受试者中探索到的dlt的最高剂量水平。
[0143]“剂量限制性毒性(dlt)”为在dlt观察期发生的不良事件(ae)并被认为至少可能与研究药物相关,具体如下:
[0144]
·
5级毒性;
[0145]
■
血液学毒性:
[0146]
·
4级血液学毒性(注:3~4级淋巴细胞减少症不计入dlt);
[0147]
·
持续任何时间的4级血小板减少症;
[0148]
·
伴有出血倾向的或需要输注血小板的3级血小板减少症;
[0149]
·
持续任何时间的4级中性粒细胞减少症;
[0150]
·
3级的中性粒细胞减少伴感染或持续时间≥7天或3级中性粒细胞减少伴发热;
[0151]
■
非血液学毒性:
[0152]
·
3、4级非血液学毒性(注:
①
3级恶心、呕吐、皮疹除外;
②
经过临床干预后可控制在3天以内的3级腹泻除外;
③
持续时间在7天以内疲劳/乏力除外);
[0153]
·
符合任一以下条件的、因临床实验室检查发现的3、4级非血液学毒性:
①
需要进行临床干预的;
②
导致住院治疗的;
③
持续时间≥7天的;
④
所有导致受试者在第1 周期中停止治疗的;
⑤
任何导致第2周期给药延迟超过2周的治疗相关毒性;
[0154]
·
≥2级的脑部病变;
[0155]
·
需进行系统治疗的眼毒性(注:任何出现视力变化或眼部毒性达2级或更高的病人都将由眼科医生进行评估);
[0156]
在dlt判定中,一些明显且无可争议的由于疾病进展或dlt以外的原因而导致的ae则不应计入dlt。在为期21天的dlt观察期内,由于非dlt原因(如与基础疾病、疾病进展、伴随用药或伴随疾病明显相关的不良事件)而退出的受试者将被视为不可评估,并将被替换。若受试者是主动退出研究,须尽快、按要求完成末次访视。被替补的受试者在统计时纳入ss集,但在计算dlt事件发生比例时不计入该组别总人数中。经申办方与研究者一致同意后,允许对部分受试者进行重复筛选,需重新分配筛选号。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。