1.本发明属于医学检验领域,涉及药物浓度检测,具体地为一种药物-蛋白解离组合物、含其的环孢霉素检测试剂盒及应用。
背景技术:
2.治疗药物监测(tdm)是对治疗指数窄、毒性作用强、个体差异大的药物,测定其血液或其他体液中的药物浓度,用以评价疗效,根据药动学原理制订个体给药方案,以提高药物治疗水平,达到临床安全、有效、合理的用药。血药浓度监测的临床实践已充分肯定了其对于药物治疗的指导与评价作用,以及提高合理用药水平所起的作用。例如,通过tdm和个体化给药方案,使癫痫发作的控制率从47%提高到74%。目前在美、英、加拿大等国家,tdm已成为一项日常医疗工作。实验室常用的药物浓度监测方法为液相质谱、气相质谱等,但因其操作复杂,仪器昂贵,对技术人员专业知识要求高,难以在医院普及。目前各个诊断试剂生产商,已相继推出部分治疗药物监测试剂盒,包括:他克莫司、环孢霉素a、伏立康唑、伊曲康唑、地高辛、奥卡西平、丙戊酸、卡马西平等,这些诊断试剂产品使用简便、反应时间短,结果准确,大大方便了监测工作的开展,随着越来越多的药物监测试剂盒被开发出来,个体化给药的普及,未来患者用药将更安全、更有效。
3.药物进入人体后,多数药物在血液中与血浆蛋白结合,部分药物还可以与血细胞结合或进入其中,药物-蛋白结合体与游离药物达成动态平衡,起到缓释、运输功能,待药物至作用部位后,发生药理作用。药物浓度检测试剂盒一般利用特定药物的抗体与患者血液样本中的药物相互结合,进而得到其浓度值。不同的药物与血浆中蛋白的结合率不同,结合率越高,结合越牢固的药物,其抗体识别过程越困难,越不容易被检测出其浓度。如器官移植中抗排异的一线药物,环孢霉素与载体蛋白有极高的结合率。
4.环孢霉素的蛋白高结合率使得其浓度检测比较困难,虽然目前已有商业化试剂盒,基本满足临床需求,但也存在一定不足,如:都需要复杂的前处理过程,需要先向样本中加入一定量特殊的萃取剂,震荡混匀几十秒后,离心数分钟,再取样上机检测,样本的处理操作较为繁琐、耗时,且实验步骤越多,人工操作的误差产生积累效果越明显,影响测值准确性,另外由于萃取剂中含有易挥发有机成分,会污染环境,而且随着使用过程的不断开盖,其有效成分也随着减少,对药物的萃取效果也产生变化。
技术实现要素:
5.为解决上述缺点/缺陷,本发明提供了一种药物-蛋白解离组合物,及该组合物应用于胶乳增强比浊法试剂盒的方法,本发明可显著简化高蛋白结合率药物的检测操作,提高检测效率,适用性广,具有较大的应用前景。
6.为了解决上述问题,本发明第一方面提供一种药物-蛋白解离组合物,其包含25-150mm ph为6.5-9.0的缓冲液、1%-1.4%金属螯合剂、0.4%-1.2%氯化铵、0.3%-1.2%非
离子型表面活性剂、0.05%-0.3%脂肪酸、0.2%-1.5%胆酸钠、0.05%-0.2%水杨酸和0.05%-0.5%谷胱甘肽;百分比为各组分占药物-蛋白解离组合物的质量百分比。
7.某一具体实施例中,所述缓冲液为磷酸盐缓冲液、hepes缓冲液、mes缓冲液或mops缓冲液。
8.某一具体实施例中,所述缓冲液的浓度为50-100mm,ph值为6.8-7.4。
9.优选地,所述缓冲液为mop缓冲液,所述缓冲液的浓度为50mm,所述缓冲液的ph值为6.8。
10.某一具体实施例中,所述金属螯合剂为edta、egta或其盐。优选地,所述金属螯合剂为edta盐如edta-2na。
11.某一具体实施例中,所述金属螯合剂的质量分数为1.4%。
12.某一具体实施例中,所述氯化铵的质量分数为0.8%-1%。优选地,所述氯化铵的质量分数为1%。
13.某一具体实施例中,所述非离子型表面活性剂为聚氧乙烯聚氧丙烯嵌段聚醚。优选地,所述非离子型表面活性剂为f68、l64中一种或两种;
14.某一具体实施例中,所述非离子型表面活性剂的质量分数为1.2%。
15.某一具体实施例中,所述胆酸钠的质量分数为0.8%-1%。优选地,所述胆酸钠的质量分数为1%。
16.某一具体实施例中,所述脂肪酸包含戊酸、己酸和庚酸中的一种或多种。优选地,所述脂肪酸为戊酸;
17.某一具体实施例中,所述脂肪酸的质量分数为0.1%-0.2%。优选地,所述戊酸的质量分数为0.1%。
18.某一具体实施例中,所述水杨酸的质量分数为0.1%-0.2%。优选地,所述水杨酸的质量分数为0.1%。
19.某一具体实施例中,所述谷胱甘肽的质量分数为0.4%-0.5%。优选地,所述谷胱甘肽的质量分数为0.4%。
20.本发明第二方面提供一种免萃取血药浓度检测试剂盒,其包含如本发明第一方面所述的药物-蛋白解离组合物。
21.较佳地,其包含:试剂r1和试剂r2;其中:
22.(1)试剂r1包含:环孢霉素蛋白复合物、如本发明第一方面所述的药物-蛋白解离组合物、防腐剂;
23.(2)试剂r2包含:抗环孢霉素单克隆抗体致敏的胶乳微球、缓冲液、稳定剂、防腐剂。
24.更佳地,所述免萃取血药浓度检测试剂盒还包含校准品;
25.所述校准品优选含环孢霉素的全血。
26.上述药物-蛋白解离组合物中,金属离子螯合剂如乙二胺四乙酸(edta)盐营造低渗环境,促进血液中细胞破裂,氯化铵主要裂解血红细胞,聚氧乙烯聚氧丙烯嵌段聚醚表面活性剂则可加速细胞裂解,并能提高试剂的抗干扰能力。脂肪酸、胆酸钠、水杨酸与血浆蛋白有较强的结合力,诱导的血浆蛋白构象变化促使了与蛋白结合药物的迅速释放。谷胱甘肽可与血浆白蛋白的药物结合活性位点形成二硫键,可一定程度阻止游离药物的再结合。
27.在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
28.本发明所用试剂和原料均市售可得。
29.本发明的积极进步效果在于:
30.1.本发明制备的试剂盒使用简便,无需繁琐样本前处理过程(约10分钟),降低了前处理中人工操作带来的误差及其对测值准确性的影响
31.2.由于市售试剂盒的萃取剂中含有易挥发有机试剂,使用过程污染环境,而且随着使用过程的不断开盖,其有效成分也随着减少,对药物的萃取效果也产生变化,进而影响测值准确性,本发明有效的避免了上述隐患。
附图说明
32.图1为实施例1试剂盒和商业化试剂盒样本对比。
33.图2为实验组3试剂盒和商业化试剂盒样本对比。
具体实施方式
34.下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
35.环孢霉素测定试剂盒(胶乳增强免疫抑制法),由试剂r1、试剂r2、校准品组成,试剂r1与试剂r2的体积比为1:1。
36.试剂r1包括:环孢霉素蛋白复合物、药物-蛋白解离组合物、防腐剂,
37.试剂r2包括:抗环孢霉素单克隆抗体致敏的胶乳微球、缓冲液、稳定剂、防腐剂
38.校准品为含环孢霉素的全血
39.试剂r2制备方法如下:
40.(1)聚苯乙烯胶乳微球的活化:取50g 240nm胶乳微球(浓度10%),加入10ml 500mm ph值为7.8的hepes溶液,7.5ml新鲜配制的浓度为20mg/ml的edc溶液,纯化水补足至终体积100ml,充分混匀,室温(20~25℃)混合30min;
41.(2)偶联:按微球:抗体质量比=15:1的比例将环孢霉素抗体加入上步反应液,室温混合偶联2h;
42.(3)封闭:将上述反应后的溶液超声5min,加入6.8ml 20%牛血清白蛋白溶液,于室温混合1h;
43.(4)洗涤:将上步反应后的溶液离心后去上清,加入等体积100mm tris7.8,超声至分散均匀,离心去上清,完成一次洗涤,重复洗2次;
44.(5)混合与保存:洗涤的2次后,再次离心去上清,加r2稀释液30ml(含100mm甘氨酸缓冲液,4%牛血清白蛋白、0.5%海藻糖、0.05%叠氮化钠,ph值8.0),超声15min,用r2稀释液定容终体积500ml,即得到试剂r2。
45.校准品制备方法如下:
46.取40ml全血,加入质量分数0.4%乙二胺四乙酸二钠液,用0.22μm滤膜之后,加入环孢霉素纯品,混匀后,按照赋值程序进行赋值,最终得到环孢霉素准品。
47.试剂r1制备方法如下:
48.实施例1
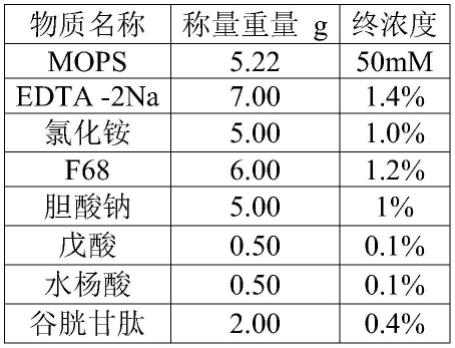
49.取纯化水450ml,按照下表称取各物质
[0050][0051][0052]
各物质溶解完全后,调ph至6.8,定容500ml,加入20μl环孢霉素蛋白复合物(母液浓度4.7mg/ml)
[0053]
实施例2
[0054]
取纯化水450ml,按照下表称取各物质
[0055]
物质名称称量重量g终浓度mops5.2250mmedta-2na5.001%氯化铵5.001.0%l641.500.3%胆酸钠4.000.8%戊酸1.000.2%水杨酸1.000.2%谷胱甘肽2.500.5%叠氮化钠0.500.1%
[0056]
各物质溶解完全后,调ph至6.8,定容500ml,加入24μl环孢霉素蛋白复合物(母液浓度4.7mg/ml)
[0057]
将r1与r2按1:1体积分装,与校准品一起组装成,环孢霉素测定试剂盒(胶乳增强免疫抑制法)。
[0058]
本发明中实施例1、2制备的试剂盒的效果相当,因此挑选实施例1进行对比例的研究。
[0059]
对比例1对实施例1制备的试剂盒进行性能分析
[0060]
表1试剂盒线性评估
[0061]
分别对高值血浆和低值血浆各进行11个梯度稀释并测试:
[0062][0063][0064]
商业化试剂盒线性范围30-1000ng/ml,本发明实施例1制备的试剂盒在此范围内回收率良好。
[0065]
为评估药物-蛋白解离组合物组份对测试的影响,共配制1组试剂与商业化试剂一起测样本,进行对比测试
[0066]
实验组1试剂r1中不添加药物-蛋白解离组合物,即r1含环孢霉素蛋白复合物、防腐剂、缓冲液,而试剂r2、校准品与实施例1共用同一批。
[0067]
实验组2试剂r1中含部分药物-蛋白解离组合物,即r1含环孢霉素蛋白复合物、防腐剂、缓冲液,edta-2na、氯化铵,各组份含量实施例1一致,但与无以下物质:f68、胆酸钠、戊酸、水杨酸、谷胱甘肽,试剂r2、校准品与实施例1共用同一批。
[0068]
实验组3试剂r1中将药物-蛋白解离组合物中的非离子型表面活性剂f68替换为行业内较常用的非离子型表面活性剂吐温80,即r1含环孢霉素蛋白复合物、防腐剂、缓冲液,edta-2na、氯化铵、胆酸钠、戊酸、水杨酸、谷胱甘肽,吐温80,各组份含量实施例1一致,试剂
r2、校准品与实施例1共用同一批。
[0069]
实施例1试剂盒试剂r1含药物-蛋白解离组合物,其试剂r2、校准品与实验组1、实验组2、实验组3共用同一批。
[0070]
样本处理
[0071]
实验组1、实验组2、实验组3及实施例1试剂盒样本不做预处理在生化仪上进行检测
[0072]
商业化试剂盒则按照说明书,使用其包装内前处理液对样本进行萃取:取200ul样本加入等量萃取液,混匀30秒,离心10min,取上清检测,进行检测,测试结果如下。
[0073]
表2实验组试剂盒、实施例1试剂盒与商业化试剂盒样本比对
[0074]
[0075][0076]
从表2可以看出,实验组1和实验组2的测值低很多,且与商业化试剂盒相关性很差,实验组2虽然添加了红细胞裂解组份,实验组3在实验组2的基础上,添加了脂肪酸、胆酸钠、水杨酸,谷胱甘肽使与蛋白结合的药物得到释放,可以检测到一定含量的环孢霉素,但
与商业化试剂相比,相关性和测值均较低,本实验采用种行业常用的表面活性剂吐温80,但效果不好。
[0077]
根据表1、2和图1、2,并结合上述分析可知,实施例1试剂盒的检测效果达到了与商业化试剂盒相当的回收率和检测效果。且实施例1的试剂盒和实验组1、实验组2、实验组3试剂盒在使用时均不需要进行复杂的前处理,差别仅在于药物-蛋白解离组合物,实施例1试剂盒的效果达到了与商业化试剂盒相当,实验组1-3的效果却远远低于实施例1试剂盒的效果。
[0078]
表3实施例1试剂盒稳定性跟踪
[0079][0080]
由表3可知,实施例1制备的环孢霉素测定试剂盒稳定性良好,4℃可储存12个月。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。