1.本实用新型涉及微纳加工和生命科学交叉的技术领域,尤其涉及一种细胞捕获及配对微流控封装芯片。
背景技术:
2.经过长期的研究,人们发现对于细胞生物学研究,即使是同种细胞也存在着个体差异性,这种性质被人们称之为细胞异质性。在传统的生物细胞实验中,群体分析会掩盖细胞个体之间的差异。所以,在单细胞层面研究细胞的异质性可以更清晰地了解细胞,研究各类生物体的生命历程。例如,癌症是一种高度异质性的疾病,研究癌症细胞的异质性可以更好地理解癌症的发生与发展对患者进行精准治疗。
3.细胞的异质性广泛存在于分化、免疫、代谢等多种细胞生命活动过程中,采用单细胞分析可以规避平均化实验中的个体差异性被掩盖的问题,从而研究细胞的异质性。细胞本身是一种包含丰富信息的生命单元,现阶段对于细胞的研究已经包含了基因组学、转录组学、代谢组学、分泌组学、细胞间相互作用等领域,随着细胞研究的深入,细胞内广泛的研究对象要求单细胞分析的实验条件具有高通量分析能力。
4.微流控芯片是一种具有在几平方厘米甚至更小的面积上对微量流体进行操控、分析的能力的实验芯片。采用微流控技术进行生物或者化学分析可以能够缩小研究尺度,减少实验误差,提高检测灵敏度,降低试剂或者样品的损耗。对于单细胞甚至是亚细胞水平的分析,微流控芯片是一种理想的实验操作平台。
5.对于在微流控芯片上进行单细胞分析,首先要对细胞进行捕获。目前,对于微流控芯片上的单细胞捕获有主动式和被动式两种方法:被动式包含微结构过滤、流体剪切力法等手段,原理是通过微结构或者细胞在不同流体动力下的差异性将细胞捕获到特定区域;主动式则包含介电电泳、光镊、声镊、磁珠分选、抗原抗体标记等方法,通过人为施加一些外源力或者生物标记来控制细胞的移动。被动式的细胞捕获方式灵敏度低,所需细胞量也比较大,同时细胞也会因为特殊的微结构造成一定的挤压形变或者损伤;主动式的细胞捕获方式往往需要添加特异性标记,会对下游单细胞分析造成一定的影响。
6.介电电泳(dielectrophoresis,dep)是一种基于电泳技术发展出的技术,是一种特殊的电泳,也被称作双向电泳。介电电泳指的是中性粒子在带有非匀强电场的液体中相对液体进行运动的现象。利用介电电泳,我们可以设计出不同的结构,外加高频电场使细胞在微流控芯片内定向移动,这是一种高通量、不需要特殊标记、对细胞无接触无损伤的细胞捕获方法。
7.目前,越来越多的研究将细胞在微流控芯片上排布成单细胞阵列进行单细胞分析。在芯片上形成多重细胞阵列可以对多种细胞进行多重分析,平行实验增强了对照性,也避免了多块芯片上样因为芯片间的差异产生的实验误差。
8.现阶段还没有很多手段可以实现多重细胞阵列,故有必要涉及一种细胞捕获及配对微流控封装芯片。
技术实现要素:
9.本实用新型的目的在于提供一种可以捕获三种细胞且可为研究同种细胞的异质性提供非常大的可能性的细胞捕获及配对微流控封装芯片,能够实现较为稳定的细胞悬液流速,实现良好的细胞捕获效果。
10.本实用新型提供一种细胞捕获及配对微流控封装芯片,包括细胞捕获及配对微流控芯片,以及与所述细胞捕获及配对微流控封装芯片键合的封装结构,所述封装结构包括进液口和出液口,所述所述细胞捕获及配对微流控芯片内设设置至少一个有细胞对单元,所述进液口平均地至少形成两条分叉流道分别流向同一个细胞对单元。
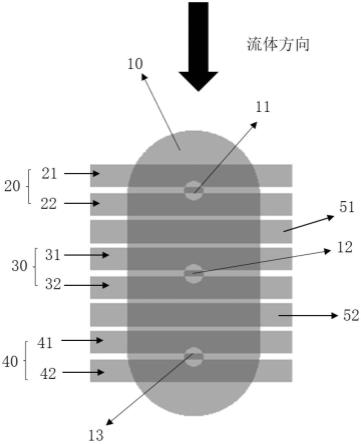
11.细胞捕获及配对微流控芯片内的细胞对单元呈阵列设置,每个细胞对单元内设有一大微阱、位于所述大微阱内且下沉间隔设置的三个小微阱、三组电极对以及位于相邻小微阱之间的屏蔽电极,所述小微阱位于对应电极对之间。
12.进一步地,所述大微阱形状呈椭圆形。
13.进一步地,细胞捕获及配对微流控芯片还包括位于所述细胞捕获区域两侧的缓冲区域。
14.进一步地,三个小微阱分别为依序排列的第一小微阱、第二小微阱和第三小微阱;所述屏蔽电极包括位于第一小微阱和第二小微阱之间的第一屏蔽电极、以及位于第二小微阱和第三小微阱之间的第二屏蔽电极。
15.进一步地,三组电极对分别为第一组电极对、第二组电极对和第三组电极对,第一组电极对包括分别位于第一小微阱两侧的第一上电极和第一下电极;第二组电极对包括分别位于第二小微阱两侧的第二上电极和第二下电极;第三组电极对包括分别位于第三小微阱两侧的第三上电极和第三下电极;所述第一屏蔽电极位于第一组电极对和第二组电极对之间,所述第二屏蔽电极位于第二组电极对和第三组电极对之间。
16.进一步地,三组电极对和两个屏蔽电极组成一个电极单元,每一个电极单元的横向方向上具有多个大微阱。
17.进一步地,细胞捕获及配对微流控芯片在纵向方向上设有n个电极单元,n个电极单元组成电极对阵列,n为正整数;细胞捕获及配对微流控芯片还包括位于分别位于其两侧的四组金属结构对,四组金属结构对包括与第一组电极对连接的第一组金属结构对、与两个屏蔽电极连接的第二组金属结构对、与第二组电极对连接的第三组金属结构对以及与第三组电极对连接的第四组金属结构对。
18.进一步地,细胞捕获及配对微流控芯片还包括玻璃基底,所述电极单元位于所述玻璃基底上。
19.进一步地,所述大微阱和小微阱作为大小嵌套的微阱结构,供细胞固定。
20.本实用新型细胞捕获及配对微流控封装芯片,可从结构上均匀地实现细胞悬液的流动,防止因悬液不均匀导致流速不稳定,同时可以在芯片上先后捕获三种细胞,实现大规模的三重细胞阵列;在阵列中三种细胞各取其一,三个为一组进行配对排列,可以为研究三细胞旁泌等细胞间相互作用或是细胞融合提供巨大的便利和可能性。
附图说明
21.为了更清楚地说明本实用新型实施例或现有技术中的技术方案,下面将对实施例
或现有技术描述中所需要使用的附图作简单的介绍,显而易见地,下面描述中的附图仅仅是本实用新型的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
22.图1是本实用新型的实施例的微流控芯片内的主视图;
23.图2是本实用新型的实施例的微流控芯片内单个细胞对单元的结构示意图;
24.图3是本实用新型的实施例的微流控芯片的局部示意图;
25.图4是本实用新型的实施例的微流控芯片的制造过程的步骤s1至s5的示意图;
26.图5是本实用新型的实施例的微流控芯片的制造过程的步骤s6至s8的示意图;图6是本实用新型的实施例的微流控芯片的制造过程且预留通孔的俯视图;
27.图7是本实用新型的实施例的微流控芯片的制造过程且漏出铜的俯视图;
28.图8是本实用新型的实施例的微流控芯片的细胞实验示意图;
29.图9是本实用新型的实施例的微流控芯片所捕获的三重细胞阵列自然光与荧光合成图对比的示意图。
具体实施方式
30.下面详细描述本实用新型的实施例,所述实施例的示例在附图中示出,其中自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过参考附图描述的实施例是示例性的,旨在用于解释本实用新型,而不能理解为对本实用新型的限制。
31.在本实用新型的描述中,需要理解的是,术语“长度”、“宽度”、“上”、“下”、“前”、“后”、“左”、“右”、“竖直”、“水平”、“顶”、“底”“内”、“外”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本实用新型和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本实用新型的限制。此外,在本实用新型的描述中,“多个”的含义是两个或两个以上,除非另有明确具体的限定。
32.本实用新型公开一种细胞捕获及配对微流控封装芯片,如图1和图2所示,其包括玻璃基底100、位于玻璃基底100上的电极层、小微阱、大微阱10和封装层,其中电极层包括三组电极对和两条屏蔽电极,其中三组电极对依序设置,小微阱位于每组电极对之间,每条屏蔽电极位于相邻组电极对之间。细胞封装芯片包括细胞捕获及配对微流控芯片,以及与所述细胞捕获及配对微流控封装芯片键合的封装结构,所述封装结构包括进液口和出液口(图中未示出),所述所述细胞捕获及配对微流控芯片内设设置至少一个有细胞对单元,所述进液口均匀地至少形成两条分叉流道分别流向同一个细胞对单元。
33.通过进口分叉流道的设计,可以实现细胞悬液的均匀进液,防止细胞悬液流速不稳定的情况,当细胞悬液流速不稳定时,通电对细胞进行抓取可能导致抓取不成功的问题,当流速稳定后进行细胞对的分拣和筛选,可以实现更加良好的细胞捕获效果。
34.细胞捕获及配对微流控芯片的内部宏观结构示意图如图3所示,其包括缓冲区域1和细胞捕获区域2,其中,缓冲区域1的宽度为4mm至6mm(最好为5mm),细胞捕获区域2为的长度和宽度分别为0.3cm至0.7cm(最好为0.5cm)和0.8cm至1.2cm(最好为1cm)。
35.缓冲区域作为细胞捕获及配对微流控芯片的前后预留的区域,缓冲区域位于细胞
捕获区域2两侧,以保证进样流速稳定。
36.细胞捕获区域2内有阵列设置的m*n个细胞对单元(m和n都是正整数,m可以为72,n可以为28),每个细胞对单元的上下间距为0.3mm至0.6mm(最好为0.4mm),每个细胞对单元的左右间距为0.1mm至0.3mm(最好为0.2mm)。
37.每个细胞对单元内设有一椭圆形的大微阱10、位于大微阱10内且下沉间隔设置的三个小微阱11、12、13、三组电极对以及位于相邻小微阱之间的屏蔽电极,细胞由三个小微阱进行捕获。
38.其中大微阱10的长度为250μm至270μm(最好为260μm)、宽度为110μm至130μm(最好为120μm)和深度为20μm至35μm(最好为27μm),小微阱的直径为13μm至17μm(最好为15μm)和深度为1μm至6μm(最好为1.2μm),微阱的尺寸要随着实验细胞种类的平均粒径进行调控,本实施例的尺寸是根据本实用新型实施例的人类肺癌上皮细胞a549确定的。
39.其中,三个小微阱分别为依序排列的第一小微阱11、第二小微阱12和第三小微阱13。
40.屏蔽电极包括位于第一小微阱11和第二小微阱12之间的第一屏蔽电极51、以及位于第二小微阱12和第三小微阱13之间的第二屏蔽电极52。屏蔽电极可以避免电极通电产生介电电泳力捕捉细胞时每组电极间的互感效应(即电极对通电后在相邻未通电电极对生成感应电场捕获细胞的情况)。
41.三组电极对分别为第一组电极对20、第二组电极对30和第三组电极对40,第一组电极对20包括分别位于第一小微阱11两侧的第一上电极21和第一下电极22;第二组电极对30包括分别位于第二小微阱12两侧的第二上电极31和第二下电极32;第三组电极对40包括分别位于第三小微阱13两侧的第三上电极41和第三下电极42。每个电极对之间的间隔为4μm至8μm(最好为6μm)。
42.三组电极对和两个屏蔽电极组成一个电极单元,即8个平行电极组成一个电极单元。每一个电极单元的横向方向上具有m个大微阱10(具体为72个),每个电极单元内的单根电极的长度为2.3cm至2.6cm(最好为2.5cm),相邻两个电极单元之间的间距为4μm至8μm(最好为6μm)。
43.本实用新型实施例采用人类肺癌上皮细胞a549,实施例中单根电极的宽度为7微米,屏蔽电极与对应的电极之间的间距为6微米。其中,人肺癌细胞系a549是1972年由giarddj通过肺癌组织移植培养建系的,源自一位58岁的白人男性。人肺癌细胞系a549能通过胞苷二磷脂酰胆碱途径合成富含不饱和脂肪酸的卵磷脂;角蛋白阳性。
44.细胞捕获及配对微流控芯片在纵向方向上设有n个电极单元(具有为28个),n个电极单元组成电极对阵列。
45.细胞捕获及配对微流控芯片还包括位于分别位于芯片两侧的四组金属结构对,具体地,四组金属结构对包括与第一组电极对20连接的第一组金属结构对、与屏蔽电极连接的第二组金属结构对、与第二组电极对30连接的第三组金属结构对以及与第三组电极对40连接的第四组金属结构对。
46.如图7所示,第一组金属结构对包括位于细胞捕获及配对微流控芯片左侧且与第一上电极21连接的第一左金属结构611以及位于细胞捕获及配对微流控芯片右侧且与第一下电极22连接的第一右金属结构612;第二组金属结构对包括位于细胞捕获及配对微流控
芯片左侧且与第一屏蔽电极51连接的第二左金属结构621以及位于细胞捕获及配对微流控芯片右侧且与第二屏蔽电极52连接的第二右金属结构622;第三组金属结构对包括位于细胞捕获及配对微流控芯片左侧且与第二上电极31连接的第三左金属结构631以及位于细胞捕获及配对微流控芯片右侧且与第二下电极32连接的第三右金属结构632第四组金属结构对包括位于细胞捕获及配对微流控芯片左侧且与第三上电极41连接的第三左金属结构641以及位于细胞捕获及配对微流控芯片右侧且与第三下电极42连接的第四右金属结构642。
47.n个电极单元通过两侧的四组金属结构形成集成控制结构,即两侧的金属结构将电极对阵列连接起来;其中与三组电极对连接的其中一组金属结构对由ito制成的,在本实施例中,第一组金属结构对由ito制成的,与其余两组电极对分别连接的两组金属结构对由铜或者其他导电金属制成(实例中选用铜),这样可以节约成本。
48.如图3所示,大微阱10和小微阱11、12、13作为大小嵌套的微阱结构,供细胞固定,在工作时,细胞从入口进入细胞捕获区域2内,同层电极单元可以同时加电产生正介电电泳力捕获细胞向下至小微阱11、12、13内,形成细胞阵列,没有捕获的细胞从出口离开细胞捕获区域2。
49.由于pdms封装材料具有良好的生物相容性且易于观察,在大微阱10采用pdms封装材料进行流道的封装,流道的高度为45μm至65μm(最好为55μm)。
50.本实用新型还揭示一种细胞捕获及配对微流控芯片的制造方法,包括如下步骤:
51.s1:如图4中(a)部分所示,在玻璃基底100上沉积ito电极层101,然后对具有ito电极层20的玻璃基底100进行清洗,确保to电极层101表面保持洁净和具有一定的黏附力;
52.针对步骤s1,清洗具有ito电极层101的玻璃基底100的具体方法为:将方阻为20ω、边长为8cm的正方形ito电极层101和玻璃基底100放置在清洗架中,浸泡在双氧水、氨水和去离子水的混合液中,双氧水、氨水和去离子水三者的比例分别为1、1和6,然后70℃水浴加热40分钟后取出。取出后用水枪喷淋ito电极层101表面,氮气吹干水分后放入硅片盒保存。表面清洗的目的是为了去除ito电极层101表面的各种颗粒和杂质,并且增加一定的表面能,以确保后续旋涂光刻胶成膜平整、黏附力足够。
53.s2:清洗完成后对ito电极层101的玻璃基底100表面进行紫外(ultraviolet,uv)照射30分钟,除去ito电极层101表面的杂质悬挂键且同时进一步增加ito电极层101的表面能,以便光刻胶有足够的黏附力黏附在ito电极层101表面。
54.s3:如图4中(b)至(d)部分所示,在ito电极层101上旋涂正性光刻胶102,制造出一定高度电极状的光刻胶图案作为湿法刻蚀保护层;
55.在旋涂正性光刻胶102之前,首先将具有ito电极层101的玻璃基底100在180℃的热板上烘烤20分钟以去除ito电极层101表面残留的水分,然后以表1的旋转参数在旋涂机内旋涂正性光刻胶102。
56.表1正性光刻胶的旋涂参数
57.58.s4:如图4中(c)部分和(f)部分所示,s3形成的图案和掩膜版200一起放入光刻机(图未示)进行曝光,形成电极层图案103;
59.旋涂完成后,首先在热板上对ito电极层102进行95℃,2分钟的前烘;然后将ito电极层102固定在对准片(图未示)上,如图3中(c)和(d)部分所示,ito电极层102和掩模版200一起放入光刻机内并调整到固定位置进行曝光,曝光剂量为40mj/cm2;如图4中(e)和(f)部分所示,曝光结束后,放入适量显影液中显影30秒并去掉正性光刻胶103,然后用去离子水洗净,氮气吹干;最后放在150℃的热板上加热2分钟坚膜,形成电极层图案103,电极层图案103具体包括三组电极对和两条屏蔽电极,电极层图案103具体如图1和图2所示。
60.具体地,形成电极层图案103后,利用ito刻蚀液进行湿法刻蚀,目的是将没有光刻胶保护区域的ito电极层101刻蚀干净,留下所需要的电极层图案103。具体通过丙酮洗取出光刻胶,得到电极层图案,具体方法为:首先将ito刻蚀液水浴加热到35℃后,电极层图案放入ito刻蚀液中刻蚀150s,最好迅速转移到装有去离子水的烧杯中稀释刻蚀液,最后水洗吹干保存。
61.刻蚀完成后需要除去正性光刻胶102,才能得到裸露的电极。需放入丙酮溶液中超声1分钟后直接吹干即可除去正性光刻胶102。得到电极层后,需要用万用表对已集成的每组电极对之间的电阻进行测试,如果每组电极对之间导通则说明电极制备失败,如若不导通则可以用于下一步制造。在下一步光刻前,还是需要对样品进行紫外照射30分钟、180℃烘烤20分钟以保证光刻胶和样品间的黏附力足够。
62.s5:如图4中(g)部分所示,在电极层图案103上利用硬接触光刻工艺进行旋涂第一负性光刻胶104,如图1和2所示,制造出小微阱11、12、13;
63.具体地,首先,按照表2将第一负性光刻胶104旋涂在电极层图案103上,然后在95℃的热板上进行5分钟的前烘,前烘后需静置20分钟使第一负性光刻胶104完全晾干,由于小微阱的曝光窗口比较小,为了防止紫外光在玻璃基底100内反射造成不必要的过曝,故需要在玻璃基底100的背面黏贴了一层黑色的墙纸(图未示)进行吸光;如图4中(g)部分所示,接着将带有不同大小的圆的结构的掩模版105和带有第一负性光刻胶104的电极层图案先后放入光刻机中,利用掩模版105和电极层图案103上的对准标记进行对准,而后进行硬接触式的曝光,曝光剂量为150mj/cm2;当紫外光照射到无遮挡的第一负性光刻胶104上时,第一负性光刻胶104会产生酸使高分子交联,可以在显影液中留下;曝光结束后放在95℃的热板上2分钟进行后烘,然后静置降温至室温。降温结束后进行显影,具体是将样品浸泡在显影液中,期间需要均匀摇晃容器使显影液流动,60s后取出后用异丙醇定影后用氮气吹干样品;最后,在150℃的热板上进行2分钟的加热坚膜,使第一负性光刻胶104完全定形且保持稳定。
64.表2小微阱层的第一负性光刻胶旋涂参数
[0065][0066]
小微阱层的第一负性光刻胶按照表2的转速制作出的小微阱的厚度约1.2微米。
[0067]
s5完成后,将细胞捕获及配对微流控芯片放置在台阶仪中测试,测试得出小微阱的厚度约为1.2μm,在光学显微镜中测量小微阱的孔径是否符合的预期。
[0068]
s6:如图5中(a)部分所示,采用磁控溅射镀铜技术对每组电极对进行集成。
[0069]
具体地,在小微阱的制造过程中,如图6所示,在这些电极的末端预留了通孔201,也就是在电极末端处没有第一负性光刻胶104,铜可以直接生长在ito电极上。为了保护微阱区域和已经被ito集成的区域不受到影响,会在样品上不必要的区域贴上高温胶带阻挡铜的生长,只裸露出图7中的铜(金属结构对)621、622、631、632、641、642。溅射过程在ar气氛围下进行,气体流量为50sccm,溅射功率为100w,大约能够溅射出一层370nm左右的铜(金属结构对)621、622、631、632、641、642,此处铜的厚度要求不是特别精确,仅需保证需要集成的部分导电即可。
[0070]
溅射完成后,三组电极对再次进行导电测试,确保每对电极对相互不导通才能进行下一步,这样才能保证后续细胞实验介电电泳力的顺利产生。
[0071]
s7:如图5中(b)部分和(c)部分所示,在小微阱上利用硬接触光刻工艺再次进行负胶光刻,制造出大微阱10;
[0072]
具体地,按照表3将第二负性光刻胶旋涂在小微阱上,然后在65℃的热板上进行1min的前烘,而后转移到95℃的热板上再烘烤5min。前烘后需要静置样品20分钟使光刻胶完全晾干。相似地,要在玻璃基底100的背面黏贴了一层黑色的墙纸进行吸光。接着将带有微阱结构的掩模版和样品先后放入光刻机中,利用掩模版和电极上的对准标记进行对准,而后进行硬接触式的曝光,曝光剂量为180mj/cm2;曝光结束后将样品放在65℃的热板上进行1min的后烘,而后转移到95℃的热板上再烘烤6min;静置降温至室温后,可以进行显影,将样品泡在su-8显影液中,60s后取出样品用异丙醇定影后用氮气吹干样品;最后,在150℃的热板对样品进行2分钟的加热坚膜,使第二负性光刻胶完全定形且保持稳定;以上步骤制作完成后,得到厚度约为25μm的大微阱10,在光学显微镜下进行镜检,验证微阱尺寸符合预期后,完成芯片主体微结构的制造。
[0073]
表3大微阱的第二负性光刻胶的胶旋涂参数
[0074][0075]
s8:如图5中(d)部分所示,pdms(polydimethylsiloxane,聚二甲基硅氧烷,有机硅)材料形成封装层301进行封装,以形成密闭空间供流体通入。
[0076]
首先,将硅片用丙酮、异丙醇、水三种溶液先后超声2min,然后进行紫外照射30分钟、180
°
烘烤20分钟以保证光刻胶和电极层图案之间的黏附力足够;待硅片恢复室温后按照表4将第三负性光刻胶(图未示)旋涂在硅片上,然后在65℃的热板上烘烤3min30s,而后在95℃热班上烘烤9min30s;前烘后需要静置30分钟使第三负性光刻胶完全晾干,利用菲林掩模版进行紫外硬接触式曝光,曝光剂量为200mj/cm2;曝光完成后进行后烘,先在65℃的热板上烘烤1min30s,而后在95℃热板上烘烤6min30s;后烘完成后,静置至常温,然后在显影液中显影7分钟,接着用异丙醇冲洗并吹干;最后,显影后,在150℃的热板上坚膜10min完
成光刻制造步骤,而后用fdts(1h,1h,2h,2h-全氟癸基三氯硅烷)表面疏水处理,防止封装层301固化期间和模板粘连,从而得到用于pdms浇铸的模板,通过台阶仪测试得到封装层301内流道高度约为55μm。
[0077]
表4第三负性光刻胶的旋涂参数
[0078][0079]
以10:1的质量比混合pdms及其固化剂并搅拌5分钟使其充分混合,接着放入真空皿内进行抽真空以除去混合液中的气泡;待气泡完全去除以后将制备好的pdms浇铸进放有带沟道结构的软光刻模具,在65℃的烘箱内烘烤3小时后pdms凝固后取出进行脱模、切割至合适大小,而后给液体入口(进液口)和出口处(出口)打孔并连接导管。
[0080]
把处理好的pdms封装层301放在微流控芯片上,在等离子体清洗器内对其进行1min的氧气等离子体(o
2 plasma)键合,便完成了微流控芯片的封装。通过上述步骤形成微流控芯片。
[0081]
封装完成后,用导电胶带粘贴电极,以便信号发生器夹住施加信号,最后将微流控芯片由夹具(图未示)固定。
[0082]
细胞捕获及配对微流控芯片的细胞实验大致流程如图8所示:在细胞实验中,屏蔽电极51、52始终接地,采用脉冲式流速通入含有低导电率缓冲液的细胞悬液后通过信号发生器在第一组电极对阵列上施加的高频交流电,其余电极对接地,产生正介电电泳力抓取第一种细胞进入微阱,而后通入低导电率缓冲液清空未被抓取的细胞,此时形成单重细胞阵列。保持第一组电极对阵列上的高频交流电使第一种细胞固定住,再采用脉冲式流速通入含有低导电率缓冲液的第二种细胞悬液,在第二组电极对阵列上通电,其余电极接地,抓捕细胞进入对应微阱,通入和之前相同的缓冲液清空未被抓取的细胞,此时前后抓捕的细胞形成了双重阵列。而后保持已经捕获到细胞的两组电极通电,向最后一组电极对阵列上通电,屏蔽线接地,三种细胞最终可以在芯片上形成三重细胞阵列。
[0083]
实验选用人类肺癌上皮细胞a549进行细胞实验,以此来验证细胞捕获及配对微流控芯片的作用。在实验中,需要搭建微流控实验平台,包括荧光宏观变焦显微镜及显示屏、两台注射泵、三台信号发生器等设备,将所选实验细胞进行自主培养并荧光染色。
[0084]
实验时,一台微泵上搭载低导电率缓冲液(下称第一微泵),一台微泵上搭载含有低导电率缓冲液的细胞悬液(下称第二微泵),通过微型三通管将两种液体连接到芯片上,而后通过程序和软件调控微泵的位移进行进样。
[0085]
先用第一微泵匀速通入纯缓冲液保证芯片内液体不含有气泡,而后停止该微泵,启动第二微泵,将第一种细胞悬液脉冲式通入所制造好的微流控芯片中,待细胞进入到工作区域内后,通过信号发生器对第一组电极对阵列施加高频交流信号(v
pp
=18v,第一个点位处流体流速较快,故施加最高的电压保证稳定抓取),其余电极接地,捕获第一种细胞形成单重细胞阵列。
[0086]
而后停止第二微泵的脉冲位移,始终保持电第一组电极对阵列的电参数,启动第
一微泵通入缓冲液清空多余未被捕获的悬浮细胞,更换第二微泵上所搭载的细胞,再次启动第二微泵,待第二种细胞进入捕获区域时,对第二组电极对阵列施加高频交流电(v
pp
=12v,第二个点位处流速相对稳定,降低电压减小互感效应对其余电极的影响),其余电极接地,捕获第二种悬浮细胞。
[0087]
接着,停止第二微泵的脉冲位移,始终保持电第一、二组电极对阵列的电参数,启动第一微泵通入缓冲液清空多余未被捕获的悬浮细胞,更换第二微泵上所搭载的细胞,再次启动第二微泵,待第三种细胞进入捕获区域时,对第三组电极对阵列施加高频交流电(v
pp
=10v,第三个点位液体流速最慢所以施加最小的电压,若电压过大反而会造成一个微阱中抓取多个细胞的情况,不利于实验),捕获悬浮细胞。
[0088]
最后,停止第二微泵的脉冲位移,始终保持电第一、二、三组电极对阵列的电参数,启动第一微泵通入缓冲液清空多余未被捕获的悬浮细胞,拍摄荧光场相片作为记录用于后续实验分析。
[0089]
通过上述细胞实验,对细胞进行红、绿、蓝三种颜色的染色以此来区分不同种细胞阵列,并且在芯片上成功捕获了三重细胞阵列,我们随机选取了7
×
8的细胞对单元进行观测,为了便于观察,将三个荧光通道的图片进行合成,自然光场与荧光合成图的对比如图9所示(比例尺为200微米)。
[0090]
可以清晰地看到细胞都坐落于小微阱中,大部分细胞对单元内有且仅有一红一绿一蓝三个细胞(视为成功配对),根据所选区域进行成功配对效率的粗略计算,共有39/56个细胞对成功配对,配对成功率约为70%。由此可见,该细胞捕获及配对微流控芯片具有大规模三重细胞阵列的构建能力,本实用新型效用达到预期。
[0091]
本实用新型细胞捕获及配对微流控芯片,是利用介电电泳捕获三重细胞阵列的微流控芯片;本实用新型通过对细胞进行红、绿、蓝三种颜色的荧光染色,可以在荧光显微镜下清楚地看到红绿蓝细胞三个一组呈阵列化排列细胞捕获及配对微流控芯片上,这验证了细胞捕获及配对微流控芯片功能达到设计预期,同时阵列化的细胞排列可以为研究同种细胞的异质性提供非常大的可能性。
[0092]
这种形式细胞具有良好的对照性和可控性,阵列中的细胞位置固定、可控且可以对细胞进行批量操作和批量分析,从而减少平行操作所产生的时间和试剂成本,降低实验误差。
[0093]
本实用新型细胞捕获及配对微流控芯片,可以在芯片上先后捕获三种细胞,实现大规模的三重细胞阵列;在阵列中三种细胞各取其一,三个为一组进行配对排列,可以为研究三细胞旁泌等细胞间相互作用或是细胞融合提供巨大的便利和可能性。
[0094]
以上所揭露的仅为本实用新型一种较佳实施例而已,当然不能以此来限定本实用新型之权利范围,本领域普通技术人员可以理解实现上述实施例的全部或部分流程,并依本实用新型权利要求所作的等同变化,仍属于实用新型所涵盖的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。