1.本技术涉及化学制药领域,尤其涉及一种地屈孕酮的制备和纯化方法。
背景技术:
2.地屈孕酮(dydrogesterone),又名去氢孕酮,化学名为9β,10α-孕甾-4,6-二烯-3,20-二酮,cas号:152-62-5,结构式如下:
[0003][0004]
地屈孕酮以孕甾烷为母核,孕甾烷具有如下的骨架结构,具有abcd四个环(从左到右,四个环依次定义为a、b、c和d),碳的标号(1-21)如下,在下文中记为c-1位、c-2位等。
[0005][0006]
地屈孕酮既广泛用于保胎及预防流产,还广泛用于治疗内源性孕酮不足引起的各种疾病,如:痛经、子宫内膜异位症、继发性闭经、月经周期不规则、功能失调性子宫出血、经前期综合征、孕激素缺乏所致先兆性流产或习惯性流产、黄体不足所致不孕症等。
[0007]
地屈孕酮已知的一条合成路线如下所示:从麦角甾醇出发,经过光化学合成10α构型中间体,然后经过沃氏氧化、双键转位、臭氧氧化、烯胺化、最后氧化获得地屈孕酮。然而,光转化过程的转化率低、分离困难,同时此过程需要用到臭氧氧化,存在安全风险,且副产物较多。
[0008][0009]
此外,在上述合成路线中,最后一步反应为烯胺的氧化反应,烯胺的存在使得氧化反应更容易进行,但同时由于烯胺相对不稳定,其非常容易水解返回醛,导致最终产物中存在21醛这个杂质,即,具有结构式i的杂质,如下式所示。由于该杂质带有醛基,作为基因毒性杂质疑似物,去除非常困难,普通的纯化方法均无法将其含量降低至符合药典标准。
[0010][0011]
另外,去除此杂质i如果采用加入过氧化物、亚氯酸钠等强氧化剂、将醛氧化成酸、然后在水中去除的方法,则会引入了过氧化物等强氧化剂,存在巨大的安全隐患,并且生产过程中过氧化物的处理容易出现危险。更重要的是,在强氧化剂的作用下,地屈孕酮产品也可能发生氧化,从而引入新的杂质,使得更加难以去除。
技术实现要素:
[0012]
本技术提供一种绿色环保、安全简便的方法来去除上述杂质i,使粗品地屈孕酮中杂质i的含量降至0.1wt%以下,符合药典标准,且高于行业内标准。
[0013]
本技术通过对杂质i进行衍生化,使之具备一定水溶性从而达到去除的目的。
[0014]
通过本技术的方法,可以使得杂质i的含量降低至0.1wt%以下,杂质清除效果非常明显,并且过程中无需加入强氧化剂,生产过程安全环保,去除了安全隐患。此外,在本技术的方法中,反应试剂温和,不引入其他新的杂质。
[0015]
本技术提供一种地屈孕酮的纯化方法,包括:通过采用衍生化试剂将地屈孕酮粗品进行衍生化,使得其中具有如下结构式i的杂质发生如下的衍生化反应从而溶于水中以被除去,从而获得地屈孕酮纯品,其中具有如下结构式i的杂质的含量小于0.1wt%
[0016]
[0017]
在本技术的技术方案中,所述衍生化是指在相转移催化剂四丁基溴化胺存在下且在超声搅拌条件下发生的有机相-水相的两相反应。
[0018]
在本技术的技术方案中,地屈孕酮的纯化方法包括如下步骤:
[0019]
s1:将地屈孕酮的粗品溶解于有机溶剂中;
[0020]
s2:加入水、相转移催化剂四丁基溴化胺和衍生化试剂,使得地屈孕酮的粗品中的具有结构式i的杂质与衍生化试剂进行反应,以获得具有如下结构式ii的化合物,所述结构式ii的化合物溶解于水中,
[0021][0022]
s3:将反应液静置分层,随后进行分液,得到的有机层经水洗、除去有机溶剂,然后重结晶得到地屈孕酮纯品。
[0023]
在本技术的技术方案中,所述有机溶剂包括二氯甲烷、氯仿、乙酸乙酯、甲苯中的一种或更多种。
[0024]
在本技术的技术方案中,所述衍生化试剂包括亚硫酸氢钠、亚硫酸氢铵、亚硫酸氢钾、亚硫酸钠、亚硫酸钾、焦亚硫酸钠、焦亚硫酸氢钾中的一种或更多种。
[0025]
在本技术的技术方案中,具有结构式i的杂质与衍生化试剂的反应在搅拌下进行,其中所述搅拌包括磁力搅拌和/或超声搅拌。
[0026]
在本技术的技术方案中,相转移催化剂四丁基溴化胺与衍生化试剂的摩尔比为1:(80~100)。
[0027]
在本技术的技术方案中,其中具有结构式i的杂质与衍生化试剂的反应在室温下进行2-8小时。
[0028]
在本技术的技术方案中,其中所述地屈孕酮的粗品与所述衍生化试剂的质量比为1:0.1-0.3。
[0029]
本技术提供一种地屈孕酮的制备方法,包括如下工艺步骤:
[0030]
(1)通过如下工艺路线获得地屈孕酮的粗品:
[0031]
(a)将式a所示的化合物进行光化学转化使c-10位的甲基由β构型翻转为α构型,得到式b所示的化合物;
[0032]
(b)将所述式b所示的化合物中c-3位羟基氧化为酮基,c-5,6位双键移位得到式c所示的化合物;
[0033]
(c)在质子酸条件下,经反应将所述式c所示的化合物中7,8位双键移位到6,7位,得到式d所示的化合物;
[0034]
(d)将所述式d所示的化合物经水解,得到式e所示化合物;
[0035]
(e)将所述式e所示的化合物的21位羟基氧化为醛基,得到式f所示的化合物;
[0036]
(f)使所述式f所示的化合物中醛基进行烯胺化反应,得到式g所示的化合物;
[0037]
(g)将所述式g所示的化合物的c-20位氧化为羰基,得到式h所示的地屈孕酮
[0038][0039]
(2)对上述步骤(1)中获得的地屈孕酮的粗品进行纯化,其中所述纯化通过根据本技术前述的方法进行。
[0040]
在本技术的技术方案中,所述质子酸采用卤化氢的醇溶液的形式添加,所述醇包括乙醇、异丙醇、丁醇或乙二醇中的至少一种,所述卤化氢的醇溶液的添加量为10v~15v,所述卤化氢的重量占所述卤化氢的醇溶液总重量的25wt%~40wt%。
[0041]
本技术提供一种纯化的地屈孕酮,其通过根据本技术所述的方法获得,其中具有如下结构式i的杂质的含量小于0.1wt%
[0042][0043]
本技术提供一种地屈孕酮药物制剂,其包含纯化后的地屈孕酮和药学上可接受的辅料或载体,其中所述纯化后的地屈孕酮通过根据本技术所述的方法获得,并且其中具有如下结构式i的杂质的含量小于0.1wt%
[0044][0045]
通过本发明所述方法,所述醛基杂质降低至0.1wt%以下,超声波条件和在相转移催化剂四丁基溴化胺存在下使得反应进行得更充分。所采用的反应试剂温和,不会引入其他新的杂质。
具体实施方式
[0046]
除非另有定义,本文所用所有技术和科学术语与本发明所属领域的普通技术人员通常理解的含义相同。若存在矛盾,则以本技术提供的定义为准。当本文中出现商品名时,意在指代其对应的商品或其活性成分。本文引用的所有专利、已经公开的专利申请和出版物均通过引用并入到本文中。
[0047]
术语“一个(种)或多个(种)”或者类似的表述“至少一个(种)”可以表示例如1、2、3、4、5、6、7、8、9、10个(种)或更多个(种)。
[0048]
地屈孕酮的制备方法
[0049]
(光化学转化的步骤)
[0050]
本技术还提供一种制备地屈孕酮的方法,所述方法包括将结构式a的化合物进行光化学转化使c-10位的甲基由β构型翻转为α构型得到结构式b的化合物的步骤
[0051][0052]
在一些实施例中,结构式a的化合物转化成结构式b的化合物通过两步光化学转化反应实现。
[0053]
在一些实施例中,所述两步光化学转化反应可以包括:使所述结构式a的化合物在第一波长的紫外光照射下开环,完成第一步光化学转化反应;使开环后的化合物在第二波长的紫外光照射下闭环,完成第二步光化学转化反应。
[0054]
在一些实施例中,所述第一步光化学转化反应和所述第二步光化学转化反应的反应溶剂为甲醇、乙醇、正己烷、石油醚、正庚烷、乙酸乙酯、四氢呋喃、乙二醇、异丙醇中的至少一种,反应温度为-10℃至50℃;第一波长为270nm至290nm,第二波长为300nm至330nm。在一些实施例中,采用高压汞灯或led灯来提供紫外光。
[0055]
在通常的光化学转化过程中,会产生多个产物,在本技术中,由于采用特定的原料a(含ots基团),可以使得该步骤的光化学转化反应具有更好的转化率和选择性(选择性达40%以上),可以取得更好的收率(收率可达25%),同时结构式b的化合物更容易从产物中分离,后处理非常简便。
[0056]
(氧化和碱性条件双键移位的步骤)
[0057]
在一些实施例中,所述方法还包括:将所述结构式b的化合物经c-3位羟基的氧化和c-5,6位双键移位得到结构式c的化合物的步骤
[0058][0059]
其中结构式b的化合物的结构存在特殊性,如苯环的共轭双键使结构性变差、c-10
位α构型的甲基改变化合物溶解性、c-21位的基团的不同等,导致该步氧化反应对氧化体系要求较高。若采用一些常用的氧化体系,要么得不到目标产物,要么收率很低。例如采用斯文氧化可以得到结构式c的化合物,但收率很低,杂质比较难控制且条件苛刻。
[0060]
可以采用沃氏氧化反应使c-3位羟基氧化为酮基且5,6双键移位到4,5位。沃氏氧化(试剂例如采用异丙醇铝/环己酮)为高温反应,且存在必须高温才能除去的高沸点物质,虽然沃氏氧化可以同时进行双键移位,但结构式c的化合物在高温或者强碱性条件下都不稳定,从而导致反应收率较低(摩尔收率约48%)。
[0061]
在一些实施例中,将所述结构式b的化合物转化成所述结构式c的化合物的方法可以包括:将所述结构式b的化合物进行氧化处理,使所述结构式b的化合物中的c-3位羟基氧化为酮基;然后进行碱性处理,使5,6双键移位到4,5位,得到结构式c的化合物。
[0062]
本技术实施例采用的氧化试剂具有如下结构式(戴斯马丁试剂):
[0063][0064]
其能够在低温下(例如-5℃至25℃、或5℃至10℃)进行氧化反应。所述氧化试剂与结构式b的化合物的摩尔比可以为(1.2~1.8):1。在一些实施例中,氧化处理时还添加水和碳酸氢盐(例如碳酸氢钠、碳酸氢钾),以促进反应,增加转化率和提高收率,转化率高达92%,摩尔收率高达70%。所述碳酸氢盐、水与结构式b的化合物的摩尔比为(1.5~2.5):(0.8~1.2):1。再采用有机碱,优选胺,例如三乙胺、吡啶等,在温和条件下进行碱性处理,可以获得较高收率的结构式c的化合物,这种方法避免了高温、长时间浓缩、强碱的影响。
[0065]
(酸性条件下双键移位的步骤)
[0066]
在一些实施例中,所述方法还包括:将所述结构式c的化合物双键移位得到结构式d的化合物的步骤;
[0067][0068]
在一些实施例中,将结构式c的化合物转化成结构式d的化合物的方法包括:在质子酸条件下,使所述结构式c的化合物的7,8位双键移位到6,7位,得到结构式d的化合物。
[0069]
由于采用盐酸、硫酸、高氯酸、冰醋酸、对甲苯磺酸、三氟乙酸等转化率都较低,在一些实施例中,所用质子酸可以是hcl,hbr等。
[0070]
由于化学结构的特殊性,该步反应如要获得高的转化率对水分含量、酸浓度、酸量也有比较苛刻的要求。在一些实施例中,将结构式c的化合物转化成结构式d的化合物的方法包括:将卤化氢的醇溶液加入含结构式c的化合物的反应溶剂中,按1g结构式c的化合物添加10ml~15ml的卤化氢的醇溶液的方式添加卤化氢的醇溶液,也即所述卤化氢的醇溶液的添加量为10v~15v。卤化氢的醇溶液中水的质量百分比小于0.2%,卤化氢的重量占卤化
氢的醇溶液总重量的25wt%~40wt%。
[0071]
在所述卤化氢的醇溶液中,醇可以采用乙醇、异丙醇,丁醇,乙二醇等。采用乙醇转化率可高达89%,而同等条件下采用甲醇转化率只有约55%。
[0072]
在一些实施例中,该步骤还可以添加质量分数为0.8%~1.2%(基于结构式c的化合物的质量)的抗氧化剂来抑制过氧化的杂质,以提高收率。抗氧化剂示例性的包括抗坏血酸钠、tbhq。
[0073]
此外,结构式d的化合物的熔点较低,较难得到固体,且在高浓度酸下有一定程度变质成油,影响固体的性状。在本技术实施例中,为了避免此类现象发生,在后处理时采用乙醇作为溶剂边搅拌边梯度降温得到固体,粗品再用正庚烷打浆除油,可以获得较高的收率。
[0074]
(水解的步骤)
[0075]
在一些实施例中,所述方法还包括:将结构式d的化合物经水解经由d1得到化合物e的步骤
[0076][0077]
在一些实施例中,将所述结构式d的化合物转化成所述结构式e化合物的方法包括:采用dmf和koac使所述结构式d的化合物中的ots转化为酯基,然后在碱性条件下水解,其中采用的碱性物质包括naoh、koh、醋酸钾、醋酸钠和苯甲酸钠中的至少一种。
[0078]
(由e制备地屈孕酮的步骤)
[0079]
本技术实施例还提供一种制备地屈孕酮的方法,包括在本技术实施例的中间体化合物e的c-20位构造酮基。
[0080]
在所述化合物e的c-20位构造酮基的方法包括:将化合物e的21位羟基氧化为醛基,得到化合物f;氧化体系可以包括naclo、nabr和2,2,6,6-四甲基哌啶-1-氧自由基,且所述氧化体系的ph范围控制在8-9
[0081][0082]
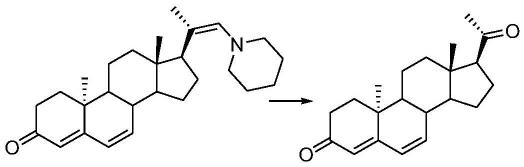
将所述化合物f的醛基进行烯胺化反应,例如使所述化合物f与1-(1-哌啶基)环己烯进行烯胺化反应,得到化合物g
[0083][0084]
氧化所述化合物g,获得地屈孕酮。例如可以将所述化合物g在cu
催化下进行空气氧化,获得地屈孕酮。
[0085][0086]
上述合成路线的中间体化合物b只需进行ab环双键构建和侧链改造即可方便的合成地屈孕酮,总收率高、路线短,是一种可工业化的合成地屈孕酮的新工艺,解决了现有技术中光转化过程转化率低、副产物较多、安全风险高、不易工业化生产的问题。
[0087]
(对地屈孕酮进行纯化的步骤)
[0088]
本技术实施例还提供一种地屈孕酮的纯化方法,包括:通过采用衍生化试剂将地屈孕酮的粗品衍生化,使得其中具有如下结构式i的杂质发生如下的衍生化反应从而溶于水中以被除去,从而获得地屈孕酮纯品,其中具有如下结构式i的杂质的含量小于0.1wt%
[0089][0090]
在本技术的实施例中,地屈孕酮的纯化方法包括如下步骤:
[0091]
s1:将地屈孕酮的粗品溶解于有机溶剂中;
[0092]
s2:加入水、相转移催化剂四丁基溴化胺和衍生化试剂,使得地屈孕酮的粗品中的具有结构式i的杂质与衍生化试剂进行反应,以获得具有如下结构式ii的化合物,所述结构式ii的化合物溶解于水中,
[0093][0094]
s3:将反应液静置分层,随后进行分液,得到的有机层经水洗、除去有机溶剂,然后重结晶得到地屈孕酮纯品。
[0095]
实施例
[0096]
以下通过具体实施例来说明制备地屈孕酮的方法。
[0097]
实施例1:a
→b[0098]
在光化反应瓶里加40g化合物a和500ml四氢呋喃,5-10℃紫外灯光下先开环,波长范围为270nm~290nm,光照8小时,hplc监测原料:产物=70:20左右,再经紫外灯照射波长范围为300nm~330nm继续光照8h,hplc监测,原料:产物=55:35左右停止;有机相浓缩,甲醇置换至小体积,降温-20℃冷冻1~2小时,过滤,烘干得白色固体16g,主要为原料;母液浓缩,乙腈置换至小体积后出料,降温-20℃冷冻1~2小时,过滤,烘干得白色固体10g化合物b,一次收率约25%。
[0099]
经检测,1h nmr(400mhz,cdcl3)δ7.78(d,j=8.3hz,2h),7.34(d,j=8.1hz,2h),5.66-5.64(m,1h),5.43
–
5.41(m,1h),4.09(s,1h),3.96(dd,j=9.3,3.1hz,1h),3.83(dd,j=9.3,6.0hz,1h),2.49-2.45(m,5h),2.29-2.24(m,2h),1.67
–
1.47(m,15h),0.97(d,j=6.7hz,3h),0.72(s,3h),0.57(s,3h)。
[0100]
实施例2:b
→
b1
→c[0101][0102]
在1l的三口烧瓶里加戴斯马丁试剂(dmp)105g(0.28mol),搅拌中加水3.78g(0.21mol),碳酸氢钠35g(0.41mol)和500ml二氯甲烷(dcm),搅拌片刻,5℃~10℃加100g(0.21mol)化合物b,保温搅拌半小时,tlc显示原料反应生成化合物b1,降温-20℃冷冻1~2小时,过滤,滤饼用冷二氯甲烷适量淋洗至滤饼无产物,有机相依次用亚硫酸钠溶液和碳酸氢钠溶液,食盐水洗涤。
[0103]
有机相加100ml三乙胺,常温搅拌1~2小时,tlc显示化合物b1转化为化合物c,有机相依次用食盐水,1m稀盐酸,食盐水洗涤,有机相40℃浓缩,正庚烷置换至小体积,降温-20℃冷冻1~2小时,过滤,烘干得黄色固体70g,摩尔收率约70%。
[0104]
经检测,1hnmr为:1h nmr(400mhz,cdcl3)δ7.78(d,j=8.3hz,2h),7.34(d,j=8.1hz,2h),5.80(s,1h),5.23
–
5.14(m,1h),3.96(dd,j=9.3,3.1hz,1h),3.83(dd,j=9.3,6.0hz,1h),3.01(ddd,j=25.3,22.6,11.6hz,2h),2.56
–
2.27(m,6h),2.21(dd,j=6.9,2.6hz,1h),2.00(dt,j=13.4,4.7hz,1h),1.93
–
1.11(m,13h),1.04(s,3h),0.97(d,j=6.7hz,3h),0.63
–
0.55(m,3h)。
[0105]
按上述反应步骤做如下表1的对比试验,其它条件与本实施例相同。
[0106]
表1:实验条件和结果
[0107]
序号条件转化率%收率%11.3eq dmp,dcm866621.0eq dmp,dcm755032.0eq dmp,dcm876341.3eq dmp,氯仿856251.3eq dmp,dcm,2eq碳酸氢钠9068
本实施例1.3eq dmp,dcm,2eq碳酸氢钠1eq水9270
[0108]
由表1可知,戴斯马汀试剂用量1.3eq左右即可,增加用量转化率没有明显提升,反而增大后处理的难度,影响收率;溶剂改为氯仿,收率没有提高;添加碳酸氢钠,可以促进反应,增加转化率和收率,添加少量水,也可以促进反应,增加转化率和收率以及速率,其原理可能是预先形成更活泼的dmp氧化中间态。
[0109]
实施例3:c
→d[0110]
在1l的三口烧瓶里加840ml的无水乙醇,低温通入干燥的氯化氢气体,制备得无水乙醇/氯化氢溶液(水分要小于0.2%,含量约35%);在2l的三口烧瓶里,加70g(0.145mol)化合物c和700ml二氯甲烷以及0.7g特丁基对苯二酚(tbhq),溶清,氮气保护,0℃~10℃下,滴加840ml的无水乙醇/氯化氢溶液,控温反应1小时左右,tlc检测原料剩余小于3%,加纯净水淬灭反应,分液,有机相用碳酸氢钠溶液洗至ph=7~8,有机相50℃以下浓缩,乙醇置换,保留约500ml乙醇,边搅拌边梯度降温,黄色固体析出,降温-20℃冷冻1~2小时,过滤,粗品再用正庚烷打浆,冷析过滤,烘干得米白色固体50g,摩尔收率约70%。
[0111]
经检测:1h nmr(400mhz,cdcl3)δ7.76(d,j=8.3hz,2h),7.33(d,j=8.1hz,2h),6.24
–
6.05(m,2h),5.65(s,1h),3.94(dd,j=9.3,3.0hz,1h),3.80(dd,j=9.2,6.0hz,1h),2.60
–
2.48(m,1h),2.44(s,3h),2.41
–
2.32(m,1h),2.27
–
2.14(m,1h),1.91
–
1.55(m,10h),1.40
–
1.29(m,1h),1.29
–
1.07(m,6h),0.98(d,j=6.7hz,3h),0.70(s,3h)。
[0112]
13
c nmr(101mhz,cdcl3)δ199.59(s),163.38(s),144.65(s),140.96(s),132.91(s),129.75(s),127.85(s),126.81(s),123.60(s),75.47(s),51.57(s),49.22(s),42.70(s),39.59(s),38.65(s),38.24(s),37.10(s),36.07(s),35.49(s),33.89(s),27.00(s),24.89(s),22.14(s),21.59(s),20.46(s),16.72(s),10.58(s)。
[0113]
质谱:c
29h38
o4s,482.9。
[0114]
按上述反应步骤做表2中的对比试验,其它条件与本实施例相同。
[0115]
表2实验条件和结果
[0116][0117][0118]
由表2可知,该反应对水分要求高,浓盐酸或者95%乙醇反应转化率低,需要干燥的氯化氢气体/无水乙醇体系反应才能大大提高转化率。该反应对酸的浓度有要求,酸含量较低(20%),转化率相对较低,酸含量在30-38%能到达到较好的效果。该反应对酸量有要求,10v~15v较为合适,太低转化率低,太高会导致产物降解,表现为后处理固体油性较重,难析出固体,收率降低。此外,反应跟酸的强度有关,浓硫酸,三氟乙酸以及三氟甲磺酸转化率也有差异。有趣的是无水甲醇做溶液,转化率也较低,四氢呋喃和异丙醇做溶剂,转化率也低于无水乙醇。反应加抗氧化剂,可以抑制过氧化的杂质,提高收率。
[0119]
实施例4:d
→
d1
[0120]
在500ml的三口烧瓶里50g(0.10mol)化合物d和200ml dmf,溶清,加50g(0.51mol)醋酸钾,100℃反应2小时,tlc检测原料反应完全,缓慢倒入1l水中,析出固体,搅拌1小时,过滤,烘干得黄色固体36g,摩尔收率约95%。
[0121]
经检测:1h nmr(400mhz,cdcl3)δ6.15(dt,j=19.5,7.4hz,2h),5.64(s,1h),4.07(dd,j=10.7,3.5hz,1h),3.76(dd,j=10.7,7.3hz,1h),2.59
–
2.44(m,1h),2.40(ddd,j=11.5,7.4,4.9hz,2h),2.24(ddd,j=13.1,5.2,1.9hz,1h),2.03(s,3h),1.95
–
1.67(m,7h),1.67
–
1.52(m,2h),1.43
–
1.31(m,2h),1.29
–
1.13(m,5h),1.00(d,j=6.6hz,3h),0.75(s,3h).
[0122]
13
c nmr(101mhz,cdcl3)δ199.40(s),171.22(s),163.31(s),141.05(s),126.73(s),123.59(s),69.30(s),52.66(s),49.32(s),42.80(s),39.68(s),38.73(s),38.45(s),37.13(s),35.61(d,j=13.6hz),33.90(s),27.21(s),25.01(s),22.14(s),20.91(s),20.53(s),16.99(s),10.66(s).
[0123]
质谱:c
24h34
o3,371.0。
[0124]
实施例5:d1
→e[0125]
在250ml的三口烧瓶里加36g(0.10mol)化合物d1和180ml甲醇,氮气保护,降温0℃~5℃,加7.2g(0.18mol)氢氧化钠固体,控温小于25℃,加完后自然回室温反应,反应0.5~1小时。tlc监测反应完全。加醋酸中和,再缓慢滴加水180ml,析出固体,冰浴搅拌1小时,过滤,烘干得黄色固体30g,摩尔收率约95%。
[0126]
经检测:1h nmr(400mhz,cdcl3)δ6.17(dt,j=23.1,7.5hz,2h),5.65(s,1h),3.64(dd,j=10.5,3.2hz,1h),3.39(dd,j=10.5,6.6hz,1h),2.69
–
2.46(m,1h),2.46
–
2.32(m,2h),2.25(ddd,j=13.1,5.2,1.9hz,1h),1.82(dddd,j=16.7,14.9,13.7,9.7hz,6h),1.69
–
1.50(m,4h),1.38(ddd,j=17.9,12.4,4.6hz,2h),1.28
–
1.15(m,5h),1.05(d,j=6.6hz,3h),0.76(s,3h).
[0127]
13
c nmr(101mhz,cdcl3)δ199.62(s),163.54(s),141.31(s),126.72(s),123.56(s),67.78(s),52.27(s),49.36(s),42.72(s),39.73(s),38.93
–
38.34(m),37.17(s),35.55(s),33.93(s),27.32(s),25.05(s),22.15(s),20.57(s),16.65(s),10.70(s).
[0128]
质谱:c
22h32
o2,329.0。
[0129]
实施例6:e
→f[0130]
在250ml的三口烧瓶里加30g(91.3mmol)化合物e和150ml二氯甲烷,搅拌下加1.5g(9.6mmol)tempo(2,2,6,6-四甲基哌啶氧化物)和溶解好的1.08g溴化钠(10.5mmol)和30ml 5%的碳酸氢钠水溶液,氮气保护,降温至0℃~5℃,滴加次氯酸钠,控温低于15℃,反应0.5~1小时。tlc监测反应完全。硫代硫酸钠溶液淬灭,搅拌10分钟,分液,有机相用食盐水洗涤一次,有机相50℃以下浓缩,石油醚置换,保留3v~5v石油醚。降温到0℃冷析2小时,过滤,滤饼用冰石油醚淋洗,烘干得28g固体化合物f,摩尔收率约92%。
[0131]1h nmr(400mhz,cdcl3)δ9.58(d,j=3.1hz,1h),6.30
–
6.04(m,2h),5.67(s,1h),2.53(dd,j=14.2,5.4hz,1h),2.50
–
2.32(m,3h),2.26(ddd,j=13.2,5.3,2.1hz,1h),1.98
–
1.78(m,5h),1.73
–
1.37(m,6h),1.36
–
1.22(m,4h),1.13(t,j=6.1hz,3h),0.80(s,3h).
[0132]
13
c nmr(101mhz,cdcl3)δ208.83(s),199.28(s),162.87(s),140.34(s),126.99(s),123.80(s),63.29(s),49.78(s),44.15(s),39.59(s),38.50(s),37.64(s),37.10(s),35.50(s),33.87(s),31.40(s),25.07(s),22.49(s),22.21(s),20.47(s),11.98(s).
[0133]
质谱:c
22h30
o2,327.0。
[0134]
实施例7:f
→g→
h(地屈孕酮)
[0135]
在100ml的三口烧瓶里加28g(85.8mmol)化合物f和42ml无水乙腈,搅拌下加22g(122mmol)环己烯哌啶(含量约90%),氮气保护,40℃搅拌溶清,加冰醋酸,继续反应3-6小时,降温到-20℃,冷析2小时,过滤,滤饼用冰乙腈淋洗,抽干,固体35℃真空干燥箱烘,得28g化合物g。
[0136]
在100ml的三口烧瓶里加0.42g(4.2mmol)氯化亚铜和42ml dmf,氮气置换三次,加热至65℃,氮气保护保温搅拌1小时,降温至室温备用。在500ml的三口烧瓶里加28g(71.2mmol)化合物g和280ml二氯甲烷,降温至0-5℃,加入氯化亚铜溶液,通入已干燥的空气,保持气体流量1l/min,反应4~8小时,tlc检测原料剩余小于2%,延长时间无变化则可停止。加入10%硫酸溶液淬灭,分液,加1%硫酸溶液洗涤有机相,有机相加0.43g醋酸,搅拌5分钟,再加6%亚氯酸钠溶液,室温搅拌30min,tlc原料几乎消失。加硫代硫酸钠淬灭,分液,有机相依次用0.5%氢氧化钠,食盐水洗涤,有机相50℃以下浓缩,水置换出料得粗品。粗品加280ml丙酮加热溶清,浓缩到小体积,降温到-20℃,冷析2小时,过滤,滤饼用冰丙酮淋洗,抽干,45℃烘箱烘干,得20g固体化合物h,摩尔收率约74.6%。
[0137]
经检测:1h nmr(400mhz,cdcl3)δ9.56(d,j=3.1hz,1h),6.14(dd,j=10.8,7.2hz,2h),5.65(s,1h),2.59
–
2.44(m,1h),2.44
–
2.29(m,3h),2.25(ddd,j=13.1,5.3,1.9hz,1h),2.01
–
1.70(m,7h),1.70
–
1.31(m,6h),1.31
–
1.20(m,4h),1.12(d,j=6.9hz,3h),0.78(s,3h).
[0138]
13
c nmr(101mhz,cdcl3)δ204.51(s),199.36(s),163.08(s),140.68(s),126.90(s),123.70(s),50.79(s),49.34(s),48.93(s),43.21(s),39.72(s),38.58(s),38.32(s),37.10(s),35.51(s),33.88(s),26.66(s),25.27(s),22.13(s),20.47(s),13.28(s),11.00(s).
[0139]
质谱:c
21h28
o2,313.0。
[0140]
实施例8
[0141]
地屈孕酮的纯化
[0142][0143]
20g地屈孕酮粗品(纯度94.9%,醛基杂质含量2.1%)加入到带磁子的反应瓶中,加入100ml二氯甲烷搅拌溶解,加入水40ml,四丁基溴化胺0.2g,亚硫酸氢钠6g,继续剧烈搅拌,将超声波反射仪的超声发射杆插入至液面以下,开启超声波反应仪,室温加搅拌反应2h。倒出反应液,静置分层,分液,有机层加50ml水,搅拌分液,再次加入50ml水,浓缩二氯甲烷至干,加入丙酮重结晶,-5~0℃析晶,过滤,干燥得地屈孕酮纯品,通过hplc检测纯度为99.9%,结构式为i的醛基杂质的含量为0.047%。
[0144]
对比例1
[0145]
地屈孕酮的纯化
[0146]
[0147]
20g地屈孕酮粗品(纯度94.9%,醛基杂质含量2.1%)加入到带磁子的反应瓶中,加入100ml二氯甲烷搅拌溶解,加入水40ml,亚硫酸氢钠6g,继续剧烈搅拌,将超声波反射仪的超声发射杆插入至液面以下,开启超声波反应仪,室温加搅拌反应2h。倒出反应液,静置分层,分液,有机层加50ml水,搅拌分液,再次加入50ml水,浓缩二氯甲烷至干,加入丙酮重结晶,-5~0℃析晶,过滤,干燥得地屈孕酮纯品,通过hplc检测纯度99.84%,结构式为i的醛基杂质的含量为0.072%。
[0148]
对比例2
[0149]
20g地屈孕酮粗品(纯度94.93%,醛基杂质含量2.1%)加入到带磁子的反应瓶中,加入100ml二氯甲烷搅拌溶解,加入水40ml,亚硫酸氢钠6g,继续剧烈搅拌,室温剧烈搅拌反应2h。倒出反应液,静置分层,分液,有机层加50ml水,搅拌分液,再次加入50ml水,浓缩二氯甲烷至干,加入丙酮重结晶,-5~0℃析晶,过滤,干燥得地屈孕酮纯品,通过hplc检测纯度95.3%,结构式为i的醛基杂质的含量为0.84%。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
