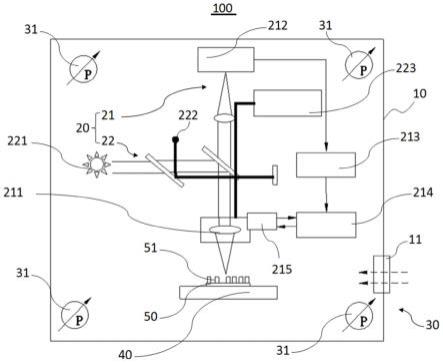
1.本发明涉及营养制品技术领域,尤其涉及一种益生菌软胶囊及其制备方法。
背景技术:
2.随着人们生活水平的提高,对健康的要求越来越高,益生菌被普遍接受并广泛使用。益生菌是一类对宿主有益的活性微生物,是定植于人体肠道、生殖系统内,能产生确切健康功效从而改善宿主微生态平衡、发挥有益作用的活性有益微生物的总称。益生菌的概念在1989年被提出,2002年科学家确定益生菌的概念和疗效。之后短短十年世界人类卫生领域发生了巨大的变化,益生菌益生元的研究和产品开发成为了潮流。该领域的研发、生产,目前在乳酸菌、双歧杆菌的研究和应用方面尤其突出。这方面的产品有传统的酸奶,以及新开发的各种酸奶,乳酸饮料,各种单复合菌保健品、食品,还有用于治疗肠道疾病的益生菌制剂。因为益生菌的保存条件苛刻,现有产品普遍存在着活菌易死亡,菌数不稳定,导致益生菌产品保质期短,质量不稳定的技术问题。
技术实现要素:
3.本发明的目的是为了解决上述现有技术的不足,而提出一种益生菌软胶囊及其制备方法。
4.为了实现上述目的,本发明采用了如下技术方案:一种益生菌软胶囊,包含胶囊壳体和内容物质,其特征在于,所述内容物质为含植物油的益生菌微胶囊混合物,益生菌微胶囊由壁材和囊芯物质组成,所述囊芯物质为益生菌菌粉,所述壁材为柠檬酸/京尼平与明胶/壳聚糖交联后形成的聚合物,所述聚合物的化学结构式如式(i)所示:
[0005][0006]
式(i)中:r1至r9选自十八种不同氨基酸甘氨酸、丙氨酸、丝氨酸、天门冬氨酸、谷氨酸氨基、脯氨酸、精氨酸、组氨酸、酪氨酸、胱氨酸、亮氨酸、苏氨酸、蛋氨酸、缬氨酸、苯丙氨酸、色氨酸、谷氨酸、赖氨酸的残基中的一种。
[0007]
优选地,所述式(i)中:
[0008]
r5、r6选自十八种不同氨基酸甘氨酸、丙氨酸、丝氨酸、天门冬氨酸、谷氨酸氨基、脯氨酸、精氨酸、组氨酸、酪氨酸、胱氨酸、亮氨酸、苏氨酸、蛋氨酸、缬氨酸、苯丙氨酸、色氨酸、谷氨酸、赖氨酸的残基中的一种; r3、r7为赖氨酸或者精氨酸的残基;
[0009]
r2、r4、r8为天门冬氨酸或谷氨酸氨基的残基;
[0010]
r1、r9为丝氨酸、苏氨酸或酪氨酸的残基。
[0011]
本发明还提供一种益生菌软胶囊的制备方法,具体包括如下步骤:
[0012]
a.将明胶溶解于醋酸中,得到明胶醋酸溶液;
[0013]
b.明胶醋酸溶液中加入壳聚糖,搅拌使壳聚糖溶解,得到明胶/壳聚糖混合溶液,
并调节ph至5.8-6.2;
[0014]
c.将益生菌菌粉与明胶/壳聚糖混合溶液混合均匀;得到含有益生菌的明胶/ 壳聚糖混合溶液;
[0015]
d.在植物油中加入表面活性剂大豆磷脂,加热后搅拌均匀;
[0016]
e.向步骤d后的植物油中加入步骤b制得的明胶/壳聚糖混合溶液进行加热和乳化,乳化完成后关闭加热,自然冷却至室温;
[0017]
f.向步骤e后的溶液体系中加入京尼平进行交联反应,充分反应完全;
[0018]
g.在步骤f后的反应体系中加入柠檬酸,并加入冰醋酸,调节ph至2-3,在n2保护下充分反应,得到益生菌微胶囊;
[0019]
h.将含有植物油的益生菌微胶囊内容物通过压制法封装于胶囊壳体中,得到益生菌软胶囊。
[0020]
优选地,所述步骤g后还包括:将步骤g后的反应体系静置,倾去上层油相后再进行离心,分离出油相,即得到纯化的益生菌微胶囊。
[0021]
优选地,所述步骤b中,优选调节ph至6。
[0022]
优选地,所述步骤f的具体步骤为:向步骤e后的溶液体系中加入体积比为 0.5%的京尼平水溶液,在室温下反应3h,升温至35℃再反应15h,充分反应后得到京尼平交联明胶/壳聚糖微胶囊。
[0023]
优选地,所述步骤d使用的植物油为玉米油、橄榄油、大豆油、花生油中的一种或几种,乳化温度控制为35-45℃,乳化时间控制为40-80min,进一步优选,乳化温度为37℃,乳化时间为60min;所述步骤g的具体步骤为:在步骤 f的反应体系中加入柠檬酸,并加入冰醋酸,调节ph至2-3,在n2保护下将反应温度升至40℃,反应8h后再冷却至室温,益生菌微胶囊。
[0024]
优选地,按照重量份数计,各组分的配比为:明胶12-32份,壳聚糖1.2-3.2 份,1.0%醋酸溶液160-300份,大豆磷脂15-25份,0.5%京尼平80-120份,1.0%柠檬酸10-35份,植物油800-1200份。
[0025]
优选地,所述通过压制法封装于胶囊壳体中具体包括如下步骤:化胶,制胶片,压丸和干燥,具体步骤为,将去离子水和明胶按比例混合加热至70℃,加入明胶,一起加热1-2h,抽真空脱泡,50℃保温,得到胶液,将胶液涂布于平整干净的板面,加热使水分蒸发,得到具有弹性胶片,再通过压丸定型和干燥得到软胶囊,化胶步骤中明胶:甘油:去离子水的重量比为 1-1.25:0.35-0.65:1-1.50。
[0026]
优选地,所述步骤c的益生菌菌粉包括如下益生菌:长双歧杆菌、短双歧杆菌、青春双歧杆菌、嗜热链球菌、保加利亚乳杆菌、乳酸乳杆菌中的一种或几种组合。
[0027]
优选地,所述步骤h的益生菌软胶囊结构组成为胶囊外壳和内容物质,内容物质为益生菌微胶囊和植物油混合物,胶囊外壳主要成分为明胶和甘油,其中甘油主要起增塑作用,提高外壳机械强度。
[0028]
优选地,明胶与壳聚糖的质量比为8:1至12:1,水相与油相体积体比为 1:3至1:5;进一步优选地,明胶与壳聚糖的质量比选择10:1,水相与油相体积体比选1:4。
[0029]
进一步优选地,各组分的配比为:明胶22份,壳聚糖2.2份,1.0%醋酸溶液240份,大豆磷脂20份,0.5%京尼平100份,1.0%柠檬酸25份,植物油 1000份。
[0030]
与现有技术相比,本发明的有益效果是:本发明通过微胶囊技术将益生菌包裹在具有囊壁结构的微胶囊中,进一步地,采用软胶囊将含植物油的益生菌微胶囊包封于内。其具有如下优点,第一,软胶囊外壳可将含植物油益生菌微胶囊混合物密封起来,使内容物保持长期稳定;第二,植物油在益生菌微胶囊表面形成油膜,可有效隔绝氧气,提高益生菌的稳定性和存活率。一方面,本发明的微胶囊囊壁结构具有很好的机械性能,能够很好地将益生菌成功包裹到囊壁结构中,克服了活菌易死亡,菌数不稳定,导致益生菌产品保质期短,质量不稳定的技术问题;另一方面,本发明的益生菌进入人体胃部后,囊壁结构能够保证在胃液中不分解,而在肠液中能快速分解释放益生菌,使益生菌能够快速有效被吸收而发生作用。
附图说明
[0031]
图1为实施例1明胶、壳聚糖以及不同质量比例壳聚糖/明胶的等电点曲线图。
[0032]
图2为明胶、壳聚糖、明胶/壳聚糖复合物、京尼平交联明胶/壳聚糖和柠檬酸二次交联明胶/壳聚糖的热重曲线图。
[0033]
图3为以京尼平和柠檬酸为交联剂,明胶和壳聚糖为囊壁制备微胶囊过程中的微胶囊显微镜时间对比图。
[0034]
图4为实施例2制备的益生菌微胶囊在模拟胃液中的溶解情况对比图。
[0035]
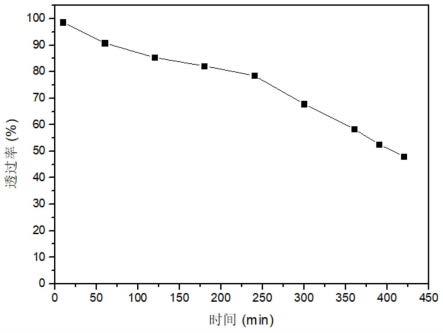
图5为实施例2制备的益生菌微胶囊在模拟胃液中透过率与时间的关系图。
[0036]
图6为实施例2制备的益生菌微胶囊在模拟肠液中的溶解情况对比图。
[0037]
图7为实施例2制备的益生菌微胶囊在模拟肠液中透过率与时间的关系图。
具体实施方式
[0038]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地说明。
[0039]
实施例1明胶、壳聚糖、明胶/壳聚糖复合材料等电点测定
[0040]
1.1明胶等电点
[0041]
称取0.5g明胶,加入100ml去离子水,50℃水浴温度下搅拌至完全溶解,得到0.5%的明胶溶液。使用0.001mol/l hcl溶液和0.001mol/l naoh 溶液调节ph,采用ph计和电导仪记录不同ph值下明胶溶液的电导率。
[0042]
1.2壳聚糖等电点
[0043]
称取0.5g壳聚糖,加入100ml 0.01mol/l hcl溶液中,室温下搅拌至壳聚糖完全溶解,得到0.5%的壳聚糖溶液。使用0.001mol/l naoh溶液调节溶液ph,采用ph计和电导仪记录不同ph值下明胶溶液的电导率。
[0044]
1.3壳聚糖/明胶复合材料等电点
[0045]
取100ml 1.0%明胶溶液于烧杯中,磁力搅拌,水浴温度为50℃。向明胶溶液中加入一定体积的1.0%壳聚糖溶液,搅拌1h,得到明胶/壳聚糖均一混合溶液。壳聚糖与明胶的体积比分别为:4:100、10:100、20:100、50:100、75:100、 100:100。使用1.0%hcl溶液和0.1mol/l naoh溶液改变混合溶液的ph,使用ph计和电导仪测定不同ph值条件下明胶/壳聚糖溶液的电导率。
[0046]
按上述方法测定得到明胶、壳聚糖的等电点以及不同质量比例壳聚糖/明胶的等电点如表1所示;明胶、壳聚糖以及不同质量比例壳聚糖/明胶的等电点曲线图如图1所示。
[0047]
表1明胶、壳聚糖的等电点以及不同质量比例壳聚糖/明胶的等电点
[0048][0049]
实施例2益生菌的制备方法
[0050]
a.称取2.2g的明胶于烧杯中,37℃水浴温度,溶解一定体积的1.0%的醋酸;
[0051]
b.待明胶完全溶解,向明胶溶液中加入0.22g的壳聚糖,搅拌溶解,得到均一明胶/壳聚糖混合溶液,并采用5.0%氨水溶液调节ph至6;
[0052]
本步骤中,调节ph至6,因为明胶为两性聚合物,其等电点为5.0,ph大于其等电点,明胶分子显负电,即-nh
3
有一部分与-oh-结合转化为-nh2,从而明胶分子中的-coo-(负电荷)含量大于-nh
3
(正电荷)含量,分子显负电。当明胶在小于等电点的介质中时,明胶分子显正电,即-coo-有一部分与-h
结合转化为
ꢀ‑
cooh,从而明胶分子中的-nh
3
(正电荷)含量大于-coo-(负电荷)含量,分子显正电。因此调节体系ph至6,使明胶负电荷,壳聚糖带由于在酸性介质中,其分子上的游离氨基因质子化而带正电,从而使带负电的明胶与带正电荷的壳聚糖因静电相互作用而发生复凝聚反应;明胶在不同的ph下的电离反应如式所示:
[0053][0054]
壳聚糖的在酸性介质中质子化反应过程如式ⅲ所示:
[0055][0056]
明胶与壳聚糖复凝聚反应如式ⅳ所示:
[0057][0058]
c.将益生菌菌粉与明胶/壳聚糖混合溶液按照一定体积比1:3混合均匀;得到含有益生菌的明胶/壳聚糖混合溶液;
[0059]
d.取100ml的植物油于三口烧瓶,加入2.0g的大豆磷脂,升温至37℃,搅拌均匀,大豆磷脂是一种两性表面活性剂,其可从大豆中提取,天然无毒;
[0060]
e.向植物油中加入明胶/壳聚糖混合溶液进行乳化,600rpm,乳化温度37℃,乳化时间60min;
[0061]
f.关闭加热,自然冷却至室温;明胶可发生溶胶和凝胶转变,温度高于35℃时,明胶溶胀,当温度低于35℃时,明胶凝胶。从而降低温度至室温,有利于微粒因明胶凝胶而形成较为固定的壳膜,提高微粒的稳定性,有利于下一步的交联反应;
[0062]
g.向步骤e冷却后的反应体系中加入10ml,0.5%京尼平溶液,25-30℃反应3h,再升温至35℃反应15h。
[0063]
本步骤中,京尼平可与含游离氨基聚合物发生交联反应,在酸性条件下,壳聚糖和明胶上的游离氨基基团亲攻击京尼平c-3位的烯碳原子,二氢吡喃环打开,形成杂环胺;另外,京尼平上的酯基基团可与氨基发生sn2亲核取代反应,形成酰胺,释放甲醇,从而形成由短链京尼平为交联桥的三维网状结构聚合物;京尼平与壳聚糖交联反应过程如式
ⅴ
所示:
[0064]
[0065][0066]
g.在步骤f后的反应体系中加入2.5ml,1.0%的柠檬酸溶液,并加入冰醋酸,调节ph至2-3,在n2保护下,反应温度升至40℃,反应8h,冷却至室温,得到益生菌微胶囊;
[0067]
本步骤中,京尼平与明胶和壳聚糖上游离氨基反应,产生交联,而壳聚糖和明胶分子上还存在游离羟基,向反应体系中加入柠檬酸,在一定条件下,柠檬酸上的羧基与大分子上游离羟基发生酯化反应,可以对明胶和壳聚糖进行二次交联,提高囊壁强度,增加微胶囊的稳定性,柠檬酸二次交联明胶/壳聚糖结构式如式ⅰ所示:
[0068][0069]
h.将反应得到的微胶囊静置2h,明胶/壳聚糖微胶囊沉积在下层,植物油在上层,倾去上层油相,再取下层微胶囊再进行离心,分离出油相,即得到微胶囊; i.取150ml去离子水和50ml甘油混合,加热至70℃,加入150g明胶,一起加热1-2h,抽真空脱泡,50℃保温,得到胶液,将胶液涂布于平整干净的板面,加热使水分蒸发,得到具有弹性胶片;将胶片与步骤h微胶囊通过压丸模进行压丸定型,温度:18-22℃,相对湿度:20-35%,得到益生菌软胶囊;将益生菌软胶囊在25-30℃干燥10h,得到软胶囊产品。
[0070]
实施例3热重分析(tg)
[0071]
3.1分析方法
[0072]
称取2-6mg样品,采用tg/dsc同步热分析仪测试,以10℃/min的速率从室温升温至
600℃,气体氛围为氮气。
[0073]
3.2分析结果
[0074]
不同样品的热分解温度如表2所示,
[0075]
表2不同样品的热分解温度
[0076][0077]
图2为明胶、壳聚糖、明胶/壳聚糖复合物、京尼平交联明胶/壳聚糖和柠檬酸二次交联微胶囊的热重曲线图,由表2和图2可见,经过柠檬酸二次交联得到的微胶囊的热分解温度最大,达到294℃,其热稳定性较京尼平的一次交联明胶/壳聚糖高。因此,经过柠檬酸二次交联的微胶囊囊壁强度较大,热稳定较高。
[0078]
上述结果的原因在于:本专利实施例2采用的是双交联剂,第一次交联采用的是京尼平,京尼平是栀子苷经β-葡萄糖苷酶水解后的产物,是一种优良的天然生物交联剂。第二次交联采用的是柠檬酸,天然存在于柠檬柑橘等果实中,一个柠檬酸分子上含有三个羧基和一个羟基,在一定反应条件下,柠檬酸可与明胶和壳聚糖上的羟基发生酯化反应,可进一步对微胶囊囊壁上的明胶/壳聚糖进行交联固化,从而提高囊壁的强度,增加微胶囊的热稳定性。
[0079]
实施例4制备过程中益生菌微胶囊的光学显微镜观察
[0080]
采用吸管吸取适量固化后的益生菌微胶囊溶液于玻璃载玻片上,置于型号为 wv-cp240/g光学显微镜下观察,并拍照记录。
[0081]
附图3为以京尼平和柠檬酸为交联剂,明胶和壳聚糖为囊壁制备微胶囊过程中的微胶囊显微镜时间对比图,由图可见,在乳化阶段,随着乳化时间的增加,微粒的粒径逐渐变小,粒径分布变窄,当乳化时间达到60min时,粒径较小,稳定性较好。因此,乳化时间以60min为佳。乳化完成后,加入京尼平进行交联,交联时间达到15h得到以京尼平交联聚合物为囊壁的益生菌微胶囊,再加入柠檬酸二次交联,得到稳定益生菌微胶囊。
[0082]
实施例5耐人工胃液实验
[0083]
图4为实施例2制备的益生菌微胶囊在模拟胃液中的溶解情况对比图,通过光学显微镜观察益生菌微胶囊在模拟胃液中的溶解情况,观察时间为6h,因为在正常进食条件下,混合食物在胃内停留4-6h后进入小肠。将微胶囊与模拟胃液混合于显微镜下观察,发现随着时间延长,少量明胶/壳聚糖微胶囊被模拟胃液分解。另外经过360min后,实施例2制备的益生菌微胶囊在模拟胃液中的透过率仅下降了约1%,实施例2制备的益生菌微胶囊在模拟胃液中透过率与时间的关系图见附图5,由此说明,实施例2制备的益生菌微胶囊具有较强抵抗胃液侵蚀的能力,防止囊芯物质在到达肠道前被胃液侵蚀和分解。
[0084]
实施例6耐模拟肠液实验
[0085]
图6为实施例2制备的益生菌微胶囊在模拟肠液中的溶解情况对比图,如图 6所示,通过光学显微镜观察益生菌在模拟肠液中的溶解情况,发现随着时间增加,囊壁结构逐渐被模拟肠液溶解,当模拟肠液处理时间达到420min时发现,微胶囊大部分已溶解。另外在波长为600nm的条件下,测定益生菌微胶囊在模拟肠液中的透过率,发现随着时间延长,处理溶液的透过率降低,当处理时间达到420min时,透过率显著降低,下降了约50%,实施例2制备的益生菌微胶囊在模拟肠液中透过率与时间的关系图参看附图7。这是因为胰蛋白酶是一种存在于胰液的蛋白质消化酶,其为胰蛋白酶原分泌进入小肠后被小肠分泌出的肠肽酶切掉一小块胰蛋白酶原所激活产生,其为肽链内切酶,能把多肽链中赖氨酸和精氨酸残基中的羧基侧切断。明胶是胶原水解产物,由氨基酸构成的多肽链,在肠液中会被胰蛋白酶消化分解,明胶和壳聚糖作为囊壁制备得到的微胶囊最终被分解。由此,明胶/壳聚糖微胶囊不耐肠液,在肠液中可释放益生菌,使益生菌有效定殖在小肠内,发挥益生菌的有益作用。
[0086]
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。