jwa多肽在制备抗新生血管性眼病药物方面的应用
技术领域
1.本发明涉及jwa多肽在制备抗新生血管性眼病药物方面的应用,属于血管新生药物技术领域。
背景技术:
2.新生血管性眼病是指一类致患者视力减退和不可逆性损害的致盲性眼病,主要分为渗出性年龄相关性黄斑变性(neovascular age-related macular degeneration,namd)、糖尿病视网膜病变(diabetic retinopathy,dr)、眼底视网膜静脉闭塞、新生血管青光眼、早产儿视网膜病变等。其中,namd和dr是首要致盲病因。namd是50岁以上人群致盲的首要原因,70岁以上人群中患病率约为5%,是目前我国排名第三位的致盲性眼病。随着人口老龄化,namd的患病率亦在不断升高,目前全球超1500万人罹患该病,预计到2050年患病人数将翻一番。
3.目前新生血管性眼病的临床一线治疗方案是眼内注射抗血管内皮生长因子(vascular endothelial growth factor,vegf)抗体药物。虽然以雷珠单抗、阿柏西普和康柏西普等为代表的抗vegf抗体药物的疗效是确定的,但仍有部分患者治疗后未获得具有临床意义的视力提升。约67.4%的namd患者黄斑区出现持续的血管渗漏,超60%的namd患者在治疗2年后视力恢复欠佳。因为病情的复杂性,部分患者必须长时间、反复接受眼内注射抗vegf药物,而反复的眼内注射给患者造成沉重的治疗压力,也大大增加了并发症的风险,如眼内炎、高眼压及视网膜色素上皮的撕裂等。而不容忽视的是,视网膜萎缩已成为眼部长期抗vegf治疗后期视力下降的主要原因之一。因此,探索除vegf以外的其他靶点,围绕新靶点、多靶点药物的研发、药物剂型及给药方式的改进有望为新生血管性眼病患者带来福音。
4.整合素是一类跨膜的异二聚体糖蛋白细胞黏附分子,分布于细胞表面,通过调节细胞内部双向信号转导的过程,调节细胞间、细胞与细胞外基质之间的作用,进而调节细胞的黏附、生长、增生、分化及迁移等行为。整合素αvβ3是目前研发热度最高的整合素之一,可被精氨酸-甘氨酸-天冬氨酸(arg-gly-asp)所构成的rgd三肽序列特异性识别,进而介导细胞间以及细胞与细胞外基质的双向信号转导。整合素αvβ3是纤维蛋白原,纤连蛋白和玻连蛋白等细胞外基质中糖蛋白的主要受体,在肿瘤及活化的血管内皮细胞表面整合素αvβ3呈上调状态并通过复杂的信号通路使活化的血管内皮细胞移行和增生。目前,rgd三肽序列被广泛应用于多种生理、病理过程的检测和治疗研究中,如肿瘤的诊断与治疗。近年来,在眼球后部血管增生疾病的研究中,整合素αvβ3愈加受到关注,以整合素αvβ3为靶点有望成为药物研发的新目标。
5.在成熟的正常血管上,整合素αvβ3表达极少或不表达且保持静止,但在新生血管上的表达却显著上调。有研究显示,整合素与肿瘤、namd和dr等疾病密切相关。namd患者的血管中整合素αvβ3和α5β1增加。眼内注射整合素αvβ3的小分子抑制剂sf-0166及risuteganib等有助减少视网膜、脉络膜新生血管,目前已进入临床研究。此外,诸多研究显示,dr早期及进展期病变的视网膜上整合素αvβ3及其配体的表达上调,且与dr严重程度呈
正相关。鉴于整合素独特的作用机制,靶向整合素具有作为原发性治疗和辅助抗vegf治疗的潜力,或可能在抗vegf无应答的患者中发挥作用。
6.jwa基因(又名arl6ip5),是周建伟等率先从维甲酸诱导的人支气管上皮(hbe)细胞分化模型中发现和克隆并长期聚焦研究的环境应答基因,其编码蛋白是一种细胞骨架结合蛋白,在正常细胞可参与调节细胞分化、应答氧化应激、dna修复等过程。此外,jwa在多种肿瘤中,通过抑制细胞增殖、迁移和血管新生等发挥抑瘤功能。基于jwa功能片段筛选的抗肿瘤多肽jp1,通过其连接的rgd序列靶向黑色素瘤表面高表达的整合素αvβ3后进入胞内,负调控核转录因子sp1,下调αvβ3表达,有效抑制小鼠黑色素瘤生长及转移。值得注意的是,jp1作为jwa基因的功能片段,是一种内源性分子,无免疫源性,在小鼠动物模型中未见任何毒副作用,与化疗药dtic(达卡巴嗪)联用,对于抑制黑色素瘤起到增效减毒的作用。食蟹猴毒性测试显示,以高于人拟用剂量30倍的150mg/kg连续两周静脉注射jp1,无可见有害作用。
7.不过,虽然jp1连接rgd序列后能够靶向黑色素瘤表面高表达的整合素αvβ3,但这并不代表其能够用于治疗脉络膜血管增生、糖尿病引起的视网膜血管渗漏等,尤其对于vegf靶点药物耐受患者能否作为治疗性药物以及是否能实现眼外途径给药,这些都亟待进一步的探索和研究。对此,目前发明人课题组已有最新的研究成果,并以此来申请本发明专利。
技术实现要素:
8.本发明的主要目的是:针对现有技术存在的问题,提出一种jwa多肽在制备抗新生血管性眼病药物方面的应用,可通过血脑/血眼等屏障经靶向整合素分子直接达到眼底组织细胞并进入细胞发挥抗炎和抗血管新生等作用,为新生血管性眼病提供新的临床用药可能。
9.本发明解决其技术问题的技术方案如下:
10.一种多肽的用途,其特征是,所述用途为用于制备治疗或预防新生血管性眼病的药物;
11.所述多肽的氨基酸序列如i或ii所示:
12.i:fpgsdrf-z;
13.ii:x-fpgsdrf-z;
14.其中,氨基酸s经磷酸化修饰,x、z分别为氨基酸或氨基酸序列;
15.x选自f、(r)9、(r)
9-f、6-氨基己酸、6-氨基己酸-f、6-氨基己酸-(r)9、6-氨基己酸-(r)
9-f之一;
16.z选自(g)
n-rgd、a-(g)
n-rgd之一,n为大于或等于0的整数,且n的取值范围为0-10。
17.优选地,所述新生血管性眼病包括湿性黄斑变性。
18.优选地,所述新生血管性眼病包括渗出性年龄相关性黄斑变性。
19.优选地,所述新生血管性眼病包括糖尿病视网膜病变。
20.优选地,所述新生血管性眼病包括眼底视网膜静脉闭塞、新生血管青光眼、早产儿视网膜病变。
21.优选地,所述多肽的n端经乙酰化修饰、c端经酰胺化修饰。
22.优选地,所述多肽的氨基酸序列为fpgsdrf-rgd,其中,氨基酸s经磷酸化修饰。
23.优选地,所述药物包括载体,所述载体为药学上可接受的载体。
24.优选地,所述药物的剂型为眼内给药剂型。
25.优选地,所述药物的剂型为眼外给药剂型。
26.本发明涉及的多肽是专利号cn201310178099x、授权公告号cn103239710b的中国发明专利中记载的系列多肽中的一部分。发明人经实践研究发现,上述多肽一方面能通过调控小胶质细胞ros/nf-κb通路抑制氧化应激和炎症反应,另一方面能通过抑制p-mek1/2和trim25,加速sp1的降解,下调血管内皮细胞中整合素αvβ3和mmp2的转录,发挥抗血管新生的作用,因此,上述多肽可作为针对新生血管性眼病进行治疗或预防的候选分子,用于制备治疗或预防新生血管性眼病的药物,具有良好的应用前景。
附图说明
27.图1为本发明实施例1的结果图。其中,a图:实验模型设计方案的技术路线图。b图:腹腔注射造影剂后5min cnv小鼠荧光血管造影检查代表图。c图:小鼠cnv的渗漏强度评分比较图。d图:fitc-dextron左心室灌注后小鼠脉络膜平铺片新生血管代表性图片。e图:fitc-dextron左心室灌注后小鼠脉络膜平铺片面积统计分析图。f图:cnv小鼠激光射击点处he染色图。g图:cnv小鼠病灶相对厚度分析图。
28.图2为本发明实施例2的结果图。其中,a图:玻腔注射1μl pbs或jp1 40μg(比例尺:10μm)cnv小鼠病灶处ros的免疫染色结果图。b图:cnv小鼠脉络膜组织中gpx、mda、sod活性测定结果图。c图:cnv小鼠病灶处iba1和nrf2的免疫荧光检测结果图,比例尺:10μm。d图:cnv小鼠脉络膜组织中nrf2的免疫印迹实验分析结果图。e图:iba1和p-p65在cnv病灶中的免疫荧光检测结果图,比例尺:10μm。f图:cnv小鼠脉络膜组织中p-p65和p65的免疫印迹实验分析结果图。g图、h图:cnv小鼠脉络膜组织中tnf-α(g)和il-6(h)的免疫荧光检测结果图,比例尺:10μm。i图:pbs或jp1处理的cnv小鼠脉络膜组织中tnf-α、il-6和vegf的免疫印迹实验分析结果图。
29.图3为本发明实施例3的结果图。其中,a图:用dcfh-da检测lps处理的bv2细胞中存在或不存在jp1时的细胞内ros水平结果图,比例尺:20μm。b图:共聚焦显微镜检测dcfh-da阳性细胞的数量并进行定量分析结果图。c图:nrf2和iba1在bv2细胞中的免疫荧光评价结果图,比例尺:20μm。d图:nrf2在bv2细胞中的平均荧光结果图。e图:bv2细胞中nrf2的免疫印迹实验分析结果图。f图:p-p65和iba1在bv2细胞中的免疫荧光检测结果图,比例尺:20μm。g图:bv2细胞中tnf-α、il-6、inos的免疫荧光检测结果图,比例尺:20μm。h图:bv2细胞中p-p65、tnf-α、il-6、inos平均荧光定量分析结果图。i图:western blot分析bv2细胞中p-p65、p65、vegf、tnf-α和il-6。
30.图4为本发明实施例4的结果图。其中,a图:免疫组化染色显示cnv小鼠脉络膜新生血管组织中整合素αv和β3的表达结果图;每对右图显示的是小图像框中区域的放大视图。b图:免疫印迹分析眼内注射pbs组,rbz 10μg组,jp1 40μg组和rbz 5μg jp1 20μg组cnv小鼠脉络膜组织中p-mek1/2,mek1/2,sp1,整合素αv,β3和cd31的蛋白质含量结果图。c图:四组cnv小鼠脉络膜组织中trim25和mmp2的免疫印迹实验分析结果图。d图至i图:jp1抑制huvecs成管(d-e)、迁移(f-g)和增殖(h-i);以vegf(50ng/ml)和不同浓度jp1(0、50、100、
200μm)干预huvecs 24h;d图为成管试验代表图;e图为闭合管计数;f图为transwell法检测huvecs的迁移能力;g图为计数迁移细胞数量;h图为huvecs的edu染色;i图为edu阳性细胞比率。j图、k图:免疫印迹实验检测vegf和jp1处理后的huvecs中p-mek1/2、mek1/2、sp1、整合素αv、β3、cd31、trim25和mmp2蛋白水平。注:e图、g图、i图的数据以平均值
±
sem表示。**p≤0.01,***p≤0.001,与vegf(50ng/ml)处理组细胞的差异。
31.图5为本发明实施例5的结果图。其中,a图:实验过程示意图。b图:糖尿病3月对照组、rbz组、jp1组及联合组小鼠fitc-dextron心室灌注后视网膜平铺片结果图。c图:angiotool软件对每组小鼠视网膜血管密度进行定量分析结果图。d图:各组小鼠视网膜伊文思蓝渗漏定量分析(n=6/组)结果图。e图:pbs和jp1处理组糖尿病小鼠视网膜组织中iba-1和p-p65的免疫荧光分析结果图。f图:免疫组化分析pbs和jp1处理的糖尿病小鼠视网膜组织中tnf-α、il-6和vegf的结果图。g图:对pbs和jp1处理的糖尿病小鼠视网膜p-p65、p65、vegf、tnf-α和il-6蛋白水平进行免疫组化分析结果图。h图:pbs和jp1处理组糖尿病小鼠视网膜组织occludin和zo-1的免疫组化分析结果图。i图:免疫荧光实验显示pbs和jp1处理组的糖尿病小鼠视网膜神经纤维层和神经节细胞层中cd31、occludin和zo-1的表达结果图。j图:pbs和jp1处理的糖尿病小鼠视网膜occludin和zo-1的免疫印迹实验分析结果图。注:c图、d图、f图、h图中的数据用mean
±
sem表示。*p≤0.05与pbs组差异,**p≤0.01与pbs组差异,***p≤0.001与pbs组差异,****p≤0.0001。
32.图6为本发明实施例6的结果图。其中,a图:腹腔注射jp1的cnv小鼠模型实验流程示意图。b图:腹腔注射jp1的cnv小鼠血管渗漏的代表性ffa图像及定量分析结果图。c图:fitc-dextron标记的血管在平挂脉膜上的典型图像和imagej软件对荧光血管区域的定量结果图。d图:h&e染色及相对cnv病变厚度定量分析结果图。e图:腹腔注射fitc-jp1和fitc的cnv小鼠模型实验流程示意图。f图:fitc-jp1组和fitc组具有代表性的ffa图像及cnv病变荧光强度定量分析结果图。g图-h图:两组腹腔注射后在指定时间点脉络膜平铺片的代表性荧光图像(fitc-jp1 5mg vs fitc 0.99mg)。注:b图、c图、d图、f图中的数据用平均值
±
sem表示。o.n:视神经。i.p:腹腔注射。n,与jp1(1mg,i.p.)组无差异,***p≤0.001,与jp1(1mg,i.p.)组比较。
33.图7为本发明结论部分的作用机制示意图。
具体实施方式
34.下面参照附图并结合实施例对本发明作进一步详细描述。但是本发明不限于所给出的例子。各实施例所用的材料、方法、实验模型条件等内容附在各实施例之后,除此之外,如无特殊说明,所用材料、实验方法均为常规材料、常规实验方法。
35.实施例1
36.本实施例为jp1抑制532nm激光诱导的小鼠脉络膜新生血管。注:jp1的序列为fpgsdrf-rgd,其中,氨基酸s经磷酸化修饰。
37.脉络膜新生血管是湿性黄斑变性最常见的病理过程。532nm激光诱导的cnv小鼠模型被广泛用于湿性黄斑变性机制和药效的研究中。抗vegf药物(如ranibizumab(雷珠单抗))作为一线用药,已在临床实验和治疗中广泛应用。为在体内评价jp1对脉络膜新生血管的影响,构建532nm激光诱导的cnv小鼠模型,并以ranibizumab作为阳性对照药物。
38.结果如图1所示。本实施例结果中,首先观察到玻璃体腔注射jp1以剂量依赖性的方式抑制了532nm激光诱导的cnv(图1a-g)。在jp1治疗组中,0和1渗漏评分的cnv病变百分比增加,而2a和2b渗漏评分的cnv病变百分比下降(图1c)。fitc-dextron左心室灌注的脉络膜铺片及he染色显示,与对照组相比,玻腔注射jp1明显减小了激光诱导的cnv面积(图1d-e)。中等剂量jp1(20μg)与ranibizumab(10μg)疗效相似,高剂量jp1(40μg)比ranibizumab(10μg)有更强的抑制cnv的作用(图1e,g)。在激光诱导后1周,低、中、高剂量jp1均有效抑制激光诱导的cnv(图1c,e,g)。值得注意的是,jp1 20μg ranibizumab 5μg的联合治疗产生了协同效应,疗效优于任一单药使用(图1e,g)。以上结果显示,相较于临床经典治疗药物ranibizumab,眼内注射40μg jp1可有效抑制cnv,jp1联合剂量减半的ranibizumab干预效果更佳。
39.实施例2
40.本实施例为jp1减轻cnv小鼠模型中小胶质细胞的氧化应激和炎症。
41.氧化应激和炎症是namd发生发展过程中的两大重要的病理事件。为评价cnv小鼠病灶部氧化应激损伤的水平,首先从cnv小鼠脉络膜组织切片中测定了活性氧(ros)的水平(图2a)。与对照组相比,jp1治疗眼cnv切片中ros荧光强度明显降低(图2a)。另外,jp1治疗眼的脉络膜组织中抗氧化酶,包括超氧化物歧化酶(sod)和谷胱甘肽过氧化物酶(gpx)水平显著上升,而氧化应激的标志物丙二醛(mda)水平明显下降(图2b)。
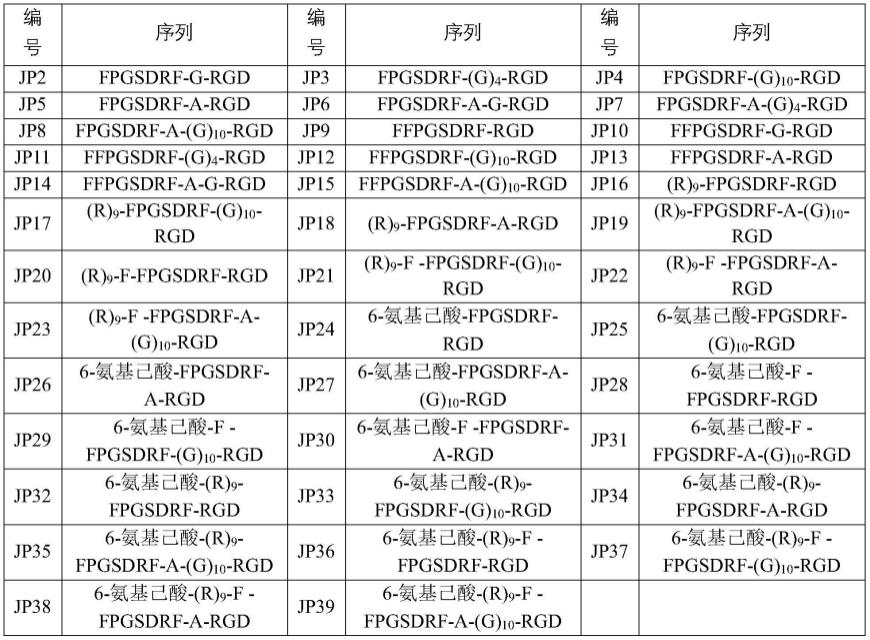
42.以往的研究表明,jwa可通过激活核因子e2相关因子2(nrf2)的表达,抑制ros的产生,从而增强神经元细胞对百草枯诱导的神经毒性的抵抗。大量证据显示,视网膜常驻的免疫细胞——小胶质细胞在namd和dr等新生血管性眼病中扮演了重要的角色。调控小胶质细胞的反应性正成为一种有前途的新生血管眼病的治疗策略。故接着研究jp1对小胶质氧化应激损伤水平的影响。免疫荧光染色过程中,使用iba1来标记小胶质细胞。iba-1和nrf2的双染显示,jp1显著减少了iba-1阳性的小胶质细胞的聚集活化,并增强了脉络膜组织中nrf2的荧光强度(图2c)。免疫印迹实验显示,jp1处理后,cnv小鼠脉络膜组织中nrf2蛋白表达显著增加(图2d)。
43.在namd的发展过程中,氧化应激可诱发炎症。考虑到nf-κb信号通路与ros密切相关,利用激光诱导的cnv小鼠模型和小鼠小胶质细胞bv2,在体内和体外检测了jp1对nf-κb信号通路及下游炎症因子的调控。与对照组相比,jp1治疗眼组织切片中cnv病灶处对p-p65的免疫反应性降低(图2e)。此外,免疫印迹实验显示,jp1下调了cnv小鼠脉络膜组织中p65的磷酸化水平(图2f)。接下来,又检测两种经典的促炎因子(tnf-α和il-6)在cnv病灶处的表达。免疫荧光染色(图2g-h)和免疫印迹实验(图2i)结果显示,jp1处理眼中tnf-α和il-6表达显著下调,同时vegf蛋白表达亦降低(图2i)。
44.实施例3
45.本实施例为jp1降低脂多糖诱导的bv2细胞氧化应激和炎症反应。
46.为了进一步验证jp1对小胶质细胞氧化应激和炎症的调控机制,采用脂多糖(lps,1μg/ml)及jp1(0、50、100、200μm)处理小鼠小胶质细胞(bv2)细胞24h,观察jp1对bv2细胞的影响。使用荧光定量分析来评价bv2细胞中的ros水平(图3a)。结果显示,lps处理24h后,小胶质细胞中ros显著增加(图3a-b)。bv2细胞中ros的产生与jp1浓度水平呈负相关(图3a-b)。此外,免疫荧光染色(图3c-d)和免疫印迹实验分析(图3e)显示,jp1剂量依赖性上调bv2
细胞内nrf2水平,这与jwa的已有文献是一致的。之后,利用lps处理的bv2细胞模型检测了jp1的抗炎潜能。免疫荧光染色结果显示,在bv2细胞中,lps上调了p-p65及炎症因子(tnf-α,il-6和inos)的表达水平,而jp1呈剂量依赖性下调了p-p65及炎症因子的表达水平(图3f-h)。免疫印迹实验分析进一步证实,1000ng/ml lps处理24h后激活nf-κb通路,并伴有炎症因子(vegf、tnf-α和il-6)上调,而jp1以剂量依赖的方式抑制p65的磷酸化,并有效降低了炎症因子水平(图3i)。
47.这些结果证实,jp1通过调控ros/nf-κb信号通路,减轻小胶质细胞氧化应激损伤和炎症反应。
48.实施例4
49.本实施例为jp1通过调控血管内皮细胞mek1/2/sp1/整合素αvβ3轴和trim25/sp1/mmp2轴抑制血管生成。
50.jp1是基于jwa蛋白功能片段设计的功能性多肽。因此,先假设jp1抑制cnv的机制与jwa基因在胃癌和黑色素瘤中的抑癌机制类似,再通过体内和体外实验来验证该假设。既往文献显示,jp1通过调节mek1/2/sp1/整合素αvβ3轴抑制黑色素瘤。因此,首先检测了整合素αv和β3在cnv病变组织中的表达。免疫组化显示jp1处理眼病灶处整合素αv和β3表达下调(图4a)。之后,通过免疫印迹实验检测cnv小鼠脉络膜组织中mek1/2、p-mek1/2、sp1、整合素αv、β3和cd31的表达。如图4b所示,jp1抑制了cnv小鼠脉络膜组织中mek1/2的磷酸化和sp1的表达,并下调了整合素αv、β3和cd31的蛋白表达水平(图4b)。同时检测到jp1下调了cnv小鼠脉络膜组织中的trim25和mmp2蛋白表达水平(图4c)。为进一步验证jp1抑制血管生成的机制,使用人脐静脉血管内皮细胞(huvecs)进行transwell试验、edu试验、成管试验和免疫印迹实验分析。予huvec细胞vegf(50ng/ml),同时予不同浓度的jp1(0、50、100、200μm)孵育24h。结果显示,jp1剂量依赖性抑制vegf诱导的huvec细胞成管(图4d-e)、迁移(图4f-g)和增殖(图4h-i),jp1以剂量依赖的方式调节mek1/2-sp1-integrinαvβ3和trim25/sp1/mmp2轴(图4j-k),这与体内实验结果一致。
51.实施例5
52.本实施例为jp1调控小胶质细胞nf-κb信号通路部分减轻糖尿病小鼠血-视网膜屏障的破坏。
53.糖尿病视网膜病变是另一个导致世界范围内工作年龄人群失明的主要原因。为研究jp1在糖尿病视网膜病变中的治疗效果,构建链脲佐菌素(stz)诱导的糖尿病小鼠模型,这是一个用于临床研究和药物实验的经典模型。fitc-dextron左心室灌注后视网膜平铺片显示,糖尿病病程3个月后,pbs组小鼠视盘周围和周围视网膜出现明显的血管渗漏,同时伴有视网膜血管弯曲,无灌注区增加(图5b)。此外,pbs治疗组的视网膜血管密度较同龄正常小鼠显著下降,但rbz或jp1治疗组的小鼠视网膜血管密度未见明显下降(图5c)。此外,伊文思蓝实验显示,pbs处理组的小鼠视网膜血管渗漏明显,而jp1处理组的视网膜未见明显渗漏(图5d)。以上结果提示jp1对糖尿病小鼠血管渗漏有抑制作用。
54.炎症是dr的主要病理特征。相关研究表明,dr中小胶质细胞激活后可释放炎症因子激活nf-κb信号通路。发明人课题组前期的研究成果表明,jwa基因通过调节nf-κb信号通路减轻神经炎症,从而对多巴胺神经元变性发挥神经保护作用。因此,本实施例继续研究了jp1是否可调节nf-κb信号通路,减轻stz诱导的糖尿病小鼠血视网膜屏障(brb)的破坏(图
5a)。免疫荧光实验显示,与pbs组相比,jp1治疗组小鼠视网膜p-p65和iba1的荧光强度降低(图5e)。免疫组化实验显示,jp1治疗后的糖尿病小鼠视网膜组织中tnf-α、il-6和vegf下调(图5f)。免疫印迹实验分析进一步证实jp1抑制nf-κb信号通路并下调炎症因子(vegf、tnf-α和il-6)(图5g)。此外,免疫组化(图5h)、免疫荧光(图5i)和免疫印迹实验分析(图5j)显示,jp1减轻了糖尿病小鼠视网膜紧密连接蛋白(occludin和zo-1)的丢失。
55.实施例6
56.本实施例为腹腔注射jp1以有效减少cnv渗漏和面积。
57.整合素αvβ3在肿瘤细胞和活化的血管内皮细胞中过表达。识别arg-gly-asp(rgd)序列的整合素已被作为肿瘤的治疗靶点被特别研究。jp1是一个连接rgd序列的多肽,特异性靶向整合素αvβ3。发明人课题组推测,jp1有潜力通过眼外给药的方式,突破血眼屏障,靶向cnv病灶发挥药效。本实施例探讨了jp1眼外给药(腹腔给药)在激光诱导的cnv小鼠模型中的治疗潜力(图6a)。血管渗漏等级(图6b)、cnv病变的平均面积(图6c)和相对厚度(图6d)表明jp1腹腔给药以剂量依赖的方式抑制cnv。在激光诱导的cnv模型中,在指定的时间点腹腔注射fitc-jp1和fitc后进行ffa和荧光显微镜成像(图6e)。fitc-jp1组cnv病灶在24h仍可见荧光,而fitc组则未见荧光(图6f)。fitc-jp1组眼内荧光强度高于fitc组(图6g)。视网膜脉络膜平铺片证实jp1增强了cnv病灶处fitc的积累(图6h),验证了jp1对cnv病灶的靶向性。上述结果表明,腹腔注射jp1可有效减少cnv血管渗漏和面积。
58.实施例7
59.本实施例为验证除jp1以外的jwa多肽的抗新生血管性眼病效果。
60.本实施例采用下表所示的各jwa多肽按实施例1至6进行检测,各jwa多肽的氨基酸s经磷酸化修饰。
61.62.受篇幅所限,本实施例未列出具体实验数据。所得实验数据表明,以上各jwa多肽按实施例1至6进行检测的结果均与jp1基本一致。
63.结论
64.由以上各实施例可知,本发明证实了以jp1为代表的系列jwa多肽对532nm激光诱导的cnv小鼠模型脉络膜新生血管和链脲佐菌素诱导的糖尿病小鼠模型视网膜血管渗漏的治疗效果。一方面,这些jwa多肽通过调控小胶质细胞ros/nf-κb通路抑制氧化应激和炎症反应;另一方面,这些jwa多肽通过抑制p-mek1/2和trim25,加速sp1的降解,下调血管内皮细胞中整合素αvβ3和mmp2的转录,发挥抗血管新生的作用(图7)。因此,这些多肽可作为针对新生血管性眼病进行治疗或预防的候选分子,用于制备治疗或预防新生血管性眼病的药物,具有良好的应用前景。
65.以上各实施例所用的材料、方法、实验模型条件等如下文所示。
66.一.主要仪器
67.finesse me 石蜡切片机 美国thermo
68.rs-232型 co2恒温培养箱 德国hera cell
69.pannoramic scan 切片扫描仪 匈牙利3dhistech
70.湿电转仪 美国bio-rad
71.lq-a2003 电子天平 上海瑶新电子科技有限公司
72.waterpro ps 超纯水系统 美国labconco公司
73.ck40 倒置光学显微镜 日本olympus
74.ds-u3 数字照相系统 日本nikon
75.cyro-2000 液氮罐 美国cbs
76.x-30r 超速离心机 美国beckman
77.diagenode bioruptor 非接触超声破碎仪 比利时diagenode
78.cl-17r 型离心机 美国thermo scientific
79.infinite m200 pro 多功能酶标仪 瑞士tecan
80.pac-300 稳压电源 美国bio-rad
81.125-br 垂直电泳仪 美国bio-rad
82.化学发光凝胶成像仪 美国bio-rad
83.相应量度的微量加样器 德国eppendorf
84.gi54t型立式自动压力蒸汽灭菌器 致微(厦门)仪器有限公司
85.thz-c恒温振荡器 江苏太仓市实验仪器厂
86.pf03通风柜 广州市泛美实业有限公司
[0087]-20℃冰箱 中国haier
[0088]-80℃冰箱 美国thermo scientific
[0089]
dk-600 电热恒温水槽 上海精宏实验设备有限公司
[0090]
zeiss lsm 510激光共聚焦显微镜 德国carl zeiss
[0091]
烤箱 上海慧泰仪器制造有限公司 dhg-9140a
[0092]
包埋机 武汉俊杰电子有限公司 jb-p5
[0093]
冻台 武汉俊杰电子有限公司 jb-l5
[0094]
组织摊片机 浙江省金华市科迪仪器设备有限公司 kd-p
[0095]
盖玻片 江苏世泰实验器材有限公司 10212432c
[0096]
微波炉 格兰仕微波炉电器有限公司 p70d20tl-p4
[0097]
显微镜 日本nikon e100
[0098]
正置荧光显微镜 日本尼康 nikon eclipse c1
[0099]
眼底荧光血管造影机器 德国carl zeiss
[0100]
眼底激光机 德国 carl zeiss
[0101]
病理切片机 上海徕卡仪器有限公司 rm2016
[0102]
眼底照相机 德国 carl zeiss
[0103]
hamiliton 微量注射器 瑞士博纳杜兹
[0104]
成像系统 日本尼康nikon ds-u3
[0105]
二.细胞来源及培养条件
[0106]
人脐静脉血管内皮细胞(huvecs)从中国科学院上海生物化学与细胞生物学研究所(中国上海)购得。huvecs细胞的培养基中添加10%胎牛血清(fbs;gibco)及1%链霉素和青霉素(gibco)的rmii-1640(thermo scientific)。细胞培养时放在37℃、5%co2的间断湿化的培养箱中。在无或jp1(0、50、100、200μm)处理的情况下,用vegf(50ng/ml)处理huvecs 24h。
[0107]
永生化小鼠小胶质细胞(bv2)由南京医科大学药学院临床医学系韩峰教授赠送,并于第7代使用。bv-2细胞培养基中加入了10%胎牛血清、1%青霉素/链霉素和1%glutamax(gibco)的dmem/f12(biosharp)。细胞培养时置于37℃、5%co2的湿化培养箱中。在无或jp1(0、50、100、200μm)处理的情况下,用脂多糖(lps)1000ng/ml)处理bv2细胞24h。
[0108]
三.动物来源
[0109]
试验用小鼠从上海灵畅有限公司获得,雄性,年龄为六到八周龄,于南京医科大学实验动物中心内饲养。所有实验小鼠和实验动物操作均通过南京医科大学伦理委员会审核,伦理编号为iacuc-1811067。小鼠饲养温度一般在18-22℃,湿度百分之五十到六十。饮水器为容量为250ml,用饮水瓶给水,每周换水2-3次。每周更换两次垫料。采用2.5%水合氯醛 5%乌拉坦(0.5g乌拉坦溶于10ml 2.5%水合氯醛),小鼠腹腔注射麻醉用量0.1ml/10g;美多丽滴眼液(参天,大阪,日本)滴眼扩瞳;医用透明质酸钠眼球表面涂抹保护角膜。
[0110]
四.主要试剂
[0111]
(一)实验用多肽
[0112]
多肽jp1等由gl biochem(shanghai)ltd.和hybio pharmaceutical co.,ltd(中国深圳,在标准gmp条件下合成。纯度》98%,水溶性。冻干粉长期保存在-20℃。
[0113]
(二)主要试剂
[0114]
细胞培养液dmem/f12(中国,兰杰柯科技有限公司),dmem(美国,gibco);胎牛血清(中国,杭州四季青生物有限公司);青霉素、链霉素、环丙沙星(中国,山东齐鲁制药有限公司);dapi、bca蛋白浓度测定试剂盒(中国,上海碧云天生物技术有限公司),ecl显色液(美国,cell signaling technology公司)。
[0115]
(三)实验用抗体
[0116]
免疫荧光实验中使用抗体:anti-iba1(012-26723,1:100,wako),anti-nrf2
(16396-1-ap,1:500,proteintech),anti-tnf-α(ab183218,1:100,abcam),anti-il-6(bs-6309r,1:100,bioss),anti-cd31(sc-376764,1:100,santa cruz),phospho-nf-κbp65(ser536,1:1600,cell signaling technology),anti-occludin(27260-1-ap,1:1600,proteintech),anti-zo-1(21773-1-ap,1:4000,proteintech)。
[0117]
免疫组化实验中使用抗体:anti-αv:(ab179475,1:500,abcam),anti-β3(13166s,1:250,cell signaling technology),anti-tnf-α(60291-1-ig,1:1000,proteintech),anti-il-6(bs-0782r,1:500,bioss),and anti-vegf(sc-53462,1:500,santa)。
[0118]
免疫印迹实验中使用抗体:anti-cd31(sc-376764,1:100,santa),anti-αv:(ab179475,1:5000,abcam),anti-β3(4702s,1:1000,cell signaling technology),anti-mmp2(18309-1-ap,1:1000,proteintech),anti-trim25(12573-1-ap,1:1000,proteintech),anti-mek1/2(1:1000,cell signaling technology),anti-p-mek1/2(ser217/221,1:1000,cell signaling),anti-sp1(21962-1-ap,1:1000,proteintech),anti-vegf(sc-53462,1:200,santa),anti-nf-κbp65(66535-1-ig,1:1000,proteintech),phospho-nf-κbp65(ser536,1:1000,proteintech),anti-occludin(27260-1-ap,1:1000,proteintech),anti-zo-1(21773-1-ap,1:1000,proteintech),anti-tnf-α(17590-1-ap,1:1000,proteintech),anti-il-6(bs-0782r,1:1000,bioss),anti-β-actin(af0003,1:1000,beyotime),anti-gapdh(af5009,1:1000,beyotime),anti-tubulin(at819,1:1000,beyotime)。
[0119]
五.试剂配制
[0120]
*免疫印迹、免疫共沉淀试剂配制
[0121]
1.上层胶缓冲液:均为常温保存,标准配方为3.0g tris ddh2o定容至1l,调节ph至6.8。
[0122]
2.下层胶缓冲液:均为常温保存,标准配方为18.15g tris ddh2o定容至1l,调节ph至8.8。
[0123]
3.电泳缓冲液:标准配方为14.40g甘氨酸 3.03g tris-base 1g sds ddh2o定容至1l,现配现用。
[0124]
4.湿转液:现配现用,配方为5.81g tris 2.92g甘氨酸 ddh2o定容至800ml,再加200ml甲醇定容至1l。
[0125]
5. 10
×
tbs缓冲液:24.2g tris和80g nacl溶于800ml ddh2o中,调节ph至7.6,用时10倍稀释,并加入1ml吐温2.0。
[0126]
6.封闭液:10g脱脂奶粉用1
×
tbs定容至200ml。
[0127]
7.洗脱液:1l ddh2o中加入15g甘氨酸和1g sds及10ml tween 2.0,调节ph至2.2,避光,4℃保存。
[0128]
*免疫组化试剂配制
[0129]
1. 4%多聚甲醛(pfa,paraformaldehyde):称量pfa粉末4g,充分溶解于100ml pbs溶液中,过滤后使用。
[0130]
2.95%乙醇:用量筒,量取无水乙醇190ml,ddh2o定容至200ml。
[0131]
3.80%乙醇:用量筒,量取无水乙醇160ml,ddh2o定容至200ml。
[0132]
4.70%乙醇:用量筒,量取无水乙醇140ml,ddh2o定容至200ml。
[0133]
5.pbst:1l ddh2o 7g na2hpo4·
12h2o 0.5g nah2po4·
2h2o 9g nacl溶于1000ml水中。
[0134]
*小动物全身麻醉药配制
[0135]
1.小鼠:2.5%水合氯醛 5%乌拉坦,起始剂量0.1ml/20g,状态良好的成年小鼠可腹腔给药0.2ml,老年鼠或合并糖尿病等小鼠麻药量酌情减少。配方:10ml ns 0.25g水合氯醛 0.5g乌拉坦。
[0136]
2.家兔:20%乌拉坦,起始剂量:10ml/2kg,12.5ml/2.5kg,15ml/3kg。
[0137]
配方:10ml ns 2g乌拉坦。家兔短暂麻醉,可将4ml异氟烷置于1片无菌纱布上,置于兔鼻前20s左右家兔丧失意识前通常会有一阵短暂激惹,随后麻醉满意。
[0138]
六.实验模型和条件
[0139]
(一)532nm激光诱发的脉络膜新生血管小鼠模型
[0140]
c57bl/6小鼠腹腔麻醉充分后,托吡卡胺散瞳,将透明质酸钠涂于角膜进行保护。在透明质酸钠上放置世泰免洗圆形盖玻片(直径8mm)。小鼠双眼视网膜接受532nm激光光凝,激光能量设定:250mw,激光光斑大小:50μm,激光爆破时间:100ms。通过眼底激光机可以在距离小鼠视神经约1pd范围内,3:00,6:00,9:0和12:00区域各射击一次,射击处可见激光斑。射击时先聚焦于视网膜,之后可使焦点稍微向后移,然后再发射激光,令在激光发射瞬间就可观察到视网膜下色素上皮下形成的气泡,提示bruch膜已经断裂,并同时观察到视网膜下的激光斑,颜色呈现灰白色。激光造模后,眼内注药组即刻予小鼠玻璃体腔注射干预药物。体式显微镜下,小鼠头部下垫置纱布,调整头位至眼球平面与桌面平行,角膜表面涂以粘弹剂,于粘弹剂上点水,形成光滑镜面,以33g胰岛素针头于小鼠角膜缘后约1mm处造孔,用33g hamiliton(2.5μl针筒,10mm尖头进样针头)进样针在造孔处插入,快速推注1μl干预药物,停顿5s,快速撤针。鼠眼涂红霉素眼膏,眼膏涂抹时注意将角膜完全遮盖。玻腔给药组激光后即刻随机分为6组,每组分别予1μl干预药物玻腔注射。干预药物分别为:pbs,ranibizumab 10μg,jp1 10μg,jp1 20μg,jp1 40μg,及jp1 20μg ranibizumab 5μg。腹腔注药组激光后第2天始以低、中、高浓度jp1(1mg,5mg和10mg,100μl)腹腔注射,两日1次,共3次,每次注射的时间点相同。在激光光凝术后第7天,应用眼底荧光血管造影(ffa)对cnv的渗漏强度进行半定量分析。采用fitc-dextron进行左心室灌注,在指定时间快速取脉络膜平铺片置于荧光显微镜下观察cnv面积。
[0141]
【手术中注意事项】小鼠全麻后,充分散瞳,期间使用透明质酸钠或者超声用耦合剂完全遮盖住角膜。麻醉后尽快完成操作或检查,防止小鼠晶体发生白内障影响后续观察。麻醉后注意保温,冬季可用恒温加热毯。用纱布垫于鼠头下,调整头位,至体式显微镜下注射平面清晰。以33g胰岛素针头在黑白交界处后约1mm处造孔,造孔瞬间感觉手指指尖的突破感后停针于原位,手部保持稳定,针尖勿在鼠眼内晃动。hamiliton微量注射器进针方向面向眼球周边部斜入,勿进针过多,伤及晶体。在镜下能观察到针体尖端即可。
[0142]
(二)链脲佐菌素诱导的慢性糖尿病小鼠模型
[0143]
c57bl/6小鼠(雄性,3-5周龄),予腹腔注射链脲佐菌素(stz)(7.5mg/ml;s-0130,sigma aldrich,圣路易斯,mo,美国),新鲜溶解的na-citrate(cam)缓冲液(ph:4.5-4.7;s4641,sigma)50mg/kg,每日1次,连续5天。1周后血糖≥300mg/dl为糖尿病起病。只有持续高糖3周的小鼠被用于后续实验。糖尿病小鼠全程未使用胰岛素干预。每月予小鼠测量血糖
确认小鼠糖尿病状态。待糖尿病小鼠发病两个月后,将小鼠们随机分为四组,每组10只,组1:眼内注射1μl pbs,组2:眼内注射1μl ranibizumab(10μg),组3:眼内注射1μl jp1(40μg),组4:眼内注射1μl联合药物(ranibizumab 5μg jp120μg)。眼内注射每周1次,共4次,模仿临床上后部新生血管性眼病患者用药频次(初始每月3次 prn注射)。末次给药一周后,采用伊文思蓝法评价小鼠视网膜血管通透性,左心室灌注fitc-dextron观察小鼠视网膜血管渗漏、血管形态、血管密度等,免疫荧光、免疫组化及免疫印迹实验检测目标蛋白的分布及含量。
[0144]
(三)眼底荧光血管造影检查
[0145]
小鼠充分麻醉后予腹腔注射荧光素钠(10%,0.1ml/kg),托比卡胺滴眼液扩瞳后用通过眼底荧光血管造影评价脉络膜新生血管cnv的渗漏程度及渗漏面积,并对cnv病变的渗漏强度进行分级,分级标准如下:0(无渗漏)、微弱的高荧光或无渗漏的斑点荧光;1(渗漏可疑),病变无进行性大小或强度增加的高荧光;2a(渗漏),高荧光强度增加,但大小不增加;2b(病理上显著渗漏),高荧光强度和大小均增加。
[0146]
(四)fitc-dextron灌注脉络膜铺片
[0147]
激光光凝后七天,对cnv小鼠全身麻醉,用34g胰岛素针灌注0.2ml含5mg/ml荧光素标记葡聚糖(fitc-葡聚糖,平均分子量2
×
106。把小鼠四肢用大头钉定于泡沫板上,保持腹部平展状态。依次剪开心前区皮肤,带毛一起去除,然后眼科剪剪开肌肉层,暴露胸壁。此时在靠近小鼠心脏搏动最明显处,用角膜剪插入肋间隙,快速剪掉一块肋骨,足以暴露心尖即可。可稍微将胸壁前推,令心尖处暴露清晰,快速在心尖搏动最明显处插入胰岛素针,感受针尖突破感后,快速注入fitc-葡聚糖至左心室内。后用一块明胶海绵使用生理盐水湿润后置于缺损的肋骨处。等待3min后,cnv小鼠用1%pfa在室温下固定1-2h。使用角膜剪刀仔细修除鼠眼结膜组织。做均匀的放射状切口将cnv小鼠脉络膜-巩膜复合体置于高粘附性盖玻片上,巩膜朝下,滴加一滴抗荧光淬灭剂,使用盖玻片压平,置于湿盒内,全程注意避光操作。荧光显微镜(bx53;使用image-pro plus 6.0软件(media cybernetics,silver spring,md,usa)测量cnv区域。如果小鼠中途心脏跳动微弱,可考虑手动心脏按压,以保证小鼠眼部有足够的fitc-葡聚糖充盈,并维持其生命体征。所有操作重在微创,快速,全程密切检测小鼠的生命体征。
[0148]
(五)fitc-dextron灌注视网膜铺片
[0149]
小鼠麻醉后,向左心室灌流1ml的含40mg/ml异硫氰酸荧光素-葡聚糖的pbs(平均mol wt:2
×
106,sigma,st louis,mo,usa)。5min后,将眼球去核后4%多聚甲醛固定过夜。在解剖显微镜下切除了角膜,视网膜从边缘到赤道呈放射状地切割,完全地剥离了视网膜。然后平铺片。用荧光显微镜观察平板支架并拍照。使用angio tool图像分析软件分析毛细血管网的血管密度。在行视网膜铺片时,可以考虑使用明胶海绵,予pbs充分湿润后,将眼球置于湿润的明胶海绵上进行操作。使用角膜剪刀仔细修除鼠眼结膜组织。然后使用15度穿刺刀在鼠眼上做一突破口,接着使用角膜剪刀插入该突破口,沿着鼠眼角膜缘力量均匀的减除圆形的角膜。注意充分剪除角膜,方便后续操作。在pbs或ns中将球形的晶状体使用注水弯针头轻柔地挑除。然后使用注水弯针头冲洗玻璃体腔,并在对称位置,以视神经为中心,连同视网膜及脉络膜全程剪开四个放射状切口。接着仍在水中,使用注水弯针头钝性分离,边分离边打水,利用水分离以及弯针的钝性分离顺势分离视网膜和脉络膜,全程不使用
镊子夹持视网膜。在眼底视网膜与脉络膜完整分离后,将视网膜在水中缓慢展开,使用弯针将水打出,将视网膜引至高粘附载波片上,而后缓慢展平,用软纸吸去载玻片上多余的液体后,再在盖玻片上点一滴抗荧光淬灭剂,盖玻片倾斜,由一侧先接触载玻片,做出向一侧倾斜—降落——躺平的动作,将盖玻片置于视网膜上,在此过程中注意排尽气泡,压平网膜。不要令盖玻片两侧同时接触载玻片,不利于排气及视网膜展平。
[0150]
(六)h&e染色
[0151]
1.取材:新鲜组织需要用4%多聚甲醛固定至少24h,修切组织后将组织平整地放入脱水盒内。
[0152]
2.脱水浸蜡:将脱水盒装入脱水机内,用梯度酒精脱水后,浸泡于65℃石蜡中。
[0153]
3.包埋:用包埋机将组织全部包埋,然后放置于-20℃冻台冷却,待蜡凝固后取出。
[0154]
4.切片:使用石蜡切片机将蜡块切片,切片厚薄大约为4μm。将切片漂浮于摊片机,40℃温水中将组织展平后,用载玻片将组织捞起,在60℃烘箱内烤片。
[0155]
5.脱蜡:分别将切片置于乙二醇乙醚乙酸酯ⅰ6h,37℃,乙二醇乙醚乙酸酯ⅱ过夜,37℃,乙二醇乙醚乙酸酯ⅲ室温10-15min,乙二醇乙醚乙酸酯ⅳ室温10-15min,100%ⅰ乙醇10min,100%ⅱ乙醇10min,95%乙醇10min,90%乙醇10min,80%乙醇10min,用自来水洗涤。
[0156]
6.苏木素染色:用苏木素染液浸染切片约10min,用流水清洗2min后用分化液分化,再流水清洗2min,用返蓝液染色后流水冲洗2min。
[0157]
7.伊红染色:将切片依次用85%酒精、95%酒精脱水,各5min,最后再用伊红染液染色10min。
[0158]
8.脱水封片:切片分别置入无水乙醇i,无水乙醇ii,无水乙醇ⅲ,二甲,二甲苯ⅱ,各放置5min,中性树胶封片。
[0159]
9.扫描后进行图像分析。
[0160]
【注意事项】鼠眼球取材时,切忌牵拉视神经,以眼科剪伸入球后,剪短视神经周围软组织及视神经,尽量在同一平面操作,剪短同一平面的组织后取下眼球。取材前,有条件者可先于小鼠左心耳做一小切口(可直接用十五度角膜穿刺刀造口,切口整齐,对周围组织损伤亦小),而后在左心室内持续灌注生理盐水直至从右心耳流出的全部都是透明生理盐水,而后用新鲜多聚甲醛溶液进行左心室继续灌注,在灌注过程中可见小鼠全身肌肉抽搐,小鼠鼠尾翘起,灌注至老鼠身体僵硬时可止,然后取材。
[0161]
(七)免疫荧光实验
[0162]
(1)石蜡切片免疫荧光实验步骤
[0163]
1.将切片在二甲苯ⅰ中放置15min-二甲苯ⅱ15min-无水乙醇ⅰ5min-无水乙醇ⅱ5min-85%酒精5min-75%酒精5min-双蒸水5min。
[0164]
2.将切片置于装载edta抗原修复缓冲液的瓷缸中(ph8.0),煮沸30min后冷于常温进行抗原修复。注意确保缓冲液没过切片。待冷却,而后将玻片置于pbs中洗涤3次,5min/次。
[0165]
3.将切片稍甩干水分,用组化笔在需要观察的组织附近画圈,然后滴入山羊血清,并封闭30min。
[0166]
4.轻柔地甩下去封闭液,用摇床晃动冲洗3遍(使用pbs洗涤),以5min/次为宜,然
后在圈内滴加稀释后的一抗,在湿盒内4℃孵育过夜。
[0167]
5.将玻片在pbs中再冲洗3次,约5min/次。稍甩干后在圈内滴加二抗,室温避光孵育1h。
[0168]
6.将玻片在pbs中再冲洗3次,约5min/次。在圈内滴加dapi染液,室温下避光孵育10min。
[0169]
7.将切片甩干,用抗荧光淬灭封片剂封片。
[0170]
8.荧光显微镜下观测并采集图像。
[0171]
(2)细胞免疫荧光实验
[0172]
1.细胞固定:细胞悬液,2800rpm 4℃离心5min,弃上清液,根据底部沉淀的细胞量加入2ml 4%多聚甲醛固定。若肉眼看不见细胞沉淀时,3000rpm/min,4℃离心10min。
[0173]
2.涂片制作:固定过的细胞悬液,2800rpm 25℃离心5min,弃上清液,根据底部沉淀加入pbs:用组化笔画好小圆圈,3000rpm/min,25℃离心10min,加入0.5ml的pbs混匀后吸取200μl,滴于小圆圈中
[0174]
3.细胞固定和破膜:室温,先在圈内加50-100μl固定液,20min后,洗去固定液,再加入破膜液,孵育20min,用pbs洗三次,5min/次。
[0175]
4.封闭:室温下使用山羊血清封闭1h。
[0176]
5.一抗孵育:摇床晃动,用pbs洗涤3个5min,加入预先配好的一抗,完全覆盖细胞,湿盒内4℃孵育过夜。
[0177]
6.二抗孵育:吸去一抗,用pbs洗涤3个5min。加入二抗覆盖细胞,室温孵育1h。
[0178]
7.dapi染色:用pbs洗涤3个5min,洗去多余的二抗,再加入dapi染液覆盖细胞,在避光室温下孵育5min。
[0179]
8.显微镜观察:于荧光显微镜下观察并拍摄图像。
[0180]
(八)免疫组化实验
[0181]
1.石蜡切片脱蜡:将切片分别置于二甲苯ⅰ15min-二甲苯ⅱ15min-二甲苯iii15min-无水乙醇ⅰ5min-无水乙醇ⅱ5min-85%酒精5min-75%酒精5min,用蒸馏水洗。
[0182]
2.抗原修复:组织切片置于盛满柠檬酸抗原修复缓冲液(ph6.0)的修复盒中,在微波炉内行抗原修复,中火8min至沸,停8min再转中低火7min。
[0183]
3.冷却后将玻片置于pbs中在摇床上洗涤3个5min。
[0184]
4.阻断内源性过氧化物酶:在室温下,将切片置入3%双氧水溶液,并避光孵育25min
[0185]
5.把玻片放入pbs中,摇床上晃动洗涤3个5min。
[0186]
6.血清封闭:在圈内滴加3%bsa,室温封闭30min。
[0187]
7.加一抗:甩去封闭液,在切片上滴加一抗稀释液,将切片平放于湿盒内,4℃过夜。
[0188]
8.加二抗:将玻片置于pbs中在摇床上洗涤3个5min。切片甩干后在圈内滴加二抗,室温孵育50min。
[0189]
9.dab显色:将玻片置于pbs中洗涤3个5min。切片甩干水后在圈内滴加dab显色液,在显微镜下通过观察掌握显色时间,用自来水冲洗切片终止,显色阳性为棕黄色。
[0190]
10.复染细胞核:用苏木素复染3min,用自来水洗,用苏木素分化液分化数秒,自来
水冲洗,苏木素返蓝液返蓝,再流水冲洗。
[0191]
11.脱水封片:将切片分别置于75%酒精5min
‑‑
85%酒精5min
‑‑
无水乙醇ⅰ5min
‑‑
无水乙醇ⅱ5min
‑‑
正丁醇5min
‑‑
二甲苯ⅰ5min中脱水透明后,将切片从二甲苯拿出来稍晾干,中性树胶封片。显微镜镜检,图像采集数据分析。
[0192]
(九)cnv组织切片的ros检测
[0193]
cnv诱导5天后,取下眼球后,将眼球置于(o.c.t)化合物(4583,sakura)中,立即快速冷冻。制作视网膜色素上皮(rpe)-脉络膜的冷冻切片(10μm厚)。用稀释的荧光探针2',7'-二氯二氢荧光素二醋酸二氟化血红素dcfhda(hr7814,biobrab)染色检测ros。荧光显微镜检测视网膜-脉络膜切片中ros水平。
[0194]
(十)mda、sod、gpx的测定
[0195]
用试剂盒检测脉络膜组织中的谷胱甘肽过氧化物酶(gpx)、丙二醛(mda)和超氧化物歧化酶(sod)的含量。利用bca蛋白检测试剂盒(中国江苏碧泰生物技术研究所)检测蛋白浓度。所有实验重复进行了5次。
[0196]
(十一)细胞内ros测量
[0197]
细胞内ros水平,采用活性氧检测试剂盒(中国江苏碧泰生物技术研究所)检测。细胞与dcfh-da(中国江苏beyotime生物技术研究所)在37℃下孵育20min。用无血清培养基洗涤后,在荧光显微镜下观察细胞。
[0198]
(十二)免疫印迹实验
[0199]
提取细胞或组织总蛋白:所有操作冰上进行,处理细胞时预先用pbs将细胞缓慢清洗2次,吸除培养液。在皿中加入ripa裂解液,吹匀后,4℃摇床30min。一般六孔板如果细胞种满,细胞形态小密集,可加100μl/孔,如细胞只长满至60%-80%,则加60-80μl/孔。2.4℃,12,000
×
g,离心15min后取上清,测蛋白浓度。标准品为bsa,标准品稀释液为生理盐水。bca蛋白浓度测定方法:bca试剂a:bca试剂b(碧云天)(50:1)配制适量bca工作液,充分混匀,举例:4ml bca试剂a 80μl bca试剂b;取10微升bsa(5mg/ml)稀释至100μl(生理盐水稀释),使终浓度为0.5mg/ml;将标准品按0,1,2,4,8,12,16,20μl加到96孔板的标准品孔中,加标准品稀释液补足到20微升(此时浓度分别为0,0.5,1,2,4,6,8,10);加适当体积样品(1μl)到96孔板的样品空中,再加标准品稀释液到20μl;在各孔中加入200μlbca工作液,37℃放置30min;测定570nm处的吸光度值。最后根据标准曲线计算出蛋白浓度。蛋白取量:选取一组蛋白中,蛋白浓度最低为基础,取总蛋白30μg/15μl,剩余的体积用双蒸水ddh2o补齐。混和后100℃煮沸5min。分装后4℃保存。每泳道加样量70-80μg(15孔≤30μl,10孔≤50μl),每泳道样品蛋白总量相等。30μg/20μl可先选择15μl/泳道。接通电极,上层胶80v,30-45min,下层胶110v,溴酚蓝指示剂迁移到分离胶下游边缘时,停止电泳。可于90v起步,待marker分子量基本分开后改为120v。取相应尺寸的pvdf膜(8.3cm
×
5.2cm,经甲醇预浸泡60s)和下层凝胶浸入转移缓冲液平衡15-30min后,按夹心法由下至上顺序把海绵、滤纸、凝胶、pvdf膜、滤纸、海绵顺按序放置好,然后细心赶去膜和胶夹心内气泡,擦干周围水。恒流模式,0.22a,90min,确保电压》110v。封闭:1
×
tbst 5%(5g/100ml质量体积比,下同)脱脂奶粉,将硝酸纤维素膜放入封闭液中,置于摇床上,常温封闭1-2h。pbst(tbst)洗涤3个5min。一抗封闭:用抗原稀释液稀释一抗1:1000放在摇床上,60次/min,4℃过夜。pbst(tbst)洗涤5min
×
5次(2次即可)。二抗封闭用1
×
tbst 5%脱脂奶粉稀释二抗1:1000羊抗
兔igg-hrp或者羊抗小鼠igg-hrp放在摇床上室温孵育1h。pbst(tbst)洗涤3个15min。底物显色显影液immobilon western 1:1配制,将显影液均匀涂于膜上后曝光。
[0200]
(十三)huvecs成管试验
[0201]
将huvecs(2.5
×
105)悬浮于250μl无血清dmem中,并将其植入24孔transwell板(corning inc.,corning,ny)的顶部腔室中。transwell板底腔中注入600μl含10%胎牛血清的dmem。48h后,用甲醇和0.1%结晶紫染色,用olympus ix70倒置显微镜(tokyo,japan)对细胞进行成像和计数。imagej软件(nih,bethesda,md)用于获得四张染色膜图像的平均细胞数。每个试验重复3次。
[0202]
(十四)edu实验
[0203]
1.将细胞完全培养基稀释并配成edu溶液,溶液稀释比为1000:1,制备成50μm edu培养基
[0204]
2. 100μl 50μm edu培养基/每孔,孵育2h;
[0205]
3.pbs轻柔清洗细胞表面,2个5min;
[0206]
4. 50μl细胞固定液/每孔(即含4%多聚甲醛的pbs)室温孵育30min
[0207]
5. 50μl 2mg/ml甘氨酸/每孔,用脱色摇床孵育5min后,弃甘氨酸溶液
[0208]
6. 100μl pbs/孔,用脱色摇床清洗5min,弃pbs
[0209]
7. 100μl渗透剂(0.5%tritonx-100的pbs)/孔,用脱色摇床孵育10min;pbs清洗1个5min
[0210]
8. 100μl的1
×
染色反应液/孔,室温、避光、用脱色摇床孵育30min
[0211]
9. 100μl渗透剂(0.5%tritonx-100的pbs)/孔脱色摇床清洗3个10min
[0212]
10.每孔每次加入100μl甲醇清洗2个5min;用pbs清洗1个5min
[0213]
11.用去离子水制备适量1
×
hoechst33342反应液,避光储存
[0214]
12.每孔加入100μl 1
×
hoechst 33342反应液,避光、室温、脱色摇床孵育30min
[0215]
13.每孔每次加入100μl pbs清洗1-3次;染色完成后尽快进行检测;湿盒,避光4℃保存待测,不应超过3天。细胞爬片或涂片,可予抗荧光淬灭封片剂封片后4℃储存待测。
[0216]
(十五)transwell实验
[0217]
1.试验前一天预备24孔板和transwell小室。将fn稀释,母液浓度1mg/ml,稀释10倍至终浓度100μg/ml。小室底部涂fn 50μl,在超净台中放置2h风干,在细胞培养箱中过夜。
[0218]
2.试验当天使用0.25%的胰酶消化细胞,细胞计数并调整细胞密度为1
×
106个/ml,种100μl到transwell小室上层,然后在小室外加入600μl 10%fbs的培养基。
[0219]
3.培养12h后将transwell小室取出,95%甲醇固定20min。
[0220]
4.用pbs洗3个5min,用0.4%台盼蓝染色30min。
[0221]
5.用pbs洗3个5min,用棉签轻轻擦去上室的细胞。
[0222]
6.将小室放在载玻片上,显微镜下拍照
[0223]
(十六)fitc-jp1的分布研究
[0224]
激光诱导一周后,将脉络膜新生血管的小鼠随机分为两组(每组10只),分别腹腔注射5mg fitc-jp1和0.99mg fitc 100μl(两组小鼠腹腔注射等量的fitc)。使用ffa法测定fitc在活体视网膜上的强度(n=5/组)。为评价fitc在cnv病灶中的积累情况,分别于腹腔注射fitc-jp1或fitc后1、3、8、24、48h对小鼠实施安乐死。然后,用荧光显微镜观察脉络膜
铺片。
[0225]
(十七)伊文思蓝试验
[0226]
血视网膜屏障(brb)采用伊文蓝法进行量化,如前面所述,稍作修改
35,36
。通过小鼠尾静脉注射伊文思蓝(45mg/kg)10s以上。然后,将小鼠放在温暖的垫子上2h。取血100μl,测定血浆伊文思蓝浓度。打开胸腔,37℃左心室灌注0.05m,ph 3.5的柠檬酸缓冲液2min,清除血管中的染料。接下来,两只眼睛被摘除并沿着赤道一分为二。在体视显微镜下解剖视网膜,在70℃下干燥24h。将每个样品用130μl甲酰胺(sigma)于70℃孵育18h,提取视网膜中与血清白蛋白结合的evans蓝染料。提取液4℃,65,000rpm离心60min。血液样本在4℃,12 000rpm离心15min,在光谱评估之前用甲酰胺稀释到1/100。为了评估伊文思蓝浓度,在620nm波长下测定视网膜提取物和血浆样品的吸光度,并与标准曲线进行比较。brb计算公式如下:结果以microliters plasma
×
gram retina dry wt-1
hour-1
表示。
[0227]
evans blue(μg)/retina dry weight(g).
[0228]
‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑
[0229]
evans blue concentration(μg)/plasma(μl)
×
circulation time(hour)
[0230]
(十八)统计分析
[0231]
全部数据均以均数
±
均数标准误差(sem)表示。组间的对比采用student’s t test,而三组及以上组间比较使用单因素方差分析。以p值《0.05定义统计学差异。采用graphpad prism v9.0软件(graphpad software,inc.,la jolla,ca,usa)统计分析。
[0232]
除上述实施例外,本发明还可以有其他实施方式。凡采用等同替换或等效变换形成的技术方案,均落在本发明要求的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。