深海链霉菌基因工程突变株生产怡莱霉素e的高产培养基及其规模化发酵工艺
技术领域
1.本发明属于生物技术领域,具体地说,是关于一种深海链霉菌基因工程突变株生产怡莱霉素e的高产培养基及其规模化发酵工艺。
背景技术:
2.深海具有复杂而独特的环境,与浅海相比,在光照,氧气浓度,压力,可用养分,盐度和温度方面变化极大,是挖掘海洋稀有放线菌资源和结构复杂多样的次生代谢产物的重要源泉。深海独特的环境促使深海生物形成了独特的生理代谢能力,这不仅保证了它们的生存,而且为其产生新颖的代谢产物提供了潜力。如今,基于其强效的抗菌、抗肿瘤、抗氧化等特性,海洋生物活性化合物在功能性食品和药物的开发中发挥着越来越重要的作用。
3.深海链霉菌s.atratus scsio zh16(genbank登录号为kt9708)可以生产一类含有三种非蛋白质氨基酸(n-取代色氨酸、2-氨基-4-己烯酸、和3-硝基酪氨酸)分环七肽家族化合物
‑‑
怡莱霉素。该菌株能够主要生产一种具有强效抗结核杆菌活性及抗三阴性乳腺癌活性的天然产物怡莱霉素e,具有广泛的开发应用前景。然而,怡莱霉素e在初始发酵工艺下的得率很低,严重制约怡莱霉素e的系统生物活性研究,成为临床前研究瓶颈。因此,通过基因编辑手段获得怡莱霉素e高产基因工程突变株,开发高产培养基,提高怡莱霉素e滴度,优化规模化发酵工艺和过程参数,实现规模化发酵势在必行。
4.培养基是微生物生存的物质基础,营养成分合适的培养基对于微生物生长及代谢至关重要。不同微生物的生长及代谢对营养物质的要求均不同,同一微生物在菌体生长和次级代谢产物生产的过程中对营养物质的需求也不同。
技术实现要素:
5.本发明针对以上瓶颈问题,首先,对发酵生产怡莱霉素e的培养基进行优化研究,以获得高产培养基配方。实验首先对于碳、氮源种类进行优化,后续通过plaekett-burman实验设计,筛选出培养基组成中对怡莱霉素e滴度有显著性影响的组分(显著影响因子),进而通过响应面优化方法对显著影响因子的添加浓度进行优化,最终得到适合怡莱霉素e的高产培养基配方。因此,本发明的第一个目的是提供一种适合深海链霉菌生产怡莱霉素e的高产培养基。
6.其次,本发明在文献报道的怡莱霉素生物合成途径的基础上,运用crispr-cas9基因编辑技术敲除了怡莱霉素生物合成基因簇中编码细胞色素p450单加氧酶的ilar后,阻断生物合成途径,提升怡莱霉素e的滴度,获得基因工程菌株深海链霉菌scsio zh16δilar。然后,采用高产培养基进行发酵生产可以显著提升怡莱霉素e滴度,并降低怡莱霉素结构种类,利于后续分离纯化。因此,本发明的第二个目的是提供一株能高效生产怡莱霉素e的基因工程菌株scsio zh16δilar。
7.再次,本发明通过噬菌体(如φc31,φbt1和tg1)附着/整合(att/int)系统,选用
φc31位点特异性整合,过表达怡莱霉素生物合成基因簇簇内正调控因子ilab。成功构建深海链霉菌scsio zh16δilar ilab::erme*菌株,采用高产培养基进行发酵,进一步提高怡莱霉素e发酵滴度。因此,本发明的第三个目的是提供一株能高效生产怡莱霉素e的基因工程菌株scsio zh16δilar ilab::erme*。
8.此外,本发明针对构建的streptomyces atratus scsio zh16δilar::ilab菌株,采用高产培养基进行发酵。根据桨叶末端线速度相似原则,并且通过调控反应器水平的ph,溶氧,残糖,残氮和转速等过程参数,实现5-l,50-l和500-l反应器上逐级规模化放大。因此本发明的第四个目的是提供一种使用上述所述的培养基和基因工程菌株实现怡莱霉素e在反应器水平规模化(0.5吨)发酵生产的工艺。
9.为实现上述目的,本发明采用如下技术方案:
10.作为本发明的第一个方面,一种利用深海链霉菌scsio zh16生产怡莱霉素e的高产培养基,包括如下重量份的组分:
11.可溶性淀粉96g-144g、黄豆粉16-24g、玉米浆1.92-2.88g、氯化钠4.8-7.2g、硝酸钠7.68-11.52g、硫酸铵5.12-7.68g、磷酸二氢钾0.192-0.288g、以去离子水溶解,并定容至1000ml,用3m氢氧化钠溶液调节ph至7.2-7.4后,加入1.53-17.67g碳酸钙。
12.优选的,所述利用深海链霉菌scsio zh16生产怡莱霉素e的高产培养基,包括如下重量份的组分:
13.可溶性淀粉120g、黄豆粉23.488g、玉米浆2.4g、氯化钠6g、硝酸钠9.6g、硫酸铵4.677g、磷酸二氢钾0.24g、以去离子水溶解,并定容至1000ml,用3m氢氧化钠溶液调节ph至7.2-7.4后,加入17.670g碳酸钙。
14.作为本发明的第二个方面,一种高效生产怡莱霉素e的基因工程菌株s.atratus scsio zh16δilar,其是基于crispr-cas9基因编辑技术,运用基因敲除质粒敲除s.atratus scsio zh16中ilar基因后获得。
15.根据本发明,所述敲除质粒为pkccas9dilar,其是通过酶切连接的方法,将用限制性内切酶spei及hindiii切割后的pkccas9do质粒和ilar基因第190位碱基区域组装有向导rna的1173bp上游片段及1109bp下游片段连接,然后转化至e.coil dh5α中获得,其中,装有向导rna的上游片段是以链霉菌s.atratus scsio zh16基因组dna为模板通过如seq id no.2所示的引物ur-f和如seq id no.3所示的引物ur-r进行pcr扩增获得长度为1114bp的片段1后,再以片段1为模板通过如seq id no.4所示的引物sgr和如seq id no.3所示的引物ur-r进行pcr扩增后获得的;下游片段是以链霉菌s.atratus scsio zh16基因组dna为模板通过如seq id no.5所示的引物dr-f与如seq id no.6所示的引物dr-r进行pcr扩增后获得的。。
16.作为本发明的第三个方面,一种高效生产怡莱霉素e的基因工程菌株s.atratus scsio zh16δilar的构建方法,包括如下步骤:
17.步骤一、通过酶切连接的方法,将用限制性内切酶spei及hindiii切割后的pkccas9do质粒和ilar基因第190位碱基区域组装有向导rna的上游片段及下游bp片段连接,然后转化至e.coil dh5α中获得pkccas9dilar重组质粒;其中,装有向导rna的上游片段是以链霉菌s.atratus scsio zh16基因组dna为模板通过如seq id no.2所示的引物ur-f和如seq id no.3所示的引物ur-r进行pcr扩增获得长度为1114bp的片段1后,再以片段1为
模板通过如seq id no.4所示的引物sgr和如seq id no.3所示的引物ur-r进行pcr扩增后获得的;下游片段是以链霉菌s.atratus scsio zh16基因组dna为模板通过如seq id no.5所示的引物dr-f与如seq id no.6所示的引物dr-r进行pcr扩增后获得的;
18.步骤二、然后通过接合转移的方法,将pkccas9dilar重组质粒导入e.coil s17-1感受态细胞中,然后将含有正确pkccas9dilar重组质粒的e.coil s17-1与s.atratus scsio zh16菌株接合而成。
19.作为本发明的第四个方面,一种高效生产怡莱霉素e的基因工程菌株scsio zh16δilar ilab::erme*,其是在s.atratus scsio zh16δilar基础上通过噬菌体φc31位点整合系统过表达ilab基因获得。
20.作为本发明的第五个方面,一种高效生产怡莱霉素e的基因工程菌株scsio zh16δilar ilab::erme*的构建方法,包括如下步骤:
21.步骤一、通过酶切连接的方法,将用限制性内切酶ndei及ecori切割后的pib139质粒和外源ilab基因连接转化至e.coil dh5α中获得pib139-ilab重组质粒;
22.步骤二、通过接合转移的方法,将pib139-ilab重组质粒导入e.coil s17-1感受态细胞中构建获得含有pib139-ilab重组质粒的e.coil s17-1;
23.步骤三、将含有pib139-ilab重组质粒的e.coil s17-1与s.atratus scsio zh16δilar菌株接合而成。
24.作为本发明的第六个方面,上述所述的高效生产怡莱霉素e的基因工程菌株scsio zh16δilar ilab::erme*在反应器水平上规模化发酵生产怡莱霉素e中的应用。
25.作为本发明的第七个方面,一种使用上述所述的高产培养基发酵生产怡莱霉素e的发酵方法,其是将深海链霉菌种子液接种于上述所述的高产培养基中进行发酵,获得怡莱霉素e。
26.根据本发明,所述深海链霉菌为深海链霉菌scsio zh16δilar ilab::erme*或深海链霉菌s.atratus scsio zh16δilar。
27.根据本发明,所述发酵条件为:通气量1.0vvm,罐压0.03mpa,温度26℃。
28.作为本发明的第八个方面,一种在反应器水平上发酵生产怡莱霉素e的规模化发酵工艺,包括如下步骤:
29.步骤一、将-80℃冷冻保存的深海链霉菌scsio zh16δilar ilab::erme*的孢子液解冻,在固体培养基中划线传代并生长7-14天,培养至产孢子量丰富状态,从固体培养基上挖取大小约0.5cm2的含有大量孢子和菌的琼脂块,接种至种子培养基(摇瓶)中并发酵培养72h。
30.步骤二、取所述新鲜种子液,按10%(v/v)的接种量接入生物反应器中,所用的培养基为上述所述的高产培养基,以26℃培养8-9天,转速与溶氧联动,维持溶氧不低于20%,获得发酵液;
31.步骤三、取所述发酵液进行高速(10000rpm)离心、浸提(甲醇)、纯化,获得怡莱霉素e;
32.步骤四、菌体生长由菌体干重或湿重来表征。取10ml混合均匀的发酵液,真空抽滤,用100ml去离子水分三次清洗,清洗后在55℃烘干24h,然后转移至干燥器中冷却并称重。
33.根据本发明,生物反应器为5-l,50-l或500-l的生物反应器。
34.根据本发明,所述固体平板培养基每升包含:可溶性淀粉4g、麦芽提取物10g、酵母提取粉4g、纯燕麦片5-10g、琼脂粉20g,以去离子水溶解后蒸煮20分钟,分装后于121℃灭菌20min,铺平板前添加终浓度为25mg/l的阿普拉霉素。
35.根据本发明,所述种子培养基每升包含:葡萄糖20g、蛋白胨2g、酵母提取粉2g、黄豆粉5g、七水硫酸镁0.5g、磷酸二氢钾0.5g、氯化钠4g、碳酸钙2g,以去离子水溶解。
36.本发明的有益效果:
37.1、本发明的培养基成分包括可溶性淀粉、黄豆粉、玉米浆、氯化钠、硝酸钠、硫酸铵、磷酸二氢钾和碳酸钙,原料易得,价格低廉,有利于推广应用;
38.2、制备本发明的培养基只需将上述原料以去离子水溶解,方法简单,难度低,无需专门技术培训及特殊仪器设备;
39.3、采用本发明的培养基及本发明构建的scsio zh16δilar ilab::erme*进行发酵培养,在该培养基中该菌株生长周期短,产素开始早,菌体密度高,次级代谢途径通量高,使用该培养基发酵培养深海链霉菌基因工程菌株scsio zh16δilar ilab::erme*生产怡莱霉素e,可提高目标产物怡莱霉素e的滴度,文献报道中怡莱霉素e液体发酵的原始水平仅为13.51mg/l,而本发明中怡莱霉素e的最高滴度可达到749.21mg/l,提升至55.45倍。
附图说明
40.图1为碳源优化结果。
41.图2为氮源优化结果。
42.图3为实验组与对照组怡莱霉素e滴度及菌株生长对比。
43.图4、图5、图6分别为黄豆粉、硫酸铵、碳酸钙对怡莱霉素e滴度影响的单因子梯度实验。
44.图7、图8、图9为黄豆粉、碳酸钙和硫酸铵对怡莱霉素e滴度影响的响应面。
45.图10为基因工程菌株怡莱霉素e滴度及菌株生长对比。
46.图11为s.atratus scsio zh16δilar ilab::erme*在5-l生物反应器中的发酵时序曲线。
47.图12为s.atratus scsio zh16δilar ilab::erme*在50-l生物反应器中的发酵时序曲线。
具体实施方式
48.以下结合具体实施例,对本发明做进一步解释说明。以下实施例仅用于说明本发明而非用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或厂商提供的条件进行。
49.应当说明,本发明选用的培养基成分均为市售产品。黄豆粉购自北京鸿润宝顺科技有限公司;可溶性淀粉购自上海泰坦科技股份有限公司;玉米浆购自山东无棣波皓生物科技有限公司。
50.应当说明,在进行反应器水平发酵规模化实验时,为保证灭菌彻底,黄豆粉需充分溶解搅匀,防止残留杂菌在发酵期间复苏。
no.5所示的引物dr-f与如seq id no.6所示的引物dr-r进行pcr扩增后获得的。
75.dr-f:cacgccacgtactcctcggagctgtgggcgcgtaccccgccg,seq id no.5;
76.dr-r:gccaagcttggtggatgcggtgaggaggaagtggaggtg,seq id no.6。
77.然后通过接合转移的方法,将pkccas9dilar重组质粒导入e.coil s17-1感受态细胞中,然后将含有pkccas9dilar重组质粒的e.coil s17-1通过上游引物cr1及下游引物cr2通过pcr扩增验证,经琼脂糖凝胶电泳鉴定条带大小,正确的条带大小应为2577bp,并通过购自北京全式金生物的胶回收试剂盒(quick gel extraction kit)回收目的片段,送往苏州金唯智生物科技有限公司测定序列的准确性。最后将含有正确的pkccas9dilar重组质粒的e.coil s17-1与s.atratus scsio zh16菌株接合而成。
78.cr1:ggtgcaagcccggacgtt,seq id no.7;
79.cr2:ccattcaggctgcgcaact,seq id no.8。
80.实施例2
81.1.碳氮源优化
82.通过筛选20余种培养基,确定培养基配方为葡萄糖120g、黄豆粉20g、玉米浆2.4g、氯化钠6g、硝酸钠9.6g、硫酸铵6.4g、磷酸二氢钾0.24g、碳酸钙9.6g。将基础发酵培养基的葡萄糖分别替换为麦芽糖、蔗糖、甘露醇和可溶性淀粉,每种碳源的质量分数相同,其他组分不变,每组3个平行。将黄豆粉分别替换为酵母浸膏、酵母提取粉、蛋白胨、麦芽提取物、牛肉浸膏,每种氮源的质量分数相同,其他组分不变,每组3个平行。实验结果如图1至图2所示。图1和图2的结果显示,最优碳源为可溶性淀粉,最优氮源为黄豆粉。
83.所用深海链霉菌突变株为深海链霉菌scsio zh16δilar。
84.2.培养基的配置
85.1)原始培养基的配置(对照组)
86.准确称取葡萄糖120g、黄豆粉20g、玉米浆2.4g、氯化钠6g、硝酸钠9.6g、硫酸铵6.4g、磷酸二氢钾0.24g。以去离子水溶解,并定容至1000ml。用3m氢氧化钠溶液调节ph至7.2-7.4后,加入9.6g碳酸钙。
87.2)发酵培养基的配置(实验组)
88.准确称取可溶性淀粉120g、黄豆粉20g、玉米浆2.4g、氯化钠6g、硝酸钠9.6g、硫酸铵6.4g、磷酸二氢钾0.24g。以去离子水溶解,并定容至1000ml。用3m氢氧化钠溶液调节ph至7.2-7.4后,加入9.6g碳酸钙。
89.3.发酵操作过程
90.将-80℃冷冻保存的深海链霉菌scsio zh16δilar孢子液解冻后,在固体培养基中划线传代并生长7-14天,在新鲜固体培养基培养至产孢。从含孢子丰富的新鲜深海链霉菌scsio zh16δilar固体平板培养基上挖取大小约0.5cm2琼脂块,接种至装有25ml种子培养基的250ml摇瓶中,以28℃、200rpm摇床发酵培养60h,获得新鲜种子液,按10%(v/v)的接种量接入所述高产培养基,以28℃、200rpm摇床振荡。
91.3)怡莱霉素e滴度检测
92.取25ml发酵液,真空抽滤,实现具体和发酵液分离。将发酵液上清用乙酸乙酯依次萃取三次,每次萃取乙酸乙酯与发酵液体积比为2:1,萃取液通过旋转蒸发仪减压蒸干,温度为55℃。用5ml甲醇将固体物质完全溶解,取1.5ml甲醇提取液转移至2ml ep管中,然后,
用离心机12000rpm离心,取上清至ep管中,用0.22μm滤膜过滤至液相小瓶,保存于4℃冰箱中供hplc检测。菌饼55℃干燥2h,在研钵中研磨,用过量甲醇超声提取,通过旋转蒸发仪减压蒸干(55℃),用10ml甲醇完全溶解,将1.5ml甲醇溶解液转移至2.0ml ep管中,用离心机12000rpm离心,取上清至2.0ml ep管中,用0.22μm滤膜过滤至液相小瓶,保存于4℃冰箱供hplc检测。综上,通过高效液相色谱仪外标法测定怡莱霉素e的含量,测定所述上清液及菌体中怡莱霉素e的含量。实验结果如图3所示。
93.结果显示,采用实验组的基础培养基测得目标怡莱霉素e的滴度为211.91mg/l。
94.实施例3试验设计、数据分析及检测结果
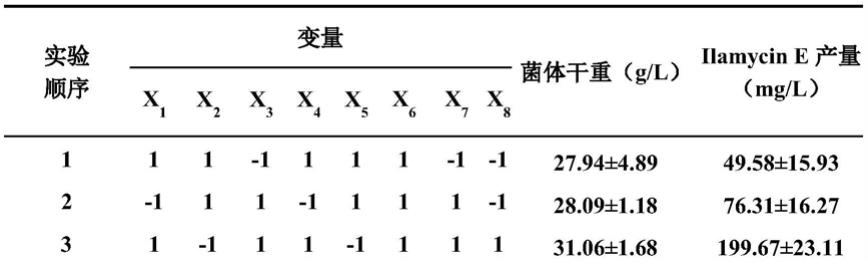
95.plackett-burman试验设计,可对多个不同因子对响应值的显著性进行分析,从而找出对发酵滴度或细胞生长最为重要的培养基组分,分别对每个因子取高( 1)和低(-1)两个水平,通过每个因子两水平之间的差异与整体差异之间的统计分析来确定各因子对相应变量的显著性。通过design expert 12数据处理软件设计,本实验选取影响因素8个,选用了n=12的pb试验设计表。各参数所代表的因素及水平见表格(参见表1和表2)。表1中x1、x2、x3、x4、x5、x6、x7、x8分别代表可溶性淀粉、黄豆粉、玉米浆、硝酸钠、硫酸铵、氯化钠、磷酸二氢钾及碳酸钙。
96.所用深海链霉菌为深海链霉菌scsio zh16δilar。
97.实验结果分析见表3。
98.表1 plackett-burman设计实验结果
[0099][0100][0101]
表2 plackett-burman设计实验培养基浓度
[0102][0103]
表3 plackett-burman设计实验结果分析
[0104][0105]
根据怡莱霉素e的滴度对八个因子进行分析,分析结果如表1和表3所示,其中当p<0.05时,表明该因子对怡莱霉素e的滴度有显著影响,故选择黄豆粉、硫酸铵、碳酸钙三种因子进行下一步的响应面优化。
[0106]
实施例4单因子梯度试验和响应面试验设计
[0107]
(1)单因子梯度试验
[0108]
基于plackett-burman实验结果,选取黄豆粉(x2)、硫酸铵(x5)、碳酸钙(x8)进行响应面分析,以考察其相互作用关系并优化其组成。为得到较为准确的响应面分析结果,首先确定接近最优区域的中心点。采用单因子梯度变化确定中心点,实验结果如图4至图6所示,黄豆粉20g/l、硫酸铵3.2g/l、碳酸钙9.6g/l最有利于怡莱霉素的生产。因此,最终选定此组合作为中心点进行下一步响应面优化实验。
[0109]
(2)响应面试验设计
[0110]
响应面实验采用三元一次中心组合设计(central composite design),每组3个平行,采用统计学软件design expert 12设计实验,各因素水平安排及怡莱霉素e滴度见表4,各因子编码水平按(-1.68,-1,0,1,1.68)分别对应黄豆粉x1(13.28g/l,16g/l,20g/l,24g/l,26.7g/l)、碳酸钙x2(1.53g/l,4.8g/l,9.6g/l,14.4g/l,17.67g/l)及硫酸铵x3(0.51g/l,1.6g/l,3.2g/l,4.8g/l,5.89g/l),其他组分不变。
[0111]
表4中心组合设计表及怡莱霉素e滴度
[0112][0113][0114]
采用design expert 12对实验结果进行数据处理,中心组合实验数据方差分析结果见表5,p《0.05表示相关显著该回归模型显著,模型失拟项不显著,决定系数r2(0.9566)和调整决定系数adj r2(0.9176)均大于90%,相对偏差cv较低,为7.67%,说明该模型能很好地对响应值进行分析和预测。对实验结果进行多元二次回归拟合,得到方程
[0115]
r=198.05 13.06a 39.37b 20.19c 4.15ab 1.05ac 6.85bc-12.05a
2-12.70b
2-17.69c2[0116]
表5中心组合设计实验结果方差分析
[0117][0118]
图7至图9为中心组合设计实验所得的响应面图(黄豆粉x1,碳酸钙x2,硫酸铵x3),由图可知各拟合曲面有最大值(响应面顶点),即各因子两两间相互作用,存在有利于怡莱霉素e生产的最优组合。因此,在上述分析的基础上,通过design expert 12软件进行优化预测(即对拟合方程求偏导)。最终优化结果为黄豆粉23.488g/l,碳酸钙17.670g/l,硫酸铵4.677g/l时,怡莱霉素e最大滴度为251.704mg/l。
[0119]
实施例5摇瓶试验
[0120]
为检验该统计学方法的有效性和可靠性,后续需要按上述预测配方进行实验验证,验证三次,每次3个平行。预测配方为:称取可溶性淀粉120g、黄豆粉23.488g、玉米浆2.4g、氯化钠6g、硝酸钠9.6g、硫酸铵4.677g、磷酸二氢钾0.24g,以去离子水溶解,并定容至1000ml。用3m氢氧化钠溶液调节ph至7.2-7.4后,加入17.670g碳酸钙。最终,实验结果255.52mg/l与预测值251.704mg/l相近,证明了回归方程的可靠性和统计学方法的有效性。
[0121]
表6优化后培养基滴度验证
[0122][0123]
在明确发酵培养基组分后,针对发酵过程的工艺参数进行优化,包括培养基初始ph值、发酵温度、种子培养时间、接种量、剪切力、溶氧水平,使得怡莱霉素e的滴度在216h达到573.05
±
11.33mg/l。
[0124]
实施例6scsio zh16δilar ilab::erme*菌株发酵验证
[0125]
本发明的scsio zh16δilar ilab::erme*菌株,其是在s.atratus scsio zh16δilar基础上通过噬菌体φc31位点整合系统过表达ilab基因获得。具体步骤如下:
[0126]
首先通过酶切连接的方法,将用限制性内切酶ndei及ecori切割后的pib139质粒和外源ilab基因连接转化至e.coil dh5α中,获得pib139-ilab重组质粒,需要说明的是,pib139质粒购自丰晖生物科技有限公司。然后通过接合转移的方法,将pib139-ilab重组质粒导入购自国家标准物质资源平台的e.coil s17-1感受态细胞,然后将含有正确pib139-ilab重组质粒的e.coil s17-1与s.atratus scsio zh16δilar菌株接合转移,操作方法同上,完成接合转移后(16-18h)覆盖抗生素混合液,于37℃倒置孵育,抗生素混合液中的阿普拉霉素能杀死不含pib139-ilab重组质粒的链霉菌,萘啶酮酸可杀死大肠杆菌,因此长出来的克隆即可能为成功转入重组质粒的链霉菌。挑取单克隆通过pcr鉴定,将正确的单克隆菌株(s.atratus scsio zh16δilarilab::erme*菌株)划线扩增并进行孢子保藏工作。
[0127]
将上述成功构建的s.atratus scsio zh16δilar菌株和s.atratus scsio zh16δilar ilab::erme*菌株分别接种于25ml发酵培养瓶中,培养基配方见实施例5的预测配方,通过hplc检测滴度差异,结果如图10所示。发酵结果显示:s.atratus scsio zh16δilar菌株的ilamycin e滴度为573.05mg/l,s.atratus scsio zh16δilar ilab::erme*菌株的ilamycin e滴度为749.21mg/l。
[0128]
实施例7反应器水平发酵优化与放大
[0129]
为了探究筛选所得培养基的大规模制备能力,首先在5-l生物反应器中进行初步的发酵放大实验,并对发酵过程中溶氧、ph、生物量、产物滴度等参数进行实时监测,记录菌体发酵的时序变化状况。培养基配方见实施例5的预测配方。
[0130]
鉴于已成功构建s.atratus scsio zh16δilar ilab::erme*菌株,为了探究反应器水平上ilab基因过表达对怡莱霉素e滴度的提升作用,故在5-l反应器上进行s.atratus scsio zh16δilar ilab::erme*菌株的发酵实验。
[0131]
该批发酵的发酵工艺为:通气量1.0vvm,罐压0.03mpa,温度26℃。5-l反应器发酵过程滴度于168h达到最高;ilamycin e最高滴度为537.96mg/l;ilamycin f对应滴度为232.33mg/l;ilamycin b1对应滴度为230.75mg/l,此时对应的生物量为47.07g/l,结果如图11所示。
[0132]
在5-l生物反应器中成功进行发酵放大后,将反应器规模进一步扩大至50-l,
ilamycin e最高滴度达到538.34mg/l,与5-l生物反应器接近,ilamycin f对应滴度为332.11mg/l;ilamycin b1对应滴度为330.78mg/l,结果如图12所示。
[0133]
综上所述,本发明的培养基成分简单,制备方法操作方便,成本低廉,不需要特殊设备,能显著提高深海链霉菌scsio zh16生产怡莱霉素e的发酵滴度。
[0134]
以上所述仅是本发明的实施方式的举例,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变型,这些改进和变型也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。