1.本发明涉及细胞转染技术领域,具体涉及一种微流控芯片及其应用。
背景技术:
2.基因编辑技术可以对细胞内遗传物质(dna、rna)进行编辑改造,遗传物质修改后的细胞能够根据不同的实验目的和需求实现不同的应用场景,比如:针对一些具有治疗应用价值的细胞(免疫细胞、干细胞等)进行基因编辑改造,能够为疾病治疗(恶性肿瘤、遗传性血液疾病等)提供一种新的细胞治疗方案。对于如何快速灵活以及安全有效地实现靶细胞分子递送﹑基因编辑和改造,如何维持分子递送之后靶细胞的状态和正常功能,迫切需要开发新的高通量﹑高效率﹑低毒性的细胞分子递送方法。细胞的快速机械拉伸变形可以导致短暂的细胞膜破裂,溶液中的物质从而能够穿过细胞膜进入到细胞中,利用这个原理实现物质高效细胞内递送的同时还可以取得相对较高的细胞存活率和活力。这种方法的优点之一是对于递送的物质形式和靶细胞类型没有特殊要求,因而该细胞递送方法的应用范围特别广泛。随着微纳加工技术的发展,微流控芯片平台具备在单细胞尺度上对细胞进行精确操作,通过设计芯片内集成的微单元操作结构和系统,可以在细胞处理、培养、功能研究、药物评价等各个方面提供新颖的技术平台和研究策略。
3.微流控芯片细胞转染平台是在细胞流动路径中集成与细胞尺寸相当的微器件结构,当细胞流过小于细胞尺寸的微结构间隙时造成细胞受力挤压,在细胞膜上形成短暂的小孔,从而让周围的外源物质进入到细胞内。这种方法的优点是可以几乎将所有不同类型的物质分子形式高效输送到几乎任何细胞类型中,同时降低对细胞的损伤、保证细胞活性。但是微结构间过小的间隙极易使细胞聚集造成芯片堵塞,大大影响了细胞处理通量。本发明基于微流控芯片平台提供了一种新型造成细胞产生物理形变的方法,即细胞与碰撞微结构发生碰撞,使细胞产生物理形变,周围外源物质通过细胞膜上产生的瞬时小孔进入到细胞内。通过这种方法,不仅进一步降低了细胞受到的损伤,同时因为没有细胞挤压结构小间隙的存在,细胞碰撞后可以快速流出芯片,从而避免了芯片堵塞,可持续对细胞进行分子递送和基因编辑改造,极大的提高了细胞处理通量,大大提高了细胞治疗的转化能力和应用范围。
4.然而,传统的相关微流控结构存在明显缺点,主要有1.细胞处理效率低,通量小。受限于芯片结构,细胞处理通道数量少,通道内部碰撞微结构少,同一时间内允许碰撞的细胞个数有限,从而影响细胞处理通量及处理效率。2.传递物质消耗大。受限于芯片结构,为了使细胞与微结构碰撞时发生足够大的形变,,对细胞流动速度要求大,因此需要的细胞液巨大,包含的传递物质消耗量大。高流速带来传递物质高消耗,处理成本上升。3.碰撞条件苛刻。受限于芯片结构,当细胞流动时,只有处于流道中线位置的细胞才有机会实现碰撞变形,当细胞浓度过高时,通道内极易塞满细胞,影响通道内细胞排列,进而影响碰撞结果因此细胞浓度及细胞流动路径受到严格限制。为保证细胞能够更多的碰撞到微结构,主通道宽度受限,太宽则细胞无法高效实现碰撞。
5.综上,传统的相关微流控结构的细胞转染方法具有低通量、高成本、实用性不强的特点,无法商业化应用。
技术实现要素:
6.基于此,有必要针对传统微流控结构的细胞转染方法低通量、高成本、实用性不强的问题,提供一种微流控芯片及其应用。
7.本发明的目的其一在于提供一种微流控芯片,包括微流控单元,所述微流控单元包括碰撞形变阵列和位于所述碰撞形变阵列两端的微流入口和微流出口;
8.所述碰撞形变阵列由多排相互间隔的凸起结构组成,所述凸起结构之间的间隙与所述微流入口和所述微流出口相通形成流道;所述凸起结构具有向所述微流入口端收缩的尖部以及向所述微流出口端延伸的延伸部,远微流入口端的凸起结构的尖部插入到相邻排的近微流入口端的两个凸起结构之间。
9.在其中一个实施例中,远微流入口端的凸起结构的尖部插入到相邻排的近微流入口端的两个凸起结构的中心线上。
10.在其中一个实施例中,所述延伸部具有向所述微流出口端收缩的尖形末端。
11.在其中一个实施例中,定义所述尖部顶点和所述尖形末端顶点连线为长轴,所述凸起结构相对于所述长轴对称,连接所述尖部和所述尖形末端部分的延伸部与所述长轴平行。
12.在其中一个实施例中,所述凸起结构的尖部与尖形末端为对称结构,所述远微流入口端的凸起结构的尖部与所述近微流入口端的凸起结构的尖形末端之间形成边缘平行的流道。
13.在其中一个实施例中,同一排的凸起结构的尖部顶点平齐。
14.在其中一个实施例中,同一排相邻的两个凸起结构之间的长轴平行。
15.在其中一个实施例中,所述微流控芯片用于处理包含细胞的悬液;
16.所述长轴的的长度为所述细胞直径的1倍以上;和/或,同一排相邻的两个凸起结构之间的距离为所述细胞直径的1~5倍。
17.在其中一个实施例中,所述凸起结构的排数为2、3、4、5或大于5排;和/或,每排的所述凸起结构的个数为2、3、4、5或大于5个。
18.在其中一个实施例中,所述微流控单元还设置有支撑分散阵列,所述支撑分散阵列由多个相互间隔的柱体组成,所述支撑分散阵列设置在所述碰撞变形阵列的近微流入口端和/或近微流出口端;优选的,所述柱体的高度大于或等于所述凸起结构的高度;更优选的,所述柱体的高度等于所述凸起结构的高度。
19.在其中一个实施例中,所述微流控芯片具有多个并联的微流控单元,且各个微流控单元的微流入口端通过一级或多级分支汇流为一个或多个进样口,各个微流控单元的微流出口端通过一级或多级分支汇流为一个或多个出样口。
20.在其中一个实施例中,在至少一个分支节点处设置有支撑分散阵列;
21.所述支撑分散阵列由多个相互间隔的柱体组成;优选的,所述柱体的高度大于或等于所述凸起结构的高度。
22.本发明的再一目的在于提供一种细胞转染的方法,使用所述的微流控芯片,并包
括以下步骤:
23.提供包含待转染细胞和待转染物质的悬液;
24.通过所述微流体入口向所述微流控芯片中通入所述悬液。
25.在其中一个实施例中,所述悬液中的细胞浓度为105个/ml~107个/ml,所述悬液的的流速为6ml/min~8ml/min
26.本发明的微流控芯片的微流控通道设置有具有尖部的凸起结构,细胞在碰撞到凸起结构的尖部之后发生物理形变,周围外源物质通过细胞膜上产生的瞬时小孔进入到细胞内,实现外源物质向细胞内的传递,例如细胞转染。本发明中,碰撞变形阵列的凸起结构为错位排布方式,远微流入口端的凸起结构的尖部插入到相邻的近微流入口端的凸起结构之间,细胞液在碰撞到前端的凸起结构之后,由宽流道分流为两个窄流道,由于流径宽度迅速变小,细胞流动线速度快速变大,提高细胞撞击到两凸起结构之间的后端凸起结构尖部上的撞击力。因此,即使在微流道入口处的流速不大,也能够由于结构变化产生变大的流速。并且,细胞液再进入前端和后端凸起结构之间的窄流道之前,经过前端凸起结构的碰撞,使得聚集在一起的细胞进行初步分散均匀,避免了团聚细胞在窄流道的拥挤,提高细胞碰撞效率。
附图说明
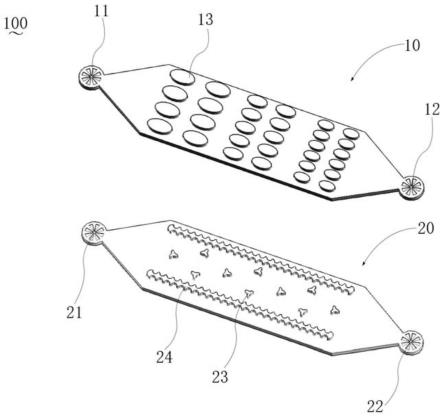
27.图1为本发明一实施例的微流控芯片的平面示意图;
28.图2为本发明一实施例的微流控芯片的三维简图;
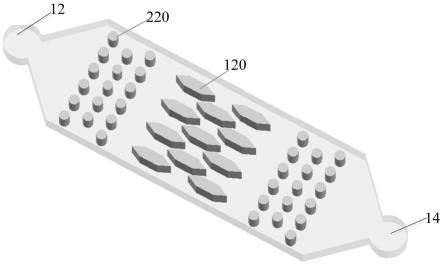
29.图3为本发明一实施例的微流控芯片的碰撞变形阵列示意图;
30.图4为本发明一实施例的微流控芯片的溶液流速与转染效率关系图;
31.图5为本发明一实施例的微流控芯片的溶液流速与细胞活性关系图;
32.图6为本发明一实施例的微流控芯片的细胞碰撞转入葡聚糖的细胞流式检测图,其中葡聚糖浓度为0.5mg/ml,相邻凸起结构间距为25μm;
33.图7为本发明一实施例的微流控芯片的不同浓度溶液转染结果的细胞流式检测图,其中流速为10ml/min;
34.图8为本发明一实施例的微流控芯片的高低浓度下溶液流速与转染效率关系图;
35.图9为本发明一实施例的微流控芯片的细胞转染的荧光图;
36.图10为本发明一实施例的微流控芯片的cas9 rnp(pd-1)转染入t细胞的t7ei assay检测图;
37.图11为本发明一实施例的微流控芯片的cas9 rnp(pd-1)转染入t细胞后的肿瘤杀伤结果图;
38.图12为本发明一实施例的微流控芯片的cas9 rnp(pd-1)转染入t细胞后的细胞凋亡实验图;
39.图13为图12对应的柱形结果图;
40.图14为本发明一实施例的微流控芯片的cas9 rnp(pd-1)转染入t细胞后的体外细胞共培养实验图;
41.图15为图14对应的柱形结果图。
具体实施方式
42.为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。附图中给出了本发明的较佳实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
43.除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
44.请参阅图1~3,本发明实施例提供一种微流控芯片,包括微流控单元10,所述微流控单元10包括微流入口12和微流出口14,所述微流控单元10包括碰撞形变阵列100,微流入口12和微流出口14分别位于所述碰撞形变阵列100的两端。所述碰撞形变阵列100由多排相互间隔的凸起结构120组成,所述凸起结构120之间的间隙与所述微流入口12和所述微流出口14相通形成流道。所述凸起结构120具有向所述微流入口端收缩的尖部121以及向所述微流出口14端延伸的延伸部122,远微流入口端的凸起结构120的尖部121插入到相邻排的近微流入口端的两个凸起结构120之间。
45.本发明的微流控芯片的微流控单元10设置有具有尖部121的凸起结构120,细胞在碰撞到凸起结构120的尖部121之后发生物理形变,周围外源物质通过细胞膜上产生的瞬时小孔进入到细胞内,实现外源物质向细胞内的传递,例如细胞转染。本发明中,碰撞形变阵列100的凸起结构120为错位排布方式,远微流入口端的碰撞形变阵列100的尖部121插入到相邻的近微流入口端的凸起结构120之间,细胞液在碰撞到前端的凸起结构120之后,由宽流道分流为两个窄流道,由于流径宽度迅速变小,细胞流动线速度快速变大,提高细胞撞击到两凸起结构120之间的后端凸起结构120尖部121上的撞击力。因此,即使在微流道入口处的流速不大,也能够由于结构变化产生变大的流速。并且,细胞液再进入前端和后端凸起结构120之间的窄流道之前,经过前端凸起结构120的碰撞,使得聚集在一起的细胞进行初步分散均匀,避免了团聚细胞在窄流道的拥挤,提高细胞碰撞效率。
46.定义液体在微流控单元10的流动趋势方向为微流控单元10的长轴,垂直于长轴的为微流控单元的短轴。“排”指的是沿短轴的方向延伸的队列,每排至少含有两个凸起结构,同排的多个凸起结构的连线形为直线。“同排”的不同凸起结构120在短轴上存在位移。“阵列”为多排凸起结构120形成的具有一定形状和规则的集体。不同排的凸起结构在长轴方向上存在位移。
47.本技术所述的“尖部”指的是有一定角度的形状,可以尖锐的夹角,如三角形夹角或者有弧度的夹角,如弧状的尖部。优选为尖锐的夹角。
48.定义所述微流控单元10中的液体流动趋势方向为所述凸起结构120的长度方向,垂直于所述长度方向为所述凸起结构120的宽度方向。
49.在一些实施方式中,所述远微流入口端的凸起结构120的尖部121插入到相邻排的近微流入口端的两个凸起结构120之间的中心线上。
50.在一些实施方式中,碰撞形变阵列100的凸起结构120横截面可以为圆形、三角形、菱形、长方形、类帆船形。
51.在一些实施方式中,所述延伸部122的近微流出口14端为平末端,例如延伸部122的近微流出口14端为直线型,例如延伸部122为长方形。在另一些实施方式中,所述延伸部122具有向所述微流出口14端收缩的尖形末端。即,凸起结构120的前端和后端均为尖形结构,形成类帆船结构。在一些实施方式中,延伸部122的后端为尖形末端,剩余部分为长方形结构。定义所述尖部121顶点和所述尖形末端顶点连线为长轴,所述凸起结构相对于所述长轴对称,连接所述尖部121和所述尖形末端部分的延伸部122与所述长轴平行。在一些实施方式中,凸起结构120的尖部121的长度为所述凸起结构120长度的0.2~0.3倍。在一些实施方式中,凸起结构120的尖形末端的长度为所述凸起结构120长度的0.2~0.3倍。
52.在一些实施方式中,所述远微流入口端的凸起结构120的尖部121与所述近微流入口端的凸起结构120的尖形末端在插入处存在交叉。在一些实施方式中,所述凸起结构120的尖部121与尖形末端为对称结构。所述远微流入口端的凸起结构120的尖部121与所述近微流入口端的凸起结构120的尖形末端之间形成边缘平行的流道。即,所述远微流入口端的凸起结构120的尖部121的边缘与近微流入口端的凸起结构120的尖形末端的边缘相互平行,从而在两者之间形成平行的流道。在一些实施方式中,该平行流道的宽度为7μm~15μm,例如12μm。
53.凸起结构120间窄通道设置太长,细胞液在此区域间流经时间增长,增大细胞偏离中心线位置的概率,最终影响碰撞概率和碰撞效果,因此选择合理的帆船结构长度至关重要。在一些实施方式中,所述凸起结构120的长度为细胞直径1倍以上,如4~6倍。在一些实施方式中,所述凸起结构120的长度为65μm~75μm,例如70μm。在一些实施方式中,凸起结构120的尖部121的长度为10μm~20μm,例如15μm。在一些实施方式中,凸起结构120的尖形末端的长度为10μm~20μm,例如15μm。
54.凸起结构120之间距离设置过大则细胞受碰撞效率降低。凸起结构120距离设置太小,则面对高浓度细胞悬液时,容易堵塞通道具体距离根据通道内。为保证细胞与三角尖端的碰撞概率,且保证碰撞区域不发生拥堵,对于凸起结构120之间的距离有一定限制,凸起结构120的长度确定对于至关重要。在一些实施方式中,所述相邻的近微流入口端的凸起结构120之间的距离为细胞直径的1~5倍。例如为2倍。在一些实施方式中,所述相邻的近微流入口端的凸起结构120之间的距离为10μm~60μm,例如为20μm、25μm、30μm、35μm、40μm、45μm、50μm、55μm。
55.在一些实施方式中,所述碰撞形变阵列100由多排凸起结构120组成,相同排的凸起结构120距离所述微流控流道的微流入口端的距离相等,同一排的凸起结构120的尖部121顶点平齐,后一排的凸起结构120插入至相邻前一排中的相邻凸起结构120之间。在一些实施方式中,所述碰撞形变阵列100中的凸起结构120的排数为2、3、4、5或大于5排。由多排错列排布的凸起结构120组成的碰撞形变阵列100,加大了细胞流经此区域所受的阻力,即使在较低的初始进口流速下,细胞也可经过多次的反复碰撞,发生多次物质传递过程,提高细胞转染效率。
56.在一些实施方式中,同一排相邻的两个凸起结构120之间的长轴平行。
57.在一些实施方式中,同一排的各凸起结构120的形状和尺寸相同。
58.在一些实施方式中,碰撞形变阵列100中的各凸起结构120的形状和尺寸相同。
59.在一些实施方式中,每排的所述凸起结构120的个数为2、3、4、5或大于5个,每排的
所述凸起结构120越多,细胞悬液在流经该横截面时形成的分流越多,流速瞬时变化越大,碰撞的撞击力越大。
60.在一些实施方式中,所述微流控单元10的还设置有支撑分散阵列200,所述支撑分散阵列200由多个相互间隔的柱体220组成,所述支撑分散阵列200设置在所述碰撞形变阵列100的近微流入口端和/或近微流出口14端。优选的,所述柱体220的高度大于或等于所述凸起结构120的高度,可以提高分散的效果。可以将高密度细胞悬液在微流入口12进行第一步稀释。前端设有支撑分散阵列200,将细胞打散,使之均匀分散在通道内,此为第二步细胞悬液稀释。碰撞形变阵列100处设有多个错位排列的凸起结构120,将整个处理通道分隔为数个小通道,此为第三步稀释。此结构极大的提高了细胞处理通量。在一些实施例中,所述柱体220的高度等于所述凸起结构120的高度,使得液体在所述微流控芯片中能够限定在各间隔的柱体或间隔的凸起结构形成微通道中进行流动,提高液体流速和细胞碰撞效率。
61.在一些实施方式中,支撑分散阵列200的柱体220横截面可以为圆形、三角形、菱形长方形等。
62.在一些实施方式中,所述微流控芯片具有多个并联的微流控单元10,例如为2、3、4、5或大于5个,且各个微流控单元10的微流入口端通过一级或多级分支汇流为一个或多个进样口,各个微流控单元10的微流出口端通过一级或多级分支汇流为一个或多个出样口。此处的分流同样具有提高流速的作用。
63.在一些实施方式中,在至少一个并联的分支节点处设置有上述支撑分散阵列200。
64.在一些实施方式中,所述微流控芯片具有多个串联的微流控单元10,例如为2、3、4、5或大于5个。优选的,在至少一个串联的分支节点处设置有上述支撑分散阵列200。
65.本发明实施例还提供了上述任一实施例的微流控芯片在细胞转染中的应用。
66.本发明实施例还提供了一种细胞转染的方法,使用上述任一实施例的的微流控芯片,并包括以下步骤:
67.提供包含待转染细胞和待转染物质的悬液;
68.通过所述微流体入口向所述微流控芯片中通入所述悬液。
69.在一些实施方式中,包含待转染细胞和待转染物质的悬液的浓度可以为0.3mg/ml以上,例如为0.5mg/ml。
70.在一些实施方式中,悬液中细胞浓度可以为105个/ml~107个/ml。
71.在一些实施方式中,悬液的流速与芯片的结构有关。在一些实施方式中,同排阵列中,相邻的凸起结构120之间的距离为23μm~27μm,悬液的流速6ml/min~8ml/min。
72.在一些实施方式中,所述待转染物质可以为核酸(dna/rna)、蛋白质、多糖等。
73.以下为具体实施例。
74.实施例1
75.通过本发明芯片,成功地将fitc标记的葡聚糖转染进入mda-mb-231细胞内部,同时考察了芯片结构、细胞悬液速度对物质转染效率及转染后细胞活性的影响,具体实验如下:
76.(一)实验内容:
77.1.配置mda-mb-231细胞悬液,细胞浓度为106个/ml,溶剂为0.6
×
pbs,加入标记fitc的葡聚糖,浓度控制为0.5mg/ml,配置好后让细胞静置20分钟后,再混匀留待使用。
78.2.单块芯片使用,取300微升上述细胞悬液。考察三种芯片结构的使用效果:碰撞形变阵列100中同排相邻凸起结构120之间距离分别为:16微米,25微米,50微米。
79.3.将步骤2中溶液用注射泵吸入注射器连接管内,每种芯片结构下,设置四种细胞悬液流速,分别为4,6,8,10ml/min,每个流速下使用一块芯片,芯片微流出口14处用软管连接,处理后的细胞悬液用离心管收集,等待下一步处理。
80.4.将收集液避光保存20分钟。取300微升上述细胞未经芯片处理的细胞悬液,加入标记fitc的葡聚糖,浓度和步骤1中保持相同作为对照组,连同实验组收集液,一起进行离心处理。
81.5.将收集液和对照组离心处理2次,离心程序设置如下:800转/分钟,3分钟。离心两次后,进行荧光图像拍摄。离心处理时,全程使用1
×
pbs。
82.6.拍摄好荧光图像后,再次向剩余处理好后的细胞悬液内加入pi染料,拍摄pi图像。
83.(二)实验结果如表1、图4-6。
84.表1:在不同芯片结构,不同细胞悬液流速下,细胞外物质转染效率及转染后细胞活性情况统计
[0085][0086][0087]
(三)实验结论
[0088]
对特定细胞而言,当相邻凸起结构120间距越小,细胞受碰撞概率越大,当细胞悬液流速越大,细胞碰撞时,所受的流体剪切力与结构本身阻力二者的合力越大,细胞形变越大,细胞膜上形成的孔洞越大,细胞外物质进入细胞内几率越大,最终提升转染率。与之相反,当相邻凸起结构120间距过大时,细胞受碰撞概率变小,当细胞悬液流速变小,则细胞碰撞时,所受的流体剪切力与结构本身阻力的两者合力越小,细胞变形几率降低且型变量小,细胞膜上形成的孔洞直径缩小,最终降低了转染效率。但是需要注意的是,相邻凸起结构120间距大小和细胞悬液流速大小同时影响细胞转染后的活性情况,间距越小,流速越大,则转染后细胞活性越低。针对mda-mb-231的细胞转染,综合考虑转染效率与转染后细胞活性两因素,应选择的芯片结构为间距为25微米的芯片,适配细胞悬液流速为8ml/min。
[0089]
实施例2
[0090]
考察本发明芯片将不同浓度标记fitc的葡聚糖转染进入mda-mb-231细胞。
[0091]
确定了芯片结构及细胞悬液流速对转染效率的影响后,利用本发明芯片,我们考察了待转染物质浓度对于转染效率的影响,具体实验如下:
[0092]
(一)实验内容
[0093]
1.配置mda-mb-231细胞浓度为106个/ml的细胞悬液,溶剂为0.6
×
pbs,分成四份,一份作为对照组,不经芯片处理,其余三份加入标记fitc的葡聚糖,浓度分别控制为0.1,0.3,0.5mg/ml,配置好后让细胞静置20分钟后,再混匀留待使用。
[0094]
2.单块芯片使用,取300微升上述细胞悬液。选取相邻凸起结构120间距为25微米的芯片进行实验。
[0095]
3.将步骤2中溶液用注射泵吸入注射器连接管内,流速设置为10ml/min,每个流速下,测试上述三组浓度下,葡聚糖经芯片内结构碰撞后进入细胞情况。
[0096]
4.将收集液避光保存20分钟。取300微升上述细胞未经芯片处理的细胞悬液,作为对照组,连同实验组收集液,一起进行离心处理。
[0097]
5.将收集液和对照组离心处理2次,离心程序设置如下:800转/分钟,3分钟。离心两次后,进行流式处理。离心处理时,全程使用1
×
pbs。
[0098]
(二)实验结果如图7。
[0099]
(三)实验结论
[0100]
细胞外物质转染效率不仅与芯片结构和细胞悬液流速有关,同时与被转染物质的浓度有关,适当提升物质浓度,可以增大转染效率。
[0101]
实施例3
[0102]
考察利用本发明芯片将cy3标记的rna转染进入mda-mb-231细胞情况。
[0103]
为证明本发明芯片的实用性及多种物质传递能力,我们考察了rna转染进入细胞情况,具体实验如下:
[0104]
(一)实验内容
[0105]
1.配置mda-mb-231细胞浓度为106个/ml的细胞悬液,溶剂为0.6
×
pbs。加入标记cy3的rna,浓度分别控制为2.2,3.3μg/ml,配置好后让细胞静置20分钟后,再混匀留待使用。
[0106]
2.单块芯片使用,取300微升上述细胞悬液。选取相邻凸起结构120间距为25微米的芯片进行实验。
[0107]
3.将步骤2中溶液用注射泵吸入注射器连接管内,流速设置为8,10ml/min,每个流速下使用一块芯片,共收集2组经芯片处理的细胞悬液。
[0108]
4.将收集液避光保存20分钟。取300微升上述细胞未经芯片处理的细胞悬液,作为对照组,连同实验组收集液,一起进行离心处理。
[0109]
5.将收集液和对照组(未经芯片处理的剩余细胞悬液)离心处理2次,离心程序设置如下:800转/分钟,3分钟。离心两次后,进行荧光图像拍摄。离心处理时,全程使用1
×
pbs。
[0110]
(二)实验结果如表2和图8。
[0111]
表2
[0112]
[0113][0114]
(三)实验结论
[0115]
本发明芯片通过适当的实验条件优化,成功将cy3标记的rna转入到肿瘤细胞内。
[0116]
实施例4
[0117]
考察本发明芯片将标记fitc的葡聚糖转染进入pbmc情况。
[0118]
实施例1~3实验证明了利用本发明芯片,可将多种物质转递到细胞内如fitc标记的葡聚糖,cy3标记的rna。本实验中我们成功地将fitc标记地葡聚糖转染进入含多种细胞的人源pbmc内,证实了本发明芯片出色的多细胞转染能力,具体方法如下:
[0119]
(一)实验内容:
[0120]
1.配置pbmc细胞系悬液,浓度为106个/ml,溶剂为1
×
pbs,加入标记fitc的葡聚糖,浓度控制为0.5mg/ml;
[0121]
2.单块芯片使用,取300微升上述细胞悬液。选取相邻凸起结构120间距为16微米的芯片进行实验。
[0122]
3.细胞悬液配好15分钟后,分别取300微升细胞悬液,通入芯片,流速分别设置为6,8,10ml/min,实验完成后,让细胞液静置10至15分钟,再取300微升步骤1中细胞悬液(含fitc)作为对照组,离心处理后使用流式细胞仪测试收集液内细胞转染情况。
[0123]
4.增加两块芯片,将细胞悬液溶剂改为0.6
×
pbs,流速分别设置为6,8ml/min,其它实验条件不变,考察pbs浓度对物质传递的影响。
[0124]
(二)实验结果如图9。
[0125]
(三)实验结论
[0126]
1.荧光波峰众多,吻合pbmc内含多种细胞,此时流速对转染效率影响甚小。
[0127]
2.pbmc处于不同pbs缓冲液内,其形状大小发生变化,处于低浓度时,细胞变大,被碰撞时,受损几率增大,因而得到的细胞最终数量变少。
[0128]
实施例5
[0129]
考察本发明芯片将cas9 rnp(pd-1)转染进入t细胞以及t细胞基因编辑和细胞功能情况。
[0130]
cas9 rnp包括蛋白和sgrna两个组分,如图10,通过本发明的微流控芯片成功递送到了人cd3 t细胞中,并通过t7ei assay检测到转染之后的t细胞被成功基因编辑,编辑效率大概21%。
[0131]
如图11,进一步对编辑过后的t细胞进行下游功能测试,发现经过芯片编辑过后的t细胞杀伤肿瘤细胞(a375人黑色素瘤细胞)的能力提高(从8.26%提升到18.7%)。
[0132]
如图12-13,通过另外一组细胞凋亡实验也进一步验证了经过芯片编辑后的t细胞对a375黑色素瘤细胞的杀伤能力提高。
[0133]
如图14-15,通过体外细胞共培养实验检测到芯片处理过的t细胞具有显著的肿瘤杀伤能力。
[0134]
综上,本发明的微流控芯片具备良好的向人t细胞递送cas9 rnp的能力,递送后的
t细胞活力几乎不受影响,而且也检测到了针对靶基因(pd-1)的基因编辑效率。芯片处理后编辑过的t细胞具有显著增强的肿瘤杀伤能力,初步验证了芯片的应用价值。
[0135]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0136]
以上所述实施例仅表达了本发明的几种实施方式,便于具体和详细地理解本发明的技术方案,但并不能因此而理解为对发明专利保护专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准,说明书可以用于解释权利要求的内容。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。