可提升2-klg产量的l-山梨糖脱氢酶突变体
技术领域
1.本发明涉及可提升2-klg产量的l-山梨糖脱氢酶突变体,属于基因工程和酶工程技术领域。
背景技术:
2.维生素c,又称抗坏血酸,是人体必须的一种维生素。广泛应用于食品、饮料、制药、化妆品和饲料领域。2-酮基-l-古龙酸(2-klg)是生产维生素c的直接前体物质。目前工业生产2-klg利用三菌两步发酵法。和一步发酵相比,三菌两步发酵法具有高能耗、高物耗、混菌发酵难以精确调控和育种困难等劣势。探索一步发酵生产2-klg成为了研究者的共同目标。由于从山梨醇生产2-klg只涉及3个酶的催化过程,分别为d-山梨醇脱氢酶、l-山梨糖脱氢酶和l-山梨酮脱氢酶。因此,目前研究者大多通过代谢工程进行一步菌的研究。主要方法是将2-klg合成途径中关键酶基因进行异源表达进行2-klg的生产,但效果并不能和工业化生产媲美。目前研究表明,l-山梨糖脱氢酶可能是2-klg生产过程中的关键限速酶。ncbi比对显示,l-山梨糖脱氢酶属于葡萄糖-甲醇-胆碱氧化还原酶家族。这类酶包含两个结构域,n末端结构域属于辅因子结合域,c末端结构域属于底物结合域。目前针对l-山梨糖脱氢酶改造的研究较少,对l-山梨糖脱氢酶进行有效的改造,有可能提升2-klg的生产强度。
技术实现要素:
3.发明人前期通过筛选获得了一株可以直接将d-山梨醇转化为2-酮基-l-古龙酸(2-klg)的氧化葡萄糖酸杆菌(gluconobacter oxydans)wsh-004,并鉴定了其中的l-山梨糖脱氢酶与l-山梨酮脱氢酶。本发明通过基因工程和酶工程的手段,制备出了可以提升2-klg产量的l-山梨糖脱氢酶突变体。
4.本发明提供了可以提升2-klg产量的l-山梨糖脱氢酶突变体,以来源于氧化葡萄糖酸杆菌(gluconobacter oxydans)wsh-004的l-山梨糖脱氢酶为出发序列,将第368位缬氨酸突变为半胱氨酸、亮氨酸、丝氨酸或苏氨酸。
5.在一种实施方式中,所述出发序列的氨基酸序列如seq id no.1所示。
6.在一种实施方式中,所述突变体是将第368位置的缬氨酸(val)变成半胱氨酸(cys),突变体命名为v368c,其氨基酸序列如seq id no.2所示。
7.在一种实施方式中,所述突变体是将第368位置的缬氨酸(val)变成亮氨酸(leu),突变体命名为v368l,其氨基酸序列如seq id no.3所示。
8.在一种实施方式中,所述突变体是将第368位置的缬氨酸(val)变成丝氨酸(ser),突变体命名为v368s,其氨基酸序列如seq id no.4所示。
9.在一种实施方式中,所述突变体是将第368位置的缬氨酸(val)变成苏氨酸(thr),突变体命名为v368t,其氨基酸序列如seq id no.5所示。
10.本发明还提供了编码所述突变体的基因。
11.在一种实施方式中,编码突变体v368c的核苷酸序列是在seq id no.6的基础上将
第368位密码子由gug替换为ugc。
12.在一种实施方式中,编码突变体v368l的核苷酸序列是在seq id no.6的基础上将第368位密码子由gug替换为cuu。
13.在一种实施方式中,编码突变体v368s的核苷酸序列是在seq id no.6的基础上将第368位密码子由gug替换为ucg。
14.在一种实施方式中,编码突变体v368t的核苷酸序列是在seq id no.6的基础上将第368位密码子由gug替换为acc。
15.本发明还提供携带所述基因的重组质粒。
16.在一种实施方式中,所述重组质粒以pmd19为出发质粒。
17.本发明还提供表达所述l-山梨糖脱氢酶突变体或携带所述基因的微生物细胞。
18.在一种实施方式中,所述微生物细胞的宿主细胞为细菌或真菌细胞。
19.在一种实施方式中,所述细菌为革兰氏阴性菌或革兰氏阳性菌。
20.在一种实施方式中,所述质粒为pmd19-t。
21.在一种实施方式中,所述微生物细胞以大肠杆菌为宿主,以pmd19-t为表达载体,表达所述l-山梨糖脱氢酶、l-山梨糖脱氢酶突变体及2-klg合成途径中关键酶基因。
22.在一种实施方式中,以cspa启动子调控l-山梨糖脱氢酶基因和l-山梨酮脱氢酶基因的表达。
23.在一种实施方式中,所述微生物细胞以大肠杆菌bl21(de3)为宿主。
24.本发明还提供了所述l-山梨糖脱氢酶突变体在生产2-酮基-l-古龙酸中的应用。
25.在一种实施方式中,所述应用是将表达所述l-山梨糖脱氢酶突变体的重组大肠杆菌在lb培养基中,于30~37℃,150~250rpm培养至od
600
=3制备种子液,转接至山梨糖培养基中于30~37℃发酵。
26.本发明还提供了可生产2-klg的重组大肠杆菌,所述重组大肠杆菌表seq id no.2~5任一所示的l-山梨糖脱氢酶及l-山梨酮脱氢酶。
27.在一种实施方式中,所述l-山梨酮脱氢酶的基因如seq id no.7所示。
28.在一种实施方式中,所述重组大肠杆菌以bl21(de3)为宿主。
29.本发明还提供了所述微生物细胞或所述重组大肠杆菌在生产维生素c或其前体物方面的应用。
30.有益效果:
31.本发明以氧化葡萄糖酸杆菌(gluconobacter oxydans)wsh-004中l-山梨糖脱氢酶为目标,通过定点突变生物技术改造l-山梨糖脱氢酶氨基酸序列,最终获得4株酶活提升的l-山梨糖脱氢酶突变体v368c、v368l、v368s和v368t,通过对表达有l-山梨糖脱氢酶突变体的菌株进行发酵,使2-klg产量达到2.5g/l、3.1g/l、2.5g/l和3.0g/l,分别为表达野生型l-山梨糖脱氢酶菌株的1.1、1.4、1.1和1.3倍。
附图说明
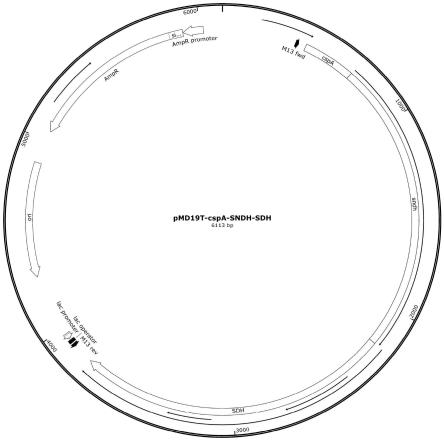
32.图1为定点突变改造的l-山梨糖脱氢酶表达载体(pmd19-cspa-sndh-sdh)构建图。
33.图2为本发明一种实施方式中质粒pmd19-cspa-sndh-v368l的示意图。
34.图3为高效液相色谱检测不同菌株发酵产2-klg图。
35.图4为不同菌株产2-klg的比较图。
具体实施方式
36.1、培养基及试剂:
37.lb培养基:蛋白胨10g/l,酵母粉5g/l,氯化钠10g/l。配制固体培养基还需加入18g/l琼脂粉。
38.山梨醇培养基:酵母粉10g/l,山梨醇50g/l。加入18g/l琼脂粉,以配制山梨醇固体培养基。
39.山梨糖培养基:山梨糖10g/l,蛋白胨10g/l,酵母粉5g/l,氯化钠10g/l。
40.2、l-山梨糖脱氢酶的基因克隆:
41.将gluconobacter oxydans wsh-004(cctcc m 2019481,菌株公开于论文《high-throughput screening of a 2-keto-l-gulonic acid-producing gluconobacter oxydans strain based on related dehydrogenases》)接种于山梨醇培养基培养。收集菌体,利用ezup柱式细菌基因组dna抽提试剂盒(购自生工生物工程(上海)股份有限公司)提取基因组,利用pcr扩增l-山梨糖脱氢酶,扩增引物包含连接质粒时所需要的同源臂序列。pcr均使用2
×
phanta max master mix(购自南京诺唯赞公司)。pcr产物回收使用sanprep柱式dna胶回收试剂盒(购自生工生物工程(上海)股份有限公司)。
42.3、l-山梨糖脱氢酶质粒构建与基因的表达:
43.1)利用pcr扩增载体,使载体线性化,并使之带有可以与扩增后的l-山梨糖脱氢酶基因互补的同源臂序列。
44.2)利用infusion-cloning试剂盒(购自南京诺唯赞公司)将线性化载体和l-山梨糖脱氢酶进行无缝连接,构建完整的质粒。
45.3)将构建好的质粒转入目标感受态,并涂布至含有相应抗生素的平板上,挑选阳性克隆子进行测序。
46.4、对表达有l-山梨糖脱氢酶及其突变体质粒的菌株及进行发酵:
47.1)将正确单菌落接种于lb培养基中,过夜培养,制备种子液。
48.2)将种子液接种以5%接种量接种与山梨糖培养基中,发酵培养72小时后,对发酵液进行收集。
49.3)将收集的发酵液12000
×
g离心3分钟,收集上清用于检测2-klg产量。
50.5、利用高效液相色谱检测发酵液中2-klg的产量:使用高效液相色谱进行测定。高效液相色谱检测条件:色谱柱:aminex hpx-87h柱(300mm
×
7.8mm;bio-rad,hercules,ca);柱温:40℃;流动相:5mm h2so4;流速:0.5ml/min,使用视差检测器检测。
51.l-山梨糖脱氢酶及其突变体的酶活测定采用可控温、可实时监测吸光度的分光光度计,用光程1.0cm的比色皿,反应体系如下:底物25mm,吩嗪硫酸甲酯(pms)2.5mm,2,6-二氯靛酚钠(dcip)0.5mm,酶终浓度0.04g/l,缓冲液为ph7.0的50mm的tris-hcl。单位酶活(u)定义为在37℃和ph 7.0条件下,1min内还原1μmol dcip所需的酶量。
52.实施例1:野生型l-山梨糖脱氢酶基因克隆、质粒的构建及表达
53.(1)l-山梨糖脱氢酶表达载体的构建:
54.从保藏的甘油管中,将gluconobacter oxydans wsh-004接种于山梨醇培养基中,
37℃,220rpm培养48h,4000rpm离心,并收集菌体,提取gluconobacter oxydans wsh-004基因组,利用引物对f1/r1进行l-山梨糖脱氢酶基因(基因序列见seq id no.6)的扩增。并回收pcr产物。引物对f1/r1如下:
55.f1:ggatttcgtaatgacgagcggttttgattacatcgttgtcg;
56.r1:atctgcagaattctcaggcgttcccctgaatgaaatccgc。
57.使用引物对f2/r2对生产2-klg关键基因l-山梨酮脱氢酶(基因序列见seq id no.7)进行扩增,并回收pcr产物。引物对f2/r2如下:
58.f2:aaaggtaatacactatgaatgttgtctcaaagactgtatctttaccg;
59.r2:aaaccgctcgtcattacgaaatccagtgcgaacgtttg。
60.使用引物对f3/r3对携带cspa启动子(seq id no.8)的pmd19质粒(pmd19-cspa)进行线性化扩增,(质粒公开于《high throughput screening platform for a fad-dependent l-sorbose dehydrogenase》)中,并回收pcr产物。引物对f3/r3如下:
61.f3:ggggaacgcctgagaattctgcagatatccatcacactgg;
62.r3:caacattcatagtgtattacctttaataattaagtgtgcctttcgg。
63.pcr反应体系均为:25μl 2
×
phanta max master mix,1μl正向引物(10μmol
·
l-1
),1μl反向引物(10μmol
·
l-1
),1μl模板dna,加入蒸馏水至50μl。l-山梨糖脱氢酶与l-山梨酮脱氢酶pcr扩增程序设定为:首先,95℃预变性3min;然后进入30个循环:95℃变性30s,56℃退火30s,72℃延伸1min;最后72℃延伸5min,4℃保温。pmd19-cspa线性化载体pcr扩增程序设定为:首先,95℃预变性3min;然后进入25个循环:95℃变性30s,56℃退火30s,72℃延伸3min;最后72℃延伸10min,4℃保温。
64.将40ng l-山梨糖脱氢酶和40ng l-山梨酮脱氢酶的pcr产物和20ng pmd19-cspa线性化载体混合,利用infusion-cloning试剂盒进行连接,构建质粒pmd19-cspa-sndh-sdh(图1)。将10μl pmd19-cspa-sndh-sdh连接产物转入大肠杆菌bl21(de3)感受态中,冰浴30min,42℃热激90s,冰浴5min,加入1ml lb培养基,37℃,220rpm培养45min,3000rpm离心3min,去掉上清,将菌体重悬于100μl lb培养基中,涂布在含有100mg/l氨苄青霉素的lb平板中,培养过夜。次日,挑选阳性克隆进行测序,验证质粒的是否正确。将测序正确的菌株命名为wt。
65.(2)l-山梨糖脱氢酶的表达:
66.将测序正确的克隆子转移至含有100mg/l氨苄青霉素的10ml lb中培养,培养过夜至od
600
=3,制备种子液。将培养好的种子液以5%转接至含有100mg/l氨苄青霉素的25ml山梨糖培养基中(接种后的od
600
=0.153),于30℃下培养72小时,收集发酵液进行产物产量检测。
67.实施例2:l-山梨糖脱氢酶突变体的制备
68.(1)单突变的制备
69.根据实施例1构建的pmd19-cspa-sndh-sdh质粒序列,分别设计并合成引入v368c、v368l、v368s和v368t突变的引物,对l-山梨糖脱氢酶的基因序列进行定点突变,并分别测序确认l-山梨糖脱氢酶突变体的编码基因是否正确;将携带突变体基因的载体导入大肠杆菌bl21(de3)中进行发酵。
70.定点突变体编码基因的pcr扩增:利用pcr技术,以携带编码野生型l-山梨糖脱氢
酶基因的表达载体pmd19-cspa-sndh-sdh质粒为模板,扩增携带突变体基因的重组质粒。
71.引入v368c突变的定点突变引物对f4/r4为:
72.f4:gaggctgggtgcacgtccgttcccaagggagcg(下划线标注突变碱基)
73.r4:tgggaacggacgtgcacccagcctcagccccagc(下划线标注突变碱基)
74.引入v368l突变的定点突变引物对f5/r5为:
75.f5:gaggctgggcttacgtccgttcccaagggagcg(下划线标注突变碱基)
76.r5:tgggaacggacgtaagcccagcctcagccccagc(下划线标注突变碱基)
77.引入v368s突变的定点突变引物对f6/r6为:
78.f6:gaggctgggtcgacgtccgttcccaagggagcg(下划线标注突变碱基)
79.r6:tgggaacggacgtcgacccagcctcagccccagc(下划线标注突变碱基)
80.引入v368t突变的定点突变引物对为f7/r7:
81.f7:gaggctgggaccacgtccgttcccaagggagcg(下划线标注突变碱基)
82.r7:tgggaacggacgtggtcccagcctcagccccagc(下划线标注突变碱基)
83.pcr体系同实施例1。突变体质粒pcr扩增程序设定为:首先,95℃预变性3min;然后进入25个循环:95℃变性30s,56℃退火30s,72℃延伸5min;最后72℃延伸10min,4℃保温。
84.(2)突变体的表达与验证
85.按照实施例1步骤(1)的方法进行l-山梨糖脱氢酶突变体的验证。将表达含有v368c突变体的菌株命名为m1,将表达含有v368l突变体(质粒图谱见图2)的菌株命名为m2,将表达含有v368s突变体的菌株命名为m3,将表达含有v368t突变体的菌株命名为m4。将重组菌株在tb培养基中,于37℃条件下培养至od
600
=0.8,降温至20℃,并添加终浓度为0.5mm/l的iptg(异丙基硫代半乳糖苷)继续培养20小时,离心收集菌体,破碎细胞后在37℃和ph 7.0条件下对酶进行纯化,在体外对纯化后的野生型酶和突变体进行酶活测试,结果显示,wt的比酶活为5400
±
400u/mg,v368c、v368l、v368s和v368t的比酶活分别是wt的1.43、1.83、1.39、1.74倍。
86.实施例3:l-山梨糖脱氢酶及其突变体发酵用于生产2-klg
87.将实施例1和实施例2中构建的菌株(wt、m1、m2、m3和m4)分别接种至添加有100mg/l氨苄青霉素的lb中,于37℃,220rpm条件下培养过夜,至od
600
=3,制备种子液。次日,将种子液以5%接种于山梨糖培养基中于30℃发酵72小时,收集发酵液,于12000
×
g离心3分钟,弃掉沉淀,收集上清,用于检测2-klg产量。
88.使用高效液相色谱的视差检测器进行发酵液中2-klg产量测定。使用5mm h2so4作为流动相,流速为0.5ml/min,aminex hpx-87h色谱柱(300mm
×
7.8mm;bio-rad,hercules,ca),柱温为40℃进行检测,检测结果见图3。结果显示,m1、m2、m3和m4发酵72小时后2-klg的产量达2.5g/l、3.1g/l、2.5g/l和3.0g/l(od
600
达3.733、3.796、3.859和3.805),2-klg产量分别为wt(2-klg产量为2.2g/l,od
600
达3.799)的1.1、1.4、1.1和1.3倍(图4)。
89.对比例1:
90.按照实施例2相同策略设计引物,分别构建突变体v368d、v368e、v368f、v368g、v368k、v368m、v368p、v368q、v368r、v368w、和v368y。按照实施例2的方法制备和表达突变体,并按照实施例3的方法进行发酵、检测。结果如表1所示。
91.表1不同单突变体的2-klg产量
92.突变体2-klg(g/l)v368d2.06297v368e0.85952v368f2.067019v368g0.677537v368k2.006918v368m2.175933v368p1.803614v368q0.700799v368r1.535407v368w2.18846v368y1.811543
93.虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。