一种表达免疫调节因子的car载体及其应用
1.本技术要求2021年4月30提交的中国发明专利申请【cn2021104819799】、名称为“一种表达免疫调节因子的car载体及其应用”的优先权,该优先权发明专利申请以引用方式全文并入。
技术领域
2.本发明属于生物工程领域,具体涉及一种car表达载体及其应用。
背景技术:
3.嵌合抗原受体修饰的t细胞(car-t)在急性b细胞淋巴瘤等血液肿瘤治疗中展现出良好的临床效果,然而对实体肿瘤却疗效不佳。car结构包含三部分,分别是用于识别肿瘤抗原的胞外区、锚定car结构的跨膜区和胞内t细胞激活信号传导结构域。car-t杀伤肿瘤细胞依赖胞外的单链可变区与相应的肿瘤相关抗原特异性结合,然后通过胞内信号结构域启动下游信号传导,引起car-t细胞的活化、增殖并通过释放ifn-γ等细胞因子发挥细胞毒性。但是,在面对实体瘤时,目前传统的car-t疗效不佳。
4.第一代car结构的胞内区仅有cd3ξ的3个itam或者fcrγ的2个itam序列,只能提供t细胞活化的第一信号,分泌il-2的能力有限,增殖能力弱,在临床试验中未取得令人满意的效果。第二代car结构在胞内信号序列后增加了串联的共刺激分子信号域,增殖和杀伤能力相比第一代提高。第三代car结构的胞内信号包含更多的共刺激域,然而研究表明其杀伤活性并没有显著提升,而且副作用更大。第四代car是在二代car的基础上引入新的功能元件增强car-t细胞的抗肿瘤活性,例如分泌细胞因子il-12、il-15或il-18的car-t,能增强car-t细胞的增殖和存活能力,从而提高car-t细胞的抗肿瘤活性。
5.目前认为,car-t对实体肿瘤疗效不佳的原因有以下几个方面。与实体肿瘤内部复杂的环境和异常的血管构成有关,通常,肿瘤血管渗漏或发育不良,常导致杀伤性t细胞无法进入其中。而car-t细胞缺乏参与渗透到肿瘤组织的趋化因子的表达,以及实体瘤外部的肿瘤相关成纤维细胞(caf)和血管组成的致密的物理屏障,导致了car-t细胞迁移及浸润至肿瘤组织内部的能力降低。此外,肿瘤微环境(tme)还能帮助肿瘤细胞逃避免疫监视,抑制机体抗肿瘤反应,也能抑制car-t细胞的浸润、增殖与存活,也是导致car-t细胞对实体肿瘤无效的主要原因之一。因此,设计构建一种能有效浸润至肿瘤组织并能逆转肿瘤免疫抑制微环境的car-t细胞,才有可能克服现有免疫治疗反应率偏低的问题,具备更有效的抗肿瘤作用。
6.综上所述,本发明在改良的二代car基础上构建了一种新型的高表达gm-csf的car-t细胞(car-gm-t),可以缓解现有技术中存在的缺陷与不足。
技术实现要素:
7.有鉴于此,本发明的目的在于提供一种新型car表达载体及其应用。
8.为实现上述目的,本发明的技术方案为:
9.一种car表达载体,其包括编码嵌合抗原受体(car)的核酸及编码免疫调节因子的核酸,其特征在于,所述编码免疫调节因子的核酸为编码粒细胞-巨噬细胞集落刺激因子(gm-csf)的核酸全长或片段。
10.进一步,所述编码嵌合抗原受体的核酸与所述编码粒细胞-巨噬细胞集落刺激因子的核酸通过编码自切割肽p2a的序列连接。
11.进一步,所述编码嵌合抗原受体的核酸还包括靶向特异性肿瘤抗原的胞外区、锚定car结构的跨膜区和含有多个串联的共刺激分子的胞内信号传导结构域,包括cd3ζ链、4-1bb和gm-csf。
12.进一步,所述靶向特异性肿瘤抗原的靶点包括her2、b7-h3、claudin18.2、cd70、muc16、fshr、fr或meso中的一种或多种。在上述靶点中,已证实,her2主要是针对her2阳性的乳腺癌、肺癌、胃癌、卵巢癌和肉瘤;meso针对胰腺癌、卵巢癌和肺癌;b7-h3和cd70针对黑色素瘤,其次muc16、fshr和fr均针对卵巢癌。clasdin18.2针对胃癌、食道胃结合部癌和胰腺癌。
13.包含上述car表达载体的慢病毒,所述慢病毒包括pwpxld、pspax2和/或pmd2.g。
14.一种car-t细胞,表达上述嵌合抗原受体。
15.上述car-t细胞在制备抗实体肿瘤药物中的应用。
16.作为一种优选,所述实体肿瘤主要包括乳腺癌、卵巢癌和肺癌,但并不局限于此。
17.进一步,所述car-t细胞可以增强gm-csf、ifn-γ和il-2分泌。
18.进一步,所述car-t细胞通过表达粒细胞-巨噬细胞集落刺激因子直接增强car-t细胞杀伤活性。
19.进一步,所述car-t细胞可以增强浸润能力,更多的car-t细胞可以浸润到实体瘤内部发挥特异性杀伤肿瘤细胞的效力。
20.进一步,所述car-t细胞浸润到实体瘤内部以后表达粒细胞-巨噬细胞集落刺激因子发挥免疫调理功能调控肿瘤微环境。
21.进一步,所述car-t细胞通过表达粒细胞-巨噬细胞集落刺激因子来激活和招募树突状细胞到所述实体瘤内部,以激活内源性t细胞的抗原特异性肿瘤免疫反应。
22.进一步,所述car-t细胞能抑制肿瘤细胞的淋巴结转移。
23.本发明所述的“趋化”是指本发明制备的car-t,即car-gm-t,促使dc细胞向肿瘤细胞做定向移动。
24.dc细胞是体内的专职抗原呈递细胞,表达mhc ii和共刺激分子,可以对肿瘤抗原进行摄取、捕获、加工,然后迁移到淋巴结内激活机体内源性t细胞抗肿瘤免疫反应。
25.有益效果
26.为进一步提高car-t对实体肿瘤的治疗效果,本发明在二代car-t的基础上构建了高表达gm-csf的car-t细胞(car-gm-t)。gm-csf是一种重要的免疫调节剂,gm-csf可以通过激活和招募树突状细胞(dc),激活t细胞免疫反应,同时还可以激活其他免疫细胞,如粒细胞、巨噬细胞和nk细胞,在肿瘤免疫应答的调节中发挥重要作用。实验证实,本发明构建的car-gm-t细胞可以高表达gm-csf,不仅可以直接增强car-t细胞自身的杀伤活性和增殖能力,同时还使这种car-t细胞比普通car-t细胞具备更强的免疫调节功能。特别地,本发明制备得到的car-gm-t细胞在以下几个方面具有突出的效果:
27.1)car-gm-t对卵巢癌细胞的杀伤力显著高于常规car-t细胞;
28.2)car-gm-t对卵巢癌细胞的杀伤力显著高于meso-car-t细胞;
29.3)car-gm-t能显著抑制黑色素瘤的生长,并明显延长了实验动物的生存时间;
30.4)car-gm-t细胞在接触肿瘤细胞前后分泌的免疫调节因子gm-csf、ifn-γ和il-2显著高于常规car-t细胞;
31.5)car-gm-t比常规car-t细胞具有更强的浸润实体瘤组织的能力,并且浸润至实体瘤内部以后发挥出更强的抗肿瘤效果;
32.5)car-gm-t抑制了肿瘤细胞向胞淋巴结的转移。
33.综上,本发明能重塑和逆转肿瘤微环境,直接或辅助增强t细胞活性,为实体瘤的治疗提供一种新策略。
附图说明
34.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作一简单地介绍。
35.图1为car-hgm表达载体的构建图;
36.图2为car-gm-t细胞分泌的gm-csf显著高于常规car-t细胞;
37.图3为car-gm-t细胞的杀伤活性图;
38.图4为meso-car-gm-t细胞对sk-ov3-meso的杀伤效率显著高于meso-car-t,且杀伤效率随着效靶比的提高而增强;
39.图5为car-gm-t杀伤肿瘤细胞时分泌的gm-csf,显著高于常规car-t细胞;
40.图6为在效靶比为5:1时car-gm-t细胞分泌的ifn-γ是常规car-t细胞的4.5倍,在不同效靶比下car-gm-t细胞接触肿瘤细胞时分泌的ifn-γ均显著高于常规car-t细胞;
41.图7为在不同效靶比下car-gm-t细胞在杀伤肿瘤细胞时分泌的il-2也均显著增强;
42.图8为car-gm-t细胞治疗小鼠腹腔瘤的效果图;
43.图9为常规car-t对b16f10-her2黑色素皮下移植瘤的生长无明显抑制作用,也不能延长小鼠生存期,而接受car-gm-t治疗能显著抑制小鼠黑色素皮下移植瘤的生长;
44.图10为接受car-gm-t治疗能明显延长小鼠的生存时间;
45.图11为小鼠接受治疗后第24天,分离小鼠肿瘤和淋巴结并将其制备为单细胞悬液,流式检测小鼠肿瘤和淋巴结内car-t细胞的比例图;
46.图12为进一步检测car-gm-t在人肿瘤组织中的浸润情况,在nsg小鼠腹腔瘤治疗后的28天,取腹腔内残余肿瘤进行免疫荧光染色,检测cd3
t细胞浸润情况图;
47.图13为常规car-t治疗组cd45.2
的免疫细胞仅占5%,car-gm-t治疗组小鼠肿瘤内免疫细胞浸润情况明显优于常规car-t治疗组;
48.图14为car-gm-t治疗组小鼠肿瘤中cd3
的t淋巴细胞占cd45.2
细胞的11%,而常规car-t治疗组cd3
的t淋巴细胞仅占5%,表明高表达gm-csf显著提高了car-t细胞治疗后小鼠肿瘤中内源性cd3
t细胞的比例;
49.图15为car-gm-t治疗组肿瘤内cd11c
mhcii
hi
的dc细胞所占比例显著高于常规car-t治疗组;
50.图16为引流淋巴结he染色结果,显示car-gm-t能抑制肿瘤细胞的淋巴结转移。
具体实施方式
51.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述。显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
52.需要说明的是,在本文中,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者装置不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者装置所固有的要素。在没有更多限制的情况下,由语句“包括一个
……”
限定的要素,并不排除在包括该要素的过程、方法、物品或者装置中还存在另外的相同要素。
53.如在本说明书中使用的,术语“大约”,典型地表示为所述值的 /-5%,更典型的是所述值的 /-4%,更典型的是所述值的 /-3%,更典型的是所述值的 /-2%,甚至更典型的是所述值的 /-1%,甚至更典型的是所述值的 /-0.5%。
54.在本说明书中,某些实施方式可能以一种处于某个范围的格式公开。应该理解,这种“处于某个范围”的描述仅仅是为了方便和简洁,且不应该被解释为对所公开范围的僵化限制。因此,范围的描述应该被认为是已经具体地公开了所有可能的子范围以及在此范围内的独立数字值。例如,范围的描述应该被看作已经具体地公开了子范围如从1到3,从1到4,从1到5,从2到4,从2到6,从3到6等,以及此范围内的单独数字,例如1,2,3,4,5和6。无论该范围的广度如何,均适用以上规则。
55.实施例一
56.1.细胞培养
57.表达荧光素酶(luciferase)的人卵巢癌细胞系(sk-ov3-luc),过表达her2蛋白的小鼠黑色素瘤细胞系(b16f10-her2)由四川大学生物治疗国家重点实验室保存,使用含10%小牛血清的dmem培养基,37℃,5%co2,常氧条件下进行培养。
58.2.car-gm-t制备
59.2.1car-hgm表达载体的构建及验证
60.用自剪切多肽p2a连接her2-car和hgm-csf,构建高表达hgm-csf的her2-car-hgm表达载体(pwpxld-her2-car-hgm-csf)(图1)。以pwpxld-her2-car-egfp载体为模板扩增her2-car-p2a片段,以pwpxld-hgm-csf载体为模板扩增hgm-csf片段。使用限制性内切酶bamhi和ecori酶切载体pwpxld使其线性化,利用同源重组的方法将片段her2-car和hgm-csf连接至线性化载体pwpxld中。
61.2.2慢病毒的包装
62.使用慢病毒三质粒系统进行慢病毒包装,质粒转导方式为磷酸钙-dna共沉淀法,辅助质粒为pspax2和pmd2.g,包装细胞为293t细胞。转染后48小时和72小时分别收取病毒上清,使用0.22μm的一次性针头式滤器(pes膜)过滤病毒上清,使用超高速离心机浓缩过滤的病毒液后分装冻存于-80℃冰箱。
63.2.3人t细胞的激活与感染
64.1)使用ficoll分离外周血单核淋巴细胞。
65.2)根据外周血单核淋巴细胞数量,取出适量human t-expander cd3/cd28 dynabeads磁珠,使用5ml dpbs清洗磁珠1次,使用t细胞完全培养基重悬。将外周血单核淋巴细胞悬液与清洗后的磁珠混匀,放入t75培养中,37℃,5%co2培养。
66.3)根据病毒滴度计算病毒用量,使用retronectin增强感染效率,感染72小时后使用流式细胞术检测各组car(包括常规car)表达情况。
67.2.4鼠t细胞的激活与感染
68.1)从小鼠淋巴结中分离淋巴结细胞。
69..2)根据外周血单核淋巴细胞数量,取出适量human t-expander cd3/cd28 dynabeads磁珠,使用5ml dpbs清洗磁珠1次,使用t细胞完全培养基重悬。将外周血单核淋巴细胞悬液与清洗后的磁珠混匀,放入t75培养中,37℃,5%co2培养。
70.3)根据病毒滴度计算病毒用量,使用polybrene增强感染效率,感染72小时后使用流式细胞术检测各组car(包括常规car)表达情况。
71.2.5培养car-gm-t细胞。
72.3.细胞因子检测
73.细胞因子分泌情况均通过elisa的方法测定,包括il-2、ifnγ、gm-csf,样品来源于car-t细胞培养上清或car-t细胞杀伤肿瘤细胞后的上清。
74.4.杀伤活性检测
75.体外杀伤活性使用乳酸脱氢酶(ldh)细胞毒性检测试剂盒进行测定,具体步骤叙述如下:
76.1)取生长状态良好的肿瘤细胞,胰酶消化并计数,使用x-vivo培养基重悬肿瘤细胞至终浓度5*10^5个/ml。
77.2)取状态良好的car-t细胞,轻轻吹散并计数,1000rpm离心3分钟,弃上清,使用x-vivo培养基重悬car-t细胞至终浓度10^6个/ml。
78.3)设置不同效靶比1:1、2.5:1、5:1、10:1,肿瘤细胞均按照每孔10^4个计算,每个效靶比均设置以下6个分组mock t(效应细胞自发组)、mock t tumor(试验组)、car-t、car-t tumor、car-gm-csf-t、car-gm-csf-t tumor,每组3个副孔,同时设置空白培养基组、肿瘤细胞自发组,肿瘤细胞最大释放组,每孔的终体积均为200μl。
79.4)待杀伤进行24小时后,显微镜观察各组细胞杀伤情况。
80.5)取出96孔细胞培养板,肿瘤细胞最大释放组每孔加入20μllysis solution(10x),37℃孵育45分钟。
81.6)孵育结束后,水平离心机室温250g离心4分钟。
82.7)每孔别取50μl上清至新的96孔板中用于后续ldh释放检测。
83.8)每孔加入50μl ldh检测反应液,室温避光孵育30分钟。
84.9)孵育完成后,每孔加入50μl终止液。
85.10)终止反应后,1小时内使用酶标仪读取490nm的吸光度。
86.11)
87.5.卵巢癌腹腔瘤模型的治疗
88.5.1动物饲养
89.1)该部分动物实验所用动物为百奥赛图公司自主研发的b-小鼠(nod-prkdcscid il2rgtm1/bcgen),该小鼠以nod-scid为遗传背景、il2rg基因被敲除,t、b、nk细胞缺失,适合人源细胞或组织移植。
90.2)购置5-6周龄雌性b-ndg小鼠,体重18-20g,购回后饲养于四川大学生物治疗国重家重点实验室spf级动物房。
91.3)b-ndg小鼠饲养期间,室温维持在25℃,实验期间自由取食、饮水。
92.5.2卵巢癌腹腔模型构建
93.1)取生长状态良好的sk-ov3-luc细胞,胰酶消化并计数,1200rpm离心3分钟,pbs洗涤2次,用无血清的dmem培养基重悬细胞至终浓度为10^6个/ml。
94.2)抓取小鼠,按照每只小鼠200μl细胞悬液进行腹腔注射接种sk-ov3-luc细胞。
95.3)定期监测小鼠体重。
96.5.3卵巢癌腹腔模型的治疗
97.1)接种后第6天,对每只小鼠进行活体呈像,根据呈像的荧光值将小鼠分为3组,每组6只,分别为pbs组、her2-car组、her2-car-gm-csf组。
98.2)接种后第7天,收集生长状态良好、car阳性率大于50%的her2-car-t和her2-car-gm-csf-t细胞,使用x-vivo培养基重悬至终浓度10^7个/ml。
99.3)分别吸取100μl上述car-t细胞悬液,经腹腔注射治疗每只小鼠。
100.5.4卵巢癌腹腔模型的治疗效果检测
101.1)小鼠治疗后,每周进行1次活体呈像检测。
102.2)定期监测小鼠精神状态,活动情况,毛发光泽度,进食情况,观察是否有不良反应发生,检测小鼠体重。
103.3)待监测结束后,麻醉小鼠后脱颈处死,取腹腔中残余的肿瘤进行免疫荧光染色,检测car-t细胞浸润情况。
104.6.黑色素皮下移植瘤模型的治疗
105.6.1动物饲养
106.(1)该部分动物实验所用的c57bl/6cd45.1来自本实验室保种,c57bl/6cd45.2购自四川大学实验动物中心。
107.(2)购置5-6周龄雌性c57bl/6cd45.2小鼠,体重18-20g,购回后饲养于四川大学spf级动物房。
108.(3)小鼠饲养期间,室温维持在25℃,实验期间自由取食、饮水。
109.6.2过表达her2蛋白的黑色素皮下移植瘤模型构建
110.(1)模型构建采用c57bl/6cd45.2小鼠,小鼠购回后适应环境1周即可用于皮下移植瘤模型构建。
111.(2)取生长状态良好的b16f10-her2细胞,胰酶消化并计数,1200rpm离心3分钟,pbs洗涤2次,用无血清的dmem培养基重悬细胞至终浓度为5*10^6个/ml。
112.(3)取100μl上述肿瘤细胞悬液于小鼠右侧胁肋部皮下注射,注意不要刺破肌肉层。
113.6.3皮下移植瘤模型的治疗
114.(1)取200mg环磷酰胺(cyclophosphamide,cpa)溶解于5ml生理盐水中,0.22μm的一次性针头式滤器过滤后,分装冻存于-20℃冰箱备用。
115.(2)接种后第10天,按照200mg/kg的剂量给每只荷瘤小鼠注射环磷酰胺,腹腔给药。
116.(3)接种后第12天,测量移植瘤体积,根据肿瘤体积将小鼠分为3组,每组15只,分别为pbs组、her2-car组、her2-car-gm-csf组。
117.(4)接种后第13天,收集生长状态良好,c57bl/6cd45.1小鼠淋巴细胞制备的her2-car-t和her2-car-gm-csf-t细胞,使用1640培养基重悬至终浓度3*10^7个/ml。
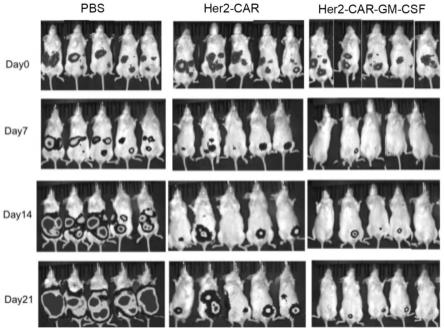
118.(5)分别吸取100μl上述car-t细胞悬液,经尾静脉注射治疗每只小鼠。
119.黑色素瘤皮下模型的治疗效果检测
120.(1)小鼠每3天进行1次瘤子体积监测,使用游标卡尺测量并记录肿瘤纵横直径大小,测量黑色素皮下移植瘤的最长和最短直径,按照以下公式计算肿瘤体积:肿瘤体积=0.52
×
长
×
宽
×
宽,绘制肿瘤生长曲线。
121.(2)定期监测小鼠精神状态,活动情况,毛发光泽度,进食情况,观察是否有不良反应发生,检测小鼠体重,绘制生存期曲线。
122.(3)治疗后21天,部分小鼠麻醉后脱颈处死,分离小鼠脾脏、引流淋巴结、淋巴结、肿瘤,分别进行he染色和流式分析。
123.实施例二
124.实验结果
125.1.car-gm-t细胞分泌gm-csf的能力增强
126.常规car-t细胞与mock t细胞激活前分泌的gm-csf无明显差异,而car-gm-t细胞分泌的gm-csf显著高于常规car-t细胞(p《0.001),符合预期(图2)。
127.2.car-gm-t细胞的杀伤活性增强
128.her2-car-gm-t细胞对天然表达her2蛋白的sk-ov3细胞杀伤效率显著高于her2-car-t,且杀伤效率随效靶比的升高而增强。her2-car-gm-t细胞在效靶比为1:1时对sk-ov3的杀伤效率能达到30%,显著高于her2-car-t组(p<0.001),而her2-car-t组在效靶比为2.5:1时杀伤效率才能达到30%,her2-car-gm-t细胞在效靶比为5:1时杀伤效率接近80%,显著高于her2-car-t细胞60%的杀伤效率(图3)。
129.检测以meso为靶点的car-gm-t(meso-car-gm-t)细胞对靶点阳性的肿瘤细胞的杀伤效率。
130.meso car-t是宾夕法尼亚大学和诺华开发的以meso为靶点的car-t疗法,而且meso car-t还是诺华针对实体瘤推出的第一个car-t产品,适应证包括卵巢癌、肺癌以及胰腺癌。
131.结果表明,meso-car-gm-t细胞对sk-ov3-meso的杀伤效率显著高于meso-car-t,且杀伤效率也会随着效靶比的提高而增强(图4)。以上结果表明高表达car-gm-csf不仅针对靶点meso有效,并且能提高不同靶点的car-t细胞的体外杀伤效率。
132.3.car-gm-t细胞杀伤肿瘤细胞时分泌gm-csf、ifn-γ、il-2的能力增强
133.检测car-t细胞杀伤肿瘤细胞时上清中细胞因子的分泌,当car-gm-t接触肿瘤细胞激活后分泌gm-csf的能力提升,与常规car-t细胞相比分泌gm-csf的能力更强(p《0.01)
(图5)。在效靶比为5:1时car-gm-t细胞分泌的ifn-γ是car-t细胞的4.5倍,在不同效靶比下car-gm-t细胞接触肿瘤细胞时分泌的ifn-γ均显著高于car-t细胞(p<0.001)(图6)。此外在不同效靶比下car-gm-t细胞在杀伤肿瘤细胞时分泌的il-2也均显著增强(图7)。
134.4.car-gm-t细胞治疗卵巢癌的效果增强
135.常规car-t细胞能控制住小鼠肿瘤生长,治疗后的第14天,有1只小鼠肿瘤消除,但在21天该小鼠肿瘤复发。而接受car-gm-t细胞治疗后的第14天,有2只小鼠肿瘤完全消退,1只小鼠肿瘤基本消退,21天时2只消退的小鼠肿瘤仍未复发,剩余3只小鼠肿瘤负荷非常小,明显小于常规car-t细胞治疗的小鼠肿瘤(图8)。以上结果表明car-gm-t比常规car-t细胞具有更显著的体内抗肿瘤效果。
136.5.car-gm-t细胞在免疫健全鼠内抗高表达her2的黑色素皮下移植瘤的效果增强
137.car-t对b16f10-her2黑色素皮下移植瘤的生长无明显抑制作用,也不能延长小鼠生存期,而接受car-gm-t治疗能显著抑制小鼠黑色素皮下移植瘤的生长(p《0.05)(图9),明显延长小鼠的生存时间(图10)。
138.6.car-gm-t细胞浸润至实体瘤内部的能力增强
139.小鼠接受治疗后第24天,分离小鼠肿瘤和淋巴结并将其制备为单细胞悬液,流式检测小鼠肿瘤和淋巴结内car-t细胞的比例。结果显示,常规car-t治疗组肿瘤内car
t细胞占cd3
t细胞的1.2%,而car-gm-t治疗组肿瘤内car
t细胞占cd3
t细胞的2.4%,是常规car-t治疗组的2倍,差异具有统计学意义(p<0.01)。分析肿瘤引流淋巴结内car
t细胞比例也得到相似的结果:常规car-t治疗组肿瘤引流淋巴结内car
t细胞仅占cd3
t细胞的0.04%,而car-gm-t治疗组小鼠肿瘤引流淋巴结内car
t细胞占cd3
t细胞的0.4%,是常规car-t治疗组的10倍,显著高于常规car-t治疗组(p<0.01)(图11)。
140.进一步检测car-gm-t在人肿瘤组织中的浸润情况,在nsg小鼠腹腔瘤治疗后的28天,取腹腔内残余肿瘤进行免疫荧光染色,检测人源cd3
t细胞浸润情况。结果显示,接受car-t治疗的小鼠肿瘤内人源cd3
t细胞仅在肿瘤边缘聚集,肿瘤内t细胞很少;而接受car-gm-t细胞治疗的小鼠肿瘤内,人源cd3
t细胞能浸润至肿瘤内部,肿瘤内部组织中的cd3
t细胞明显增多,说明高表达gm-csf除增强car-t细胞的杀伤活性以外还能增强car-t细胞渗透进入肿瘤内部的能力(图12)。以上结果表明,高表达gm-csf能增强car-t细胞的浸润能力,car-gm-t细胞能更有效的进入肿瘤和淋巴结内发挥功能。
141.7.car-gm-t细胞激活内源性t细胞
142.在小鼠肿瘤细胞中分析cd45.2
的内源性免疫细胞,分析内源性免疫细胞的浸润情况。结果显示,car-gm-t治疗组小鼠肿瘤中cd45.2
的免疫细胞占8%,而car-t治疗组cd45.2
的免疫细胞仅占5%,car-gm-t治疗组小鼠肿瘤内免疫细胞浸润情况明显优于car-t治疗组(p<0.05)(图13)。
143.在cd45.2
的内源性免疫细胞中分析cd3
的t淋巴细胞。结果显示,car-gm-t治疗组小鼠肿瘤中cd3
的t淋巴细胞占cd45.2
细胞的11%,而car-t治疗组cd3
的t淋巴细胞仅占5%,表明高表达gm-csf显著提高了car-t细胞治疗后小鼠肿瘤中内源性cd3
t细胞的比例(p<0.01)(图14)。
144.8.car-gm-t细胞趋化dc细胞至肿瘤
145.在cd45.2
的细胞中分析cd11b
cd11c
的细胞,再从这部分细胞中分析cd11c
mhcii
hi
的dc细胞。结果显示,car-gm-t治疗组肿瘤内cd11c
mhcii
hi
的dc细胞所占比例显著高于常规car-t治疗组(p<0.01)(图15),表明car-gm-t治疗组肿瘤内成熟的dc细胞更多。
146.9.car-gm-t细胞抑制肿瘤细胞淋巴结转移
147.b16f10为小鼠黑素瘤高转移细胞株,本发明团队使用car-t细胞和car-gm-t细胞治疗b16f10-her2黑色素皮下移植瘤模型。引流淋巴结he染色结果显示,pbs治疗组有大量黑色素斑块,car-t治疗组可见少量黑色素斑块,car-gm-t治疗组可见大量淋巴细胞,无黑色素斑块。以上结果表明,未接受治疗的小鼠淋巴结内有大量肿瘤细胞转移,car-t治疗能抑制部分肿瘤细胞转移,高表达gm-csf能增强car-t细胞抑制肿瘤细胞淋巴结转移的能力(图16)。
148.上面结合附图对本发明的实施例进行了描述,但是本发明并不局限于上述的具体实施方式,上述的具体实施方式仅仅是示意性的,而不是限制性的,本领域的普通技术人员在本发明的启示下,在不脱离本发明宗旨和权利要求所保护的范围情况下,还可做出很多形式,这些均属于本发明的保护之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。