1.本发明涉及细胞实验及中药实验研究领域,具体涉及用于细胞培养实验用的中药动物含药血清的制备及鉴定方法。
背景技术:
2.随着现代医学的发展,体外细胞培养技术已成为生命科学研究、疾病机制研究、药物筛选及生物制品生产等多个领域中基础且不可替代的技术手段。体外细胞培养是指从体内组织取出细胞模拟体内生存环境,在无菌、适当温度及酸碱度和一定营养条件下,使其生长繁殖并维持结构和功能的一种培养技术。体外细胞的培养方式可分为贴壁培养、悬浮培养、固定化培养、微载体培养、空中纤维培养、微囊法培养等。目前体外细胞培养技术在肿瘤学、药理学及病毒学等研究领域的基础实验研究应用非常广泛,神经细胞、肝细胞、肠系膜细胞、平滑肌细胞、心肌细胞、内皮细胞及肿瘤细胞等机体生理病理细胞目前均可实现体外培养。
3.在药理学研究方面,外源化合物(西药)被直接用于靶细胞的培养,特别是大量候选药物的初始筛选阶段,优势在于可以根据筛选目的设计实验条件,短期内获得大量包括药物反应和细胞毒性在内的实验数据这一优势使标准化的细胞培养流程及自动化设备的使用成为可能,相关研究效率也大大提高。特别是在生物制品方面,细胞培养已经成为其最主要的生产方式之一,例如目前流感疫苗等多种疫苗由细胞发酵生产,大大缩短了相关研究的进程,加快了临床推广的速度。因此体外细胞培养技术在现代医学研究领域发挥了至关重要的作用。
4.目前西药用于体外细胞培养的技术已经非常成熟,但中草药用于体外细胞培养的方法仍存在较大的争议。中药成分非常复杂,除有效成分外,还含有非有效成分和杂质,甚至毒性成分等,很难确定一种或几种成分代表中药和中药复方的实际作用;如果将中药粗制品直接加入离体生物反应体系,可能导出假阳性或假阴性或相反的结果,对于可能存在较大研究前景的项目被早早扼杀。因此,寻找一种既符合实验要求、又能代表中药特别是复方疗效的细胞培养方法是亟待解决的问题。
5.对于中药及复方的体外细胞实验,干预方法从最初的粗提取物直接添加,逐步发展为以血清药理学为理论基础的含药血清添加,广泛应用于各领域实验研究中。中药粗提后直接添加是提取中药的有效成分,直接添加到细胞体系中的一种方法。传统的粗提取方法经过煎煮、过滤、浓缩等步骤,杂质仍较多、理化性质复杂,直接添加至细胞体系中不良影响较多,现代药剂提取技术可将粗提取物进行纯化,包括杂质的去除、酸碱度与渗透压的调整等,超细粉末等新技术的应用,使提取物的质量进一步提高,理化干扰因素进一步减少,可以将提取物纯化至含药量90%以上,可制成颗粒、粉剂或冻干粉,以便于保存,临近实验时再溶解、离心、过滤,添加至细胞培养基中使用。即便如此,中药提取物直接进行体外细胞实验还是存在诸多弊端,其主要包括:
①
粗提物既含有有效成分,也含有大量无效成分,能非特异性地影响和干扰体外实验结果,导致实验结果的假阳性;
②
粗提物的杂质、电解质、
渗透压、酸碱度等对体外实验都可能造成一定影响;
③
传统的口服给药,中药复方进入人体后经过消化道消化吸收、肝肠循环等,可代谢产生新的物质,提取物的体外药理实验结果难以反映机体真实血药浓度下的药理作用及变化规律。
6.为解决这一问题,1984日本田代真一首先提出了血清药理学方法于中药的细胞培养实验,我国1995年起开始开展中药血清药理学研究,它是指给动物灌胃或人服用一定量的中药单方或复方制剂,一定时间采血,分离血清,用含中药成分血清进行体外试验的一种实验方法。该方法利用了生物体对中药复杂成分的选择作用,能够反映中药在体内的消化吸收、代谢及最后产生药理效应的真实结果,血清中既含有药物原形成分,也有代谢成分以及体内产生的应激成分,能够反映药物在体内的真实状态。含药血清的制备常选用同种属或代谢行为类似的动物,如大鼠、家兔等,客观地模拟了药物与机体相互作用过程,较接近药物体内环境中产生的药理效应的真实过程。尽管此方法已在我国实验领域运用20余年,但诸多学者对此方法仍存在较大的争议,争议的焦点主要是如何保证用于细胞培养的血清中含有中药?这也是导致中药体外细胞培养的结果认可度不高的关键原因之所在。故此,发明者针对这一关键问题展开研究,形成这一套方法,解决了血清中是否含有中药?什么时间采集的血清中含药浓度最佳?的问题,为相关中医药体外细胞培养研究提供了有效的方法。
技术实现要素:
7.针对上述存在的问题,本发明旨在提供一种由中药组方制备的含药血清及制备方法,其动物血清中可检测出中药成分,并明确提出血清药物浓度最高时间窗及鉴定方法,为其他中药动物含药血清制备及进一步实验研究提供基础。
8.为了实现上述目的,本发明所采用的技术方案如下:
9.本发明存在技术要点:
10.动物的选择
11.中药含药血清的制备首先要解决供体动物的选择,因为不同物种之间可能存在年龄、生物特性及免疫学差异等,不同种属、年龄的动物对药物吸收也不同,势必造成血药成分、浓度的差异。因此中药药理学实验中,制备含药血清的动物应尽量选择同种属或代谢行为与人类生物特性相似的动物进行实验,从而缩小或避免种属间血清在理化、生物等特性上的差异,减少因种属差异而造成的免疫反应,提高实验结果的可靠性。以大鼠为例,我们选取大鼠作为含药血清制备动物,研究发现大鼠与人在药物代谢方面相似性较高,此外大鼠灌胃相对小鼠方便操作,且大鼠取血较小鼠方便,血液量充足。大鼠平均寿命为2.5-3年。一般可认为:0-2个月为幼年期,2-20个月为成年期,20个月以后为老年期。含药血清制备我们选择成年大鼠,即8-12周龄大鼠。
12.药物选择
13.中药成分主要包括以下类别:
14.生物碱类(苦参碱、小檗碱、麻黄碱、党参碱、麦角新碱等);
15.糖类(d-木糖、d-半乳糖、d-葡糖糖醛酸、低聚糖、多糖类等);
16.苷类(皂苷类、黄酮苷、杏仁苷、芍药苷等);
17.苷元类(皂苷元、黄酮苷元、香豆素苷元、酚苷元等);
18.挥发油类(当归挥发油、桃仁精油、红花油、赤芍挥发油等);
19.生物碱类(川芎嗪、地龙解热碱、黄嘌呤类等);
20.蛋白质类(地龙等);
21.氨基酸类;
22.其它类。
23.因中药成分复杂,动物血清中化学成分含量也较为复杂,以目前现有的实验技术很难确定血清中所有中药成分,为更大程度检测到动物血清中含药,我们一般选择5种以上中药的主要成分进行检测,该主要成分应该为不同的类型(如皂苷、酚类、醚类、挥发油等),当使用高效液相色谱在血清中检测到选择的至少一种中药成分时,我们视为动物血清中含有中药成分。
24.给药方案
25.给药方案主要指给药剂量、给药次数、给药时间、给药途径等,其中给药剂量尤为重要。一般认为中药含药血清中血药浓度可以直接反映当时机体的血药浓度,含药血清的浓度(体积比)愈高则药效愈强。而该血药浓度主要与给药剂量存在一定量效关系。对于动物的给药剂量选择,目前比较公认的给药剂量公式为给药剂量等于临床用药量
×
动物等效剂量系数(按体表面积)。给药时间及给药次数与成人服用中药等同,即2次 /日灌胃,早晚分次灌胃。中药给药途径多数为水溶液或混悬液灌胃。
26.采血时机
27.采血时机主要指药物与动物作用的最佳时间点,采血时机掌握的是否准确直接影响着血清中含药的多少。因为不同药物达到血药浓度的高峰期不同,所以其最佳采血时间也不一样。一般来说,中药含药血清理想的采血时间应落在血药浓度的高峰期。以大鼠为例,根据现有文献研究分析发现大鼠代谢比人快,中药灌胃后43.7%的药物浓度到达峰值的时间小于1h;47.9%的药物浓度达到峰值的时间为1-2h;仅8.3%的药物达到峰值的时间大于2h,因此我们选择给药后0.5h、1h、1.5h、2h腹主动脉取外周血进行鉴定,获取峰值最高的血清最佳采集时间点;根据药代动力学研究发现大鼠通过药物灌胃后药物浓度稳定需要48h左右,因此我们采血时机选择持续灌胃48h后,于第3天末次灌胃后进行血清采集。中药含药血清制备及鉴定流程
28.1.实验药物制备
29.取组方中药,全方无特殊煎煮方法药物(特殊煎煮方法药物遵《中国药典》规范执行)加冷水至没过药材3-5cm浸泡于专用中药电砂壶中1h,武火烧至沸腾后转为文火慢煎煮2h,倒出中药药液约为160ml,得到生药浓度2g/ml的中药汤剂,晾凉后置于密封瓶中,4℃冰箱储存备用。
30.2.动物分组及给药
31.使用随机数字表法对30只大鼠进行编号并分成5组,每组6只,分组如下:
32.a组(0.5h含药血清)、b组(1h含药血清)、c组(1.5h含药血清)、d组(2h含药血清)及e组(空白血清)。
33.适应性饲养1周后,a-d组按上述给药量换算公式换算给药,2 次/日灌胃,e组给予等量生理盐水灌胃,持续灌胃3天。
34.3.取血及血清制备
35.所有实验动物持续灌胃3天,于第3天末次灌胃前禁食12h,给药后0.5h、1h、1.5h、
2h腹主动脉取外周血。动脉血收集后4℃冰箱中静置30min,设置离心机转速4000rpm/min,时间15min,收集上层血清于无菌ep管中并标记,后于56℃水浴锅灭活30分钟,经0.22μm微孔滤膜过滤除菌,封装好,保存于-20℃冰箱中储存备用。
36.4.血清的含药鉴定及药物浓度高峰时间测定
37.使用血清药理学技术,用大鼠的外周血提取含药血清,使用高效液相色谱法(hplc)建立质控标准,选择中药组方中5种不同中药成分的含量为基线进行检测,对血清样本进行预处理,处理各组血清以及空白组和标准品组,配制好后置于进样器中,将标记好的进样器放入编码后的机器孔位,设置30min为每样之间的间隔,启动仪器等待绘制hplc色谱图。当在血清中检测到选择的任意一种中药成分时,我们视动物血清中含有中药成分。
38.5.含药血清采集时间的确定及血清采集
39.经高效液相色谱检测绘图,当我们检测到血清中含有5种中药成分中任意一种以上时,我们认定动物血清中含有中药;当检测到中医成分时,我们对血清中含有的中药成分及波峰出现对应的采血时间进行记录,以该时间做为后期同种属动物含药血清制备时药物载体动物取血的时间。具体实施案例一培元化瘀方含药血清制备及鉴定
40.1.实验材料
41.1.1实验动物
42.spf级雄性wistar实验室用大白鼠30只,已经饲养8周以上,体重(250-300g之间,动物许可证号:scxk2019-0014)一次性购自西安科奥生物有限公司,喂养在陕西中医药大学综合楼实验中心动物房中,室温维持在25℃左右,室内湿度维持在35%上下,12h照明,可自由饮食进水。
42.1.2实验主要仪器
43.微量移液器
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
proline,苏州,biohit
44.超纯水系统
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
nw10lvf,中国香港,heal force
45.超速冷冻离心机
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
h-2050r,长沙,湖南湘仪
46.酶标仪elx-800
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
美国,biotek
47.电热恒温培养箱
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
dh36001b,天津,天津泰斯特
48.超低温冰箱
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
8930086v,美国,thermo
49.超净工作台
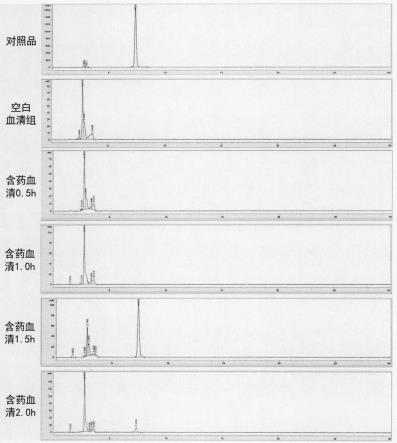
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
sw-cj-1fd,苏州,苏州净化
50.自增压液氮罐yds-30
ꢀꢀꢀꢀꢀ
中国,四川亚西
51.高效液相色谱仪 1260
ꢀꢀꢀ
美国,安捷伦
52.1.3实验药物
53.培元化瘀方制备:黄芪30g,当归15g,川芎20g,生地20g,熟地12g,西洋参10g,太子参6g,桃仁6g,红花12g,地龙6g,黄精9g,鹿角胶8g,甘草6g。由陕西中医药大学附属医院中药房提供。全方中药剂量符合《中国药典》规范。按人与大鼠动物体重对照表进行药物剂量折算配制,实验大鼠灌胃剂量=临床用药量
×
大鼠/成人等效剂量系数(按体表面积),得出浓度为2g/ml,每天每只灌胃1.8ml。中药浓缩液煎煮方法:取配方中药2付,全方除鹿角胶外加冷水至没过药材3-5cm浸泡于专用中药电砂壶中1h,武火烧至沸腾后转为文火慢煎煮2h,
倒出中药药液约为 160ml,另取鹿角胶烊化后加入,得到生药浓度2g/ml的中药汤剂,晾凉后置于密封瓶中,4℃冰箱储存备用。
54.2.实验方法
55.2.1培元化瘀方含药血清的制备
56.使用随机数字表法对30只大鼠进行编号并分成5组,每组6只,具体分组情况如下:
57.a组(0.5h含药血清):27、25、22、23、26、17号大鼠。
58.b组(1h含药血清):15、12、18、10、29、13号大鼠。
59.c组(1.5h含药血清):28、24、4、7、6、9号大鼠。
60.d组(2h含药血清):2、11、8、20、30、1号大鼠。
61.e组(空白血清):3、16、19、21、14、5号大鼠。
62.适应性饲养1周后,a-d组按12g/kg/d,2次/日灌胃,e组给予等量生理盐水灌胃,持续灌胃3天,于第3天末次灌胃前禁食12h,给药后0.5h、1h、1.5h、2h腹主动脉取外周血。动脉血收集后4℃冰箱中静置30min,设置离心机转速4000rpm/min,时间15min,收集上层血清于无菌ep管中并标记,后于56℃水浴锅灭活30分钟,经0.22μm微孔滤膜过滤除菌,封装好,保存于-20℃冰箱中储存备用。空白血清组制备方法与上文相同。灌胃过程中因天气炎热以及灌胃操作不当等问题死亡8只,死亡率为26.67%,其中血清组6只:23号、17号、13号、4号、11号、20 号;空白血清组2只:5号、16号。最终采集含药血清组18只,空白血清组4只,平均每只获得动脉血为3.8
±
0.2ml,离心后为1.4
±
0.2ml。
62.2.2培元化瘀方含药血清的鉴定
63.使用血清药理学技术,用大鼠的外周血提取含药血清,使用高效液相色谱法(hplc)建立质控标准,以培元化瘀方中川芎嗪、黄芪皂苷、红花黄酮苷元、当归挥发油及地龙蛋白质等5种不同成分对照品的含量为基线,对比不同时间段的血清,筛选出最适的含药的血清组。上样色谱条件如下:
64.色谱柱:c18柱,4.6mmx250mm,5μm,美国惠普公司
65.检测波长:245nm
66.流动相:甲醇∶水(33∶67)
67.进样量:10μl
68.流速:1ml/min;
69.温度:26℃。
70.样品:a-d组含药血清(0.5h、1h、1.5h、2h)、e组空白血清、 f组川芎嗪、黄芪皂苷、红花黄酮苷元、当归挥发油及地龙蛋白质标准品
71.检测波长:245nm
72.对血清样本进行预处理,处理各组血清以及空白组和标准品组,配制好后置于进样器中,将标记好的进样器放入编码后的机器孔位,设置 30min为每样之间的间隔,启动仪器等待绘制hplc色谱图。
73.3.含药血清鉴定结果
74.在上述色谱条件下进行测定,得血清色谱图(图1,包括对照品、空白血清组、0.5h含药血清组、1h含药血清组、1.5h含药血清组、2h含药血清组高效液相色谱图)。
75.由图可知,川芎嗪标准品组在7.331min出现波峰,与之对应的是c组1.5h在
7.339min出现波峰,其次为d组2h在7.338min处有波峰,其峰高、峰面积相对较小,证明2.1方法下制备的含药血清为有效含药血清,其中末次给药后1.5h和2h腹主动脉取血所得含药血清均有药,1.5h 最好含药浓度较高,2h次之。
75.4.结论及分析
76.本发明制备含药血清大鼠的死亡率为26.67%,成功取得22只大鼠的含药血清。采用高效液相色谱法,黄芪皂苷、红花黄酮苷元、当归挥发油及地龙蛋白质在选取时间内未检测出,检测出川芎嗪成分,对比川芎嗪标准品的峰值出现时间点,得出1.5小时取得的含药血清较佳,2小时取得的次之,证实血清中确实含药。具体实施案例二上述方法制备的培元化瘀方含药血清用于细胞实验研究案例:
77.基于mek/erk信号通路探究培元化瘀方对hmec-1细胞的作用机制
78.1.实验材料
79.1.1研究对象
80.hmec-1,人微血管内皮细胞,货号:zq0456,购自上海中桥新舟公司,内皮细胞样,单层贴壁生长,使用中乔新舟内皮细胞专用培养液,货号:zq-1304,培养于陕西中医药大学综合楼细胞房的培养箱中,恒定温度:37℃,气相:95%空气,5%co2。收到细胞为复苏后状态,对培养瓶外表进行消毒后直接置于培养箱中,24小时后便可开展后续实验。
81.1.2培元化瘀方含药血清
82.按上述实验方法制备培元化瘀方含药血清,并使用高效液相色谱进行含药成分检测,确认血清含药后,将血清置于56℃水浴锅灭活30 分钟,经0.22μm微孔滤膜过滤除菌,封装好,保存于-20℃冰箱中储存备用。
83.1.3实验主要试剂
84.内皮细胞专用培养基
ꢀꢀꢀꢀꢀ
上海中桥新舟,中国
85.pbs
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
武汉博士德,中国
86.胰蛋白酶
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
北京索莱宝,中国
87.0.9%氯化钠注射液
ꢀꢀꢀꢀꢀꢀ
费森尤斯卡比,中国
88.matrigel基质胶
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
corning,美国
89.cck-8试剂盒
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
武汉博士德,中国
90.针式滤器(有机系0.22)
ꢀꢀꢀ
天津领航,中国
91.移液器无菌吸头
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
biosharp,中国
92.2ml冻存管
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
corning,美国
93.50ml/15ml无菌离心管
ꢀꢀꢀꢀ
nest,中国
94.25cm透气盖细胞培养瓶
ꢀꢀꢀ
corning,美国
94.96孔板、6孔板、24孔板
ꢀꢀ
corning,美国
95.1.4实验主要仪器
96.水平摇床
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
wd-9405,北京,北京六一
97.微量移液器
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
proline,苏州,biohit
98.超纯水系统
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
nw10lvf,中国香港,heal force
99.超速冷冻离心机
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
h-2050r,长沙,湖南湘仪
100.酶标仪elx-800
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
美国,biotek
101.电热恒温培养箱
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
dh36001b,天津泰斯特
102.倒置显微镜
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
cx40m,宁波,宁波舜宇
103.二氧化碳培养箱
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
cb-150,德国,bind
104.超低温冰箱
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
8930086v,美国,thermo
105.超净工作台
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
sw-cj-1fd,苏州,苏州净化
106.自增压液氮罐yds-30
ꢀꢀꢀꢀꢀ
中国,四川亚西
107.高效液相色谱仪 1260美国,安捷伦
108.2.实验方法
109.2.1 cck-8细胞增殖实验
110.用cck-8试剂盒来开始高速灵敏的细胞增殖检测,此试剂对细胞无明显毒性,细胞增殖越快,其颜色显现越深。取对数期生长的hmec-1,胰酶消化离心机离心后,使用基础培养基重悬细胞,吹打均匀后,将处理好的细胞密度调整为为5
×
105个/ml的细胞悬液以每孔100μl接种于96 孔板中,将细胞分为空白血清组(5%、10%、15%);培元化瘀方含药血清组(5%、10%、15%)共6组,每组6个复孔;向各组添加对应浓度的血清,放入37℃,5%co2的环境中过夜,每孔添加10μl的cck-8溶液, 1h后于酶标仪上检测各组细胞在450nm时的吸光度(optical density,od) 值的大小。将细胞分组换为空白血清组和培元化瘀方含药血清组(20%、 25%、30%、35%、40%、45%、50%),重复上述实验3次。
111.2.2划痕愈合实验
112.迁移能力是细胞活性的主要标志之一,将hmec-1置入在已标记好的6孔板中,每孔加入5
×
105个细胞,每孔加入100ng/ml vegf,继续加入基础培养基至2ml,置于37℃,5%co2环境里过夜,观察到细胞贴壁长满后,吸掉多余的培养基,用100μl无菌枪头垂直标记横线来划痕,后用pbs清洗2遍,去除掉落的细胞,但注意不可用力过大。将细胞分成3组,空白血清组、培元化瘀方含药血清组和阴性对照组(仅加入基础培养基),每组2个复孔,按条件配制号每孔的生长环境后,拍照标记为0h,分别于12h、24h拍照记录细胞数量和形态及生长趋势变化,本实验须重复3次。
113.2.3体外血管生成评估
114.将实验分成3组,分别为空白血清组、培元化瘀方含药血清组和阴性对照组(仅加入基础培养基),每组5个复孔;在96孔板中每孔包被50μl融化好的基质胶,此操作在4℃冰盒上进行,等待1h待基质胶凝固后,每孔接种1.0
×
104个hmec-1,于4h、8h、12h、24h后显微镜下拍照观察。图像用imagej进行分析。
115.2.4统计学分析
116.细胞增殖实验结果运用统计学软件spss22.0计算其结果差异是否有统计学意义,细胞划痕愈合实验、体外血管生成实验结果图像结果采用imagej软件进行分析。
117.3.实验结果
118.3.1 hmec-1细胞培养
119.细胞形态为内皮细胞样,为梭形,贴壁生长,仅为单层。给予 8ml专业培养基培养,生长周期为4-6天,处于对数生长期时可达2-3天,传代比例为1∶2或1∶3。见图2所示。
120.3.2 cck-8细胞增殖实验
121.结果从6个复孔中去除最大和最小值,剩余4个od值取平均数做折线图可得,培元化瘀方组的细胞抑制作用较空白血清组强,平均 od值较低,其中在血清浓度为15%时的抑制作用最强,如图3所示。
122.3.3细胞划痕迁移实验
123.划痕实验可说明hmec-1在不同干预的情况下的迁移表现,可得出:培元化瘀方含药血清组的细胞迁移性较空白血清组显著降低,培元化瘀方减弱并抑制了细胞的迁移能力,划痕周边的细胞迁移至中间的距离明显变小,划痕愈合速度变慢,24h后三组原有条带间的距离均变短。(图中数据单位为像素距离)具体情况见图4。
124.3.4体外血管生成实验
125.刚开始细胞悬液中的细胞并未贴壁密度较高,每间隔1h观察1 次,从3h开始出现细胞成环现象,3-12h可见血管网大面积形成,而16-24h 血管网逐渐破裂消失。依据imagej软件计算3h、12h时血管网格数(meshindex)及平均网格尺寸(mean mesh size),实验结果表明:3h时三组管腔数量无显著差别,阴性对照组管腔面积大于空白血清组和含药血清组,空白血清组和含药血清组组间差异无统计学意义;12h时空白血清组管腔数量明显多于阴性对照组和含药血清组,组间差异有统计学意义;平均官腔面积结果为含药血清组>空白血清组>阴性对照组,组间差异有统计学意义。16h时生成血管网开始瓦解,相对于阴性对照组和空白血清组而言,含药血清组血管网瓦解过程较慢,可能是含药血清使新生血管网变的较为成熟,分解速度变慢。由此可知,含药血清组相对于空白血清组在12h表现的管腔数量少,管腔面积大,生成的血管更加成熟,培元化瘀方对血管的生成有抑制作用。详见图5。
126.结论分析
127.如图1高效液相色谱法鉴定含药血清结果示,1.5h和2h组均为含药血清,其中1.5h取得的血清在同一时间的峰值与标准品结果最为相近。
128.如图2 hmec-1细胞生长良好,形态为内皮细胞样,为梭形,贴壁生长,仅为单层。
129.如图3 hmec-1细胞的增殖实验结果提示,含培元化瘀方的血清可抑制细胞的生长。
130.如图4 hmec-1细胞划痕实验结果提示,含培元化瘀方的血清对细胞迁移起抑制作用。
131.如图5 hmec-1体外血管生成实验结果提示,含培元化瘀方的血清与空白血清相比可以抑制新生血管生成。
132.上述实验证实用本发明制备的中药含药血清确实含有中药,且制备的中药含药血清用于体外细胞实验均取得了阳性结果,再次证实本发明提供的中药含药血清制备方法真实有效,可用于体外细胞培养及相关中医药实验研究。
133.以上资料显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
附图说明
图1为川芎嗪血清色谱图;图2为hmec-1细胞核固红染色(40
×
光学显微镜下);图3为细胞增殖实验结果图;图4为划痕实验结果(40
×
光学显微镜下);图5为血管生成实验结果(40
×
光学显微镜下)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
