1.本发明涉及生物材料技术领域,尤其涉及一种脱细胞液、脱细胞基质水凝胶及其制备方法和应用。
背景技术:
2.类器官是一种三维细胞培养技术,可以在体外模拟体内器官的组织结构与基因表达。类器官为包含干细胞在内的多种细胞在体外经过自分化及自组装形成三位聚集体,其细胞种类、比例及细胞的空间结构及排列与体内器官具有较高的相似性,并可以模拟体内器官的部分功能。此外,与传统的二维细胞培养相比,类器官的基因表达与体内更为接近。因此,基于类器官的生物活性检测结果与体内更具有相关性。所以,目前类器官被广泛用于生物学研究、药物研究、医学研究、精准医学的转化应用等。
3.目前,类器官的培养主要以生物材料来源的脱细胞基质水凝胶提供的支撑与空间。脱细胞基质水凝胶可以较好地保留原组织或器官的细胞外基质蛋白成分、活性因子和天然的三维结构,相比于人工合成材料和天然的单一成分材料在维持细胞特性及后续的再生医学方面更具优势。它能较好还原组织受损前的微环境,具有促进细胞粘附、增殖和分化的生物活性以及可生物降解的特性,并且有越来越多的报道证明其生物功能与修复效果具有组织特异性。然而,脱细胞基质水凝胶的制备以物理或化学法为主,目前暂无统一标准化的方法,操作复杂,且脱细胞程度较低,易有细胞残留。物理方法本身一般不足以实现完全的脱细胞,化学方法更多的采用酶学处理方法,如某些胰蛋白酶,酶法在脱细胞的过程中,也可能会降解掉一些蛋白质,对本身的成分有一定的影响。这些方法会不同程度的影响改变组织器官基质生物化学组成成分,操作复杂,成本较高且脱细胞程度较低,易有细胞残留。
4.基于以上,本发明提供一种由组织等生物材料来源制备成脱细胞基质水凝胶的方法,该方法适用于多种组织,脱细胞程度高,可有效减少细胞残留,对原材料的组织结构损失小。
技术实现要素:
5.有鉴于此,有必要针对现有问题,提供一种脱细胞液、脱细胞基质水凝胶及其制备方法和应用。
6.为达到以上技术目的,本技术采用的技术方案如下:
7.第一方面,本发明提供一种脱细胞液,包括以下终浓度的组分:nacl或nh4cl,1-5mol/l;脱氧胆酸钠,1%-10%;dmso,0.5-5%;磷酸三丁酯,0.1%-5%;甘氨酸,0.01-0.5mol/l;溶剂为水。
8.优选地,所述脱细胞液还包括:triton x或tween-20或np-40,0.1-2%。
9.进一步地,所述脱细胞液还包括ph调节剂。
10.进一步地,所述ph调节剂为盐酸,将脱细胞液ph调节至2-5。
11.第二方面,本发明提供一种脱细胞基质水凝胶的制备方法,包括以下步骤:
12.步骤1,将收集的组织块进行预处理;
13.步骤2,将步骤1获得的组织块剪切后置于上述脱细胞液中搅拌处理,得到脱细胞支架;
14.步骤3,将所述脱细胞支架清洗后冻干,冻干后研磨成基质粉末;
15.步骤4,将所述基质粉末用消化液消化,获得预凝胶;
16.步骤5,滤除所述预凝胶未消化的杂质,然后调节ph至6.5-7.5,得到脱细胞基质水凝胶。
17.进一步地,步骤1中预处理过程包括去除杂质、清洗、表面消毒。
18.进一步地,步骤2中组织块在脱细胞液中常温搅拌处理4-8h。
19.进一步地,步骤3中脱细胞支架冻干前先于-80
±
5℃环境中冷冻2h以上。
20.优选地,步骤3中脱细胞支架冻干前先于-80
±
5℃环境中冷冻2-4h。
21.进一步地,所述冻干温度为-80
±
5℃。
22.进一步地,所述消化液为含盐酸的胃蛋白酶消化液,消化时间为2-48h。
23.进一步地,步骤5中滤除所述预凝胶未消化的杂质采用22um微孔滤膜。
24.进一步地,步骤5中采用0.5-5m氢氧化钠溶液调节ph。
25.第三方面,本发明提供一种脱细胞基质水凝胶,是采用上述制备方法获得。
26.第四方面,本发明提供上述方法制得的脱细胞基质水凝胶在类器官培养中的应用。
27.本发明的有益效果:
28.1、本发明的脱细胞液及脱细胞基质水凝胶成分简单,制备工艺简单,重复性好,适用于多种组织,脱细胞程度高,制备时间短,且最大程度的保留了脱细胞基质内部结构的完整性,对原材料的组织结构损失小,可有效减少细胞残留,为脱细胞基质水凝胶的应用提供了基础。
29.2、采用本发明的脱细胞基质水凝胶进行类器官培养,与类器官组织及细胞具有良好的生物相容性,并且具有较好的组织修复效果,可以更好地与细胞亲和,有利于3d培养的细胞存活与增殖。
附图说明
30.图1为实施例1的脱细胞基质水凝胶的实物图;
31.图2为实施例2的脱细胞基质水凝胶滴于培养皿的成胶图;
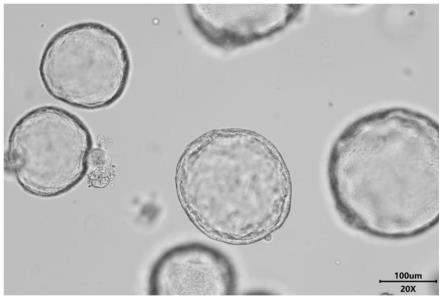
32.图3为实施例4中培养的小鼠肠类器官光镜图;
33.图4为实施例5中培养的小鼠肺类器官光镜图;
34.图5为实施例6中培养的肠癌类器官光镜图。
具体实施方式
35.在本发明的描述中,百分比均为质量百分比。
36.在本发明的描述中,需要说明的是,实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得
的常规产品。
37.本发明提供一种脱细胞液,包括以下终浓度的组分:nacl或nh4cl,1-5mol/l;脱氧胆酸钠,1-10%;dmso,0.5-5%;磷酸三丁酯,0.1-5%;甘氨酸,0.01-0.5mol/l;溶剂为水。在脱细胞液中加入磷酸三丁酯和甘氨酸可以提升脱细胞效率。
38.在本发明的优选实施例中,所述脱细胞液还包括:triton x或tween-20或np-40,0.1-2%。进一步在脱细胞液中加入前述成分中的一种,形成包含磷酸三丁酯-甘氨酸-triton x/tween-20/np-40体系,有助于进一步减少细胞残留。
39.在本发明的实施例中,所述脱细胞液还包括ph调节剂。采用盐酸作为ph调节剂,将脱细胞液ph调节至2-5,在酸性环境下,更有利于体系中细胞脱除,提升脱细胞效率。
40.本发明还提供一种脱细胞基质水凝胶的制备方法,包括以下步骤:
41.步骤1,将收集的组织块进行预处理;
42.步骤2,将步骤1获得的组织块剪切后置于上述脱细胞液中搅拌处理,得到脱细胞支架;
43.步骤3,将所述脱细胞支架清洗后冻干,冻干后研磨成基质粉末;
44.步骤4,将所述基质粉末用消化液消化,获得预凝胶;
45.步骤5,滤除所述预凝胶未消化的杂质,然后调节ph至6.5-7.5,得到脱细胞基质水凝胶。
46.在本发明的实施例中,步骤1中预处理过程包括去除杂质、清洗、表面消毒等过程。
47.在本发明的实施例中,步骤2中组织块在脱细胞液中常温搅拌处理4-8h,以保证组织块与脱细胞液充分接触反应,形成脱细胞支架。
48.在本发明的实施例中,步骤3中脱细胞支架冻干前先于-80
±
5℃环境中冷冻2h以上。预冷冻有助于保护脱细胞支架的力学性能。
49.在本发明的优选实施例中,步骤3中脱细胞支架冻干前先于-80
±
5℃环境中冷冻2-4h。
50.在本发明的实施例中,所述冻干温度为-80
±
5℃。
51.在本发明的实施例中,所述消化液为含盐酸的胃蛋白酶消化液,消化时间为2-48h。
52.在本发明的实施例中,步骤5中滤除所述预凝胶未消化的杂质采用22um微孔滤膜。
53.在本发明的实施例中,步骤5中采用0.5-5m氢氧化钠溶液调节ph。
54.本发明提供一种脱细胞基质水凝胶,是采用上述制备方法获得。
55.此外,本发明提供上述方法制得的脱细胞基质水凝胶在类器官培养中的应用。
56.下面结合附图和具体的实施例对本发明做进一步详细说明,所述是对本发明的解释而不是限定。
57.实施例1
58.本实施例提供猪小肠粘膜脱细胞基质水凝胶的制备方法,包括以下步骤:
59.步骤1,取新鲜猪小肠组织,剪去表面的脂肪组织和部分外膜,至蒸馏水中清洗再进行表面消毒;
60.步骤2,将步骤1获得的猪小肠组织块剪切后置于脱细胞液中,脱细胞液按照终浓度的组成为:1mol/l的nacl、1%的脱氧胆酸钠、0.5%的dmso、0.1%的磷酸三丁酯、0.1mol/
l的甘氨酸、0.1%的triton x,于80r/min搅拌4小时,用盐酸将脱细胞液ph调节至ph=3,得到脱细胞支架;
61.步骤3,将得到的脱细胞支架使用去离子水进行清洗;
62.步骤4,将所述清洗后的脱细胞支架置于-80
±
5℃冰箱冷冻2h后,移入-80
±
5℃冻干机中冻干,然后将其剪碎、研磨成粉末,以获得基质粉末;
63.步骤5,将所述基质粉末移入含盐酸胃蛋白酶的溶液中室温下搅拌消化4h,获得预凝胶;
64.步骤6,使用22um微孔滤膜抽滤去除预凝胶中未消化的杂质;
65.步骤7,用氢氧化钠将所述预凝胶ph调节至7,得到脱细胞基质水凝胶水凝胶,得到的脱细胞基质水凝胶如图1所示。
66.步骤8,按照qubit dsdna hs assay kit说明书使用,对得到脱细胞基质水凝胶水凝胶进行dna浓度检测,检测结果为0.02ng/ul,残留的dna非常低,说明脱细胞处理能够有效减少细胞残留。
67.实施例2
68.本实施例提供猪胎盘脱细胞基质水凝胶的制备方法,包括以下步骤:
69.步骤1,取新鲜猪胎盘组织,剪去表面的脂肪组织和部分外膜,至蒸馏水中清洗再进行表面消毒;
70.步骤2,将步骤1获得的猪胎盘组织块剪切后置于脱细胞液中,脱细胞液按照终浓度的组成为:3mol/l的nh4cl、质量浓度为6%的脱氧胆酸钠、3%的dmso、3%的磷酸三丁酯、0.2mol/l的甘氨酸、1%的tween-20,于100r/min搅拌8小时,用盐酸调节至ph=4,得到脱细胞支架;
71.步骤3,将得到的脱细胞支架使用去离子水进行清洗;
72.步骤4,将所述清洗后的脱细胞支架置于-80
±
5℃冰箱冷冻2h后,移入-80
±
5℃冻干机中冻干,然后将其剪碎、研磨成粉末,以获得基质粉末;
73.步骤5,将所述基质粉末移入含盐酸胃蛋白酶的溶液中室温下搅拌消化24h,获得预凝胶;
74.步骤6,使用22um微孔滤膜抽滤去除预凝胶中未消化的杂质;
75.步骤7,用氢氧化钠将所述预凝胶ph调节至7,得到脱细胞基质水凝胶水凝胶,得到的脱细胞基质水凝,滴于培养皿凝固后状态如图2所示。
76.步骤8,按照qubit dsdna hs assay kit说明书使用,对得到脱细胞基质水凝胶水凝胶进行dna浓度检测,检测结果为浓度过低未检出dna,说明脱细胞处理能够已基本无细胞残留。
77.实施例3
78.本实施例提供猪脐带脱细胞基质胶的制备方法,包括以下步骤:
79.步骤1,取新鲜猪脐带组织,剪去表面的脂肪组织和部分外膜,至蒸馏水中清洗再进行表面消毒;
80.步骤2,将步骤1获得的猪脐带组织块剪切后置于脱细胞液中,脱细胞液按照终浓度的组成为:5mol/l的nacl、质量浓度为8%的脱氧胆酸钠、5%的dmso、5%的磷酸三丁酯、0.5mol/l的甘氨酸、2%np-40,于50r/min搅拌6h,用盐酸调节至ph=4,得到脱细胞支架;
81.步骤3,将得到的脱细胞支架使用去离子水进行清洗;
82.步骤4,将所述清洗后的脱细胞支架置于-80
±
5℃冰箱冷冻2h后,移入-80
±
5℃冻干机中冻干,然后将其剪碎、研磨成粉末,以获得基质粉末;
83.步骤5,将所述基质粉末移入含盐酸胃蛋白酶的溶液中室温下搅拌消化8h,获得预凝胶;
84.步骤6,使用22um微孔滤膜抽滤去除预凝胶中未消化的杂质;
85.步骤7,用氢氧化钠将所述预凝胶ph调节至7,得到脱细胞基质水凝胶水凝胶,得到的脱细胞基质水凝胶。
86.步骤8,按照qubit dsdna hs assay kit说明书使用,对得到脱细胞基质水凝胶水凝胶进行dna浓度检测,检测结果dna浓度为0.01ng/ul,残留的dna非常低,说明脱细胞处理能够已基本无细胞残留。
87.实施例4
88.小肠粘膜脱细胞基质胶应用于肠类器官培养
89.本实施例提供一种用小肠粘膜脱细胞基质水凝胶的类器官的培养方法,是采用实施例1的猪小肠粘膜脱细胞基质水凝胶进行,该方法包括以下步骤:
90.1)将新鲜的小鼠肠进行预处理,先用含1%双抗的生理盐水进行数次洗涤、去除血块等杂质,并充分切碎。
91.2)将组织块进行吹散、过滤,获取直径15um-100um的细胞团,离心去除上清备用,细胞计数取2
×
105个细胞用于类器官培养。
92.3)取适量小鼠肠类器官培养基(创芯国际生物科技(广州)有限公司,货号m501)重悬细胞,用预冷的枪头在冰上取适量实施例1制备的基质水凝胶与细胞悬液混合,制备成细胞-胶混合液。
93.4)用移液器将细胞-胶混合液滴到60mm培养皿中,形成30-50ul/滴的胶滴。
94.5)将接种胶滴后的培养皿放入co2培养箱内静置2min,轻晃胶滴无明显流动后小心倒扣,待其充分凝固30min。
95.6)培养皿中加入3ml实施例1的基质水凝胶,然后置于恒温培养箱在37℃,5%co2浓度下培养。
96.7)每隔2天更换一次培养基,培养6天后可得到小鼠肠类器官,类器官平均直径在80~100μm,在普通光学显微镜下观察组织形态结构如图3所示。通过细胞计数后,细胞总数量为1.5
×
106个,数量比培养前增殖了7.5倍。
97.实施例2和实施例3的水凝胶用于本实施例也能获得同样的培养效果。
98.实施例5
99.胎盘脱细胞基质胶应用于肺类器官培养
100.本实施例提供一种用胎盘粘膜脱细胞基质水凝胶的类器官的培养方法,是采用实施例2的猪胎盘粘膜脱细胞基质水凝胶进行,该方法包括以下步骤:
101.1)将新鲜的小鼠肺进行预处理,先用含1%双抗的生理盐水进行数次洗涤、去除血块等杂质,并充分切碎。
102.8)将组织块进行消化吹散、过滤,获取直径15um-100um的细胞团,离心去除上清备用,细胞计数取2
×
105个细胞用于类器官培养。
103.2)取适量小鼠肺类器官培养基(创芯国际生物科技(广州)有限公司,货号m504)重悬细胞,用预冷的枪头在冰上取适量实施例2制备的基质水凝胶与细胞悬液混合,制备成细胞-胶混合液。
104.3)用移液器将细胞-胶混合液滴到60mm培养皿中,形成30-50ul/滴的胶滴。
105.4)将接种胶滴后的培养皿放入co2培养箱内静置2min,轻晃胶滴无明显流动后小心倒扣,待其充分凝固30min。
106.5)培养皿中加入3ml实施例2的基质水凝胶,然后置于恒温培养箱在37℃,5%co2浓度下培养。
107.6)每隔2天更换一次培养基,培养7天后可得到小鼠肺类器官,类器官平均直径超过100μm,在普通光学显微镜下观察组织形态结构如图4所示。通过细胞计数后,细胞总数量为3.4
×
106个,数量比培养前增殖了17倍。
108.实施例1和实施例3的水凝胶用于本实施例也能获得同样的培养效果。
109.实施例6
110.脐带脱细胞基质胶应用于肠癌类器官培养
111.本实施例提供一种用脐带粘膜脱细胞基质水凝胶的类器官的培养方法,是采用实施例3的脐带粘膜脱细胞基质水凝胶进行,该方法包括以下步骤:
112.1)将新鲜的肠癌组织进行预处理,先用含1%双抗的生理盐水进行数次洗涤、去除血块等杂质,并充分切碎。
113.2)将组织块进行消化吹散、过滤,获取直径15um-100um的细胞团,离心去除上清备用,细胞计数取2
×
105个细胞用于类器官培养。
114.3)取适量肠癌类器官培养基(创芯国际生物科技(广州)有限公司,货号m102)重悬细胞,用预冷的枪头在冰上取适量实施例3制备的基质水凝胶与细胞悬液混合,制备成细胞-胶混合液。
115.4)用移液器将细胞-胶混合液滴到60mm培养皿中,形成30-50ul/滴的胶滴。
116.5)将接种胶滴后的培养皿放入co2培养箱内静置2min,轻晃胶滴无明显流动后小心倒扣,待其充分凝固30min。
117.6)培养皿中加入3ml实施例3的基质水凝胶,然后置于恒温培养箱在37℃,5%co2浓度下培养。
118.7)每隔2天更换一次培养基,培养6天后可得到肠癌类器官,类器官平均直径在50~100μm,在普通光学显微镜下观察组织形态结构如图5所示。通过细胞计数后,细胞总数量为8.4
×
106个,数量比培养前增殖了42倍。
119.实施例1和实施例2的水凝胶用于本实施例也能获得同样的培养效果。
120.对比例1
121.将实施例1中脱细胞液的0.1mol/l甘氨酸去掉,其他条件一样同实施例1。按照实施例1方法进行脱细胞基质水凝胶中dna浓度测定,检测结果dna浓度为7.58ng/ul,残留的dna远高于实施例1,说明加入甘氨酸有利于提高脱细胞效率。
122.对比例2
123.将实施例1中脱细胞液的0.1mol/l磷酸三丁酯去掉,其他条件一样同实施例1。按照实施例1方法进行脱细胞基质水凝胶中dna浓度测定,检测结果dna浓度为5.4ng/ul,残留
的dna远高于实施例1,说明加入磷酸三丁酯有利于提高脱细胞效率。
124.对比例3
125.将实施例1中脱细胞液的ph调为7.5,其他条件一样同实施例1。按照实施例1方法进行脱细胞基质水凝胶中dna浓度测定,检测结果dna浓度为2.96ng/ul,残留的dna远高于实施例1,说明ph为酸性有利于提高脱细胞效率。
126.以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
