hdac6抑制剂在选择性诱导t细胞扩增中的用途
技术领域
1.本发明涉及生物医药技术领域,具体涉及hdac6抑制剂在选择性诱导t细胞扩增中的用途。
背景技术:
2.记忆性干细胞样t细胞(t memory stem cells,tscm)是t细胞的一个亚群,兼具记忆性细胞和干细胞的特点,处于记忆性t细胞早期分化阶段,能够分化为中央记忆性t细胞(central memory t cells,tcm)、效应记忆性t细胞(effector memory t cells,tem)和效应性t细胞(effector t cells,tef)。
3.现有研究表明,tscm细胞与tcm细胞或tem细胞相比,具有更强大的抗肿瘤能力,在机体内的生存能力也更加卓越,因此在肿瘤免疫治疗中具有很好的应用价值。由于tscm细胞在人外周血t细胞中所占比例很少,约为2%-4%,如何诱导tscm细胞大量增殖成为关键。
4.然而,现有技术中缺乏较为简便高效地扩增tscm细胞的方法,并存在使t细胞的增殖效率降低的缺点,不利于将获得的细胞进行下一步的应用。比如,用化合物tws119培养诱导tscm细胞的同时,t细胞的增殖效率会大幅度降低,t细胞仅能扩增1-3倍。
5.这样的问题限制了tscm细胞的应用,因此,需要一种能选择性扩增 tscm细胞的方法,期望对t细胞的增殖效率影响较小,且不影响t细胞杀伤效率等与治疗能力相关的细胞特性。
技术实现要素:
6.本发明提供了使用hdac6抑制剂,具体为化合物acy-1215、acy241 选择性诱导t细胞扩增的方法,及hdac6抑制剂在制备tscm细胞中的用途。本发明人发现,hdac6抑制剂如化合物acy-1215、acy241均在几乎不影响t细胞增殖的情况下,能够显著提升tscm细胞占t细胞的比例,为体外扩增tscm细胞提供了新的技术手段。
7.组蛋白去乙酰化酶(histone deacetylases,hdacs)可调节与细胞生长、转移、凋亡相关的多种细胞途径。hdacs抑制剂可以影响多种细胞效应,诱导细胞凋亡,阻碍细胞循环,抑制血管生成,其作为一种抗肿瘤制剂被广泛研究。hdac6因其独特的结构和功能受到越来越多的关注,成为多种疾病潜在的治疗靶点,最受关注的主要是其在肿瘤及中枢神经系统中的作用。
8.研究证实,hdac6抑制剂在治疗阿尔茨海默病、脑胶质瘤及神经保护方面的作用也受到越来越多研究者的关注。目前发现的hdac6抑制剂主要包括acy241、acy-1215、tubacin、tubastatin a等,这些抑制剂具有相似但不尽相同的特性及应用,主要用于抗肿瘤及中枢神经系统保护等方面。因hdac6具有较高的特异性,疗效好,不良反应少,具有良好的应用前景。
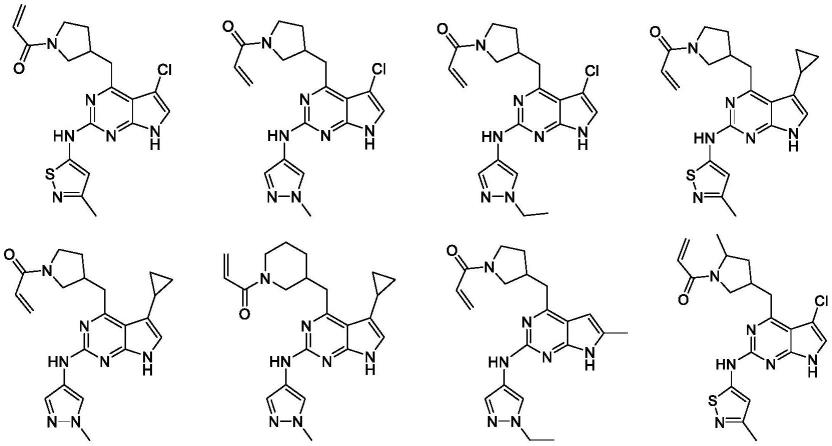
9.化合物acy-1215的分子式为c
24h27
n5o3,名称为2-(二苯基氨基)-n-[7-(羟基氨基)-7-氧代庚基]-5-嘧啶羧酰胺,分子量为433.5,cas号为:1316214-52-4,分子结构式如
下所示:
[0010][0011]
化合物acy-1215是一种有效的选择性hdac6抑制剂,对hdac6 的ic50值为4.7nm,对其他亚型的ic50值均>1μm,对hdac8有微弱活性(ic50值为0.1μm)。acy-1215在低剂量能有效诱导α-微管蛋白乙酰化,仅在较高剂量下引起组蛋白h3、h4上赖氨酸的乙酰化,证实了其对hdac6的特异性抑制作用。
[0012]
在波替单抗(硼替佐米)处理过的多发性骨髓瘤细胞(mm细胞)中,随着多泛素化蛋白水平的增加,该药可显著破坏聚集体的形成,表明波替单抗和该药联用可抑制蛋白酶体和聚集体形成。低剂量acy-1215联合波替单抗可产生协同抗mm细胞增殖作用,同时延长内质网应激和促进细胞凋亡。在2种不同的异种移植scid小鼠模型中,小鼠皮下注射人类mm细胞和静脉注射表达荧光素酶的人mm细胞后,联用上述两药,肿瘤生长明显减缓,小鼠总体存活时间显著延长。目前acy-1215单用或与地塞米松、波替单抗、来那度胺联用的治疗方式正在进行ⅰ期、ⅱ期临床试验。
[0013]
化合物acy241的分子式为c
24h26
cln5o3,名称为2-[(2-氯苯基)苯基氨基]-n-[7-(羟基氨基)-7-氧代庚基]-5-嘧啶甲酰胺,分子量为467.95,cas 号为:1316215-12-9,分子结构式如下所示:
[0014][0015]
acy241是一种口服有活性的选择性hdac6抑制剂,对hdac6和 hdac3的ic50值分别为2.6和46nm。在多种实体瘤细胞系中,用acy241 和紫杉醇(paclitaxel)联用,能显著增加癌细胞死亡率。在卵巢癌细胞中,较低浓度acy241能选择性地抑制hdac6,而高浓度导致ⅰ类hdac均被抑制,在体内具有较好的安全性。
[0016]
目前没有关于hdac6抑制剂类以及以上两种化合物在选择性促进记忆性干细胞样t细胞增殖中的相关报道。
[0017]
具体而言,本发明包括以下内容。
[0018]
1.诱导记忆性干细胞样t细胞增殖的方法,其包括使用hdac6抑制剂处理包含或能够产生所述记忆性干细胞样t细胞的细胞群(如pbmc细胞、cd3
t淋巴细胞、cd8
t淋巴细胞或cd4
t淋巴细胞)。
[0019]
2.根据项1所述的方法,其中,所述hdac6抑制剂为选自tubastatina tfa,tubastatin a,pracinostat(sb939),uf010,sklb-23bb,acy-775, brd73954,
citarinostat(化合物acy-241),hpob,mpi-5a,cg347b, tubastatin a hcl,tubacin,th34,wt161,cay10603,acy-738,tinostamustine(edo-s101),bg45,nexturastat a,sr-4370,化合物 acy-1215中的一种或多种,优选选自化合物acy-1215、化合物acy241。
[0020]
3.根据项2所述的方法,其中化合物acy241的浓度为0.001至10um,优选为0.001至0.1um,更优选为0.001至0.03um,独立地,化合物 acy-1215的浓度为0.001至10um,优选0.001至0.1um,更优选0.001 至0.01um。
[0021]
4.根据项1~3中任一项所述的方法,其中所述记忆性干细胞样t细胞经过基因修饰,例如表达嵌合抗原受体(car)或t细胞受体(tcr)。
[0022]
5.根据项4所述的方法,其中所述记忆性干细胞样t细胞包括为 cd45ro
或cd45ro-,且为ccr7
的记忆性干细胞样t细胞。
[0023]
6.根据项5中任一项所述的方法,其中所述记忆性干细胞样t细胞进一步表达以下表型标志物中的一个或多个:cd45ra
、cd95
、cd27
、 cd62l
、cd28
、cd127
、pd1-、tim3-、cd122
、pdl1-、lag3-、cd3
、 cd4
和cd8
。
[0024]
7.根据项1~4中任一项所述的方法,其中所述细胞群选自外周血单核细胞pbmc、cd3
t淋巴细胞、cd8
t淋巴细胞或cd4
t淋巴细胞。
[0025]
8.根据项1所述的方法,包括使用细胞因子诱导记忆性干细胞样t细胞,所述细胞因子为以下一种或多种细胞因子的组合:il2、il21、il7和 il15,优选地,il2的浓度为5至10000u/ml,il7的浓度为0.1至100ng/ml, il21的浓度为0.1至100ng/ml,il15的浓度为0.1至100ng/ml。
[0026]
9.根据项1所述的方法,包括使用细胞激活剂诱导扩增记忆性干细胞样t细胞,所述细胞激活剂为一个或多个包被抗cd3抗体和抗cd28抗体的磁珠。
[0027]
10.hdac6抑制剂在制备治疗或预防肿瘤的药物中的用途,包括利用 hdac6抑制剂制备记忆性干细胞样t细胞,其中,所述hdac6抑制剂为选自tubastatin a tfa,tubastatin a,pracinostat(sb939),uf010, sklb-23bb,acy-775,brd73954,citarinostat(acy-241),hpob,mpi-5a, cg347b,tubastatin ahcl,tubacin,th34,wt161,cay10603,acy-738, tinostamustine(edo-s101),bg45,nexturastat a,acy-1215和sr-4370 中的一种或多种,优选选自化合物acy-1215、化合物acy241。
[0028]
在本技术中,所述acy241的浓度可以为0.001-100um的范围,例如,浓度可以为0.001-100um、0.001-10um、0.001-3um、0.001-1um、0.001
ꢀ‑
0.5um、0.001-0.3um、0.001-0.1um、0.001-0.05um、0.001-0.03um、0.001
ꢀ‑
0.01um。所述acy-1215的浓度可以为0.001-100um,例如,浓度可以为 0.001-100um、0.001-10um、0.001-3um、0.001-1um、0.001-0.5um、0.001
ꢀ‑
0.3um、0.001-0.1um、0.001-0.05um、0.001-0.03um、0.001-0.01um。
[0029]
在某些实施方式中,其还包括以下步骤:分离获得外周血单核细胞 pbmc、cd3
t淋巴细胞、cd8
t淋巴细胞或cd4
t淋巴细胞。
[0030]
在某些实施方式中,所述方法还包括:向上述分离的细胞例如pbmc 等加入一种或多种t细胞激活因子。所述t细胞激活因子包括:cd3抗体、cd28抗体、4-1bb抗体、cd80抗体、cd86抗体、pha、pma和/ 或离子霉素。这些因子可以以任何常用的形式,例如溶解在溶液中或固定在载体上的形式进行添加。具体的添加时机及频率例如为开始培养前后及培养中,例如为数天(例如1,2,3,4天)1次,只要能够实现本发明的效果即可,不限于此。
[0031]
在某些实施方式中,所述方法还包括:向能够产生所述记忆性干细胞样t细胞的细胞群,例如经分离的所述pbmc加入一种或多种细胞因子;所述细胞因子包括选自下组的一种或多种:il4、il2、il15、il7、il21、 ifn和tnf。同样地,这些细胞因子也可以以任何常用的形式,例如溶解在溶液中或固定在载体上的形式进行添加。具体的添加浓度及时机只要能够实现本发明的效果即可,不限于实施例给出的方式。
[0032]
在某些实施方式中,所述方法还包括干细胞培养基;其中所述干细胞培养基包括选自下组的一种或多种:dmem培养基、1640培养基、mem 培养基、kbm-581培养基、aim培养基、macs培养基和x-vivo培养基等常用于干细胞培养的培养基。
[0033]
本发明的方法特别适用于car-t细胞,当用于car-t细胞(例如,本发明的分别表达gpc3-41bb-car、bcma-41bb-car、cd19-41bb-car 的t细胞)时,car-t细胞的杀伤能力和car的表达稳定,基本不受影响。
附图说明
[0034]
图1为加入不同浓度的化合物hdac6抑制剂时t细胞增殖情况。
[0035]
图2为hdac6抑制剂提高tscm细胞(t细胞)的细胞占比。a,共培养第7天的细胞占比,b为共培养第12天的细胞占比。
[0036]
图3为hdac6抑制剂对t细胞表型的影响示意图。a为以ccr7作为纵轴,cd45ro作为横轴的结果,b为以cd62l作为纵轴,cd8作为横轴的结果。
[0037]
图4为加入hdac6抑制剂后的car-t细胞参数。a为扩增倍数,b 为平均细胞直径,c为扩增倍数,d为平均细胞直径。
[0038]
图5为hdac6抑制剂促进tscm细胞(car-t细胞)的形成。a为流式图,b为流式结果。
[0039]
图6为hdac6抑制剂对car-t细胞杀伤毒性的影响的细胞图。
[0040]
图7为hdac6抑制剂促进肿瘤细胞反复刺激后car-t细胞的增殖。 a为扩增倍数,b为平均细胞直径。
具体实施方式
[0041]
以下通过实施例来进一步阐述本发明。但是应该理解,所述实施例只是举例说明的目的,并不意欲限制本发明的范围和精神。
[0042]
实施例1构建用于制备car-t细胞的慢病毒载体
[0043]
在本实施例中,制备了靶向gpc3、cd19、bcma的car-t的细胞。具体为,首先人工合成了以下包含car结构的片段:
[0044]
gpc3-41bb-car由前导序列(核苷酸如seq id no.10所示,氨基酸序列如seq id no.11所示,在以下car中使用了相同的前导序列)、gpc3scfv(核苷酸序列如seq id no.1所示,对应氨基酸序列如seq id no.7 所示)、cd8铰链区和跨膜区(核苷酸序列如seq id no.4所示)、41bb(核苷酸序列如seq id no.5所示)、cd3zeta(核苷酸序列如seq id no.6所示)从5’端至3’端依次拼接构建而成。
[0045]
cd19-41bb-car由前导序列(同上)、cd19 scfv(核苷酸序列如seq id no.2所示,对应氨基酸序列如seq id no.8所示)、cd8铰链区和跨膜区 (核苷酸序列如seq id no.4所示)、41bb(核苷酸序列如seq id no.5所示)、cd3zeta(核苷酸序列如seq id no.6所示)从
5’端至3’端依次拼接构建而成。
[0046]
bcma-41bb-car由前导序列(同上)、bcma scfv(核苷酸序列如seqid no.3所示,对应氨基酸序列如seq id no.9所示)、cd8铰链区和跨膜区(核苷酸序列如seq id no.4所示)、41bb(核苷酸序列如seq id no.5 所示)、cd3zeta(核苷酸序列如seq id no.6所示)从5’端至3’端依次拼接构建而成。
[0047]
将这些人工片段构建到慢病毒载体(lv100a,system biosciences公司) 中,随后依照其说明书记载的方式转染获得慢病毒,分别得到 gpc3-41bb-car、bcma-41bb-car、cd19-41bb-car慢病毒。
[0048]
实施例2通过慢病毒感染获得car-t细胞
[0049]
通过ficoll分离液分离新鲜人外周血,获得大于1
×
107的外周血单核淋巴细胞(pbmc)。用pbs稀释抗人cd3及抗人cd28抗体(上海近岸生物科技有限公司,使其终浓度达到1μg/ml。然后,向细胞培养皿中加入稀释后的抗体混合液,然后将其均匀铺至细胞培养皿中,于室温孵育2小时。 2小时后,用pbs洗涤一次抗体混合液。随后,将分离的pbmc用含有 xvivo15培养基、5%fbs、200u/ml il2 t或xvivo15培养基、5%fbs、 20ng/ml il21、10ng/ml il7的淋巴细胞培养液进行重悬,使其终浓度达到 1
×
106个细胞/ml,加入放置抗体混合液的培养皿中于37℃、5%co2培养 24小时,以激活t细胞。
[0050]
取一定量的t细胞培养液,加入终浓度为1mg/ml的synperonic f108 混匀,于水浴锅加热至37℃,配制为感染试剂。随后,准备实验所需细胞培养皿。先取1mg/ml抗人cd3抗体和0.5mg/ml抗人cd28抗体用pbs 缓冲液按1:1000的体积比稀释并混匀,然后用retronectin(重组人纤维连接片段,takara公司,t100b,1mg/ml)试剂按1:40的体积比稀释并混匀,然后将其均匀铺至细胞培养皿中,于室温孵育2小时。2小时后,用pbs 进行洗涤,细胞培养皿准备完成。
[0051]
用所配感染试剂稀释已激活的t细胞,每皿细胞密度为1*106/ml,并按moi=3的比例分别加入实施例1所制备的各种慢病毒并混匀。随后均匀铺在所述细胞培养皿中,进行慢病毒感染,从而获得了分别表达 gpc3-41bb-car、bcma-41bb-car、cd19-41bb-car的t细胞。
[0052]
感染后监测细胞密度,使这些感染后的细胞的密度维持在1
×
106个细胞/ml。14天后,观察到总细胞数的扩增在10-100倍的范围。
[0053]
实施例3:不影响t细胞增殖的hdac6抑制剂浓度。
[0054]
将新鲜人外周血经ficoll分离获得的外周血单个核细胞(peripheralblood mononuclear cell,pbmc),pbmc细胞(5*105/ml)与cd3/cd28磁珠 (dynabeads)、il21(25ng/ml)、il7(20ng/ml)以及不同浓度(3,1,0.5,0.3, 0.1,0.03,0.01um)的化合物acy-1215或acy241共培养12天,每2天换新鲜培养基并补加化合物和细胞因子,并取细胞进行台盼蓝染色计数,检测t细胞增殖倍数,将实验结果示于图1。
[0055]
结果显示,如图1所示,在两组中,与对照相比,t细胞的相对扩增倍数均随化合物浓度的降低而增加,显示t细胞增殖抑制的逐步减轻。尤其是在为0.1,0.03,0.01um的低剂量时,化合物acy-1215及acy241 均对t细胞增殖不显示抑制。
[0056]
实施例4:hdac6抑制剂促进tscm细胞(t细胞)的增殖。
[0057]
在本实施例中,发明人对浓度进一步进行细化,使用了0.1,0.03,0.01, 0.003,0.001um的抑制剂化合物进行了共培养。
[0058]
将新鲜人外周血经ficoll分离获得外周血单个核细胞(peripheral bloodmononuclear cell,pbmc),pbmc细胞(5*105/ml)与cd3/cd28磁珠 (dynabeads)、il21(25ng/ml)、il7(20ng/ml)以及不同浓度(0.1,0.03,0.01, 0.003,0.001um)的化合物acy-1215或acy241共培养12天,每2天换新鲜培养基并补加化合物和细胞因子。在第7天,第12天分别取细胞孵育,检测tscm细胞的流式抗体(cd3、cd4、cd8、cd45ro、cd45ra、 cd62l、ccr7、cd95、cd122、cd127、cd27、cd28、pd1、tim3、 pdl1、lag3,均为赛默飞公司)并用流式细胞仪(bd公司)检测。实验结果分别示于图2a,b。
[0059]
结果显示,在0.01,0.003,0.001um的浓度下,化合物acy-1215及 acy241均能够显著提升cd45ro-ccr7
cd62l
cd95
即tscm细胞占 cd3细胞比例、以及cd45ro-ccr7
cd62l
cd95
即tscm细胞占cd8 细胞比例。在0.003,0.001um的浓度下,化合物acy-1215及acy241 能够显著提升cd45ro-ccr7
cd62l
cd95
即tscm细胞占cd4细胞的比例。
[0060]
实施例5:hdac6抑制剂化合物对t细胞表型的影响。
[0061]
将新鲜人外周血经ficoll分离获得外周血单个核细胞(peripheral bloodmononuclear cell,pbmc),pbmc细胞(5*105/ml)与cd3/cd28磁珠 (dynabeads)、il21(25ng/ml)、il7(20ng/ml)以及0.01,0.003,0.001um的化合物acy-1215或acy241共培养12天,每2天换新鲜培养基并补加化合物和细胞因子,第12天取细胞孵育检测tscm细胞的流式抗体(cd3、 cd4、cd8、cd45ro、cd45ra、cd62l、ccr7、cd95、cd122、cd127、 cd27、cd28、pd1、tim3、pdl1、lag3,赛默飞公司)并用流式细胞仪(同上)检测。实验结果示于图3。a为以ccr7作为纵轴,cd45ro作为横轴的结果,b为以cd62l作为纵轴,cd8作为横轴的结果。
[0062]
结果显示,关于hdac6抑制剂化合物对t细胞表型的影响,在图3 中,在第一行的q1象限中,对照为34.7%,0.01,0.003,0.001um的化合物acy-241组分别为45.8%,47.0%,57.1%;而0.01,0.003,0.001um 的化合物acy-1215组分别为52.5%,58.8%,55.2%。由此可知,与对照相比,在0.01,0.003,0.001um的化合物acy-1215及acy241组中,为 cd45ro-ccr7
表型的t细胞的比例,即tscm细胞的比例均显著提升。同时,与对照相比,各浓度的化合物acy-1215及acy241共培养后,cd8 和cd62l蛋白的表达稳定,表明对cd4/cd8表型无明显影响,能够持续维持归巢蛋白cd62l的高表达。
[0063]
实施例6:化合物hdac6抑制剂不影响car-t细胞增殖。
[0064]
新鲜人外周血经ficoll分离获得外周血单个核细胞(peripheral bloodmononuclear cell,pbmc),同实施例2地制备了car-t细胞 gpc3-41bb-car。将car-t细胞(gpc3-41bb-car,5*105/ml)与 cd3/cd28磁珠(dynabeads)、il21(25ng/ml)、il7(20ng/ml)以及不同浓度 (0.5,0.1,0.05um,示于图4a,b;或0.1,0.03,0.01um,示于图4c,d)化合物acy-1215或acy241共培养12天,每2天换新鲜培养基并补加化合物和细胞因子,并在不同时间点取细胞进行台盼蓝染色计数,检测 car-t细胞增殖效果。实验结果示于图4,a5表示化合物acy-1215,a1 表示化合物acy241。
[0065]
结果显示,在0.5,0.1,0.05um化合物acy-1215及acy241组中,以上化合物对car-t细胞的增殖曲线与对照组没有显著差别,car-t细胞的平均细胞直径亦保持同样的趋势。在0.1,0.03,0.01um化合物 acy241及0.03,0.01um化合物acy-1215组中,与对照相比,car-t 细胞的扩增曲线有极轻微的降低,几乎没有影响。0.1,0.03,0.01um浓度下化合物acy241及化合物acy-1215对平均细胞直径亦几乎没有影响。
[0066]
实施例7:化合物hdac6抑制剂促进tscm细胞(car-t细胞) 的增殖。
[0067]
将新鲜人外周血经ficoll分离获得外周血单个核细胞(peripheral bloodmononuclear cell,pbmc),制备car-t细胞(gpc3-41bb-car,5*105/ml) 与cd3/cd28磁珠(dynabeads)、il21(25ng/ml)、il7(20ng/ml)以及0.1, 0.03,0.01um化合物acy-1215或化合物acy241共培养12天,每2天换新鲜培养基并补加化合物和细胞因子,在第12天分别取细胞孵育检测 tscm细胞的流式抗体,其中用于检测tscm细胞特性的抗体使用了cd3、 cd4、cd8、cd45ro、cd45ra、cd62l、ccr7、cd95、cd122、cd127、 cd27、cd28、pd1、tim3、pdl1、lag3,用于检测上述car的流式抗体使用了靶向gpc3抗体(acrobiosystems公司)并用流式细胞仪(同上)检测。实验结果示于图5,图5a中两种化合物浓度均为0.1um,图5b 中从上到下分别以car,cd8,cd62l表达为横轴。
[0068]
结果显示,如图5a所示,在化合物acy-1215或acy241组中,与对照组相比,在q1象限中分布的cd45ro-ccr7
表型细胞比例升高(图 1),表明化合物acy-1215或acy241均能够显著提升tscm细胞 (cd45ro-ccr7
)比例,同时,与对照组相比,在q6象限中分布的表达pdl1
lag3
的细胞比例降低,表明化合物acy-1215或acy241降低了耗竭性蛋白pdl1,lag3的表达。
[0069]
如图5b所示,与对照组(84.2%)相比,与0.1,0.03,0.01um化合物acy-1215及acy241共培养时细胞的car表达率稳定(例如,87.6%, 86.6%,90.6%)。在化合物0.1,0.03,0.01um acy-1215或acy241组中, cd8蛋白表达稳定,流式图显示cd62l蛋白表达稳定。表明化合物 acy-1215或acy241不会对car-t细胞中car的表达造成显著影响。
[0070]
实施例8:hdac6抑制剂对car-t细胞杀伤毒性的影响。
[0071]
新鲜人外周血经ficoll分离获得外周血单个核细胞(peripheral bloodmononuclear cell,pbmc),将如实施例2地制备的car-t细胞 (gpc3-41bb-car,5*105/ml)与cd3/cd28磁珠(dynabeads)、il21(25 ng/ml)、il7(20ng/ml)以及化合物acy-1215(0.1um)或acy241(0.1um) 共培养12天,在第7天,第12天分别取car-t细胞与huh-7细胞(购自中科院细胞库)按细胞数1:1共孵育48h,显微镜拍照观察以及流式检测 car-t细胞对huh-7细胞的杀伤效果,同时设置了仅huh-7细胞(标记为 huh-7组)和huh-7细胞与普通t细胞共孵育(标记为huh-7 t组)的对照组,将镜下照片示于图6,各组上方的图为与化合物共培养第7天的细胞,下方的图为共培养第12天的细胞。
[0072]
结果显示:在huh-7组与huh-7 t组中,仍能够辨认出huh-7细胞的形态,在化合物acy-1215或acy241处理组car-t细胞对huh-7细胞均具有极高的杀伤效果,与对照组相似,可100%杀死huh-7细胞。这是由于tscm的体外细胞杀伤能力一般弱于终末期分化的细胞,试验表明化合物acy-1215或acy241处理对杀伤能力没有负面影响,不会造成细胞杀伤能力的损失。
[0073]
实施例9:hdac6抑制剂促进肿瘤细胞反复刺激后car-t细胞的增殖。
[0074]
新鲜人外周血经ficoll分离获得外周血单个核细胞(peripheral bloodmononuclear cell,pbmc),上述制备的car-t细胞(gpc3-41bb-car, 5*105/ml)与cd3/cd28磁珠(dynabeads)、il21(25ng/ml)、il7(20ng/ml) 以及化合物acy-1215(0.5,0.1,0.05um)共培养12天,在第12天分别取car-t细胞与辐照(x-rad细胞辐照仪,辐照剂量为30gy)的huh7细胞按细胞数1:1共培养,培养基为xvivo15,每4天重新补加辐照的huh7 细胞作为一
次刺激,共刺激2次,每次用台盼蓝计数细胞增殖情况。
[0075]
实验结果如图7所示,与对照组相比,化合物acy-1215处理组在0.5, 0.1,0.05um浓度下时,第8天car-t细胞的扩增倍数及趋势均高于对照组,car-t细胞的平均细胞直径亦保持同样的趋势。
[0076]
综上所述,在使用hdac6抑制剂处理包含或能够产生所述记忆性干细胞样细胞的细胞群时,无论是分离的pbmc还是经过基因编辑得到的 car-t细胞,在处理一段时间后,都能够显著提升tscm细胞占t细胞比例,且对t细胞增殖效果没有显著的影响。
[0077]
由于hdac6抑制剂是在体内具有较好的安全性的试剂,因此可以期待hdac6抑制剂在治疗和/或预防癌症、自身免疫疾病或病毒感染疾病中的应用,尤其是car-t细胞中tscm细胞比例的增加,可被用于对受试者进行个性化诊断和治疗等。
[0078]
综上,本技术提供了诱导干细胞样细胞增殖的方法。该方法能够快速、简便和/或稳定地诱导干细胞样细胞增殖。本技术提供的方法可以在体外诱导记忆性干细胞样t细胞增殖。此外,本技术提供的方法能够被借鉴用以制备干细胞样细胞增殖诱导剂。本技术提供的方法还能够用于治疗和/或预防癌症、自身免疫疾病或病毒感染疾病。此外,本技术的方法可被用于对受试者进行个性化诊断和治疗。例如,能用于诱导包含经t细胞表达嵌合抗原受体(car)或t细胞受体(tcr)修饰的t细胞的记忆性干细胞样t细胞的增殖。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。