1.本发明属于生物化学医药领域,具体涉及一个阿朴菲类生物碱化合物、其提取方法及应用。
背景技术:
2.2型糖尿病(t2dm)是一组以高血糖水平为特征的代谢疾病,是一种全球流行的慢性代谢性疾病,t2dm通常表现为高血糖和高脂血症,其特征是胰岛β细胞因不同程度的长期胰岛素抵抗(ir)而无法分泌足够的胰岛素。糖尿病的糖脂代谢和ir是一个漫长而复杂的过程,主要发生在肝脏、肌肉和脂肪组织中。2型糖尿病患者患糖尿病并发症的风险增加,会损害肝脏、心脏和眼睛等器官,从而导致许多危及生命的严重健康问题。虽然二甲双胍、罗格列酮、阿卡波糖等降糖药被广泛用于控制血糖,但仍不能满足临床需要,人们仍迫切需要新的有效降糖药,以获得更多的效益和治疗选择。
3.无根藤(cassytha filiformis l)为樟科无根藤属植物,是一种寄生草本植物,其在我国主产于海南、广西、台湾等地区,具有清热止咳、凉血止血等功效。
技术实现要素:
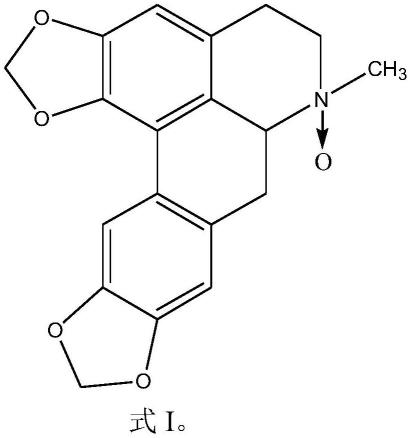
4.本发明第一个方面是提供一个阿朴菲类生物碱化合物,其结构如式i所示:
[0005][0006]
本发明第二个方面是提供上述一个阿朴菲类生物碱化合物的提取方法,包括以下步骤:
[0007]
(1)无根藤全草,干燥粉碎,使用有机溶剂加热回流提取,过滤得到无根藤总提取液,减压浓缩至无醇味,得总提取液;取所得总提取液,加入2%hcl调ph=2~3,加入乙酸乙酯萃取,去掉上层有机相,回收下层,下层加入氢氧化钠溶液调节ph=9~10,加入乙酸乙酯萃取,去掉下层,回收上层有机相,减压浓缩,得乙酸乙酯萃取总浸膏,即总生物碱部分;
[0008]
(2)取所得总生物碱浸膏,进行硅胶柱层析,使用不同比例的二氯甲烷-丙酮为洗
脱剂,进行梯度洗脱,收集二氯甲烷-丙酮=4:1比例洗脱下来的洗脱液进行浓缩,干燥;干燥所得流份采用sephadex lh-20进行纯化,甲醇为洗脱剂,每50ml接为一个流份;
[0009]
(3)对所得流份fr.7、fr.8合并,采用高效液相色谱进一步纯化,即得本发明所述的化合物。
[0010]
进一步,所述步骤(1)中所用的提取剂为甲醇(分析纯)和/或95%乙醇;所述的步骤(2)中,硅胶柱层析所用硅胶粒径为200-300目。
[0011]
进一步,所述步骤(2)所述二氯甲烷-丙酮体积比为依次为100:0、19:1、9:1、4:1、2:1、1:1。
[0012]
进一步,所述步骤(2)中,浓缩采用减压浓缩,干燥采用真空冷冻干燥。
[0013]
进一步,所述步骤(3)中所述高效液相色谱柱为ymc-pack ods-a柱,洗脱剂为甲醇-水=60:40,流速为2ml/min,洗脱时间为40min;该化合物的保留时间为23.3min。
[0014]
本发明第三个方面是提供以上所述的阿朴菲类生物碱化合物在制备提高正常肝细胞细胞葡萄糖消耗药物上应用。
[0015]
进一步,所述的应用中,所述的正常肝细胞为人肝正常细胞。
[0016]
进一步,所述的人肝正常细胞为hl-7702细胞。
[0017]
进一步,所述阿朴菲类生物碱化合物的浓度为0.3125-5μm。
[0018]
本发明的有益效果:
[0019]
本发明的所述的阿朴菲类生物碱化合物,是从无根藤中分离得到的结构新颖的化合物,化学结构中含有氮氧结构。通过体外细胞实验表明,其具有显著提高hl-7702细胞葡萄糖消耗的功效,为解决t2dm的治疗问题提供新的选择。
附图说明
[0020]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
[0021]
图1为不同处理对hl-7702细胞存活率的影响。
[0022]
图2为不同处理对hl-7702细胞葡萄糖消耗的影响。
具体实施方式
[0023]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0024]
实施例1
[0025]
取无根藤全草50kg,干燥粉碎,使用甲醇或者乙醇加热回流提取,过滤得到无根藤总提取液,减压浓缩至无醇味,得总提取液;取所得总提取液,加入2%hcl调ph=2~3,加入乙酸乙酯萃取,去掉上层有机相,回收下层,下层加入氢氧化钠溶液调节ph=9~10,加入乙酸乙酯萃取,去掉下层,回收上层有机相,减压浓缩,得乙酸乙酯萃取总浸膏(248.5g),即总
生物碱部分;
[0026]
取所得总浸膏,使用硅胶干法上样,即先将乙酸乙酯萃取总浸膏加少量甲醇溶解,再加入少量硅胶拌匀,待有机溶剂挥发干后,磨细,使用硅胶(200-300目)柱层析,采用不同体积比的二氯甲烷-丙酮为洗脱剂进行梯度洗脱,洗脱至无色为止,收集二氯甲烷-丙酮比例为4:1的洗脱液,减压浓缩,真空冷冻干燥,获得干粉状有效部位。每种梯度的洗脱液的配比以及所得流份的命名如表1所示:
[0027]
表1不同梯度洗脱液所得的流份命名
[0028]
洗脱液配比(二氯甲烷-丙酮,v/v)所得流份命名编号100:0fr.119:1fr.29:1fr.34:1fr.42:1fr.51:1fr.6
[0029]
对所得有效部位采用sephadex lh-20进行纯化,甲醇为洗脱剂,每50ml接为一个流份,对所得流份fr.7、fr.8合并,采用高效液相色谱进一步纯化,得到1个化合物。高效液相色谱柱为ymc-pack ods-a柱,洗脱剂为甲醇-水=60:40,流速为2ml/min,洗脱时间为40min;化合物的保留时间约为23.3min。
[0030]
经鉴定,该化合物为阿朴菲类生物碱,其分子式如式i所示:
[0031][0032]
本发明所述的化合物的高分辨质谱数据见表2。
[0033]
表2本发明化合物的高分辨质谱数据
[0034]
质谱仪电离模式实测值理论值分子式hr-esi-ms[m h]
340.1185340.1185c
19h17
no5[0035]
本发明所述化合物的波谱数据见表3。
[0036]
表3本发明所述化合物的波谱数据
[0037][0038][0039]1h nmr测试条件为600mhz,cd3od;
13
c nmr测试条件为150mhz,cd3od。
[0040]
本发明化合物对细胞增殖及细胞毒性检测试验
[0041]
方法:
[0042]
(1)hl-7702细胞复苏及培养:经-80℃冰箱中取出,离心弃去上层冻存液,加入含20%胎牛血清、1%双抗的dmem培养基重悬细胞,相对湿度为95%,37℃,5%co2的孵箱中培养;视细胞生长情况,每24~36h更换新鲜培养基,待细胞生长至80%~90%,予以传代或冻存。
[0043]
(2)mtt法检测细胞活力。简而言之,hl-7702细胞接种于96孔板中,每孔100μl细胞混悬液,培养方式如上。然后用不同浓度的化合物处理细胞后,在5%co2、37℃条件下进行培养24h。取出化合物处理后的96孔板,每孔加入10μl mtt溶液(5mg/ml),混匀后37℃孵育4h,小心去除mtt溶液,每孔加入150μldmso溶解结晶,用酶标仪在490nm波长处检测每孔的吸光度。
[0044]
细胞存活率=(加药细胞od/空白对照细胞od)*100
[0045]
实验结果见表4和图1。
[0046]
表4不同处理对hl-7702细胞存活率的影响
[0047][0048][0049]
本发明所得有效部位中分离得到的阿朴菲类生物碱化合物从5μm往下依次2倍稀释至0.3125μm,共5个处理浓度下对hl-7702细胞毒性影响。如图1所示:ck为空白对照组(不经过化合物处理)。因此,与空白对照组相比,化合物在0.3125-5μm浓度范围内没有显著细胞毒性。
[0050]
本发明化合物促人肝正常细胞(hl-7702细胞)葡萄糖消耗活性实验方法:
[0051]
(1)培养方法同上述细胞增殖及细胞毒性检测试验(1)。
[0052]
(2)阿朴菲类生物碱化合物干预培养hl-7702细胞葡萄糖消耗的分组:取1瓶生长密度为95%左右的hl-7702细胞,消化后20%基础培养基吹打为8ml细胞悬液,均匀接种于96孔培养板,每孔100μl细胞悬液,外围一圈孔给予100μlpbs用于液封,37℃,5%co2条件下培养。
[0053]
(3)取含0.5%胎牛血清、1%双抗的高糖培养基(含4.5g/l d-葡萄糖),将提前配制好的药物母液(100mm)制成各给药浓度组。吸去孔板中旧培养基,设置6个复孔,每孔100ul含各浓度药物的0.5%高糖培养基。ck组为1ml 0.5%胎牛血清、1%双抗的高糖培养基内加入与最高给药浓度等体积的dmso(0.1%)制成的空白对照培养基,同设置6个复孔,每孔100ul空白对照培养基。阳性药组为1ml0.5%胎牛血清、1%双抗的高糖培养基内溶解4μl 500mm二甲双胍溶液制成的2mm阳性对照含药培养基,同设置6个复孔,每孔100ul阳性对照含药培养基。37℃,5%co2条件下培养24h。
[0054]
(4)在各孔取2μl上清培养基,另取2μl高糖培养基做6个对照孔,每孔加入200μl葡萄糖检测试剂,混合均匀,37℃孵育10min后,用酶标仪于505nm波长处测定各孔吸光值(od值)。葡萄糖消耗浓度(mm)=标准液浓度-(标准液浓度*加药细胞od值/标准液od值)
[0055]
实验结果见表2和图2。
[0056]
表2不同处理对hl-7702细胞葡萄糖消耗的影响
[0057]
化合物处理方法葡萄糖消耗浓度(m m)空白对照组7.92实验组1(化合物-0.3125μm)9.14
*
实验组2(化合物-0.625μm)9.70
*
实验组3(化合物-1.25μm)9.35
**
实验组4(化合物-2.5μm)9.06
*
实验组5(化合物-5μm)9.30
*
阳性药组(met-二甲双胍-2mm)11.64
***
[0058]
注:与对照组比较*p《0.05,**p《0.01,***p《0.001。
[0059]
本发明所得有效部位中分离得到的阿朴菲类生物碱化合物从5μm往下依次2倍稀释至0.3125μm,共5个处理浓度下均能够显著的提高hl-7702葡萄糖消耗活性。如图2所示:ck为空白对照组(不经过化合物处理),met为阳性对照组(2mm二甲双胍处理)。因此,与空白对照组相比,化合物能显著的提高hl-7702葡萄糖消耗活性。
[0060]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。