1.本发明涉及药物制剂技术领域,具体涉及一种盐酸异丙嗪注射液及其制备方法。
背景技术:
2.盐酸异丙嗪是吩噻嗪类衍生物,因其化学结构式中含吩噻母环以及低价硫,极其容易被氧化为醌状化合物及亚砜,故干品在空气中日久会变为蓝色,水溶液的氧化更为迅速。盐酸异丙嗪能竞争性阴断组胺h1受体从而产生抗组胺作用,能对抗组胺所致之毛细血管扩张,降低其通透性,缓解支气管平滑收缩所致的喘息,较盐酸苯海拉明作用强而持久。另外,因盐酸异丙嗪较易进入脑组织,有明显的镇静作用,能加强催眠药、镇痛药及麻醉药的中枢抑制作用。
3.但是,现有的制备方法制备生产的盐酸异丙嗪注射液,盐酸异丙嗪注射液杂质水平较高,无菌保障水平较低,其稳定性期间容易出现溶液颜色不合格现象。
4.如中国专利申请201310605500.3中公开了一种盐酸异丙嗪注射液的制备方法。制备时先取50-80ml注射用水,加入0.05-1g抗氧剂并搅拌溶解,再加入1-4g盐酸异丙嗪并搅拌溶解,继续加入0.4-0.8g渗透压调节剂并搅拌溶解,用适量ph调节剂调节溶液ph为4-5.5,加注射用水至100ml,过滤,灌封,灭菌。但是该申请制备的盐酸异丙嗪注射液不耐受终端灭菌,采用121℃灭菌15min后ph值明显降低、总杂增加,在高温条件下存放,溶液颜色发生显著变化稳定性较差。
5.再如中国专利申请201310605554.x中公开了一种盐酸异丙嗪注射液。每100ml该注射液中含有1-4g盐酸异丙嗪、0.05-1g抗氧剂、0.4-0.8g渗透压调节剂、适量ph调节剂及余量的注射用水。其制备方法是先取50-80ml注射用水,加入0.05-1g抗氧剂并搅拌溶解,再加入1-4g盐酸异丙嗪并搅拌溶解,继续加入0.4-0.8g渗透压调节剂并搅拌溶解,用适量ph调节剂调节溶液ph为4-5.5,加注射用水至100ml,过滤,灌封,灭菌;该申请制备的注射液中含有多种辅料,并且得到的注射液同样存在在高温条件下存放,溶液颜色发生显著变化稳定性较差的问题。
6.因此为了提升盐酸异丙嗪注射液的质量、有效期内的稳定性以及无菌水平,需要开发一种能够耐受终端灭菌,且高温条件下稳定性高的盐酸异丙嗪注射液的制备方法。
技术实现要素:
7.本发明的目的在于克服现有技术中的不足,提供一种盐酸异丙嗪注射液及其制备方法,在制备及灌封过程中采用充氮气保护的方式,降低了盐酸异丙嗪注射液在配制过程中药液被氧化的风险,本发明提供的盐酸异丙嗪注射液中通过加入特定含量配比1-2:1.4-2.8的无水亚硫酸钠和焦亚硫酸钠作为辅料,从而提高了盐酸异丙嗪注射液终端灭菌耐受性及在稳定性期间产品质量的稳定性。
8.本发明是通过以下技术方案实现的:提供一种盐酸异丙嗪注射液,该注射液的原料包括盐酸异丙嗪、无水亚硫酸钠、焦亚硫酸钠和注射用水;其中所述无水亚硫酸钠和所述
焦亚硫酸钠的重量比为1-2:1.4-2.8。
9.进一步地,所述的无水亚硫酸钠的含量为0.25-0.50mg/ml;所述的焦亚硫酸钠的含量为0.35-0.70mg/ml。
10.进一步地,所述盐酸异丙嗪的含量为25mg/ml。
11.再提供一种制备上述的盐酸异丙嗪注射液的方法,包括以下具体步骤:
12.①
基料:在充氮后的注射用水中加入无水亚硫酸钠和焦亚硫酸钠,搅拌溶解,得到混合液a;
13.②
混料:向步骤1)的混合溶液a中加入盐酸异丙嗪,搅拌溶解,以得到混合液b;
14.③
过滤,灌封于安瓿内,并对其121℃灭菌15min,即得所述盐酸异丙嗪注射液。
15.进一步地,在步骤
①
中,所述注射用水温度≤30℃;所述注射用水的溶氧量≤0.2ppm。
16.进一步地,在步骤
①
和步骤
②
中,所述搅拌时间为5-10min。
17.进一步地,在步骤
①‑
步骤
③
中,全程保持充氮操作,控制安瓿内药液上方残氧量≤2.0%。
18.更进一步地,在步骤
③
中,所述过滤的滤芯是聚醚砜滤芯。
19.本发明的有益效果在于:本发明与现有技术基础上在制备过程中采用控制水温、充氮气保护的方式,降低了盐酸异丙嗪注射液在配制及灭菌过程中药液被氧化的风险,通过在灌封过程中顶空充氮控制顶空残氧量的方式,降低了盐酸异丙嗪注射液在灌封、灭菌及存放过程中药液被氧化的风险,处方组成中在原有技术基础上减少辅料组成通过加入特定含量配比1-2:1.4-2.8的无水亚硫酸钠和焦亚硫酸钠作为双重抗氧化剂辅料,降低成本并在配制过程、灭菌过程及存放过程中起协同抗氧化作用进一步降低了药液被氧化风险,通过处方组成及制备工艺的改进后,可以提升盐酸异丙嗪注射液的产品质量,而且使盐酸异丙嗪注射液在原有技术基础上从不可耐受f0≥12终端灭菌转变为可耐受f0≥12过度灭杀,极大地提升了盐酸异丙嗪注射液的无菌保障水平,进而提高了盐酸异丙嗪注射液在效期内的产品质量的稳定性。
具体实施方式
20.下面结合具体实施例进一步说明本发明的内容,但不应理解为对本发明的限制。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段;下述实施例的原料,如未作具体说明,均为市售购买所得。
21.实施例1
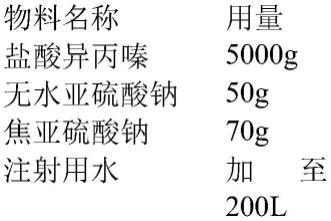
22.一种盐酸异丙嗪注射液包括以下组分:
[0023][0024]
制备方法:
[0025]
配液罐中加入配制量的80%注射用水,控制注射用水温度为30℃,底部充入氮气,在线监测注射用溶氧量,当溶氧量≤0.2ppm,开始投料,加入处方量无水亚硫酸钠及焦亚硫酸钠,搅拌5分钟至完全溶解,再加入处方量盐酸异丙嗪,搅拌5分钟至完全溶解,经0.45μm 0.22μm聚醚砜滤芯过滤后采用灌封前后分别进行充氮的方式灌封于2ml无色中硼硅安瓿内,控制药液上部残氧量应≤2.0%,进行熔封,采用121℃灭菌15min方法进行灭菌,得到所述的盐酸异丙嗪注射液。
[0026]
参照《中国药典》2020版盐酸异丙嗪注射液标准检测样品质量,并将制备的样品进行留样稳定性考察样品置于高温60℃条件下10天、30天及加速条件40℃
±
2℃/75%
±
5%rh 1月、2月、3月、6月进行检测,检测结果见下表1。
[0027]
表1
[0028][0029]
根据上表1的检测数据可以看出,本实施例制备的盐酸异丙嗪注射液样品可耐受f0≥12终端灭菌,且在高温及加速6月条件下质量稳定。
[0030]
实施例2一种盐酸异丙嗪注射液及其制备方法
[0031]
所述的盐酸异丙嗪注射液包括以下组分:
[0032][0033]
制备方法:
[0034]
配液罐中加入配制量的80%注射用水,控制注射用水温度为30℃,底部冲入氮气,在线监测注射用溶氧量,当溶氧量≤0.2ppm,开始投料,加入处方量无水亚硫酸钠及焦亚硫酸钠,搅拌10分钟至完全溶解,再加入处方量盐酸异丙嗪,搅拌10分钟至完全溶解,经0.45μm 0.22μm聚醚砜滤芯过滤过滤后采用灌封前后分别进行充氮的方式灌封于2ml无色中硼硅
安瓿内,控制药液上部残氧量应≤2.0%,进行熔封,采用121℃灭菌15min方法进行灭菌,得到所述的盐酸异丙嗪注射液。
[0035]
参照《中国药典》2020版盐酸异丙嗪注射液标准检测搅拌结束后的中间体药液、过滤后中间体药液含量及样品质量,并将样品进行留样稳定性考察样品置于高温60℃条件下10天、30天及加速条件40℃
±
2℃/75%
±
5%rh 1月、2月、3月、6月进行检测,检测结果见下表2和表3。
[0036]
表2
[0037][0038]
表3
[0039][0040]
根据上表2及表3的检测数据可以看出,本实施例制备的盐酸异丙嗪注射液过程中原辅料投料搅拌10分钟后,中间体药液完全溶解,含量符合要求,经过聚醚砜滤芯过滤后药液含量与过滤前一致,聚醚砜滤芯对药液无吸附,样品可耐受f0≥12终端灭菌,且在高温及加速6月条件下质量稳定。
[0041]
对比例1
[0042]
参照专利申请cn201310605500.3中公开的方法进行样品制备。
[0043]
样品处方为:
[0044][0045]
制备方法:
[0046]
先在配置罐中加入50ml注射用水,加入0.02g亚硫酸氢钠、0.02g亚硫酸钠、0.04g维生素c搅拌溶解,再加入4g盐酸异丙嗪并搅拌溶解,继续加入0.8g葡萄糖并搅拌溶解,用10wt%碳酸钠溶液调节溶液ph为4.8,加注射用水至100ml,取样测半成品性状、ph值、可见异物、含量合格后,过滤(先经0.45μm折叠筒式过滤器过滤,再经0.22μm折叠筒式过滤器过滤),灌封,经121℃灭菌15分钟进行灭菌灭菌,即得到盐酸异丙嗪注射液样品。
[0047]
参照中国药典2020版盐酸异丙嗪注射液项下检测样品质量,并将样品进行留样稳定性考察样品置于高温60℃条件下10天、30天,检测结果见下表3。
[0048]
表4
[0049][0050]
根据上表3的检测结果可以看出该样品不耐受终端灭菌,采用121℃灭菌15min后ph值明显降低、总杂增加,在高温条件下存放,溶液颜色发生显著变化稳定性较差。
[0051]
对比例2
[0052]
经查询目前国内盐酸异丙嗪注射液上市品处方多数为盐酸异丙嗪、维生素c、焦亚硫酸钠及无水亚硫酸钠。针对上述处方的国内上市品(上市品1遂成制药有限公司生产的盐酸异丙嗪注射液批号为:72002093,上市品2遂成制药有限公司生产的盐酸异丙嗪注射液批号为:71901111)与实施例2制备的样品,参照中国药典2020版盐酸异丙嗪注射液项下检测样品质量,并对上述样品采用121℃灭菌15分钟进行灭菌,具体检测数据见下表4。
[0053]
表5
[0054][0055]
根据上表4的检测结果可以看出,上市品1和上市品2与本发明实施例2制备的盐酸异丙嗪注射液样品相比,0天总杂高于实施例2制备的样品;采用121℃灭菌15min后上市品的ph值明显降低,总杂含量明显增加且性状发生改变,说明上市品1和上市品2不耐受过度灭菌,无菌保障较低。
[0056]
对比例3
[0057]
参照实施例2调整无水亚硫酸钠与焦亚硫酸钠的质量比为1:4,制备方法通实施例2。
[0058]
参照中国药典2020版盐酸异丙嗪注射液项下检测样品质量,并将样品进行留样稳定性考察样品置于高温60℃条件下10天、30天,检测结果见下表5。
[0059]
样品处方为:
[0060][0061][0062]
表6
[0063][0064]
根据上表5的检测结果可知,调整无水亚硫酸钠与焦亚硫酸钠的配比,直接影响样品ph值,灭菌后样品ph值不在限度范围之内,且灭菌后总杂较大,质量较差。
[0065]
对比例4
[0066]
参照实例2调整无水亚硫酸钠与焦亚硫酸钠比为1:1,制备方法同实施例2。
[0067]
参照中国药典2020版盐酸异丙嗪注射液项下检测样品质量,并将样品进行留样稳定性考察样品置于高温60℃条件下10天、30天,检测结果见下表6。
[0068]
样品处方为:
[0069][0070]
表7
[0071][0072][0073]
根据上表6的检测结果可知,调整无水亚硫酸钠与焦亚硫酸钠的配比,影响样品ph值,未灭菌的样品及灭菌后样品ph值均不在限度范围之内,且灭菌后性状超出限度、总杂较
大,质量较差。
[0074]
对比例5
[0075]
参照实施例2处方进行样品制备。
[0076]
制备方法:
[0077]
配液罐中加入配制量的80%注射用水,控制注射用水温度为30℃,配制过程中未进行溶氧量控制,开始投料,加入处方量无水亚硫酸钠及焦亚硫酸钠,搅拌10分钟至完全溶解,再加入处方量盐酸异丙嗪,搅拌10分钟至完全溶解,经0.45μm 0.22μm聚醚砜滤芯过滤过滤后采用灌封前后分别进行充氮的方式灌封于2ml无色中硼硅安瓿内,控制药液上部残氧量应≤2.0%,进行熔封,采用121℃灭菌15min方法进行灭菌,得到所述的盐酸异丙嗪注射液。
[0078]
参照《中国药典》2020版盐酸异丙嗪注射液标准检测样品质量,检测结果见下表8。
[0079]
表8
[0080][0081]
根据上表7的检测数据可以看出,本实施例制备的盐酸异丙嗪注射液样品在药液配制过程中未进行控制注射用水溶氧量,配制过程中未进行全程充氮保护,灭菌后的样品ph值可及总杂均超出限度要求,较实施例2制备的样品质量交差。
[0082]
对比例6
[0083]
参照实施例2处方进行样品制备。
[0084]
制备方法:
[0085]
配液罐中加入配制量的80%注射用水,控制注射用水温度为30℃,底部冲入氮气,在线监测注射用溶氧量,当溶氧量≤0.2ppm,开始投料,加入处方量无水亚硫酸钠及焦亚硫酸钠,搅拌10分钟至完全溶解,再加入处方量盐酸异丙嗪,搅拌10分钟至完全溶解,经0.45μm 0.22μm聚醚砜滤芯过滤过滤后灌封于2ml无色中硼硅安瓿内,进行熔封,采用121℃灭菌15min方法进行灭菌,得到所述的盐酸异丙嗪注射液。
[0086]
参照《中国药典》2020版盐酸异丙嗪注射液标准检测样品质量,并将样品进行留样稳定性考察样品置于高温60℃条件下10天、30天及加速条件40℃
±
2℃/75%
±
5%rh 1月、2月、3月、6月进行检测,检测结果见下表9。
[0087]
表9
[0088][0089][0090]
根据上表8的检测数据可以看出,本实施例制备的盐酸异丙嗪注射液样品在药液灌封过程中未对顶空进行残氧量控制,顶部未充氮保护,灭菌后的样品0天检测可符合质量标准,但在稳定性期间ph值下降,有关物质增加,较实施例2制备的样品稳定性较差。
[0091]
对比例7
[0092]
所述的盐酸异丙嗪注射液包括以下组分:
[0093][0094]
制备方法:
[0095]
配液罐中加入配制量的80%注射用水,控制注射用水温度为30℃,底部冲入氮气,在线监测注射用溶氧量,当溶氧量≤0.2ppm,开始投料,加入处方量无水亚硫酸钠,搅拌10分钟至完全溶解,再加入处方量盐酸异丙嗪,搅拌10分钟至完全溶解,经0.45μm 0.22μm聚醚砜滤芯过滤过滤后采用灌封前后分别进行充氮的方式灌封于2ml无色中硼硅安瓿内,控制药液上部残氧量应≤2.0%,进行熔封,采用121℃灭菌15min方法进行灭菌,得到所述的盐酸异丙嗪注射液。
[0096]
参照《中国药典》2020版盐酸异丙嗪注射液标准检测样品质量,并将样品进行留样稳定性考察样品置于高温60℃条件下10天天进行检测,检测结果见下表10。
[0097]
表10
[0098][0099]
根据上表10的检测数据可以看出,本实施例制备的盐酸异丙嗪注射液样品处方中单独使用无水亚硫酸钠作为抗氧化剂,样品0天检测ph值及总杂均超出限度要求,且在高温10天时,样品出现黄绿色沉淀药液浑浊,较实施例2制备的样品稳定性较差。
[0100]
对比例8
[0101]
所述的盐酸异丙嗪注射液包括以下组分:
[0102][0103]
制备方法:
[0104]
配液罐中加入配制量的80%注射用水,控制注射用水温度为30℃,底部冲入氮气,在线监测注射用溶氧量,当溶氧量≤0.2ppm,开始投料,加入处方量焦亚硫酸钠,搅拌10分钟至完全溶解,再加入处方量盐酸异丙嗪,搅拌10分钟至完全溶解,经0.45μm 0.22μm聚醚砜滤芯过滤过滤后采用灌封前后分别进行充氮的方式灌封于2ml无色中硼硅安瓿内,控制药液上部残氧量应≤2.0%,进行熔封,采用121℃灭菌15min方法进行灭菌,得到所述的盐酸异丙嗪注射液。
[0105]
参照《中国药典》2020版盐酸异丙嗪注射液标准检测样品质量,并将样品进行留样稳定性考察样品置于高温60℃条件下10天,检测结果见下表11。
[0106]
表11
[0107]
根据上表11的检测数据可以看出,本实施例制备的盐酸异丙嗪注射液样品处方中单独使用焦亚硫酸钠作为抗氧化剂,样品0天检测ph值及总杂均超出限度要求,且在高温10天时,样品出现黄绿色沉淀药液浑浊,较实施例2制备的样品稳定性较差。
[0108]
对比例9
[0109]
增加无水亚硫酸钠含量为0.75mg/ml、焦亚硫酸钠含量为1.05mg/ml,所述的盐酸异丙嗪注射液组分如下:
[0110][0111]
制备方法:
[0112]
配液罐中加入配制量的80%注射用水,控制注射用水温度为30℃,底部冲入氮气,在线监测注射用溶氧量,当溶氧量≤0.2ppm,开始投料,加入处方量无水亚硫酸钠及焦亚硫酸钠,搅拌10分钟至完全溶解,再加入处方量盐酸异丙嗪,搅拌10分钟至完全溶解,经0.45μm 0.22μm聚醚砜滤芯过滤过滤后采用灌封前后分别进行充氮的方式灌封于2ml无色中硼硅安瓿内,控制药液上部残氧量应≤2.0%,进行熔封,采用121℃灭菌15min方法进行灭菌,得到所述的盐酸异丙嗪注射液。
[0113]
参照《中国药典》2020版盐酸异丙嗪注射液标准检测样品质量,并将样品进行留样稳定性考察样品置于高温60℃条件下10天及加速条件40℃
±
2℃/75%
±
5%rh 1月、3月进行检测,检测结果见表12。
[0114]
表12
[0115][0116]
根据上表12的检测数据可以看出,在本发明所述的辅料含量基础上增加辅料含量制备的盐酸异丙嗪注射液,样品0天检测ph值及总杂均超出限度要求,较实施例制备的样品质量较差。
[0117]
对比例10
[0118]
增加无水亚硫酸钠含量为0.125mg/ml、焦亚硫酸钠含量为0.175mg/ml,所述的盐酸异丙嗪注射液组分如下:
[0119][0120]
制备方法:
[0121]
配液罐中加入配制量的80%注射用水,控制注射用水温度为30℃,底部冲入氮气,在线监测注射用溶氧量,当溶氧量≤0.2ppm,开始投料,加入处方量无水亚硫酸钠及焦亚硫酸钠,搅拌10分钟至完全溶解,再加入处方量盐酸异丙嗪,搅拌10分钟至完全溶解,经0.45μm 0.22μm聚醚砜滤芯过滤过滤后采用灌封前后分别进行充氮的方式灌封于2ml无色中硼硅安瓿内,控制药液上部残氧量应≤2.0%,进行熔封,采用121℃灭菌15min方法进行灭菌,得到所述的盐酸异丙嗪注射液。
[0122]
参照《中国药典》2020版盐酸异丙嗪注射液标准检测样品质量,并将样品进行留样稳定性考察样品置于高温60℃条件下10天及加速条件40℃
±
2℃/75%
±
5%rh 1月、3月进行检测,检测结果见表13。
[0123]
表13
[0124][0125]
根据上表13的检测数据可以看出,在本发明所述的辅料含量基础上降低辅料含量制备的盐酸异丙嗪注射液,样品0天检测性状、总杂均超出限度要求,且在稳定性期间总杂增长,较实施例制备的样品质量及稳定性较差。
[0126]
对比例11
[0127]
参照实施例2处方进行样品制备。
[0128]
制备方法:
[0129]
配液罐中加入配制量的80%注射用水,控制注射用水温度为30℃,底部冲入氮气,在线监测注射用溶氧量,当溶氧量≤0.2ppm,开始投料,加入处方量无水亚硫酸钠及焦亚硫
酸钠,搅拌10分钟至完全溶解,再加入处方量盐酸异丙嗪,搅拌10分钟至完全溶解,经0.45μm 0.22μm聚丙烯滤芯过滤部分药液后,经0.45μm 0.22μm聚偏二氟乙烯滤芯过滤剩余药液,
[0130]
参照《中国药典》2020版盐酸异丙嗪注射液标准检测未过滤的药液与经不同材质过滤后的药液含量,详见表14。
[0131]
表14
[0132][0133]
根据上表14的检测数据可以看出,选用聚丙烯、聚偏二氟乙烯材质滤芯进行过滤,药液过滤后含量较过滤前偏低,聚丙烯及聚偏二氟乙烯滤芯对中间体药液有吸附。
[0134]
通过以上检测结果可以看出,本技术通过采用无水亚硫酸钠和焦亚硫酸钠作为辅料,并对制备工艺进行改进后不仅提升了盐酸异丙嗪注射液的产品质量,而且使盐酸异丙嗪注射液可耐受f0≥12终端灭菌,提升了盐酸异丙嗪注射液的无菌保障水平,进而提高了盐酸异丙嗪注射液在效期内的产品质量的稳定性。
[0135]
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
